Газета «Новости медицины и фармации» Гастроэнтерология (457) 2013 (тематический номер)
Вернуться к номеру
Эндоскопические исследования при воспалительных заболеваниях кишечника: когда, почему, как?
Авторы: Дорофеев А.Э., Томаш О.В., Руденко Н.Н., Сибилев А.В. - Донецкий национальный медицинский университет им. М. Горького
Рубрики: Гастроэнтерология
Разделы: Справочник специалиста
Версия для печати
Среди воспалительных заболеваний кишечника (ВЗК) наиболее значимыми в медико-социальном плане являются неспецифический язвенный колит (НЯК) и болезнь Крона (БК). Они представляют собой серьезную проблему не только в гастроэнтерологической, но и в общемедицинской практике [2]. Это связано с целым рядом обстоятельств. Во-первых, этиопатогенетические механизмы ВЗК далеки от полной расшифровки, несмотря на определенный прогресс в этом направлении. Во-вторых, многообразие клинической картины, сочетающей в себе как кишечные, так и внекишечные проявления, максимально затрудняет своевременную верификацию этой патологии и является источником многочисленных диагностических ошибок. В-третьих, с каждым годом отмечается неуклонный рост количества больных данной патологией, особенно среди лиц трудоспособного возраста, а также среди детей. По данным эпидемиологических исследований последних лет, распространенность НЯК составляет 30–240 случаев, БК — 10–150 случаев на 100 тыс. населения. Кроме того, эти заболевания зачастую протекают тяжело, могут сопровождаться хирургическими и онкологическими осложнениями, приводящими пациентов к инвалидизации и смерти. Последнему особенно способствуют несвоевременная диагностика и выбор неэффективной терапии. Однако и рекомендуемое стандартами лечение ВЗК, как правило дорогостоящее, сопровождается существенными побочными эффектами и не всегда позволяет добиться стойкой ремиссии.
На сегодняшний день адекватная диагностика ВЗК, способная предотвратить или хотя бы отсрочить неблагоприятные исходы этой патологии, невозможна без эндоскопических исследований [41]. В арсенале эндоскописта имеется традиционная фиброколоноскопия (ФКС), позволяющая провести осмотр всей толстой кишки, а также колоноилеоскопия (осмотр терминального отдела подвздошной кишки). Проведение последней особенно актуально для диагностики БК. Фибросигмоидоскопия обеспечивает осмотр дистальных (левых) отделов толстой кишки. Фиброэзофагогастродуоденоскопия (ФЭГДС) позволяет выявить сочетанные поражения верхних отделов желудочно-кишечного тракта (ЖКТ) и кишечника. Для визуализации тонкой кишки целесообразно использование малодоступных в Украине видеокапсульной эндоскопии и двухбаллонной энтероскопии.
Эндоскопическое исследование при ВЗК призвано решать целый ряд важных задач: 1) первичная диагностика ВЗК; 2) дифференциальная диагностика НЯК и БК; 3) оценка распространенности и активности процесса; 4) оценка эффективности лечения; 5) наблюдение за дисплазией и неоплазией; 6) оценка состояния после оперативного вмешательства; 7) эндоскопическое лечение (дилатация стриктур, установка стента) [11, 20, 24, 41].
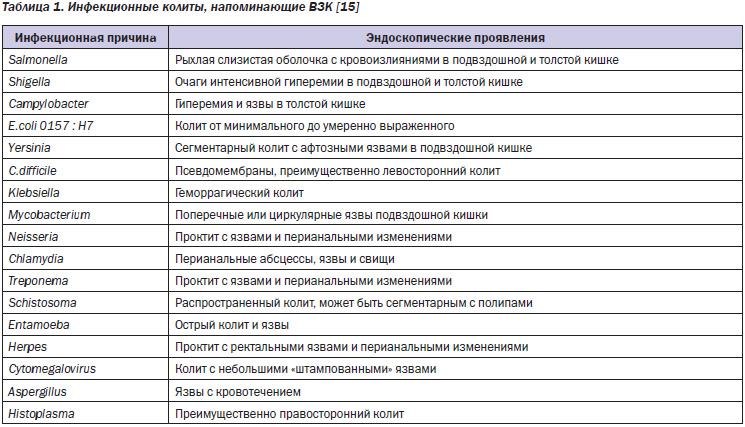
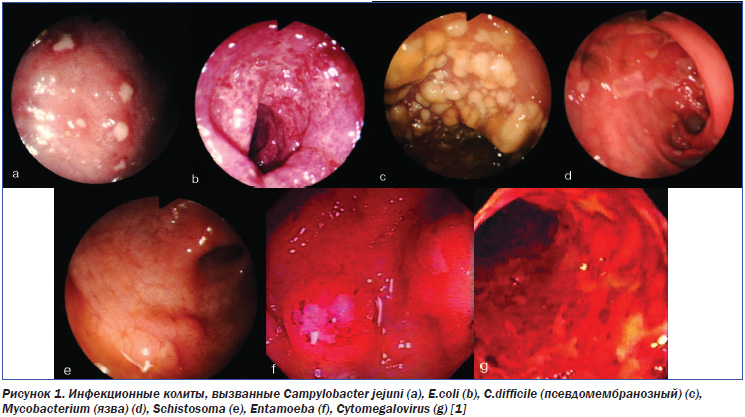
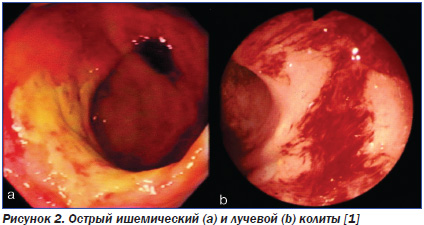
Напомним, что ни НЯК, ни БК не имеют сколь-нибудь явных патогномоничных эндоскопических признаков [12]. Поэтому первичная диагностика ВЗК предполагает прежде всего проведение дифференциальной диагностики с патологией, имеющей аналогичную клинико-эндоскопическую картину. Многие колиты, в первую очередь инфекционные, сопровождаются патологическими изменениями, сходными с таковыми при ВЗК (табл. 1, рис. 1). В связи с этим на первом этапе дифференциальной диагностики следует исключать именно инфекционные причины поражения кишечника.
Кроме того, сходные с ВЗК изменения слизистой оболочки кишечника могут быть индуцированы приемом нестероидных противовоспалительных препаратов (НПВП). Следует помнить, что их прием может способствовать появлению симптомов ВЗК (как в виде первой манифестации болезни, так и вследствие обострения диагностированного ранее заболевания). Однако эти препараты способны также индуцировать НПВП-энтеро- и колопатии с эндоскопической картиной, напоминающей таковую при ВЗК. Аналогичные изменения описаны при приеме пеницилламина и препаратов золота, при лучевых колитах, сосудистой патологии (васкулиты, ишемические колиты) и при эрозивно-язвенной форме колоректального рака [38].
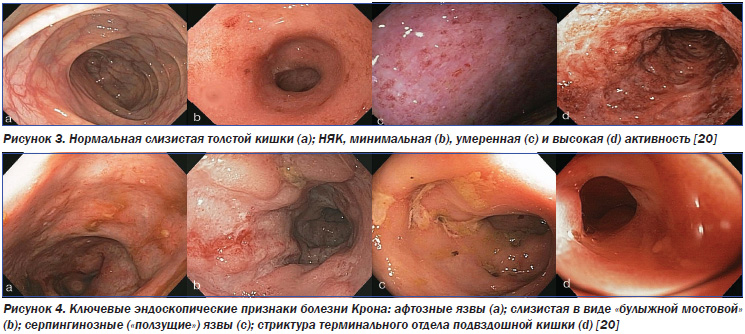
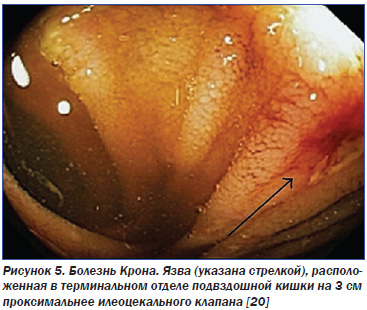
Уточнение нозологической формы ВЗК — НЯК или БК — является вторым шагом диагностики. НЯК характеризуется воспалительно-деструктивными проявлениями в слизистой оболочке толстой кишки и нередким вовлечением в процесс других органов (печени, суставов, кожи, глаз). В 46–50 % случаев заболевание ограничивается проктитом или проктосигмоидитом, в 17–20 % процесс распространяется на всю нисходящую кишку (до селезеночного угла), в 30–37 % наблюдается тотальный колит (панколит). БК представляет собой неспецифическое гранулематозное сегментарное хроническое воспалительное поражение кишечника неясного генеза со склонностью к образованию фистул. В 40–55 % случаев отмечается сочетанное поражение дистального отдела тонкой кишки (старое название, предложенное Кроном, — «терминальный илеит») и толстой кишки. Изолированное поражение этих отделов возникает реже — у 25–40 и 15–25 % пациентов соответственно [17]. И лишь в 10 % случаев патологический процесс локализуется в пищеводе, желудке и проксимальном отделе тонкого кишечника. Таким образом, болезнь Крона — это заболевание не только тонкой кишки, поскольку возможна локализация этого патологического процесса на всем протяжении пищеварительного тракта. Примерно у половины больных с толстокишечной локализацией БК наблюдается поражение и аноректальной области [38].
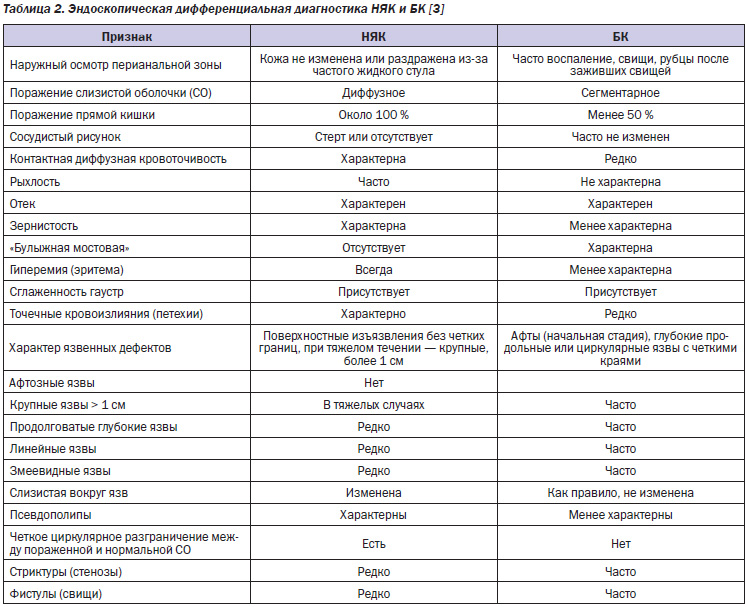
У большинства пациентов оценка эндоскопических признаков позволяет без особого труда провести дифференциальную диагностику между НЯК и БК (табл. 2, рис. 1–3).
Учет выраженности патологических изменений с оценкой их активности и распространенности формирует эндоскопическую составляющую (индекс эндоскопической активности) клинического диагноза ВЗК. Динамическое наблюдение за этими параметрами на фоне проводимой терапии позволяет оценивать адекватность и эффективность последней, а также прогноз заболевания в целом.
Однако у 5–20 % больных ни эндоскопическое, ни даже морфологическое исследование не может разграничить НЯК и БК из-за сочетания признаков обоих заболеваний. В этом случае принято говорить о неклассифицируемом ВЗК (unclassified IBD) или недифференцируемом колите (indeterminate colitis) [35].
К сожалению, закономерным и самым тяжелым осложнением ВЗК является возникновение колоректального рака (КРР). Он развивается у 10–15 % пациентов с ВЗК, что в 2–5 раз выше, чем в общей популяции [13, 18]. Кроме того, имеются данные о более высоком уровне смертности от КРР, возникающего на фоне предшествующих НЯК или БК [39]. На сегодняшний день самым эффективным методом раннего выявления рака или предраковых изменений является эндоскопический скрининг. ФКС, особенно в сочетании с прижизненной окраской метаплазированных участков слизистой (хромоэндоскопия), позволяет визуализировать их и прицельно взять биопсию для последующего морфологического исследования [42]. Частота профилактической ФКС зависит прежде всего от длительности и активности заболевания, распространенности патологического процесса, возраста начала болезни, семейного онкоанамнеза, наличия полипов кишечника. В соответствии с рекомендациями ECCO (European Crohn’s and Colitis Organization) все пациенты с НЯК вне зависимости от активности процесса нуждаются в скрининговой ФКС для оценки степени риска развития КРР через 6–8 лет от начала болезни. Изолированное аноректальное поражение не требует дальнейшего скрининга рака. Сопутствующий склерозирующий холангит является показанием к ежегодной колоноскопии при любой распространенности и активности кишечного процесса. Частота ФКС зависит от риска развития КРР. Этот риск формируют главным образом 4 фактора (наличие каждого оценивается в 1 балл): панколит, эндоскопические и/или гистологические признаки воспаления, наличие псевдополипов и семейный анамнез КРР. В группе низкого риска (0–2 балла) эндоскопию следует проводить 1 раз в 3–4 года, в группе высокого риска (3–4 балла) — 1 раз в 1–2 года [46]. Британское гастроэнтерологическое общество предлагает следующую частоту ФКС в зависимости от длительности заболевания: пациентам с анамнезом болезни 11–20 лет — 1 раз в 3 года, 21–30 лет — 1 раз в 2 года, больше 30 лет — ежегодно [6]. Разумеется, эти сроки следует соотносить с данными предыдущего эндоскопического и особенно морфологического исследования конкретного больного. ФКС рекомендовано проводить в период ремиссии НЯК и обязательно при качественной подготовке пациента. В случае сохранения в кишечнике даже остаточных количеств каловых масс исследование следует повторить [46].
Совершенно очевидно, что для решения всех стоящих перед ней задач ФКС должна быть качественной. Качество исследования обеспечивается 3 составляющими: профессионализмом эндоскописта, современной эндоскопической техникой и адекватной подготовкой пациента к исследованию. К сожалению, повседневная эндоскопическая практика нередко сталкивает нас с пациентами, недостаточно качественно подготовленными к ФКС. Оказывается, эта проблема является интернациональной. Так, в США низкий уровень подготовки к ФКС отмечается в 10–30 % исследований [29, 47]. Закономерным следствием этого являются невозможность выполнения тотальной ФКС, низкая выявляемость патологии (в том числе и онкологической), дополнительный дискомфорт для пациента [23]. С целью оптимизации подготовки к колоноскопии проанализированные причины ее неадекватности были разделены на пациент-зависимые и процедура-зависимые [43].
К основным пациент-зависимым причинам относятся возраст, пол, социально-экономический статус пациента, его сопутствующая патология и лекарственный анамнез. И хотя перечисленные факторы относятся к немодифицируемым, их учет, несомненно, важен, поскольку влияет на конечный результат. Так, в американском и двух азиатских исследованиях больные старше 60–66 лет были подготовлены к ФКС достоверно хуже [7, 9, 37]. Многочисленные исследования, проведенные как в западной, так и в восточной популяции, продемонстрировали, что мужской пол является независимым фактором риска недостаточной подготовки кишечника, которая у мужчин встречалась в 1,4–1,6 раза чаще, чем у женщин [7, 9, 32]. Эти данные в очередной раз подтвердили общеизвестный факт, что в большинстве популяций мужчины по различным причинам заботятся о своем здоровье в меньшей степени, чем женщины. Сопутствующая патология (в частности, наличие в анамнезе инсульта, оперативных вмешательств на органах ЖКТ и малого таза) также ассоциируется с низким качеством подготовки к ФКС [9, 36, 37]. Особенно значимым в этом плане оказался сахарный диабет [44]. Его наличие повышало вероятность неудовлетворительной подготовки в 8,6 раза [9]. Это связано с закономерным для диабета нарушением гастроинтестинальной моторики и замедлением толстокишечного транзита [8]. Наличие в анамнезе плохой переносимости слабительных препаратов затрудняет выполнение пациентом рекомендованной методики в полном объеме. Кроме того, худшая подготовка к ФКС чаще отмечается у больных с низким образовательным и социоэкономическим статусом [7, 37].
К процедура-зависимым факторам, влияющим на качество подготовки к колоноскопии, относятся соблюдение соответствующих инструкций, назначенное время подготовки и время ожидания процедуры. Так, несоблюдение режима подготовки (нарушение диеты, дозы и кратности приема препарата) повышало риск некачественной подготовки в 2,7–4,8 раза [36]. Различные отклонения от врачебных рекомендаций были выявлены у 86,7 % пациентов с плохой подготовкой к ФКС [37]. В связи с этим врач должен не только создать у обследуемого высокую мотивацию адекватной подготовки, но и убедиться в том, что пациент правильно понял ее методику. Последнюю предпочтительнее излагать и устно, и письменно, с четким указанием дозировок и времени выполнения каждого этапа [22].
В одном азиатском исследовании риск некачественной подготовки повышался в 1,86 раза при длительном периоде от момента назначения ФКС до фактического ее выполнения (> 16 недель), в связи с чем его следует максимально сокращать [7].
Определенное значение может иметь назначенное время подготовки. Принципиально возможны 2 варианта: начало подготовки накануне с окончанием на следующий день, т.е. в день исследования (режим day before) или полная подготовка непосредственно в день проведения ФКС (режим same day). По мнению ряда исследователей, режим same day обеспечивает более качественную очистку кишечника, при которой повышалась выявляемость плоских поражений слизистой [10, 19, 40].
Принципиально важными являются выбор слабительного препарата для подготовки к ФКС и адекватного режима его приема. Эти положения четко оговорены в Руководстве Европейского общества гастроинтестинальной эндоскопии (ESGE), опубликованном в 2013 году [21]. В состав этого общества, объединяющего эндоскопистов из 49 стран Европы, Ближнего Востока и Северной Африки, входит и Украинская ассоциация эндоскопии [27]. Рекомендации Руководства отражают официальную позицию ESGE по различным аспектам подготовки кишечника к исследованию. Ниже приведены основные положения этого документа.
За сутки до исследования следует рекомендовать пациенту соблюдение диеты с низким содержанием клетчатки. В тайваньском исследовании соблюдение малошлаковой диеты в течение 2 суток увеличило качество подготовки к исследованию. К сожалению, рекомендованную диету соблюдали меньше половины пациентов [48]. В целом данные о целесообразности увеличения периода диетических ограничений до 3 дней противоречивы.
Не следует использовать очистительные клизмы как дополнение к стандартной (т.е. медикаментозной) подготовке кишечника, поскольку это не улучшает ее качество. Добавим, что использование клизм в качестве основного (единственного) метода очистки кишечника не упоминается в принципе.
Прокинетики метоклопрамид, домперидон, цизаприд и тегасерод не улучшали ни переносимость процедуры подготовки к ФКС, ни качество самой подготовки. Мосаприд и итоприд, не влияя на качество очистки кишечника, уменьшали тошноту, рвоту, вздутие и абдоминальную боль, возникавшие у пациентов в процессе подготовки, однако эти эффекты были недостоверными. В связи с этим рутинное использование прокинетических препаратов не рекомендуется. По нашему мнению, применение мосаприда и итоприда может быть целесообразным, если у больных упомянутые симптомы имеются исходно (до подготовки), а также при наличии инертной кишки.
У 32–57 % пациентов при ФКС отмечается вспенивание кишечного содержимого, что затрудняет осмотр и делает его более некомфортным. В связи с этим целесообразно использование пеногасителя симетикона, доказавшего свою эффективность в ряде исследований. Рекомендованный режим приема: 120–240 мг или 45 мл 30% суспензии вместе с вечерней и утренней дозами слабительного.
В качестве препаратов для очистки кишечника на протяжении многих лет чаще всего используются полиэтиленгликоль (ПЭГ, или макроголь) и фосфат натрия (ФН). Принято считать, что они обеспечивают сопоставимое качество подготовки. Однако в метаанализе 104 исследований показано несомненное преимущество ПЭГ в степени очистки проксимальной части кишки [4]. В связи с этим, а также по причине достаточно большого спектра побочных эффектов ФН ESGE выступает против его широкого использования. К наиболее тяжелым из них относится повреждение почек (острая фосфатная нефропатия) с развитием острой почечной недостаточности (ОПН) в течение нескольких недель после ФКС. Согласно данным Food and Drug Administration, в 2006–2007 гг. в США был зафиксирован 171 случай ОПН после использования ФН и только 10 после ПЭГ [5]. К другим побочным эффектам ФН относятся электролитные нарушения (гиперфосфатемия, гипокалиемия, гипокальциемия, гипер- или гипонатриемия) и способность повреждать слизистую оболочку кишечника. Последнее делает нецелесообразным использование препарата при наличии или подозрении на наличие любого активного колита, включая ВЗК. Кроме того, ФН противопоказан пациентам до 18 лет, беременным, кормящим, при электролитных нарушениях в анамнезе, асците, остром коронарном синдроме в последние 6 мес., хронической болезни почек III–V стадии (скорость клубочковой фильтрации (СКФ) менее 60 мл/мин), симптомах сердечной недостаточности, неспособности поддерживать адекватный прием жидкости, замедленном кишечном транзите. По мнению экспертов, препарат может быть использован у отдельных категорий пациентов при непереносимости альтернативных препаратов и только в случае, если по предварительной оценке врача (включающей определение СКФ до ФКС!) риск развития побочных эффектов ФН является низким.
Таким образом, использование ПЭГ является более приемлемым по соображениям безопасности. Вследствие этого ПЭГ безальтернативен в так называемых особых ситуациях, к которым относят проведение ФКС беременным, при ВЗК и ургентных ФКС при кишечных кровотечениях.
Предметом обсуждения является использование различных режимов и доз ПЭГ, а также его сочетание с другими слабительными.
Одним из стандартных вариантов является режим раздельной дозы (split dose regimen), при котором пациент начинает принимать ПЭГ (как правило, 4 л) накануне исследования и завершает в день процедуры (подготовка в режиме day before). Как отмечено в метаанализе 5 РКИ (1232 пациента), по сравнению с режимом полной дозы (4 л в день накануне ФКС) сплит-режим обеспечивает более высокий уровень очистки кишечника и лучше переносится [30].
Для подготовки к исследованию, проводимому во 2-й половине дня, рекомендован режим того же дня (same day regimen), предполагающий прием всей дозы ПЭГ утром в день выполнения ФКС. Это повышает переносимость подготовки (нет нарушений в день накануне исследования, сохраняется работоспособность и качество сна) при аналогичном уровне очистки кишечника. Исследование, проведенное в Корее, продемонстрировало, что для качественной подготовки большее значение имеет время приема ПЭГ, а не время суток, в которое проводится эндоскопия. Последняя доза ПЭГ, по мнению исследователей, должна приниматься за 4–7 часов до ФКС [14].
Минусом полнодозовых режимов является необходимость употребления достаточно большого объема жидкости (4 л), что особенно проблематично в формате режима того же дня. Подобный подход нежелателен при отечно-асцитическом синдроме, застойной сердечной недостаточности, тяжелой артериальной гипертензии, а также при инертной кишке. В связи с этим предложены альтернативные варианты подготовки. Они предусматривают использование половинных доз ПЭГ (обычно 2 л) в сочетании с другими слабительными: аскорбатом, сенной, бисакодилом, магнезией, оливковым маслом и лубипростоном. Подобные схемы улучшают переносимость подготовки, но, к сожалению, могут снижать ее качество, особенно правых отделов кишки.
Еще одним осмотическим слабительным, позволяющим проводить низкообъемную (low-volume) очистку кишечника, является магния цитрат (МЦ). Он широко используется в Великобритании для подготовки к ФКС в комбинации с различными слабительными, чаще всего с натрия пикосульфатом (НП), который является секреторным слабительным. Эта комбинация (препарат пикопреп) обеспечивает такой же уровень качественной подготовки, как и полнодозовые режимы. Так, в канадском мультицентровом исследовании с участием более 600 человек использование МЦ/НП обеспечивало хороший/отличный уровень подготовки как левых, так и правых отделов толстой кишки у 92 и 97 % пациентов соответственно. Примечательно, что добавление бисакодила качество подготовки не улучшало [34].
Близкая по составу комбинация НП с окисью магния и лимонной кислотой в двух канадских исследованиях показала высокую клиническую эффективность при вечернем приеме и сплит-дозировке; последняя при этом улучшала качество подготовки правых отделов кишки. Отмечалась хорошая переносимость обоих режимов подготовки [16, 25]. В исследовании, проведенном в Великобритании, прием всей дозы НП утром в день ФКС оказался эффективнее двухдневного сплит-режима [33].
Полнодозовый режим с ПЭГ может сопровождаться наличием достаточно большого количества жидкости в просвете кишки к моменту осмотра, что в исследовании D.J. Tolan et al. (2007) позволяло добиться адекватного осмотра при проведении виртуальной (т.е. посредством компьютерной томографии) колоноскопии только у 75 % больных [45]. Это представляется важным, поскольку Руководство ESGE рекомендует минимизировать время между приемом последней дозы слабительного и проведением ФКС; оно не должно превышать 4 ч.
Кроме того, меньший объем гораздо лучше переносится пациентами и повышает их приверженность к врачебным рекомендациям. Низкообъемные режимы особенно предпочтительны у пациентов с сердечно-сосудистой патологией и электролитными нарушениями. В американском исследовании SEE CLEAR II Study с участием 603 пациентов сравнивались 2 таких режима: МЦ/НП и 2 л ПЭГ с бисакодилом. При одинаковом качестве подготовки всех отделов кишечника прием МЦ/НП сопровождался существенно меньшим числом побочных эффектов и лучшей переносимостью [28].
Таким образом, в условиях увеличивающейся распространенности ВЗК растет роль ФКС как метода, позволяющего не только устанавливать диагноз и оценивать тяжесть НЯК и БК, но и мониторировать эффективность проводимой терапии, а также своевременно выявлять жизнеугрожающие осложнения. Для успешного решения этих важных задач необходима адекватная подготовка к исследованию, которая способна обеспечить качественный осмотр, будучи при этом безопасной и по возможности комфортной. Основным препаратом, рекомендованным Руководством ESGE-2013, является ПЭГ, который используется в различных по дозе и времени приема режимах. Альтернативой может быть низкообъемный режим с МЦ/НП — препаратом, имеющим достаточную доказательную базу [26]. При этом, однако, следует помнить, что МЦ/ПН (как и ФН) способен вызывать воспалительные изменения слизистой кишечника в 10 раз чаще, чем ПЭГ, и учитывать это при подготовке именно пациентов с ВЗК [31].
1. Атлас клинической гастроэнтерологии / Под ред. А. Форбса, Дж.Дж. Мисиевича, К.К. Комптон и др.: Пер. с англ. — М.: Рид Элсивер, 2010. — 392 с.
2. Дорофєєв А.Е., Звягінцева Т.Д., Харченко Н.В. Захворювання кишечника (керівництво для лікарів). — Горлівка: Ліхтар, 2010. — 532 с.
3. Симонова Е.В. Дифференциальная диагностика воспалительных заболеваний кишечника: эндоскопические аспекты // НМиФ. — 2012. — 407 (гастроэнтерология). — 53-7.
4. Belsey J., Crosta C., Epstein O. et al. Meta-analysis: the relative efficacy of oral bowel preparations for colonoscopy 1985-2010 // Aliment. Pharmacol. Ther. 2012 Jan; 35(2): 222-37.
5. Belsey J., Epstein O., Heresbach D. Systematic review: adverse event reports for oral sodium phosphate and polyethylene glycol // Aliment. Pharmacol. Ther. 2009; 29: 15-28.
6. Cairns S.R., Scholefield J.H., Steele R.J. et al. Guidelines for colorectal cancer screening and surveillance in moderate and high risk groups (update from 2002) // Gut. 2010; 59: 666-89.
7. Chan W.K., Saravanan A., Manikam J. et al. Appointment waiting times and education level influence the quality of bowel preparation in adult patients undergoing colonoscopy // BMC Gastroenterol. 2011; 11: 86.
8. Chandrasekharan B., Anitha M., Blatt R. et al. Colonic motor dysfunction in human diabetes is associated with enteric neuronal loss and increased oxidative stress // Neurogastroenterol. Motil. 2011; 23: 131-8, e26.
9. Chung Y.W., Han D.S., Park K.H. et al. Patient factors predictive of inadequate bowel preparation using polyethylene glycol: a prospective study in Korea // J. Clin. Gastroenterol. 2009; 43: 448-52.
10. Church J.M. Effectiveness of polyethylene glycol antegrade gut lavage bowel preparation for colonoscopy — timing is the key! // Dis. Colon. Rectum. 1998; 41: 1223-5.
11. Chutkan R.K., Scherl E., Waye J.D. Colonoscopy in inflammatory bowel disease // Gastrointest. Endosc. Clin. N. Am. 2002 Jul; 12(3): 463-83.
12. Dignass A., Eliakim R., Magro F. et al. Second European evidence-based Consensus on the management of ulcerative colitis, part 1: Definitions and diagnosis // J. Crohns. Colitis. 2012 Dec; 6(10): 965-90.
13. Dyson J.K., Rutter M.D. Colorectal cancer in inflammatory bowel disease: what is the real magnitude of the risk? // World J. Gastroenterol. 2012 Aug 7; 18(29): 3839-48.
14. Eun C.S., Han D.S., Hyun Y.S. et al. The timing of bowel preparation is more important than the timing of colonoscopy in determining the quality of bowel cleansing // Dig. Dis. Sci. 2011; 56(2), 539-44.
15. Fefferman D.S., Farrell R.J. Endoscopy in inflammatory bowel disease: indications, surveillance, and use in clinical practice // Clin. Gastroenterol. Hepatol. 2005; 3: 11-24.
16. Flemming J.A., Vanner S.J., Hookey L.C. Split-dose picosulfate, magnesium oxide, and citric acid solution markedly enhances colon cleansing before colonoscopy: a randomized, controlled trial // Gastrointest. Endosc. 2012 Mar; 75(3): 537-44.
17. Freeman H.J. Natural history and clinical behavior of Crohn’s disease extending beyond two decades // J. Clin. Gastroenterol. 2003; 37: 216-9.
18. Guagnozzi D., Lucendo A.J. Colorectal cancer surveillance in patients with inflammatory bowel disease: What is new? // World J. Gastrointest. Endosc. 2012 Apr 16; 4(4): 108-16.
19. Gupta T., Mandot A., Desai D. et al. Comparison of two schedules (previous evening versus same morning) of bowel preparation for colonoscopy // Endoscopy. 2007; 39: 706-9.
20. Hamilton M.J. The valuable role of endoscopy in inflammatory bowel disease // Diagn. Ther. Endosc. 2012; 2012: 467979.
21. Hassan C., Bretthauer M., Kaminski M.F. et al. Bowel preparation for colonoscopy: European Society of Gastrointestinal Endoscopy (ESGE) guideline // Endoscopy. 2013; 45(2): 142-50.
22. Hassan C., Fuccio L., Bruno M. et al. A predictive model identifies patients most likely to have inadequate bowel preparation for colonoscopy // Clin. Gastroenterol. Hepatol. 2012; 10: 501-6.
23. Hillyer G.C., Basch C.H., Basch C.E. et al. Gastroenterologists’ perceived barriers to optimal pre-colonoscopy bowel preparation: results of a national survey // J. Cancer. Educ. 2012 Jun; 27(3): 526-32.
24. Hommes D.W., van Deventer S.J. Endoscopy in inflammatory bowel diseases // Gastroenterology. 2004 May; 126(6): 1561-73.
25. Hookey L.C., Vanner S.J. Pico-salax plus two-day bisacodyl is superior to pico-salax alone or oral sodium phosphate for colon cleansing before colonoscopy // Am. J. Gastroenterol. 2009 Mar; 104(3): 703-9.
26. Hoy S.M., Scott L.J., Wagstaff A.J. Sodium picosulfate/magnesium citrate: a review of its use as a colorectal cleanser // Drugs. 2009; 69(1): 123-36.
27. http: //www.esge.com/esge-national-societies.html
28. Katz P.O., Rex D.K., Epstein M. et al. A dual-action, low-volume bowel cleanser administered the day before colonoscopy: results from the SEE CLEAR II study // Am. J. Gastroenterol. 2013; 108: 401-9.
29. Kazarian E.S., Carreira F.S., Toribara N.W., Denberg T.D. Colonoscopy completion in a large safety net health care system // Clin. Gastroenterol. Hepatol. 2008; 6: 438-42.
30. Kilgore T.W., Abdinoor A.A., Szary N.M. et al. Bowel preparation with split-dose polyethylene glycol before colonoscopy: a meta-analysis of randomized controlled trials // Gastrointest. Endosc. 2011; 73(6), 1240-5.
31. Lawrance I.C., Willert R.P., Murray K. Bowel cleansing for colonoscopy: prospective randomized assessment of efficacy and of induced mucosal abnormality with three preparation agents // Endoscopy. 2011 May; 43(5): 412-8.
32. Lebwohl B., Wang T.C., Neugut A.I. Socioeconomic and other predictors of colonoscopy preparation quality // Dig. Dis. Sci. 2010; 55: 2014-20.
33. Longcroft-Wheaton G., Bhandari P. Same-day bowel cleansing regimen is superior to a split-dose regimen over 2 days for afternoon colonoscopy: results from a large prospective series // J. Clin. Gastroenterol. 2012; 46(1), 57-61.
34. Love J., Bernard E.-J., Cockeram A. et al. A multicentre, observational study of sodium picosulfate and magnesium citrate as a precolonoscopy bowel preparation // Can. J. Gastroenterol. 2009; 23(10): 706-10.
35. Mowat C., Cole A., Windsor A. et al. Guidelines for the management of inflammatory bowel disease in adults // Gut. 2011; 60: 571-607.
36. Ness R.M., Manam R., Hoen H., Chalasani N. Predictors of inadequate bowel preparation for colonoscopy // Am. J. Gastroenterol. 2001; 96: 1797-802.
37. Nguyen D.L., Wieland M. Risk factors predictive of poor quality preparation during average risk colonoscopy screening: the importance of health literacy // J. Gastrointestin. Liver. Dis. 2010; 19: 369-72.
38. Nikolaus S., Schreiber S. Diagnostics of inflammatory bowel disease // Gastroenterology. 2007; 133: 1670-89.
39. Ording A.G., Horvath-Puho E., Erichsen R. et al. Five-Year Mortality in Colorectal Cancer Patients with Ulcerative Colitis or Crohn’s Disease: A Nationwide Population-based Cohort Study // Inflamm. Bowel. Dis. 2013 Mar; 19(4): 800-5.
40. Parra-Blanco A., Nicolas-Perez D., Gimeno-Garcia A. et al. The timing of bowel preparation before colonoscopy determines the quality of cleansing, and is a significant factor contributing to the detection of flat lesions: a randomized study // World J. Gastroenterol. 2006; 12: 6161-6.
41. Rameshshanker R., Arebi N. Endoscopy in inflammatory bowel disease when and why // World J. Gastrointest. Endosc. 2012 Jun 16; 4(6): 201-11.
42. Repici A., Laterra M.A., Cisaro F. et al. Unveiling cancer in IBD: screening colonoscopy or chromoendoscopy // Curr. Drug. Targets. 2012 Sep 1; 13(10): 1268-72.
43. Romero R.V., Mahadeva S. Factors influencing quality of bowel preparation for colonoscopy // World J. Gastrointest. Endosc. 2013 February 16; 5(2): 39-46.
44. Taylor C., Schubert M.L. Decreased efficacy of polyethylene glycol lavage solution (golytely) in the preparation of diabetic patients for outpatient colonoscopy: a prospective and blinded study // Am. J. Gastroenterol. 2001; 96: 710-4.
45. Tolan D.J., Armstrong E.M., Burling D., Taylor S.A. Optimization of CT colonography technique: a practical guide // Clin. Radiol. 2007 Sep; 62(9): 819-27.
46. Van Assche G., Dignass A., Bokemeyer B. et al. Second European evidence-based Consensus on the management of ulcerative colitis: Special situations // J. Crohns. Colitis. 2013 Feb; 7(1): 1-33.
47. Van Dongen M. Enhancing bowel preparation for colonoscopy: an integrative review // Gastroenterol. Nurs. 2012 Jan-Feb; 35(1): 36-44.
48. Wu K.L., Rayner C.K., Chuah S.K. et al. Impact of low-residue diet on bowel preparation for colonoscopy // Dis. Colon. Rectum. 2011 Jan; 54(1): 107-12.