Газета «Новости медицины и фармации» Гастроэнтерология (457) 2013 (тематический номер)
Вернуться к номеру
Нарушения метаболизма кишечной микрофлоры у больных с синдромом раздраженной кишки
Авторы: Дорофеев А.Э., Рассохина О.А., Коваленко Е.Г. - Донецкий национальный медицинский университет им. М. Горького, кафедра внутренних болезней № 2
Рубрики: Гастроэнтерология
Разделы: Клинические исследования
Версия для печати
Синдром раздраженного кишечника (СРК) становится все более актуальной проблемой в последнее время. Центральная нервная система (ЦНС) играет важную роль в развитии СРК [1, 2]. Несмотря на сложность и неоднозначность патогенеза, общепризнана роль психогенных дезадаптаций, висцеральной гиперчувствительности и нарушений моторики кишечника в возникновении заболевания [2–4]. При этой патологии состояние центральной нервной системы может являться основополагающим моментом в возникновении и прогрессировании заболевания. В то же время в процессе болезни могут развиваться нарушения ЦНС с изменениями психологического статуса, что во многом предопределяет прогноз и качество жизни таких больных. Однако СРК может отражать дисбиотические нарушения толстого кишечника, дисфункцию вегетативной нервной системы, нарушения обмена серотонина, гистамина [1, 5]. Одним из основных медиаторов ЦНС является серотонин, который обладает свойствами гормона и нейротрансмиттера. Серотонин имеет разнообразные рецепторы, которые представлены 7 видами и несколькими подтипами. Преобладающее количество серотонина — 95 %, синтезируемое в организме, находится в энтерохромаффинных клетках кишечника, около 2 % — в головном мозге и тромбоцитах [6]. В ЦНС серотониновые рецепторы в большом количестве определяются в солитарном тракте, желатиновой субстанции, ядрах тройничного и блуждающего нервов, гиппокампе, которые характеризуются как серотонинергическая система мозга [6–8]. Серотонинергическая система мозга участвует в регуляции общего уровня активности ЦНС, двигательной активности, сна и памяти и в значительной степени определяет эмоциональное поведение человека [4–6, 8]. Несмотря на значительное разнообразие серотониновых рецепторов, в серотонинергической системе головного мозга и желудочно-кишечном тракте определяются сходные рецепторные типы. Прежде свего это рецепторы 5НТ3, связанные с G-белками. Гиперпродукция серотонина является ответной и компенсаторной реакцией на активацию катехоламинами 5HT3-рецепторов энтерохромаффинных клеток, при этом отмечаются усиление продукции серотонина и повышение уровня внутриклеточного кальция, что может вызвать усиление болевого синдрома со стимуляцией перистальтики и развитием висцеральной гиперчувствительности у больных СРК [6, 8, 9]. Длительное наличие феномена висцеральной гиперчувствительности в сочетании с повышенной активностью серотонинергической системы ЦНС могут приводить к модификации эмоционального поведения, психологического статуса пациентов с СРК с развитием у них депрессивных состояний, что нарушает качество жизни и усугубляет течение основного заболевания. Сопутствующие функциональные вегетативные нарушения, аффективные и тревожные, депрессивные или ипохондрические расстройства отмечаются у 75–80 % больных СРК [4]. Изменения вегетативного и эмоционального статуса, висцеральной ноцицепции, изменение моторики толстого кишечника в сочетании с изменением химического состава химуса, лабильностью иммунных систем способствуют нарушению количественного и качественного состава кишечной флоры и ее метаболизма и нарушению синтеза короткоцепочечных жирных кислот (КЖК) [10]. КЖК, являясь продуктом деградации белков и сахаров микрофлорой толстого кишечника, обеспечивают трофическую и энергетическую функции, дифференцировку и регенерацию эпителия, ионный гомеостаз, стимуляцию местного и системного иммунитета, цитопротекцию, участвуют в рециркуляции желчных кислот, регулируют перистальтику кишечника [10–12]. Увеличение концентрации КЖК под влиянием анаэробной микрофлоры способствует высвобождению серотонина [6]. Повышенное содержание серотонина усиливает кишечную моторику, секрецию слизи, провоцирует болевую импульсацию. При дисбиозе кишечника нарушается инактивирование ферментными системами микрофлоры биологически активных веществ, гистамина и серотонина. Гиперпродукция серотонина и гистамина бактериями толстого кишечника приводит к образованию избыточного количества токсических веществ, усилению моторной активности, изменению вегетативного тонуса, что усугубляет симптомы СРК [5]. В условиях измененного микробного метаболизма в кишечнике отмечается повышенное выделение с фекалиями лизоцима, обладающего антигистаминными свойствами, снижение продукции гистидазы поврежденной слизистой оболочкой кишечника, что также приводит к увеличению концентрации гистамина в крови, развитию сенсибилизации к условно-патогенной флоре. Таким образом, дисбактериоз кишечника способствует развитию и поддержанию моторно-эвакуаторной дисфункции, свойственной СРК, в то же время кишечная дисфункция является предрасполагающим фактором возникновения кишечного дисбиоза. При прогрессировании дисбиотических процессов в слизистой оболочке прослеживаются морфологические изменения эпителия: снижение серотонинпродуцирующих ЕС-клеток, что способствует угнетению перистальтики, возрастает количество вспомогательных клеток, инфильтрирующих эпителиальный пласт эозинофилов, лимфоцитов, плазмоцитов, нейтрофилов, фибробластов стромы, уменьшается количество лаброцитов, продуцирующих гистамин, что приводит к отеку и дальнейшей инфильтрации соединительной ткани клеточными элементами [13, 14]. Возможно, это способствует формированию рефрактерных к медикаментозной терапии клинических типов СРК. Поэтому своевременная адекватная коррекция изменений состояния и функции ЦНС, дисбактериоза у больных СРК является существенным подспорьем терапии таких больных.
Цель работы: оценить клинико-психологические особенности, уровень серотонинемии в связи с метаболическими изменениями КЖК у больных СРК.
Материалы и методы
Было обследовано 72 больных синдромом раздраженной кишки, среди которых было 45 (62,5 %) женщин и 27 (37,5 %) мужчин в возрасте от 18 до 60 лет. Диагноз СРК устанавливался с учетом Римских критериев III (2006) [3]. У наблюдавшихся больных были выявлены 4 клинических типа СРК: с преобладанием запоров — 27 пациентов (37,5 %; тип 1), с преобладанием поносов — 21 (29,2 %; тип 2), смешанный — 18 (25,0 %; тип 3) и недифференцированный — 6 больных (8,3 %; тип 4). Помимо общеклинических методов обследования у всех пациентов с СРК была изучена типологическая направленность высшей нервной деятельности по опроснику Айзенка, реактивная и личностная тревожность по методу Спилбергера. Оценка уровня тревожности проводилась в баллах. Значения до 30 баллов расценивались как низкий уровень тревожности, от 31 до 45 баллов — как средняя степень тревожности, а показатели выше 45 баллов отражали высокий уровень тревожности. У всех больных определяли уровень серотонина сыворотки крови. Кроме того, у всех больных методом газожидкостного хроматографического анализа было исследовано количественное и качественное содержание короткоцепочечных жирных кислот в кале. Были рассчитаны профили (Сn/S(C2+C3+C4)) уксусной (С2), пропионовой (С3) и масляной (С4) кислот, вносящих основной вклад в общий пул кислот, анаэробные индексы (АИ) — отношение содержания суммы более восстановленных кислот (пропионовой и масляной) к содержанию менее восстановленной уксусной кислоты.
Результаты и обсуждение
Частота различных типов высшей нервной деятельности у больных СРК отличалась от cреднепопуляционной. Среди больных СРК преобладали холерики (44,5 %) и меланхолики (31,9 %), что достоверно выше, чем в популяции, а количество сангвиников было снижено (р < 0,05) (табл. 1). Различные формы СРК отличались частотой встречаемости отдельных типов высшей нервной деятельности. Если при СРК с преобладанием запоров преобладали меланхолики — 74,1 % (р < 0,05), то среди пациентов с преобладанием поносов и чередованием поносов и запоров доминировали холерики (76,2 и 66,7 % соответственно; р < 0,05), что в 3–4 раза выше, чем в общей популяции. Следовательно, у больных СРК отмечается снижение встречаемости стабильных типов высшей нервной деятельности — сангвиников и флегматиков и выявлено преобладание неуравновешенного, сильного типа — холериков и нестабильного, слабого типа — меланхоликов, что создает предпосылки для модификаций эмоционального поведения.
Реактивная и личностная тревожность у больных СРК, лечившихся в стационаре, была высокой (реактивная — 70,8 % больных, личностная — 81,9 % пациентов). При этом наиболее высокая личностная тревожность выявлена у больных СРК с преобладанием запоров, а реактивная тревожность была максимальной у пациентов с чередованием поносов и запоров. Частота встречаемости больных СРК со средней реактивной тревожностью колебалась при различных формах от 23,8 % у больных с преобладанием поносов до 37,0 % у пациентов с преобладанием запоров, а низкая реактивная тревожность не была выявлена ни у одного больного. Показатели личностной тревожности отражают устойчивость человека к стрессовым ситуациям, его прошлый опыт, а уровень реактивно-ситуационной тревожности определяет психоэмоциональный ответ и влияние различных социально-психологических факторов. Болезнь, госпитализация, пребывание в стационаре индуцируют стрессорную реакцию, на которую организм пациента не всегда отвечает адекватно, что может реализовываться в депрессивных состояниях и приводить к изменению психосоматических, эмоциональных и поведенческих реакций.
Таким образом, СРК чаще развивается у лиц с несбалансированной высшей нервной деятельностью, преимущественно холериков и меланхоликов, а эпизоды активности заболевания сопровождаются высокой реактивной и личностной тревожностью, что может отражать модификации эмоционального поведения.
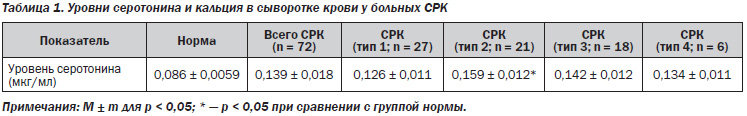
У всех больных СРК уровень серотонина в сыворотке крови был повышен — 0,139 ± 0,018 мкг/мл (р < 0,05). При этом максимально повышенным уровень серотонина был у больных СРК с преобладанием поносов — 0,159 ± 0,012 мкг/мл (р < 0,05), а у пациентов с СРК с запорами он был несколько ниже, чем в целом по группе, — 0,126 ± 0,011 мкг/мл, хотя достоверно превышал нормальные показатели. У больных СРК с чередованием поносов и запоров, так же как и у больных с недифференцированным типом СРК, уровень серотонина сыворотки крови был недостоверно ниже, чем у пациентов с поносами, но выше, чем у больных с запорами. При этом значительное увеличение концентрации серотонина в сыворотке крови (выше 0,150 мкг/мл) обнаружено у 22 (30,6 %) пациентов с СРК, в том числе у 10 (47,6 %) больных с поносами. У пациентов с СРК с преобладанием запоров значительное повышение его выявлялось только у каждого десятого больного — 3 (11,1 %) (р < 0,05). В группе пациентов с СРК с чередованием поносов и запоров частота встречаемости больных с различными степенями повышения серотонина была практически одинаковой. По-видимому, группы больных СРК третьего и четвертого типов являются наиболее полиморфными в отношении уровня серотонина, и поэтому необходимо уточнение дополнительных клинико-патогенетических особенностей течения заболевания для решения вопроса о назначении ингибиторов обратного захвата серотонина.
Таким образом, у всех больных СРК уровень серотонина в сыворотке крови был повышен, однако более выраженное повышение выявлено у пациентов с СРК с поносами, которые имели значительные нарушения моторики кишечника с выраженной висцеральной гиперчувствительностью, что обусловлено непосредственной активацией серотонином первичных афферентных нейронов подслизистого слоя кишечника [15]. Это может быть связано не только с его гиперпродукцией, но и с нарушением процессов серотонинопексии, обусловливающей более длительный срок высоких концентраций этого биогенного амина в сыворотке крови, что оказывает влияние не только на моторику кишечника, но и на активность серотонинергических структур ЦНС, способствуя модификации поведенческих реакций, повышению уровня тревоги.
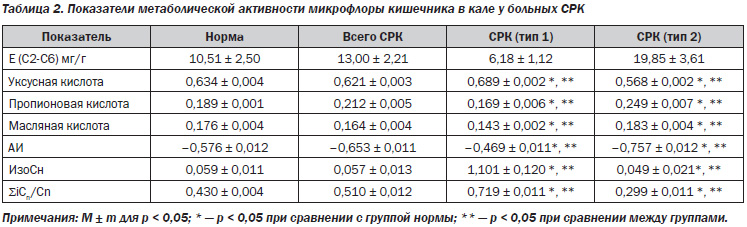
Изучение абсолютного содержания КЖК в кале у пациентов с СРК демонстрирует различные значения концентраций кислот по сравнению с нормой. Поскольку показатели метаболической активности микрофлоры кишечника у больных СРК с преобладанием запоров и СРК с преобладанием поносов были наиболее репрезентативными, а соответствующие данные у пациентов с 3-м и 4-м типом СРК занимали промежуточные значения, в данной статье проанализированы первые два типа СРК. Абсолютные концентрации КЖК могут быть выражены следующим рядом: СРК с запорами > норма > СРК с поносами (6,18 ± 1,12 > 10,51 ± 2,50 > > 19,85 ± 3,61 мг/г). Представленные изменения абсолютного содержания КЖК в кале могут быть связаны с количественным и качественным изменением состава микроорганизмов, среды их обитания, нарушением моторики, изменением иммунной реактивности и другими причинами [10]. При этом наблюдались разнонаправленные изменения концентрации отдельных КЖК: повышение относительного содержания уксусной кислоты, снижение доли пропионовой и масляной кислот (табл. 2).
Повышение доли уксусной кислоты может быть связано с резкой активизацией аэробных микроорганизмов, представителей патогенной и условно-патогенной микрофлоры кишечника (Enterobacret spp., Citobacter spp., Esherichia coli, Corynebacterium spp., Streptococcus faecalis, Staphilococcus spp., Pseudomonas spp., Bacillus spp., Campylobacter и др.). Активация аэробов в толстом кишечнике связана с угнетением анаэробной популяции (лактобактерии, бифидобактерии, бактероиды, пептострептококки, эубактерии, фузобактерии, пропионобактерии и др.) и отражает глубокий дисбаланс микробиоценоза, поскольку в норме соотношение между анаэробами и аэробами составляет 10 : 1 [11].
Низкие концентрации пропионовой кислоты могут объясняться как снижением активности и численности анаэробной флоры в кишечнике, так и повышенной абсорбцией пропионата. Градиент рН слизистой и серозной оболочек в дистальных отделах кишечника, равный 6,8/7,4, способствует повышению абсорбции пропионата [12]. Поэтому снижение градиента рН, вызванное микробиотическими сдвигами, будет способствовать повышенному проникновению ионизированной формы пропионата в клетку, ее ацидификации, активации Na+-H+-обменника и поступлению Na+ в клетку, что вызывает пассивную диффузию Н2О в клетку и снижение содержания воды в полости кишечника. Кроме того, масляная кислота также стимулирует абсорбцию Na+ в дистальных отделах кишечника, что может нарушать процессы секреции и реабсорбции, изменять реологические свойства слизи. К тому же, пропионат и бутират способны индуцировать сократительную активность гладких мышц за счет влияния на кислото-чувствительный кальций-зависимый миогенный механизм [10].
Бутират обладает способностью влиять на процессы дифференцировки эпителия и клеточного роста, блокируя клеточный цикл в ранней фазе G1, что приводит к апоптозным изменениям клеток, таким как конденсация хроматина и гипоплоидия ядра [12]. Апоптоз не наблюдается в присутствии ингибиторов кальмодулина [16], что подтверждает мессенджерную функцию кальмодулина в реакциях апоптоза, индуцированных повышением уровня масляной кислоты и внутриклеточной концентрацией Са. По-видимому, изменение уровня масляной кислоты в кишечном содержимом у больных СРК будет влиять на интенсивность пролиферативных, секреторных процессов в толстом кишечнике.
При изучении относительного содержания изокислот и содержания соотношения изокислоты/короткоцепочечные жирные кислоты с неразветвленной цепью (SiCn/Cn) была отмечена гиперпродукция изокислот, что объясняется увеличением активности аэробной микрофлоры, обладающей наибольшей протеолитической активностью. Увеличение протеолиза пептидов слизи будет отражаться на снижении вязкостных характеристик слизи, ее повышенной секреции у больных СРК. Отмечалось смещение АИ, отражающих окислительно-восстановительный потенциал внутрипросветной среды, в область слабоотрицательных значений по сравнению с нормой. Это также свидетельствует об изменении состава микрофлоры кишечника в связи с переключением метаболизма эпителиоцитов с цикла Кребса на активацию гексозомонофосфатного шунтирования [10], что и отображается на изменении профиля С2-С4 кислот.
Усиление метаболической активности аэробной микрофлоры с увеличением доли уксусной кислоты и снижением пропионовой и масляной кислот было характерно для больных СРК с преобладанием запоров и сопровождалось снижением секреторной и сократительной активности толстого кишечника. АИ были смещены в область слабоотрицательных значений, что приводит к увеличению продукции токсичных форм кислорода, активации процессов перекисного окисления липидов. На этом фоне начинают активно продуцировать условно-патогенные штаммы аэробных микроорганизмов — «аэробизация» среды. Подобные изменения характеризуют стрессовое воздействие на эпителий кишечника, приводят к нарушению окислительно-восстановительного потенциала в приэпителиальной зоне, просвете кишечника. Изменение продукции изокислот у больных СРК с запором и их соотношения с КЖК было повышено, что также объясняется увеличением активности аэробной микрофлоры, обладающей выраженными протеолитическими свойствами (кишечные палочки, фекальные стрептококки рассматриваются как сильнейшие протеолитики), и способствует повышению вязкостных характеристик слизи [10, 11].
Увеличение доли пропионовой и масляной кислот при резком снижении концентрации уксусной кислоты соответствовало увеличению анаэробного спектра микрофлоры, было характерно для СРК с преобладанием поноса и вызывало повышение секреторной функции эпителия, пропульсивной активности кишечника. АИ были смещены в область резко отрицательных значений по сравнению с нормой, что приводит к активации анаэробного типа гликолиза, угнетению жизнедеятельности облигатных анаэробов за счет блокирования терминальных ферредоксинсодержащих ферментов и активизации условно-патогенных штаммов анаэробов, в частности штаммов условно-патогенных бактероидов, клостридий, клебсиелл. При этом в отличие от больных СРК с запорами, у которых преобладала аэробная флора, КЖК, вырабатываемые анаэробными бактериями, подавляют способность фагоцитов к эффективной борьбе с бактериями и вызывают «паралич» нейтрофилов. Незавершенный фагоцитоз может быть следствием снижения продукции фагоцитами свободных радикалов кислорода [18]. Значения относительного содержания изокислот и содержания соотношения изокислоты/короткоцепочечные жирные кислоты с неразветвленной цепью (SiCn/Cn) у больных СРК 2-го типа были низкими, что характеризуется увеличением активности анаэробов (рода Bacteroides spp.), имеющих слабую протеолитическую активность и усиление экскреции слизи с фекальными массами.
Выводы
Разнонаправленные нарушения кишечного дисбиоза, метаболизма КЖК коррелировали с изменениями уровня серотонина сыворотки крови, что может обусловливать клинико-патогенетические различия типов СРК.
Таким образом, СРК чаще развивается у холериков и меланхоликов, а эпизоды активности заболевания сопровождаются высокой реактивной и личностной тревожностью, которые сочетаются с повышением серотонинемии, разнонаправленными изменениями уровня кальция сыворотки крови и короткоцепочечных жирных кислот кала. Клинико-психологические особенности СРК, а также уровень серотонина сыворотки крови и КЖК кала необходимо учитывать при назначении индивидуализированной терапии таким больным.
1. Дзяк Г.В., Залєвський В.І., Степанов Ю.М. Функційні захворювання кишечника. — Дніпропетровськ: ПП «Ліра ЛТД», 2004. — 200 с.
2. Маев И.В., Черемушкин С.В. Синдром раздраженного кишечника. Римские критерии III // Гастроэнтерология. — Приложение к Consilium medicum. — 2007. — Т. 9., № 1. — С. 11.
3. George F. Longstrrth, eds. Functional bowel disorders // Gastroenterology. — 2006. — 130. — 1480-1491.
4. Жуков Н.А. и соавт. Современные представления о патогенезе синдрома раздраженного кишечника // Клиническая медицина. — 2003. — № 12. — С. 7-12.
5. Дорофеева Г.Д., Бондарь Л.С., Нофаль Али Нджм. Особенности вегетативного статуса, уровней серотонина и гистамина у детей с синдромом раздраженного кишечника // Український медичний альманах. — 2001. — Т. 4, № 3. — С. 59-62.
6. Кляритська І.Л., Курченко М.Г. Сучасні підходи до лікування синдрому роз’ятрених кишок // Нова медицина. — 2003. — № 6. — С. 34-37.
7. Бархатова В.П., Завалишин И.А. Нейротрансмиттерная организация двигательных систем головного и спинного мозга в норме и патологии // Журн. невропатол. и психиатрии. — 2004. — № 8. — С. 77-80.
8. Заморський І.І., Резніков О.Г. Агоністи та антагоністи серотонінових рецепторів: реалії та перспективи клінічного застосування // Журн. АМН України. — 2004. — № 3. — С. 429-445.
9. Weisshaar E., Duncer N., Rohl F.W., Gollnick H. Antipruritic effect of two different 5НТ3 receptor antagonist and an antihistamine in haemodialisis patients // Exp. Dermatol. — 2004. — Vol. 13. — P. 298-304.
10. Ардатская М.Д. Диагностическое значение короткоцепочечных жирных кислот при синдроме раздраженного кишечника // Российский журнал гастроэнтерологии, гепатологии, колопроктологии. — 2000. — № 3. — С. 36-41.
11. Ардатская М.Д. Дисбактериоз кишечника // Materia Medica. — 2003. — № 2–3. — С. 16.
12. Binder H.J., eds. Short Chain Fatty Acids / Falk Symposium 73. — 1993.
13. Clouse R.E. Pericrypt eosinophilic enterocolitis and chronic diarrhea // Gastroenterol. — 1992. — № 7. — P. 168-80.
14. Григорьев А.В. Желудочно-кишечный тракт как среда обитания бактерий. Раздел 1. Морфология желудочно-кишечного бактериального биотопа. — М.; К., 2004. — 95 с.
15. Ивашкин В.Т., Полуэктова Е.А., Белхушет С. Синдром раздраженного кишечника как биопсихосоциальное заболевание // Клинические перспективы гастроэнтерологии. — 2003. — № 6. — С. 2-9.
16. Маршалл В.Дж. Клиническая биохимия: Пер. с англ. — М.: Бином; СПб.: Невский диалект, 2002. — 348 с.
17. Кот Ю.Г. Вклад комплекса Са2+/кальмодулин в передачу сигнала о механическом напряжении в соединительной ткани // Вісник Харківського національного університету ім. В.Н. Каразіна. — 2005. — Вип. 1–2, № 709. — С. 44-47.
18. Белобородова Н.В., Белобородов С.М. Метаболиты анаэробных бактерий (летучие жирные кислоты) и реактивность макроорганизма. — РОО «Мир науки и культуры», 2006.