Газета «Новости медицины и фармации» №8 (762), 2021
Вернуться к номеру
Пробіз® Імуно: можливості й перспективи комплексного впливу на імунну відповідь при респіраторних інфекціях (частина перша)
Авторы: Гогунська І.В., Зарицька І.С.
ДУ «Інститут отоларингології ім. проф. О.С. Коломійченка НАМН України», м. Київ, Україна
Рубрики: Инфекционные заболевания
Разделы: Справочник специалиста
Версия для печати
До цього часу близько 1,5 тисяч збудників інфекційних захворювань визнано відповідальними за захворювання людей [1], і їх перелік, швидше за все, буде збільшуватися найближчими роками [2–4]. Серед найбільш поширеної інфекційної патології в усіх вікових групах одне з чільних місць посідають гострі респіраторні захворювання (ГРЗ). Так, у США дорослі хворіють на застуду приблизно два-три рази на рік, тоді як діти можуть мати до восьми випадків ГРЗ на рік [5–7]. Орієнтовні щорічні витрати у США, пов’язані з гострими респіраторними вірусними інфекціями (ГРВІ), за винятком грипу, перевищують 22 млрд доларів [8]. В Україні щорічно на ГРЗ хворіють 10–14 млн осіб, що становить 25–30 % загальної захворюваності й близько 75–90 % інфекційної захворюваності в державі [9]. Зокрема, проведене у 2017 році анкетування продемонструвало, що 74 % дорослого населення м. Одеси хворіють на ГРВІ 1–2 рази на рік (сезон) [10].
За даними Всесвітньої організації охорони здоров’я (ВООЗ), захворюваність на ГРЗ має постійну тенденцію до зростання, чому сприяють, зокрема, процеси глобалізації, урбанізації і посилення міжконтинентальних міграційних процесів. Гострі інфекції верхніх дихальних шляхів (риносинусит, середній отит, фарингіт/тонзиліт, ларингіт) і нижніх дихальних шляхів (трахеїт, бронхіт, бронхіоліт, пневмонія) можуть спричинятись як вірусами, так і бактеріями [9, 11]. Повітряно-крапельний і контактний шляхи передачі ГРЗ, висока сприйнятливість населення до вірусів-збудників обумовлюють швидкість і частоту поширення ГРЗ, особливо під час сезонних послаблень імунного захисту [9, 11]. Унаслідок високої мінливості антигенної структури, вірулентності циркулюючих вірусів і появи нових високопатогенних збудників ГРВІ досі є погано контрольованою інфекцією, а їх ускладнення становлять серйозну небезпеку, можуть бути фатальними або призводити до інвалідності [9–16].
Одним з найефективніших профілактичних заходів є набуття вакцинального імунітету до певного патогену. Однак вакцинація не завжди є можливою, зокрема у зв’язку з наявністю тимчасових або постійних протипоказань. Протягом досить тривалого періоду на початку пандемічної ситуації з коронавірусною інфекцією була відсутня вакцина від COVID-19. Донині всі присутні на ринку вакцини є такими, що були розроблені й досліджені у форс-мажорних умовах і дозволені ВООЗ до застосування в надзвичайній ситуації, їх безпека не вивчена повною мірою і відповідно до вимог до реєстрації вакцин. Про певні недоліки у вивченні безпечності вакцин від COVID-19 свідчить, наприклад, те, що починаючи з квітня 2021 р. у США повідомляється про збільшення випадків міокардиту й перикардиту після вакцинації іРНК COVID-19 (Pfizer-BioNTech і Moderna), особливо в підлітків і молодих людей. Центр контролю й профілактики захворювань США (CDC) продовжує рекомендувати вакцинацію проти COVID-19 для всіх людей віком від 12 років, враховуючи ризик захворювання на COVID-19 і пов’язані з ним можливі тяжкі ускладнення, такі як тривалі проблеми зі здоров’ям, госпіталізація і навіть смерть [17]. Крім того, досі має місце дефіцит вакцин, який особливо виражений у менш розвинених економічно країнах і ще не скоро буде подоланий.
Незважаючи на досягнення сучасної медичної науки, можливості етіотропного лікування для більшості вірусних респіраторних інфекцій обмежені [11, 16]. ВООЗ для профілактики й лікування грипу рекомендує застосування інгібіторів нейрамінідази, зокрема осельтамівіру й занамівіру [16].
Антибіотики мають обмежену ефективність у лікуванні більшої частини неускладнених ГРІ у дорослих і дітей. Більшість із цих станів, навіть за відсутності антибактеріального лікування, закінчуються одужанням, а ускладнення за відсутності антибіотикотерапії малоймовірні. Нераціональне призначення антибіотиків призводить до медикаментозно-індукованих побічних ефектів і сприяє поширенню стійких до антибіотиків мікроорганізмів у суспільстві [11, 16].
Переважна кількість ГРІ перебігають із симптомами, медикаментозна корекція яких значно покращує якість життя пацієнта впродовж перебігу хвороби [11, 16]. Хоча гарячковий респіраторний синдром при ГРЗ у більшості хворих самообмежується, деякі групи мають підвищений ризик тяжкого перебігу хвороби або смерті. Ці групи включають літніх людей, дуже молодих людей, а також осіб із супутніми хворобами, наприклад із серцево-легеневими, пацієнтів із цукровим діабетом, осіб з ослабленим імунітетом і вагітних [11, 16].
Імовірність захворювання на респіраторну інфекцію, її перебіг і розвиток ускладнень обумовлюється станом як загального, так і місцевого імунітету слизових оболонок дихальних шляхів. Захист здійснюється за допомогою двох систем — неспецифічного (вродженого, природного) і специфічного (набутого) імунітету. Неспецифічний імунітет виступає як перша лінія захисту і як заключна його стадія, а система набутого імунітету виконує функції специфічного розпізнавання, запам’ятовування чужорідного агента й підключення потужних засобів вродженого імунітету на заключному етапі процесу [18].
Незважаючи на складну організацію і досконалість захисних механізмів, будь-яке порушення їх функції може призвести до інфекційного захворювання. Запобігти «поломці» природного захисту організму допомагає комплекс заходів, що спрямовані на зміцнення природних захисних сил і підвищення активності імунної –системи.
Серед основних напрямків профілактики простудних захворювань виділяють такі:
- загартовування, здоровий спосіб життя, проведення гігієнічних заходів;
- специфічна імунізація (вакцинопрофілактика);
- застосування імуномодуляторів;
- вітамінопрофілактика [18].
Поінформованість споживачів, пошук альтернативних, безпечних та економічно вигідних методів лікування й стурбованість розвитком резистентності до антибіотиків змусили дослідників шукати альтернативу існуючим терапевтичним режимам, в основному залежним від антибіотиків. Серед великої кількості запропонованих варіантів терапія пробіотиками видається найбільш життєздатною, з довгою історією і гарантованою безпекою [19].
Пробіз® Імуно (виробник Unique Biotech, Індія) — комплексний біотерапевтичний препарат, який уже добре зарекомендував себе в Україні, як основний компонент він містить штам Unique IS-2 виду B.coagulans (BC Uni-IS-2), який на сьогодні є одним з найбільш перспективних пробіотичних засобів.
За даними метааналізу результатів 52 рандомізованих клінічних досліджень, найважливіші докази на користь пробіотиків отримані щодо профілактики або лікування 5 порушень: некротизуючого ентероколіту, гострої інфекційної діареї, гострих інфекцій дихальних шляхів, діареї, пов’язаної з антибіотиками, і дитячих кольок (Liu Y. et al., 2019). Основні механізми дії пробіотичних препаратів: пригнічення адгезії бактерій; посилення бар’єрної функції слизової оболонки; модуляція вродженої та адаптивної імунної системи (включно з індукцією толерогенних дендритних клітин і регуляторних Т-клітин); секреція біоактивних метаболітів; регуляція роботи кишкової і центральної нервової систем [20].
У табл. 1 підсумовано дані стосовно механізмів імунотропної дії пробіотиків.
Відомо, що існує взаємний зв’язок між мікробіотою кишечника й печінкою (так звана вісь «кишечник — печінка») і центральною нервовою системою (через вісь «кишечник — мозок»). Більше того, останнім часом визнається вісь «кишечник — легені», оскільки кишкова мікробіота посилює активність альвеолярних макрофагів, відіграючи роль у захисті хазяїна при бактеріальних і вірусних інфекціях. Зростаючий обсяг досліджень підтверджує корисну роль пробіотиків не тільки при патології шлунково-кишкового тракту (ШКТ), але й при захворюваннях респіраторної і нервової системи і в підтриманні психічного здоров’я шляхом модуляції осей «кишечник — легені» і «кишечник — мозок» відповідно [23, 24].
Збільшується доказова база того, що шлунково-кишковий мікробіом є важливим гравцем в імунній системі, а порушення симбіотичних стосунків між мікробіомом ШКТ і системою імунітету може негативно вплинути на розвиток і перебіг інфекційних захворювань [25, 26].
Численні рандомізовані клінічні дослідження як серед дітей, так і серед дорослих, а також їх метааналізи продемонстрували, що певні пробіотичні штами можуть зменшити частоту, тривалість і/або ступінь тяжкості ГРЗ і покращити імунну відповідь на вакцинацію проти збудників респіраторних інфекцій у різних популяціях [26–36].
На сьогодні особливо актуальним є пошук ефективного лікування інфекції, спричиненої пандемічним коронавірусом SARS-CoV-2. Оскільки дієві противірусні препарати відсутні до цього часу, а доступність вакцин залишається обмеженою, пробіотики можуть бути цінною альтернативою для профілактики й полегшення перебігу коронавірусної інфекції. Недавні дослідження демонструють, що, хоча інфекція SARS-CoV-2 є захворюванням з початковими респіраторними проявами, має місце тісний взаємозв’язок між кишковим мікробіомом і тяжкістю клінічних проявів у пацієнтів з COVID-19 [37–40].
Застосування пробіотичних препаратів для запобігання респіраторним інфекціям і їх лікування сприяє суттєвому зменшенню економічного тягаря грипоподібних ГРЗ [35, 41, 42]. Результати аналізу I. Lenoir-Wijnkoop et al. (2016, 2019) продемонстрували, що використання пробіотиків дозволяє заощадити витрати, пов’язані з непрацездатністю хворих на ГРЗ, і запобігти застосуванню антибіотиків [42]. Якщо врахувати втрату продуктивності, загальна економія суспільства може становити 784 млн і 1,4 млрд доларів США для сценаріїв YHEC і Cochrane відповідно [42].
Пробіотичні спороутворюючі бактерії виду Bacillus coagulans уперше були виділені із зіпсованого консервованого молока Хаммером у 1915 р. З того часу накопичено суттєву доказову базу, що підтверджує безпечне використання спороутворювачів як потенційних пробіотиків. Спори бактерій можуть виживати в умовах надзвичайної кислотності шлунка, у присутності жовчних солей і в інших несприятливих умовах ШКТ. Крім того, бактерії-спороутворювачі є більш стабільними при переробці й зберіганні харчових і фармацевтичних препаратів, що сприяє комерціалізації штамів Bacillus із пробіотичними атрибутами у вигляді різноманітного асортименту біологічно активних добавок [19].
Різні види Bacillus використовувались для виробництва додаткових нутрицевтиків, включно з вітамінами, зокрема рибофлавіном, кобаламіном, інозитолом і каротиноїдами [43–45].
Повідомляється, що різні штами Bacillus виявляють антимікробну, антиоксидантну й імуномодулюючу активність, що пов’язана з їх здатністю продукувати антимікробні пептиди, дрібні позаклітинні ефекторні молекули і змогою взаємодіяти з хазяїном за допомогою адгезії [46].
Bacillus coagulans здатна відновлювати екологічний баланс кишкової мікробіоти шляхом пригнічення розмноження патогенних мікроорганізмів синтезованими бактеріоцинами. Очищений бактеріоцин Bacillus coagulans виявляв широкий спектр антимікробної дії проти клінічно значущих патогенів [47].
Також Bacillus coagulans чинить імуностимулюючу дію: зменшує співвідношення Тh2/Тh1, підвищує вміст Т-хелперів 1-го типу, що запускають реакції клітинного імунітету, активує природні кілери, що також підсилює клітинний імунітет. Крім того, Bacillus coagulans стимулює перетворення В-клітин у плазматичні клітини, стимулює синтез IgM, IgG1, IgG2a, IgG2b, IgA і знижує викид IgE. Отже, у присутності Bacillus coagulans посилюється вираженість гуморального імунітету в організмі людини. При цьому підвищення секреції IgA сприяє більш ефективній боротьбі з патогенними бактеріями на поверхні слизових оболонок, у той час як зниження викиду IgE допомагає в подоланні симптомів алергічних захворювань [48].
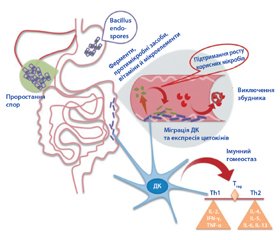
На рис. 1 відображено можливі механізми корисної дії спороутворюючих пробіотиків Bacillus (SFBP) [19].
Ефективність застосування різних штамів виду Bacillus coagulans як одного з найбільш перспективних пробіотиків вивчена щодо лікування багатьох захворювань людини й запобігання їм [49].
У рандомізованому подвійному сліпому плацебо-контрольованому дослідженні доведено ефективність B.coagulans проти гострих інфекцій верхніх дихальних шляхів і гастроінтестинальних інфекцій у дітей 6–8 років. При застосуванні Bacillus coagulans суттєво зменшилась частота виникнення симптомів ГРЗ, зокрема закладеності носа, кров’янистого носового слизу, свербіння в носі й хрипоти. Також зменшилась тривалість хрипоти, головного болю, почервоніння очей і втоми, пов’язаних з ГРЗ. Суттєво знизилась частота метеоризму при кишкових інфекціях. Ці сприятливі ефекти на симптоми інфекції верхніх дихальних шляхів і ШКТ були пов’язані з модуляцією імунної системи, оскільки В.coagulans змінив сироваткові рівні TNF-α, CD163, G-CSF, ICAM-1, IL-6, IL-8, MCP-2, RAGE, uPAR і PF4. Отже, ці результати свідчать про те, що В.coagulans можна використовувати як функціональний інгредієнт із позитивними імуномодулюючими властивостями в дітей [50].
Bacillus coagulans Unique IS2TM (MTCC 5260, ATCC PTA-11748) — це факультативний анаероб, грампозитивний спороутворюючий нетоксичний комерційний штам [51].
Метаболічний аналіз SEED виявив 2638 функціональних генів (434 підсистеми), з яких найбільша кількість припадає на центральний вуглеводний обмін (501 ген, включно з ксилозою, сахарозою, мальтозою й утилізацію мальтодекстрину й хітину), амінокислоти й похідні (361 ген), білковий обмін (240 генів), кофактори й вітаміни (197 генів), метаболізм РНК (142 гени), спороносіння і спокій (92 гени) і реакція на стрес (84 гени). Генерація повної генетичної будови B.coagulans Unique IS-2 виявила багато цікавих пробіотичних ознак і пролила світло на молекулярний механізм пробіотичних та інших корисних властивостей штаму, дозволила підтвердити безпечність пробіотика для широкого використання у фармацевтичній і харчовій галузях [52].
R. Sudha et al. (2010) виконали дослідження фенотипу й генотипу штаму BC Uni-IS-2, який був виділений з калу людини після перорального застосування. Філогенетичне дерево, побудоване за допомогою програми Clustal W на основі послідовності гена 16S рРНК, додатково підтвердило, що штам BC Uni-IS-2 утворив когерентний кластер з двома іншими штамами B.coagulans, а саме B.coagulans ATCC 7050 і Bacillus coagulans NCIM 2030. Оцінка його пробіотичних атрибутів показала, що Bacillus coagulans Unique IS-2 має багатообіцяючу перспективу пробіотичних властивостей з огляду на його виживання в шлунково-кишкових умовах, змодельованих in vitro, і, отже, пропонує чудові можливості для його успішної комерціалізації як біотерапевтичного агента [51].
Перевага штаму BC Uni-IS-2 полягає в тому, що він є дуже стійким до жорстких виробничих процесів, що дозволяє вводити його в будь-яку лікарську форму без втрати життєздатності на відміну від вегетативних лактобактерій і Bifidobacterium spp., які не витримують важких процесів і потребують охолодження.
Для підтвердження високого рівня виживаності й проростання BC Uni-IS-2 була використана високодосконала модель in vitro «Симулятор мікробної екосистеми кишечника людини (SHIME®)». Результати показали відмінні показники виживання як в умовах голодування, так і під час годування (99 % +). B.coagulans Unique IS-2 розпочинають проростання у вегетативну клітину в тонкому кишечнику й продовжують його в товстому кишечнику. У товстій кишці вегетативні клітини змогли виробляти молочну кислоту й ацетат (також продукуються молочнокислими бактеріями) [53].
Штам BC Uni-IS-2 може синтезувати –різноманітні травні ферменти, антимікробні молекули (включно з бактеріоцинами), вітаміни групи В (В3, В5, В6, В7, В9, В12) і вітамін К [54, 55].
BC Uni-IS-2 показав позитивний результат тесту на каталазу й оксидазу і негативний — на гідроліз індолу й желатину. Отже, B.coagulans Unique IS-2 містить фермент для нейтралізації перекису водню і має цито–хром С у своєму дихальному ланцюгу, але не здатний розщеплювати триптофан з утворенням індолу й гідролізом желатину [51, 56, 57].
Гостра й підгостра пероральна токсичність штаму BC Uni-IS-2 (MTCC-5260) вивчалась у експерименті на щурах. У дослідженні не було виявлено жодних змін у параметрах, що вивчались (клінічні ознаки, маса тіла, прийом їжі, аналіз сечі, гематологічні дослідження, клінічна хімія, патогістологія), через 14 і 28 днів застосування штаму. Bacillus coagulans Unique IS-2 не виявляв жодних ознак токсичності до дози 1300 мг/кг маси тіла (5 ∙ 109 КУО/г) при введенні протягом 14 днів, тобто відповідав рівню відсутності побічної дії (No Observed Adverse Effect Level — NOAEL). Ці результати дозволяють розглядати штам Bacillus coagulans Unique IS-2 як непатогенний і безпечний для споживання людиною [58].
FDA підтвердила статус GRAS (Generally Recognized as Safе — «загальновизнаний як безпечний») для BC Uni-IS-2 [59]. Безпека спороутворюючого препарату B.сoagulans Uni-IS-2 пройшла суворий процес оцінки для визначення його GRAS, оскільки оцінювались його ізоляція, ідентифікація, характерні властивості, спосіб виробництва, оцінки дієтичного впливу й дані досліджень. Цей статус робить BC Uni-IS-2 чудовим варіантом інгредієнта не тільки біологічно активних добавок, але й різних харчових продуктів [60].
Опубліковані численні результати дослідження ефективності застосування BC Uni-IS-2 при різних патологіях як у дорослих, так і в дітей. На цей час існує суттєва доказова база щодо ефективності BC Uni-IS-2 при патології кишечника (гостра діарея, функціональний запор, функціональний біль у животі, синдром подразненого кишечника) у дітей і дорослих [61–67]. Продемонстровано відсутність суттєвих відмінностей між групами BC Uni-IS-2 і плацебо щодо побічних ефектів і безпеки.
За результатами дослідження виявлено, що споживання жувальних таблеток з умістом BC Uni-IS-2 позитивно модулює запальну реакцію при гінгівіті й зубному нальоті. Пробіотик BC Uni-IS-2 у вигляді жувальної таблетки ефективно зменшує і пригнічує карієс за рахунок впливу на рівень Streptococcus mutans і лактобактерій у слині й зубному нальоті в дітей [68].
Відповідно до опублікованих результатів багатьох досліджень рекомендовано використання пробіотичних продуктів з метою зменшення ризику раку. Зокрема, було вивчено антимутагенний потенціал BC Uni-IS-2 проти штамів TA98 і TA100 Salmonella typhimurium. Продемонстровано значну антимутагенність щодо мутагену азиду натрію — інгібування 93–97 % і 62–88 % ревертантів, індукованих азидом натрію в штамах TA98 і TA100 відповідно. Зроблено висновок, що антимутагенність штаму BC Uni-IS-2 привертає увагу до його хіміопрофілактичної і фармакологічної важливості й перспективи застосування як біотерапевтичного засобу [69].
Аналіз цитотоксичності показав зменшення клітинної проліферації клітин COLO 205, HeLa і K562 у присутності BC Uni-IS-2 порівняно з нераковими клітинами HEK 293T. Для подальшого підтвердження індукції апоптозу бактеріями BC Uni-IS-2 пік sub-G0-G1 клітинного циклу кількісно визначали за допомогою проточного цитометра й отримали 40 % апоптозу клітин у культурі COLO 205, оброблених BC Uni-IS-2, порівняно з необробленими контрольними клітинами. Вестерн-блот-аналіз показав збільшення проапоптотичного білка BAX, зменшення антиапоптотичного білка Bcl2, зменшення мітохондріального мембранного потенціалу, збільшення вивільнення цитохрому С та активності каспази-3 і розщеплення полі(АДФ-рибоза)полімерази. Автори публікації припускають, що BC Uni-IS-2 може бути ефективним в індукції апоптозу клітин раку товстої кишки і може розглядатися для ад’ювантної терапії в лікуванні раку товстої кишки [70]. У запобіганні респіраторним інфекціям і їх лікуванні велике значення мають протизапальні й імуномодулюючі властивості пробіотичного штаму. Протизапальну дію BC Uni-IS-2 оцінювали в щурів на моделі гострого запалення і підтвердили значне зменшення проявів запальної реакції, індукованої карагенаном [71].
Протизапальний ефект BC Uni-IS-2 також було вивчено з використанням індукованого ліпополісахаридом (ЛПС) запалення на клітинах макрофагів мишей лінії RAW 264,7 з визначенням рівня білка і РНК циклооксигенази-2 (ЦОГ-2) за допомогою імуноблоту й полімеразної ланцюгової реакції зі зворотною транскрипцією відповідно. Результати дослідження продемонстрували, що протизапальна дія BC Uni-IS-2 була опосередкована інгібуванням ЦОГ-2 і запальних цитокінів шляхом пригнічення активності NF-κB [72].
Імуномодулюючі ефекти вивчали з використанням ЛПС-активованих мононуклеарів периферичної крові шляхом кількісної оцінки цитокінів, що продукуються клітинами Th1 (TNF-α, IFN-, IL-2) і Th2 (IL-6, IL-10). Імуномодуляція була опосередкована через значне продукуванням цитокінів Th1. Дані свідчать про те, що термостійкий компонент супернатанту BC Uni-IS-2 зміг зменшити запалення за допомогою його модуляції [72].
В експерименті було підтверджено антимікробну дію бактеріоцину, екстрагованого з B.coagulans IS-2, як щодо грамнегативних (E.coli, S.enterica), так і щодо грампозитивних (L.monocytogenes) бактерій [54].
Отже, з огляду на вищенаведені дані численних експериментальних досліджень, рандомізованих контрольованих клінічних досліджень та оглядів і метааналізів B.coagulans Unique IS-2, який є основним компонентом біотерапевтичного засобу Пробіз® Імуно (виробник Unique Biotech, Індія), має суттєву доказову базу й перспективи щодо застосування як імуномодулюючого засобу, зокрема для запобігання респіраторним інфекціям і їх лікування.
Список литературы
Список літератури знаходиться в редакції

/10_m.jpg)
/12_m.jpg)