Газета «Новости медицины и фармации» №6 (758), 2021
Вернуться к номеру
Ревматическая полимиалгия в клинических рекомендациях 2018–2020 гг. Часть II: диагностика васкулита
Авторы: Пузанова О.Г.(1), Лызиков А.А.(2)
(1) — ЧВУЗ «Киевский медицинский университет», г. Киев, Украина
(2) — УО «Гомельский государственный медицинский университет», г. Гомель, Республика Беларусь
Рубрики: Ревматология
Разделы: Справочник специалиста
Версия для печати
С помощью современных методов
прижизненной диагностики не удается
получить доказательства обязательного
наличия ГКА у каждого больного РП,
хотя никогда нельзя быть уверенным
в полном отсутствии васкулита.
Н.В. Бунчук, 2010 [1, c. 131]
Введение
Частое сочетание ревматической полимиалгии (РП) с васкулитом [1–5] явилось основанием для обозначения ее термином polymyalgia arteritica, который был предложен 50 лет назад B. Hamrin, как и гипотеза о том, что РП является проявлением генерализованного гигантоклеточного артериита (ГКА) [6]. Говоря о возможности появления признаков ГКА в разное время после дебюта РП и не всегда в сочетании с лабораторными маркерами воспаления, Н.В. Бунчук (2010) назвал клиническое обследование определяющим методом диагностики васкулита, тогда как ультразвуковое исследование (УЗИ) позвоночных и сонных артерий — «уместным» и отметил необходимость применения магнитно-резонансной томографии (МРТ) и позитронно-эмиссионной томографии (ПЭТ) с 18F-фтордеоксиглюкозой (ФДГ) для выявления аортита [1, с. 106-108, 130-132]. По выражению M.A. Cimmino (2017), визуализирующие методы диагностики, такие как УЗИ, МРТ, ПЭТ и компьютерная томография (КТ), «разительно изменили наше понимание васкулитов крупных сосудов» (large vessel vasculitis, LVV), позволяя выявлять их как причину лихорадки, слабости и других неспецифических симптомов [7].
В Украине первые случаи диагностики LVV с помощью ФДГ-ПЭТ/КТ состоялись во Всеукраинском центре радиохирургии клинической больницы «Феофания» и были описаны С.И. Смиян и соавт. в 2014 г. [8]. В Республике Беларусь такие исследования выполняются в Республиканском ПЭТ-центре ГУ «Республиканский научно-практический центр онкологии и медицинской радиологии имени Н.Н. Александрова».
Визуализирующие методы обнаруживают LVV в 1/3 случаев клинически изолированной РП, что показал систематический обзор D. Camellino и соавт. [9]. Поздний ГКА при РП обычно является субклиническим аортитом: F. Liozon и соавт. выявляли его в 6 раз чаще, чем при классическом ГКА [10], подтверждая мнение экспертов клиники Мейо и других [4, 5] о решающей роли этих методов диагностики.
В случае выявления аортита при РП M.A. Cimmino и соавт. допускают его трактовку как РП-ассоциированного васкулита, ГКА, артериита Такаясу (при дебюте болезни в возрасте до 50 лет) или изолированного аортита (т.е. васкулита одного органа) [7]. Он также может быть связан с наличием ревматоидного артрита (РА), спондилоартрита, IgG4-заболевания, системной красной волчанки, синдрома Бехчета, синдрома Когана и ряда инфекций.
Опасность ГКА-аортита состоит в высоком риске развития аневризм и острого аортального синдрома в связи с разрывом или расслоением грудной аорты [11–13]. В патогенезе дилатации восходящей аорты имеет значение воспаление ее стенки [14] и ускоренное развитие атеросклероза на фоне приема глюкокортикоидов (ГК) [15]; вероятно, велика роль Chlamidia pneumoniae и анаэробов [16, 17]. За исключением атеросклероза и артериальной гипертензии (АГ), роль неинфекционных заболеваний в возникновении аортита и его осложнений неоднозначна. Так, ранее обсуждаемый протективный эффект сахарного диабета в отношении развития аневризм аорты, включая ГКА-ассоциированные [12, 18], связывают с применением метформина [19].
Болезни аорты — актуальная проблема медицины [16, 19–22]. Диагноз аневризмы аорты устанавливают при увеличении ее диаметра больше 50 % от исходного. Диаметр восходящей аорты больше 60 мм считается угрожающим в отношении вероятности разрыва и является показанием к хирургическому лечению. В последние 30 лет отмечался неуклонный рост количества операций, производимых по поводу расслоений и аневризм грудной аорты. Ежегодно на 100 тыс. населения выявляли 4–10 случаев расслоений и 5–10 случаев аневризм восходящей аорты, но истинная заболеваемость представляется большей в связи с асимптомным течением болезни до развития осложнений [17, 23]. Вопрос о программном скрининге на аневризмы грудной аорты у мужчин с ГКА был поднят в 2015 г. в Великобритании [12, 18]. D. Lariviere и соавт. назвали ГКА «самой частой формой аортита, которой присущи протяженные поражения, утолщение стенок и дистальное сужение просветов, особенно нисходящей аорты и подключичных артерий» [24]. По словам A. Saeyeldin и соавт., применение визуализирующих методов «остается единственным надежным подходом к диагностике и наблюдению аневризм грудной аорты» [25].
Аналитическим параметрам и практическим аспектам использования этих тестов при ГКА посвящен ряд публикаций [4, 5, 7, 12, 24, 26–28]. С помощью КТ- и МРТ-ангиографии выявляют характерные признаки LVV — циркулярное утолщение и контрастное усиление стенки, стеноз, окклюзию, дилатацию, аневризму сосуда. К МРТ-ангиографическим признакам васкулита относят также отек стенки сосуда, но патогномоничным он не является [7]. Цветовая допплерография при воспалении ветвей аорты выявляет темное гипоэхогенное утолщение их стенок — симптом «halo».
Говоря об отсутствии оптимального метода визуализирующей диагностики LVV, M.A. Cimmino и соавт. [7] считают основным ограничением применения УЗИ, МРТ и ПЭТ недостаток их сравнения с золотым стандартом — гистологическим исследованием. То же в отношении КТ отмечает P.M. Villiger [29]. В итоге важным компонентом диагностических решений остается клиническое суждение. Так, ПЭТ позволяет получить панорамное изображение аорты и ее ветвей, но чувствительность теста снижается уже после трех дней высокодозовой ГК-терапии, и особенно после десяти [30]. До недавнего времени применение ПЭТ не позволяло оценивать височные и интракраниальные артерии — из-за их малого размера и интенсивного поглощения ФДГ мозгом. Из-за отсутствия стандартизации сохранялись противоречия в интерпретации результатов ПЭТ/КТ. Изучение МРТ-ангиографии как теста для диагностики аортита выявило такое его преимущество перед КТ-ангиографией (в дополнение к отсутствию лучевой нагрузки), как возможность применения на 5-й день ГК-терапии: позитивная прогностическая ценность превысила 89 %. Тест оказался полезным и для диагностики височного артериита — с чувствительностью 93,6 % при сравнении с биопсией. Было показано преимущество ПЭТ/МРТ перед ПЭТ/КТ для выявления васкулита — по параметрам утолщения стенки и контрастного усиления сигнала на Т1-взвешенных сканах. При этом по состоянию на 2017 г. такая база данных доказательной медицины, как PubMed, содержала одинаковое количество сообщений об использовании МРТ и ПЭТ для диагностики LVV в клинических исследованиях [7].
Совершенствуя диагностику васкулита, методы комбинируют одновременно и последовательно. С. Löffler и соавт. подтвердили высокую чувствительность УЗИ при оценивании подключичных и подмышечных артерий, но низкую в отношении выявления аортита, воспаления артерий брюшной полости и нижних конечностей и рекомендовали ПЭТ/КТ как следующий этап диагностики. По их данным, чувствительность ультразвуковой диагностики ГКА достигает 80 %, а сочетание цветовой допплерографии с ПЭТ/КТ повышает ее на 16–20 % [27].
Как отмечает P.M. Villiger, УЗИ, МРТ и ПЭТ/КТ — высокоспецифичные методы диагностики LVV, ни один из которых не валидирован для контроля болезни (табл. 1) [29].
Включение РП в круг системных васкулитов, как и классификация субтипов LVV и ГКА и определение их дистракторов, остается предметом научных исследований и дискуссий. По мнению K.D. Lensen и соавт. [11], клинический спектр ГКА включает «классический» краниальный, изолированный крупнососудистый и смешанный субтипы. M.J. Koster и соавт. в согласовании с C. Dejaco [26] предложили перечень клинических дифференциально-диагностических признаков и симптомов РП и основных субтипов ГКА (табл. 2).
Как видно из табл. 2, клинически трудно различать именно РП и крупнососудистый ГКА. Их общие «очень частые» симптомы — лихорадка, снижение веса и проксимальные миалгии, «частые» — маркеры острой фазы. Распространенный при РП ремиттирующий серонегативный симметричный синовит с мягким отеком редко встречается при LVV, но при этом субтипе васкулита очень часто выявляют перемежающуюся хромоту конечностей, асимметрию пульса на них и шумы над экстракраниальными сосудами. Жевательная хромота и нарушения зрения не присущи ни РП, ни LVV (что подразумевает отсутствие этих факторов риска (ФР) развития необратимой слепоты и инсульта при обеих болезнях), но головная боль, отек и болезненность в височной области все же встречаются при васкулите крупных сосудов.
Вывод экспертов клиники Мейо состоит в важности физикальных методов диагностики LVV: у лиц с высокой вероятностью васкулита (т.е. у всех больных РП, а особенно при ее персистенции) нужно обязательно измерять артериальное давление (АД) на обеих руках, проводить аускультацию сердца и сосудов, оценивать пульс на сонных артериях и артериях конечностей. Выявление асимметрии АД и пульса на конечностях, диастолического шума на аортальном клапане или систолического шума на магистральных артериях является основанием подозревать LVV и показанием к последующей инструментальной визуализации [12, 26].
Хотя с позиций доказательной медицины ФР развития осложнений ГКА не могут быть прямо экстраполированы на РП, их следует учитывать. Это касается и основного предиктора инсульта, особенно у мужчин, — «новой» головной боли (височной, затылочной, лобной или генерализованной [31]), и предикторов слепоты — боли в челюсти, диплопии и аномалий височных артерий, и ФР развития аневризм аорты и смерти от их разрывов, таких как мужской пол, курение, атеросклероз и АГ [12]. Отметим, что в отсутствие ГКА ФР развития аневризм абдоминальной аорты является мужской пол, а ФР их разрыва — женский.
Современные рекомендации, посвященные РП, ГКА и болезням аорты
За прошедшее десятилетие был создан ряд международных и национальных рекомендаций, посвященных РП и ГКА (табл. 3). Наряду со специализированными ассоциациями, такими как Европейская лига борьбы с ревматизмом (EULAR) и Американская коллегия ревматологов (ACR) [32–34], Британские общества ревматологов и специалистов здравоохранения в ревматологии (BSR, BHPR) [35, 36], Французская рабочая группа по изучению васкулитов крупных сосудов (GEFA) [37], Немецкое общество ревматологов (DGRh), Австрийское общество ревматологии и реабилитации (ÖGR), Швейцарское общество ревматологов (SGR) [38], Итальянское общество ревматологов (SIR) [39], ведение васкулита крупных сосудов как междисциплинарную проблему отразили разработки Ассоциации научно-медицинских обществ Германии (AWMF) [40] и Европейской федерации головной боли (EFH) [31]. При этом лишь в 2020 г. опубликовано четыре руководства и в 2018 г. — три. Кроме того, были изданы рекомендации по диагностике и ведению заболеваний аорты Европейского общества кардиологов (ESC) [16] и консенсус по хирургическим заболеваниям аорты Общества кардиоваскулярных патологов и Европейской ассоциации кардиоваскулярных патологов [20]. Говоря о развитии при РП острого аортального синдрома в связи с патологией грудной аорты, отметим ряд международных рекомендаций последних лет по скринингу, диагностике и лечению аневризм брюшной аорты [19, 21] — прежде всего у пожилых, но без выделения такой группы риска, как больные РП/ГКА. Заслуживают внимания и алгоритмы, предложенные экспертами клиники Мейо и другими для оптимизации ведения пациентов с подозрением на LVV и мониторинга аортита [12, 13, 26].
Рекомендации EANM/SNMMI/PIG/ASNC (2018) по применению ФДГ-ПЭТ/КТ(A) при васкулитах крупных сосудов и РП
Включение ПЭТ в стандарты ведения РП (как дополнительного диагностического теста для выявления васкулита) впервые произошло в 2020 г. при разработке первого итальянского клинико-практического руководства [39]. В его прототипе — руководстве DGRh/ÖGR/SGR (2018) по ведению РП в Германии, Австрии и Швейцарии — были учтены итоги систематического обзора 30 исследований, посвященных визуализирующим методам диагностики ГКА, но рекомендаций о применении ПЭТ в клинической практике сделано не было [38]. Тогда же Европейская ассоциация ядерной медицины (EANM) и Общество ядерной медицины и молекулярной визуализации (SNMMI), а именно их профильные комитеты и рабочая группа по изучению ПЭТ (PIG), разработали руководство по применению ФДГ-ПЭТ/КТ при васкулитах крупных сосудов и РП, которое было одобрено Американским обществом ядерной кардиологии (ASNC) [42]. Его целевой аудиторией названы радиологи и клиницисты, а содержание касается подготовки и выполнения процедуры и интерпретации результатов у лиц с предполагаемым LVV и РП.
Нами проведен контент-анализ этого документа и сравнительный анализ его положений с современными руководствами по РП, ГКА и болезням аорты (см. табл. 3) и ранее разработанными руководствами обществ ядерной медицины по применению ФДГ-ПЭТ/КТ при опухолях, инфекциях, атеросклерозе, саркоидозе [43–48]. Кроме того, с использованием поисковой системы Google, поисковых терминов polymyalgia rheumatica и positron emission tomography и метода перехода по ссылке проведен поиск статей, опубликованных в рецензируемых журналах в 2018–2020 гг., выполнен контент-анализ их названий и резюме. В итоге отобрано и изучено 87 публикаций, включая 28 изданных после 2018 г. и не включенных в обсуждаемые рекомендации.
Известно, что гибридный метод ФДГ-ПЭТ/КТ позволяет получать изображения, отражающие и активность метаболизма глюкозы (по степени захвата ФДГ), и структурные изменения в результате проведения одного исследования на одном оборудовании. Указав на сильную связь между степенью захвата ФДГ сосудистой стенкой и степенью ее инфильтрации макрофагами, а также преимущественное использование именно этого радиофармпрепарата для визуализации атеросклеротических бляшек, F. Hyafil и соавт. называют ФДГ-ПЭТ «признанным методом диагностики и мониторинга активности воспаления» при атеросклерозе [49]. В последние годы активно изучаются возможности применения ФДГ-ПЭТ/КТ для диагностики, мониторинга и прогнозирования исходов воспалительных болезней кишечника, IgG4-заболевания, поликистоза почек, ВИЧ-ассоциированных болезней, инфекций протеза сустава и др.
Точность ФДГ-ПЭТ/КТ как теста на выявление воспаления суставных структур и околосуставных тканей безусловно значима для дифференциальной диагностики РП с рядом ревматических болезней с поздним дебютом, инфекциями и опухолями [50–54]. Но и в итальянском руководстве 2020 г. [39], и в его прототипах [33, 38] предпочтение в этом аспекте отдано клинико-анамнестическому методу исследования и клиническому суждению: «Реальную потребность в дополнительных тестах должен определять лечащий врач во избежание избыточных скринингов, менее полезных пациенту, чем затраченные на них ресурсы» [42].
Говоря о периферическом артрите как атипичном признаке, требующем консультации ревматолога и являющемся ФР паранеопластического характера РП при вовлечении ≥ 6 суставов [41], укажем, что вовлечение коленных, лучезапястных и грудино-ключичных суставов [1, 38] оказалось почти присущим этой болезни: частота выявления гонита с помощью ПЭТ составила 50 % [55]. Что касается периартикулярного захвата ФДГ, то его излюбленной локализацией при РП является плечевой пояс [56].
В связи с этим в итальянском руководстве по РП [39] предложено применять ФДГ-ПЭТ/КТ как тест с высокой диагностической точностью (доказательная база — 2В, т.е. нерандомизированные исследования) только для выявления васкулита на этапе специализированной помощи (уровень доказательности — 5D, т.е. мнение экспертов). Это соответствует другим рекомендациям 2018–2020 гг. [31, 34, 36, 40] о подозрении на ГКА крупных сосудов как основном показании к данному тесту. Так, EULAR (2018) не рекомендует КТ и ПЭТ для оценки воспаления краниальных артерий, но допускает их использование (наряду с УЗИ и МРТ) «для выявления воспаления стенок и/или изменений просвета экстракраниальных артерий, подтверждающих диагноз LVV-ГКА» [34]. Позиция ревматологов Великобритании (BSR, 2020) состоит в том, что «для оценки поражения аорты и ее проксимальных ветвей можно использовать ФДГ-ПЭТ, МРТ- или КТ-ангиографию, а также цветовую допплерографию подмышечных артерий» [36]. Немецкая ассоциация AWMF (2020) дает две рекомендации: «При подозрении на преимущественное вовлечение экстракраниальных сосудов показаны МРТ/МРТ-ангиография, ПЭТ/КТ или ПЭТ» и «Для (дополнительной) оценки поражения аорты при преимущественно краниальном ГКА возможно применять МРТ, КТ или ПЭТ/КТ» [40]. Наконец, EFH (2020) рекомендует неврологам Европы при подозрении на экстракраниальный ГКА выполнять именно ФДГ-ПЭТ/КТ [31], что соответствует итальянским рекомендациям.
По результатам применения ПЭТ/КТ при РП частота выявления LVV-ГКА достигает 20–30 % при «изолированной» РП и 40 % при РП с признаками васкулита [9, 57, 58]. Это существенно влияет на прогноз и лечебную тактику. Некоторые авторы считают, что при сильном клиническом подозрении на ГКА от проведения ПЭТ/КТ не должны удерживать даже отрицательные результаты биопсии (т.е. отсутствие артериита с преобладанием мононуклеарной инфильтрации или гранулематозного воспаления с наличием гигантских многоядерных клеток), УЗИ (т.е. отсутствие симптома «halо») и МРТ (т.е. отсутствие отека и утолщения стенки аорты) [59, 60]. В связи с этим представляет интерес моноцентровое исследование D. Prieto-Peña и соавт. [61], по итогам которого наилучшими предикторами позитивных результатов ФДГ-ПЭТ/КТ (т.е. выявления LVV) при «классической» РП оказались воспалительная боль в нижней части спины (отношение шансов (ОШ) 4,7; 95% доверительный интервал (ДИ) 1,03–21,5), тазовая боль (ОШ 4,9; 95% ДИ 1,50–16,53) и воспалительная боль в нижних конечностях (ОШ 8,8; 95% ДИ 1,7–46,3). В данном случае использовали классификационные критерии EULAR/ACR 2012 г. [29], тест провели у 84 больных РП (средний возраст 71,4 года, доля женщин — 60,7 %), основным показанием к нему была персистенция РП, и частота позитивных результатов составила 60,7 %.
Таким образом, применяя ФДГ-ПЭТ/КТ у пациентов с «классической» РП, в каждом втором случае можно выявить артрит или периартрит коленных суставов, в каждом третьем — воспаление –аорты и ее проксимальных ветвей (особенно при наличии воспалительной боли в спине, тазе, нижних конечностях). При персистенции признаков РП крупнососудистый васкулит имеет место в большинстве случаев.
При невыявлении ГКА диагностическая роль ПЭТ/КТ тоже велика: обычно ее результаты позволяют определить другие причины системного воспаления у пожилых, включая инфекции и злокачественные опухоли (для чего метод и был исходно разработан). B.H. De и соавт. допускают ее «синергичное значение… для оптимальной диагностики, мониторинга активности болезни и оценки прогрессирования повреждений при васкулите крупных сосудов» [60], что ранее предположили I. Einspieler и соавт. для ПЭТ/МРТ [59, 62].
Тем не менее в итальянском руководстве 2020 г., впервые обозначившем перспективы клинического применения гибридных тестов при РП, отмечена «неопределенная роль визуализирующих методов» и для диагностики, и для мониторинга терапии [39]. Это утверждение основано на выводе EANM/SNMMI/PIG/ASNC (2018), представленном в табл. 4 как «консенсусное положение» по применению ФДГ-ПЭТ/КТ(A) при LVV и РП [42]. К тому времени были изданы протоколы этих обществ по проведению ФДГ-ПЭТ для диагностики инфекций (2013) [43], опухолей (2015) [44] и поражений сердца (2013) [45], в т.ч. при саркоидозе (2017) [46], и встал вопрос о разработке стандарта для выявления LVV и РП. Основным ограничением применения ФДГ-ПЭТ/КТ(А) эксперты сочли «отсутствие международного консенсуса по определению васкулита и/или РП на основе интенсивности и паттерна захвата ФДГ». Фактором, мешающим интерпретации результатов ФДГ-ПЭТ, была названа «активность атеросклероза» [42].
Как видно из табл. 4, большинство утверждений EANM/SNMMI/PIG/ASNC (2018) поддержано уровнем доказательности II (т.е. первичными исследованиями, но не метаанализами). Лучше всего обосновано положение о «возможности обнаружения с помощью КТ-ангиографии структурных изменений сосудов и осложнений васкулита» (класс доказательности II, сила рекомендации A). Положение о высокой эффективности применения ФДГ-ПЭТ для выявления LVV и РП основано на доказательствах такого же уровня (II-В), как и итальянская рекомендация 2020 г. в отношении ФДГ-ПЭТ/КТ. Слабыми доказательствами и мнением экспертов поддержаны: время экспозиции ФДГ 60 мин; опции отсрочки ГК или выполнения ФДГ-ПЭТ в течение первых трех дней терапии; «возможная польза применения ФДГ-ПЭТ/КТ(А) для оценки ответа на лечение».
Так же, как рекомендации европейских обществ ревматологов 2018–2020 гг. [38, 39, 41], разработка обществ ядерной медицины отражает значимость консенсусного подхода к созданию медицинских стандартов в условиях недостатка доказательств.
В ней указано [42], что в течение 6 ч до введения ФДГ пациенту разрешено употреблять только воду, за 24 ч следует исключить интенсивные физические нагрузки. С учетом ранее изданных руководств [44, 45] при лихорадке неясного генеза и подозрении на поражение сердца рекомендована безуглеводная диета с высоким содержанием жиров в течение 12–24 ч до исследования, 12–18-часовой голод и/или внутривенное введение гепарина за 15 мин до введения ФДГ. Перед сканированием пациент должен опорожнить мочевой пузырь. Для уменьшения захвата ФДГ мышцами и бурым жиром исследование проводят в теплом (20–22 °С) помещении, этому же способствует прием пропранолола в дозе 20 мг за час до введения радиофармпрепарата.
С указанием на слабость доказательств влияния уровня гликемии на захват ФДГ воспаленными тканями уровень < 7 ммоль/л определен как предпочтительный: при большем содержании глюкозы в крови биодоступность ФДГ нарушается (она быстрее поступает в органы с высокой плотностью инсулиновых рецепторов, включая миокард и скелетные мышцы), что ухудшает качество сканов. В целом «следует стремиться к максимально возможному снижению уровня гликемии» [42]. В основу этого утверждения положены данные J. Bucerius и соавт., которые в проспективном исследовании 195 пациентов установили отрицательную корреляцию между уровнем гликемии натощак перед проведением ПЭТ и степенью захвата ФДГ воспаленной стенкой аорты и сонных артерий. Оптимальная длительность экспозиции ФДГ составила 2,5 ч, тогда как доза ФДГ оказалась менее значимым фактором [63].
Необходимость стандартизации протокола ФДГ-ПЭТ/КТ по времени также отмечена в обсуждаемом руководстве — с указанием на то, что в большинстве клинических исследований этого теста при васкулитах крупных сосудов время экспозиции ФДГ составляло 60 мин [42], и то, что в 2016 г. EANM рекомендовала соблюдение 2-часового интервала между введением ФДГ и получением сканов ПЭТ при атеросклерозе [47]. Удвоение стандартного 60-минутного периода экспозиции при положении пациента лежа на спине и применении больших матриц изображения улучшает визуализацию мелких сосудов головы и шеи, что показали P. Huet и соавт. [64].
Альтернатива этому подходу была предложена в рекомендациях EHF (2020) для неврологов, занимающихся лечением ГКА. Отмечая технические трудности интерпретации результатов ФДГ-ПЭТ при краниальном ГКА, для визуализации поверхностных височных и экстракраниальных артерий рекомендовано применение МРТ с индукцией магнитного поля 3–7 Тл. Перспективными названы применяемые в экспериментальных исследованиях методы фотоакустической визуализации и оптической когерентной томографии поверхностных височных артерий [30].
Ввиду отсутствия рекомендаций по процедуре ФДГ-ПЭТ/КТ при ГКА/РП на момент издания обсуждаемого руководства в нем предложено сканирование всего тела, включая стопы, оптимальное положение пациента — лежа на спине, прижав руки к телу (т.к. больные РП обычно не могут удерживать руки поднятыми над головой). Направление сканирования — краниокаудальное. Его длительность для получения трехмерного изображения — 2–3 мин. Доза ФДГ — 2–3 МБк/кг или 0,054–0,081 мКи/кг (в зависимости от вида камеры). Стандарт времени экспозиции ФДГ — 60 мин.
Отметим, что применение ПЭТ/КТ предусматривает сочетание ФДГ-ПЭТ с низкодозовой КТ без введения контраста — для коррекции затухания сигнала и анатомической референции. КТ-ангиография с контрастным усилением названа альтернативой, «возможной в соответствии с локальным или национальным протоколом» и учетом недостатка доказательств в пользу ее рутинного применения при ГКА [42].
Анализ литературы показал, что клинические факторы, влияющие на распределение ФДГ в артериальной стенке при LVV, были определены уже после издания руководства EANM/SNMMI/PIG/ASNC. По итогам изучения парных ПЭТ-сканов у 69 пациентов с LVV J.S. Rosenblum и соавт. доказали, что сильнее всего на захват ФДГ артериальной стенкой влияют возраст, индекс массы тела (ИМТ) и уровень С-реактивного белка — и через 60, и через 120 мин после введения ФДГ, тогда как показатель клиренса креатинина имеет значение только через час [65].
Кроме того, на интерпретацию результатов ФДГ-ПЭТ/КТ у пожилых пациентов с РП может влиять наличие сосудистого воспаления в связи с атеросклерозом, а также диабет и прием ГК.
Особенности захвата ФДГ при атеросклерозе известны и описаны (классическим является «лоскутное» поражение — patchy-pattern) и учтены в рекомендациях обществ ядерной медицины [47, 49]. Прогресс в этом аспекте может быть связан с выявлением разных функциональных профилей макрофагов сосудистой стенки при ишемической болезни сердца и ГКА [66].
Представляя атеросклероз аорты в группе ее воспалительных заболеваний, Общество кардиоваскулярных патологов и Европейская ассоциация кардиоваскулярных патологов в консенсусе 2015 г. подтверждают гораздо более частое выявление выраженного атеросклероза в брюшной аорте по сравнению с грудной: он обнаруживается в 80 и 10 % резецированных сегментов соответственно [20]. Общества ядерной медицины привлекают внимание к интерпретации захвата ФДГ именно подвздошно-бедренным артериальным сегментом — «излюбленной локализацией атеросклероза». При LVV на ПЭТ/КТ-сканах имеется типичная гладкая линейная картина поражения аорты, подключичных, сонных, позвоночных артерий, а при артериите Такаясу — также и легочной артерии [42].
Прием ГК влияет на захват ФДГ и воспаленными тканями, и печенью, являясь в исследованиях мешающим фактором. Окном возможностей по диагностике васкулита при РП в рекомендациях EANM/SNMMI/PIG/ASNC определен 3-дневный период ГК-терапии. Есть вероятность «восстановления патологического захвата ФДГ и снижения частоты ложноотрицательных результатов» после кратковременной отмены ГК, которая возможна лишь при низком риске ишемических осложнений [42]. Данные о 5-дневном диагностическом окне метода ПЭТ/МРТ [7] требуют изучения, как и опция отмены ГК для проведения визуализирующих тестов при подозрении на LVV.
Частота развития диабета и бремя этого заболевания у лиц с РП/LVV, длительно получающих ГК, впервые определены в метаанализе L. Lai и соавт. [67]. Кумулятивные дозы ГК составили 5,6 и 8,2 г за 4,4 и 6,4 года их приема соответственно. В итоге заболеваемость диабетом у больных РП и ГКА оказалась выше, чем в сопоставимых по полу и возрасту здоровых популяциях: уровни кумулятивной заболеваемости составили 6 % при РП и 13 % при ГКА, рассчитанной ожидаемой заболеваемости — 4,8 % при РП и 7 % при ГКА. Риск развития диабета de novo при ГКА оказался вдвое выше, чем при РП. Важно отметить большой средний возраст участников (71,6 и 74,9 года при РП и ГКА соответственно), гетерогенность первичных доказательств, полученных в основном из Европы и за тот период, когда распространенность диабета была ниже, чем в настоящее время, а также прием разных препаратов ГК и недостаток данных о наличии других ФР развития диабета, включая средства для лечения АГ и атеросклероза. Опираясь на результаты метаанализа и тот факт, что риск развития диабета особенно высок на первом году ГК-терапии и «растет на 5 % с каждым принятым граммом преднизолона», L. Lai и соавт. предположили большую, чем ожидается, долю ГК-индуцированного диабета в структуре диабета de novo при ГКА. Указано на невозможность различить эффект болезни и эффект лечения [67]: поскольку системное воспаление индуцирует инсулинорезистентность, то и РП, и ГКА могут повышать риск развития диабета.
Как показано нами ранее [13], риск развития диабета у больных ГКА повышен, по оценкам разных авторов, на 5–70 %. На фоне высокодозовой ГК-терапии он превышает риски развития всех других ее осложнений, будучи повышен в 3–8 раз.
Данные факты могут ограничить применение ФДГ-ПЭТ для контроля активности васкулита у лиц с РП, длительно получающих ГК, особенно в дозах > 30 мг/сут, страдающих диабетом или имеющих другие ФР его развития. Для этой цели тест еще не валидирован [29, 42], и прогресс может быть связан с использованием трейсеров ПЭТ, альтернативных ФДГ, что предложено при атеросклерозе [49].
Подготовку пациента к КТ(А) и получение изображений рекомендовано проводить в соответствии с руководством Американской коллегии радиологов, Североамериканского общества кардиоваскулярной визуализации, Общества интервенционной радиологии и Общества педиатрической радиологии (ACR/NASCI/SIR/SPR, 2016) [48]. Положение пациента лежа на спине с прижатыми к телу руками необходимо именно для выполнения ПЭТ/КТ (в других случаях руки подняты за голову, что у больных РП может быть затруднено). Сканированию подлежит вся аорта и ее ветви, включая сосуды шеи, рук, внутренних органов, почек, таза и бедер. Контрастное вещество (низко- или изоосмолярное, с содержанием йода 300–40 мг/мл) в количестве 80–150 мл следует вводить в антекубитальную вену со скоростью 3,0–5,0 мл/с. Оптимальная артериальная фаза сканирования предусматривает болюсное введение контрастного вещества, сканирование в краниокаудальном направлении, профилактику артефактов, связанных с движениями аорты, и синхронизацию с электрокардиографией (ЭКГ). По вопросам специфических аппаратных КТ-настроек предложено «обращаться за индивидуальными рекомендациями, поскольку параметры и протоколы могут отличаться у разных производителей и зависеть от типов камер» [42].
Отметим, что в 2011–2016 гг. ряд научных обществ [16, 44, 48, 68] рекомендовали применение мультиспиральной КТ (МСКТ), ЭКГ-синхронизацию, автоматизацию введения контрастного вещества, индивидуальное определение его дозы с учетом веса пациента, ИМТ и клиренса креатинина, а также реконструкцию КТ-сканов в срезах толщиной 1 мм, позволяющих получать 3D-изображения. Целью КТ-ангиографии определили «диагностику и установление локализации первичных васкулопатий, включая васкулиты, инфекции и дегенеративные болезни» [48].
В обсуждаемом руководстве EANM/SNMMI/PIG/ASNC (2018) отмечена польза применения КТ-ангиографии на разных этапах развития LVV. При активном васкулите она позволяет оценить просветы сосудов и выявить острые осложнения критических стенозов, в хронической стадии болезни является альтернативой МРТ по выявлению аневризм и полезна при планировании перкутанных и хирургических вмешательств. В отсутствие атеросклероза диагностика LVV с помощью КТ-ангиографии не вызывает затруднений: дистрактором васкулита является утолщение стенки по всей окружности, тогда как атеросклеротические бляшки выглядят более фокусно. При этом доказательная база применения ПЭТ/КТ с контрастным усилением остается слабой [42].
Характерный КТ-ангиографический признак аортита определен C. Agard и соавт., S. Prieto-González и соавт. — это циркулярное утолщение стенки аорты до 2–3 мм с адвентициальным и периадвентициальным контрастным усилением [12, 26, 69, 70]. Предполагается связь степени контрастного усиления с активностью воспаления стенки аорты, поскольку в исследованиях наблюдали ослабление его выраженности в ходе ГК-терапии у больных ГКА; утолщение стенки аорты при этом сохранялось [71].
В обсуждаемом руководстве предложено такое определение понятий, касающихся LVV: толщина стенки аорты 2–2,9 мм — незначительное увеличение, 3–3,9 мм — умеренное, ≥ 4 мм — значительное [42]. Именно толщина > 4 мм указана в консенсусе Общества кардиоваскулярных патологов и Европейской ассоциации кардиоваскулярных патологов как один из критериев воспалительной атеросклеротической аневризмы [20].
Как видим из табл. 4, и ФДГ-ПЭТ, и КТ-ангиография признаны EANM/SNMMI/PIG/ASNC ценными для выявления LVV (класс доказательств 2). Эффективность применения с этой целью ФДГ-ПЭТ/КТ(А) названа «неопределенной, несмотря на пользу КТ-ангиографии» [42]: тогда как захват ФДГ усилен и при васкулите, и при атеросклерозе, МСКТ-ангиография информативна в отношении локализации, распространенности и стадии патологического процесса, позволяет выявлять неотложные состояния уже при первом исследовании, контролировать развитие аневризм и диссекций аорты. Это важно отметить с учетом того, что воспаление — не единственный фактор, определяющий прогрессирование типичных для ГКА дилатаций сосудов.
Интерпретация результатов ФДГ-ПЭТ/КТ
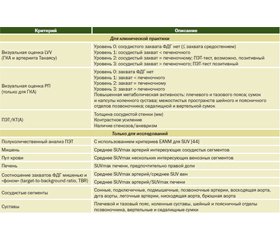
В качестве унифицированных, воспроизводимых и легких в использовании критериев васкулита при РП и ГКА в обсуждаемом руководстве названы оценка по визуальной шкале (ВШ), паттерн и степень захвата ФДГ, общий сосудистый счет (TVS), полуколичественные характеристики, стандартизированный показатель захвата (SUV), отношение захвата ФДГ стенкой сосуда к захвату ФДГ печенью, легкими, кровью. Меньше критериев предложено для артериита Такаясу: оценка по ВШ, полуколичественные оценки, степень захвата, SUV, отношение захвата ФДГ стенкой сосуда к захвату ФДГ кровью [42].
Доказательства, полученные за последние 15 лет, поддержали использование ВШ с градацией от 0 до 3 баллов, сравнивающей сосудистый захват ФДГ с печеночным: 0 — нет захвата (т.е. ≤ захвата средостением), 1 — низкий (< захвата печенью), 2 — средний (= захвату печенью), 3 — высокий (> захвата печенью); при уровне 2 тест считают возможно позитивным, при уровне 3 — позитивным на наличие активного LVV [12, 42, 72, 73]. Оценка сосудистого воспаления по этому параметру является общепринятой. Кроме того, доказательствами класса II-B поддержан такой ориентир, как нормализация захвата ФДГ до фоновой активности пула венозной крови (табл. 4).
Параметр TVS определяют как негативный (0 баллов) или позитивный по семи сегментам (грудная и брюшная аорта, подключичные, подмышечные, сонные, подвздошные и бедренные артерии), применяя полуколичественную оценку захвата (1 балл — минимальный захват, 2 — отчетливо повышенный, 3 — очень заметный). Расчет TVS возможен и по шкале от 0 до 21 балла, где 0 соответствует отсутствию захвата ФДГ во всех семи сосудистых сегментах, 21 — максимальному (по 3 балла) захвату в каждом из них [42]. Отметим, что в 2020 г. D. Malik и соавт. выявили сильную корреляцию между показателями TVS и скорости оседания эритроцитов у больных РП с васкулитом, подтвержденным ПЭТ. У обследованных 106 пациентов захват ФДГ отмечали в среднем в 13,18 ± 3,40 сосудистого сегмента (от 3 до 19), причем наиболее сильный (по показателям SUVmax) — в грудной аорте, брюшной аорте и подключичных артериях [56].
Учитывая частое сочетание РП и LVV, визуальную оценку сосудистого захвата и расчет TVS рекомендовано дополнять описанием типичного паттерна захвата ФДГ структурами опорно-двигательного аппарата — синовиальными оболочками плечевого, тазобедренного и коленного суставов, сухожилиями надостной мышцы и двуглавой мышцы плеча, сумок (субакромиально-поддельтовидной, седалищной и вертельной), а также межостистыми пространствами шейного и поясничного отделов позвоночника [42]. Захват оценивают по шкале от 0 до 3 баллов [57, 74].
Стандартизированные критерии интерпретации результатов применения ФДГ-ПЭТ/КТ(А) при LVV и РП, предложенные EANM/SNMMI/PIG/ASNC для использования в клинической практике и клинических исследованиях, приведены в табл. 5.
Интересно отметить, что применение параметров SUV и TBR (target-to-background ratio — отношение сосудистого захвата ФДГ к захвату печенью или кровью) для первичной диагностики LVV в клинической практике не было рекомендовано (см. табл. 5), но допускалась возможность их использования для оценки эффективности лечения и выявления рецидивов [42, 75]. Позже J.S. Rosenblum и соавт. установили наибольшую информативность в отношении наличия васкулита показателей TBR, определенных через 2 ч после введения ФДГ [65]. Эти данные также важны для оценки аналитических параметров ПЭТ и стандартизации протокола исследования при РП и LVV.
Параметр target-to-blood pool ratio (отношение захвата ФДГ стенкой сосуда к захвату кровью) также предложено использовать только в исследованиях [42] — на основании рекомендации EANM применять его для оценки воспаления сосудистой стенки при атеросклерозе [47] и результатов ряда исследований при ГКА [76, 77].
Как указано выше, для оценки выраженности артериита можно учитывать нормализацию захвата ФДГ стенкой артерии по сравнению с содержанием этого маркера в полых венах [77], но все же чаще принято оценивать воспаление при сравнении с захватом ФДГ печенью, используя параметр target-to-liver ratio [12, 72, 77]. На активность захвата ФДГ циркулирующей кровью влияет ряд факторов, включая содержание клеток, уровень гликемии и клиренса креатинина [78–80], и суммация их эффектов может сказываться на результатах клинических исследований.
Повторные тесты ПЭТ/КТ и полуколичественные оценки их результатов рекомендовано проводить в соответствии с тем же протоколом, что и первичные. Для оценки ответа на лечение необходимо сравнение со сканами, полученными до начала терапии. При выявлении даже слабого захвата ФДГ в исходно пораженном сегменте его предложено рассматривать как остаточное воспаление [42].
В целом в обсуждаемых рекомендациях отмечена высокая диагностическая точность ПЭТ и ПЭТ/КТ для выявления LVV [42]. Она подтверждена в метаанализах Y.H. Lee и соавт. [81] и M. Soussan и соавт. [73] и оказалась большей при ГКА, чем при артериите Такаясу. Это связывают с менее длительным приемом ГК к моменту проведения исследований при заболевании пожилых людей. По результатам исследований [51, 72, 82, 83] чувствительность данного гибридного теста составляет от 64 до 92,3 %, специфичность — от 76,5 до 100 %. Указанные различия обусловлены применением разных критериев для диагностики васкулитов и РП, отсутствием четких ПЭТ-критериев LVV, гетерогенностью групп, редкостью сравнения теста с золотым стандартом и влиянием высоких доз ГК, которые срочно назначаются при подозрении на ГКА [12, 42].
Именно подтверждение наличия аортита при РП названо наиболее трудной диагностической задачей, а захват радиофармпрепарата (т.е. ПЭТ-тест) — обычно единственной модальностью, позволяющей выявить воспаление крупных сосудов.
Подчеркнем, что эффективность ПЭТ/КТ-ангиографии остается неопределенной [42].
Мониторинг эффектов ГК- и иммуносупрессивной терапии с помощью ПЭТ/КТ
Результаты исследований, посвященных ПЭТ-контролю лечения LVV, противоречивы и получены в малых гетерогенных когортах. В обсуждаемом руководстве упомянуто одно проспективное исследование контроля ГК-терапии и одно — метотрексата (оба при ГКА), а также указано на отсутствие исследований ПЭТ-контроля эффектов средств биологической терапии, включая тоцилизумаб при ГКА [42]. Наблюдаемое при ГКА длительное сохранение лимфоцитарной инфильтрации в биоптатах височных артерий (до года от начала приема высоких доз ГК) [12] перекликается с выявлением повышенного сосудистого захвата ФДГ спустя 6 месяцев — в срок, когда его не считают проявлением васкулита. Что касается РП, то ПЭТ-контроль васкулита при ней не изучен; неизвестен и период времени после окончания ГК-терапии, оптимальный для подтверждения ее эффективности. В связи с этим эксперты рекомендуют изучать возможности метода ФДГ-ПЭТ/МРТ [42], преимуществом которого является меньшая лучевая нагрузка [62].
Перспективы дальнейших исследований визуализирующей диагностики LVV и РП изложены в заключительной части рекомендаций EANM/SNMMI/PIG/ASNC.
С клинической точки зрения предложено: определить показания и частоту применения ФДГ-ПЭТ/КТ(А) для диагностики и мониторинга РП и LVV; включить параметры визуализирующих тестов в критерии диагностики этих болезней; разработать клинические рекомендации по применению ФДГ-ПЭТ/КТ(А) при LVV и РП (на основе новых рандомизированных исследований и имеющейся разработки по злокачественным опухолям [44]); продолжить изучение влияния ГК на захват ФДГ и достичь консенсуса по как можно более раннему применению ПЭТ до начала ГК-терапии; изучать условия, при которых у больных LVV возможно поражение миокарда, включая повышение кардиоваскулярного риска в связи с ГК-терапией васкулита.
Наряду с доказательным подходом к ведению РП и LVV нужно разрабатывать терагностику — т.е. определить диагностический тест, помогающий идентифицировать среди лиц с конкретной нозологией подгруппы пациентов, наиболее подверженных проявлениям позитивного или негативного эффекта терапии. Трейсером ПЭТ может быть меченный радиоизотопом тоцилизумаб [42] — в случае ГКА, но не РП [13, 38–41].
В организационном плане необходимо «повсеместное возмещение затрат на проведение ФДГ-ПЭТ/КТ(А) при LVV и РП» и развитие онлайн-тренингов по интерпретации результатов визуализирующих тестов [42].
Методологические аспекты подразумевают стандартизацию оценок результатов ФДГ-ПЭТ/КТ(А) при LVV и РП (что особенно важно для объединения данных из разных медицинских центров); определение эффективности ФДГ-ПЭТ и КТ как отдельных и гибридных стандартизированных тестов при этих заболеваниях. Необходимо точно определить понятия, касающиеся LVV, и достичь консенсуса по их количественным оценкам. Следует изучить влияние длительной (90–120 мин) экспозиции ФДГ и модификации теста ФДГ-ПЭТ/КТ (такой как dual-time-point imaging, DTPI) на качество сканов у больных с почечной недостаточностью. Остается актуальной разработка новых методик визуализации и реконструкции черепа, позволяющих лучше описывать височные артерии и различать субтипы ГКА [42]. В связи с этим интересны результаты, показавшие возможности применения ФДГ-ПЭТ/КТ для диагностики опухолей и васкулитов головы и шеи, включая краниальный ГКА в исследовании GAP [79–81].
К техническим задачам отнесены: оптимизация применения гибридных визуализирующих методов для мониторинга остаточных изменений сосудистой стенки при LVV; оптимизация применения МСКТ и компьютерных технологий для различения LVV и воспаления при атеросклерозе; разработка новых мультимодальных систем камер ПЭТ/МРТ для улучшения визуализации черепа; использование в качестве трейсеров ПЭТ радиоизотопов, тропных к белкам и клеткам, вовлеченным в патогенез РП и LVV [42].
Заключение
Улучшение диагностики васкулита при РП, как и в целом патологии аорты и ревматических болезней пожилых — актуальная задача медицинской науки и практики, решению которой посвящено множество исследований и ряд рекомендаций. Выявление воспаления и дегенеративных изменений стенки аорты до развития осложнений возможно лишь с помощью визуализирующих исследований. В их применении нуждается значительная часть больных РП. При этом клиническая оценка остается важной частью диагностического процесса, а клинико-анамнестический метод — основным для дифференциации РП с опухолями и ревматическими болезнями с поздним дебютом. При обследовании пациентов следует измерять АД билатерально, проводить аускультацию сердца и сосудов, оценку сосудистого статуса магистральных артерий. Клиническое подозрение на LVV должно возникать и сопровождаться визуализирующим обследованием при выявлении асимметрии АД и пульса на конечностях, диастолического шума на аортальной регургитации, сосудистых шумов, а также персистенции РП, воспалительной дорсалгии, тазовой боли и боли в нижних конечностях.
При всем разнообразии визуализирующих тестов оптимального среди них нет, и ни один не валидирован для мониторинга течения и терапии РП и LVV. В 2020 г. именно ФДГ-ПЭТ/КТ одобрена двумя ассоциациями клиницистов — Итальянским обществом ревматологов и Европейской федерацией головной боли. Контент-анализ рекомендаций обществ ядерной медицины EANM/SNMMI/PIG/ASNC (2018) показал поддержку применения ФДГ-ПЭТ/КТ(А) для диагностики поражения экстракраниальных сосудов при РП, несмотря на слабость доказательной базы. Обоснована польза ПЭТ и ПЭТ/КТ для выявления LVV. Точность ПЭТ и МСКТ-ангиографии как отдельных тестов лучше доказана, но гибридный тест является более информативным.
Новые исследования нужны для усовершенствования процедуры и повышения ценности теста для первичной диагностики васкулита, выявления рецидивов и контроля терапии. Требует уточнения стандарт времени экспозиции ФДГ. В клинической практике и исследованиях следует учитывать факторы, влияющие на результаты теста и их интерпретацию, — атеросклероз, диабет, возраст, индекс массы тела, уровни гликемии и маркеров острой фазы.
Для клинической практики и исследований EANM/SNMMI/PIG/ASNC рекомендуют разные критерии оценки результатов ФДГ-ПЭТ/КТ(А). Наряду с визуальными качественными методами предложено применять полуколичественные, такие как сравнение захвата ФДГ артериальными сегментами с захватом печенью или кровью. Для их валидации необходимы крупные проспективные исследования.
Кроме стандартизации оценок результатов ФДГ-ПЭТ/КТ(А), необходимы консенсус по как можно более раннему выполнению теста до начала ГК-терапии, обеспечение реимбурсации, внедрение новых методик визуализации сосудов черепа и подходов к снижению лучевой нагрузки. В перспективе стандартизированное ведение РП и васкулитов дополнит терагностика.
Мультидисциплинарный подход к выявлению LVV как причины болевых синдромов у пожилых отражают рекомендации EHF (2020), разработанные для неврологов. Факторами, ограничивающими применение ФДГ-ПЭТ, в них названы высокая стоимость и лучевая нагрузка, низкая доступность и отсутствие стандартизации [31].
Говоря о лучевой нагрузке, отметим неприменимость понятия эффективной дозы для оценки популяционных рисков в эпидемиологических исследованиях. Как пишут M. Salvatori и соавт. (2019), в клинической практике снижение лучевой нагрузки должно достигаться как при подготовке, так и при проведении визуализирующих тестов (в т.ч. ПЭТ/КТ) и включать выбор радиофармпрепарата, индивидуальное определение дозы облучения, соблюдение референтных диагностических уровней и правил подготовки к исследованию, использование соответствующих протоколов КТ и параметров экспозиции, адаптацию новых технических устройств к новым алгоритмам реконструкции [87].
Конфликт интересов. Авторы заявляют об отсутствии какого-либо конфликта интересов при подготовке статьи. Авторы не получали от отдельных лиц и организаций финансовой поддержки исследования, гонораров и других форм вознаграждения.
Информация о вкладе каждого автора: Пузанова О.Г. — изучение статуса проблемы, поиск и обработка источников литературы, написание текста; Лызиков А.А. — коррекция текста с внесением ценного интеллектуального содержания, подготовка текста к печати.
Список литературы
Список литературы находится в редакции

/10_m.jpg)
/11_m.jpg)
/13_m.jpg)
/13_m2.jpg)