Газета «Новости медицины и фармации» №5 (757), 2021
Вернуться к номеру
Доброякісна гіперплазія передміхурової залози в практиці сімейного лікаря
Авторы: Тетяна Чистик
Рубрики: Урология
Разделы: Справочник специалиста
Версия для печати
Доброякісна гіперплазія передміхурової залози (ДГПЗ) — одне з найчастіших хронічних захворювань у чоловіків похилого віку, що призводить до збільшення передміхурової залози доброякісного генезу, простатичної обструкції і виникнення симптомів нижніх сечових шляхів (СНСШ) [1]. Поширеність цієї патології зростає з віком. Згідно зі статистичними даними, морфологічні ознаки ДГПЗ виявляються в 75 % чоловіків віком від 60 до 80 років і 90 % чоловіків віком понад 80 років. Клінічно захворювання також має досить значне поширення, при цьому ознаки порушеного сечовипускання встановлюються в 60 % чоловіків віком понад 60 років [2]. Зменшення діаметра струменя сечі констатують у 25 % чоловіків віком 55 років, а серед пацієнтів, старших за 75 років, їх число досягає вже 50 % [3].
Крім того, відзначається тенденція до омолодження захворювання, про що свідчить наявність морфологічних ознак ДГПЗ у 50 % чоловіків віком 40–50 років [2, 3].
Ключові моменти патогенезу ДГПЗ та основні фактори її розвитку
Дослідження останніх років дозволили розширити уявлення про патогенез ДГПЗ. Так, була доведена найважливіша роль гіпоталамо-гіпофізарно-гонадної взаємозалежності, що забезпечує зростання передміхурової залози. Визначено, що лютеїнізуючий гормон проникає в передню частку гіпофіза й визначає виділення фолікулостимулюючого й адренокортикотропного гормонів. Лютеїнізуючий гормон впливає на інтерстиціальні клітини яєчок і стимулює продукцію чоловічого статевого гормону — тестостерону. У яєчках синтезується близько 95 % загальної кількості тестостерону. Із загальної кількості циркулюючого в крові тестостерону 98 % пов’язано з білками плазми і лише 2 % знаходиться у вільному й біологічно активному вигляді й проникає в клітини передміхурової залози [4].
Перетворення вільного тестостерону в дигідротестостерон у клітинах передміхурової залози регулюється впливом ферменту 5α-редуктази. У цитоплазмі клітини дигідротестостерон зв’язується з андрогенним білковим рецептором і формується андрогенно-рецепторний комплекс. Цей комплекс проникає в клітинне ядро і активує ДНК, що, у свою чергу, призводить до зростання й диференціації клітин передміхурової залози, тобто виникнення доброякісної гіперплазії простати (залозистої гіперплазії) [5].
Також доведена роль естрогенів у патогенезі ДГПЗ. Відносне підвищення рівня естрогенів, які в чоловічому організмі утворюються переважно шляхом конверсії андростендіону в естрадіол за участю ензим-комплексу ароматази, сприяє виробленню фібробластичного фактора росту й проліферації стромального компонента в передміхуровій залозі (стромальній гіперплазії) [4]. Є дані про те, що найбільша активність ароматази в передміхуровій залозі припадає на періуретральну зону, що відіграє роль у розвитку ДГПЗ [6].
Останніми роками було доведено, що невелика частина 5α-дигідротестостерону у хворих на ДГПЗ під впливом ферменту 5α-редуктази перетворюється на 5α-андростандіол, який виконує роль біологічного блокатора α-1-адренорецепторів простати й визначає координовану роботу детрузора й замикального механізму шийки сечового міхура [7]. З активацією утворення андрогенно-рецепторного комплексу в клітинах передміхурової залози зменшується кількість 5α-андростандіолу, що лежить в основі збільшення кількості й підвищення активності α-1-адренергічних рецепторів простати, шийки сечового міхура й простатичного відділу уретри. Це призводить до скорочення гладкої мускулатури цих органів, розвитку динамічного компонента й появи іритативних симптомів захворювання.
Порушення мікроциркуляції в тканині передміхурової залози призводить до формування метаболічних змін, а уретро-простатичний рефлюкс унаслідок підвищення внутрішньоуретрального тиску викликає асептичний запальний процес. Він супроводжується набряком залози. Так формується обструктивний компонент клінічної картини ДГПЗ. Вивільнення лімфоцитами тромбоцитоподібного фактора росту внаслідок асептичного запального процесу відіграє важливу роль у генезі проліферації простатичних клітин [7].
На сьогодні відомо, що серед факторів, які сприяють розвитку ДГПЗ, важливе місце посідає метаболічний синдром (МС). Одним з провідних механізмів патогенетичної єдності МС та індукованого росту передміхурової залози є інсулінорезистентність/гіперінсулінемія як ключовий компонент МС [8–10]. Інсулінорезистентність веде до збільшення симпатичної активності через порушення метаболізму глюкози у вентромедіальних гіпоталамічних нейронах, що призводить до підвищеної системної активності α-адренорецепторів (автономної симпатичної гіперактивності або нейропатії), у тому числі гладких м’язів простатичної капсули й шийки сечового міхура. Це, у свою чергу, призводить до індукції росту передміхурової залози й розвитку СНСШ навіть за відсутності зростання простати [8, 9].
Хронічне запалення простати також визнається провідним фактором розвитку ДГПЗ [11]. Його гістологічними ознаками є запальні інфільтрати в передміхуровій залозі, що складаються з Т-лімфоцитів (CD3+), В-лімфоцитів (СD19, СD20+) і макрофагів [12]. У цих запальних інфільтратах продукуються цитокіни (інтерлейкіни-2, -6, -8, -15 і γ-інтерферон), які посилюють проліферацію клітин передміхурової залози, зокрема фібробластів. Клітини простати, що межують з вогнищами запалення, гинуть, їх місце займають ділянки стромальної гіперплазії [10].
Згідно з даними клінічного дослідження MTOPS, наявність інфільтратів у біоптаті передміхурової залози було виявлено в 40 % пацієнтів із ДГПЗ, особливо в осіб, які мали високий рівень специфічного простатичного антигену [11]. Такі пацієнти мали більш високий ризик прогресування ДГПЗ і розвитку затримки сечі [13]. У дослідженні J.L. St Sauver et al. (2008) було показано, що середній час від встановлення діагнозу простатиту до діагнозу ДГПЗ становив 8,1 року, від встановлення діагнозу простатиту до лікування — 9,8 року, від діагнозу простатиту до гострої затримки сечі — 6 років [14].
Також слід зазначити, що до факторів, які сприяють розвитку ДГПЗ, належить генетична схильність, важка фізична праця, стаж куріння понад 10 років, вживання алкоголю більше ніж 1 раз на тиждень, гіподинамія, стреси, незбалансоване харчування й нерегулярне статеве життя [15].
Клінічні прояви ДГПЗ
Виникнення симптомів ДГПЗ обумовлене механічним здавлюванням уретри вузлами гіперплазії й підвищенням тонусу гладкої мускулатури передміхурової залози й сечового міхура. Ці зміни визначають наявність двох основних груп симптомів, характерних для аденоми: симптомів спорожнення (обструктивні) та симптомів накопичення (іритативні) [16].
Симптоми спорожнення обумовлені трьома факторами [17]: 1) пасивним — унаслідок збільшення маси залози й здавлювання простатичного відділу уретри; 2) динамічним, обумовленим стимуляцією α-адренорецепторів, які регулюють скорочення гладком’язових елементів передміхурової залози, що призводить до підвищення тонусу гладком’язових структур, які займають близько 40 % об’єму гіперплазованої передміхурової залози; 3) гіпоксичним, що пов’язано з розвитком гіпоксії детрузора й зниженням його скорочувальної здатності. Для симптомів спорожнення характерні: млявий струмінь сечі; утруднене сечовипускання; необхідність напружувати черевну стінку при сечовипусканні; збільшення часу сечовипускання; переривчастість сечовипускання; відділення сечі по краплях у кінці сечовипускання; неповне спорожнення сечового міхура; парадоксальна ішурія.
Симптоми накопичення є проявом гіперактивності детрузора, викликаної подразненням рецепторів у шийці сечового міхура і у фіброзно-м’язовій стромі передміхурової залози. Вони проявляються у вигляді частого сечовипускання, у тому числі в нічні години, імперативних позивів до сечовипускання, неможливості утримати сечу при позиві [18].
Для I (компенсованої) стадії ДГПЗ характерні розлади сечовипускання при повному спорожненні сечового міхура. Хворі відзначають зміну акта сечовипускання, що стає менш інтенсивним і більш частим. З’являється ноктурія до двох і більше разів. Надалі спостерігається збільшення частоти денних сечовипускань, поява імперативних позивів, при яких хворий не може відстрочити початок сечовипускання, аж до неутримання сечі. Сеча виділяється млявим струменем, іноді падає майже вертикально, а не утворює, як раніше, криву характерної параболічної форми. При цьому для полегшення спорожнення сечового міхура хворим нерідко на початку або в кінці сечовипускання доводиться напружувати передню черевну стінку. У цій стадії стан хворого може залишатися стабільним без прогресування протягом довгих років за рахунок резервних можливостей сечового міхура, верхніх сечових шляхів і нирок [16, 17].
У II стадії наростають симптоми обструкції сечового міхура і з’являється залишкова сеча > 50 мл. Для спорожнення сечового міхура хворі змушені напружувати м’язи живота протягом усього акту сечовипускання. Сечовипускання здійснюється хвилеподібно, переривчасто, різноманітно з періодами відпочинку, що досягають кількох хвилин. Наростаюче зниження функцій нирок проявляється спрагою, сухістю, гіркотою в роті, поліурією та іншими характерними симптомами [17, 18].
У III стадії розвивається повна декомпенсація функції сечового міхура й спостерігається парадоксальна ішурія. У цій стадії спорожнення сечового міхура неефективне навіть за участю екстравезикальних сил. Стінка сечового міхура розтягнута, він переповнений сечею і може бути визначений візуально або при пальпації внизу живота. Для повної декомпенсації сечового міхура характерні втрата тонусу як детрузора, так і внутрішнього сфінктера сечового міхура. При цьому спостерігається парадоксальне поєднання затримки і нетримання сечі — мимовільне виділення сечі по краплях при переповненому сечовому міхурі (ischuria paradoxa). Порушення функції нирок і верхніх сечових шляхів призводить до хронічної ниркової недостатності [17, 18].
Отже, наростання клінічної симптоматики визначається прогресуванням ДГПЗ, що залежить від багатьох факторів. При аналізі даних про прогресування ДГПЗ у 737 чоловіків, які були рандомізовані в групу плацебо в дослідженні MTOPS, було встановлено, що ризик прогресування ДГПЗ був значно вище в пацієнтів, які приймали плацебо, з базовим об’ємом простати 31 мл і більше, рівнем простатоспецифічного антигену (ПСА) 1,6 нг/мл і вище, піковою швидкістю потоку сечі Qmax менше за 10,6 мл/с, залишковим об’ємом сечі 39 мл і більше, віком 62 роки і старше. Протягом 5 років спостереження даної групи клінічне прогресування захворювання спостерігалось у 16,6 % пацієнтів. Найбільш частим проявом прогресування (79,5 %) стало суб’єктивне погіршення СНСШ (збільшення балу за Міжнародною шкалою симптомів простати (IPSS) ≥ 4), збільшення об’єму передміхурової залози на 24 %, рівня ПСА — на 14 % [19].
У ретроспективному аналізі, проведеному F. Di Silverio et al. [31], були оцінені гістологічні дослідження 3942 пацієнтів, прооперованих з приводу СНСШ/ДГПЗ за 20-річний період. Ознаки хронічного запалення були виявлені в 43 % чоловіків даної вибірки, а також відзначено зв’язок між наявністю хронічного запалення в передміхуровій залозі та її об’ємом.
Методи діагностики ДГПЗ
Метою діагностичних заходів є виявлення захворювання, визначення його стадії і супутніх ускладнень, а також параметрів захворювання, що дозволяють вибрати оптимальний метод лікування. Крім цього, під час діагностичного процесу доводиться проводити диференціальну діагностику ДГПЗ з іншими захворюваннями передміхурової залози, які також проявляються СНСШ.
Клінічна діагностика включає збір скарг і анамнезу, заповнення щоденника сечовипускання і анкети з 35-бальною шкалою сумарної оцінки симптомів при захворюваннях простати (IPSS). При сумі балів 0–7 симптоми інтерпретуються як незначні, 8–19 балів — як помірні, 20–35 балів — як виражені [17].
Проводять фізикальне обстеження, що включає пальцеве ректальне дослідження простати й пальпацію сечового міхура. Під час виконання пальцевого ректального дослідження визначаються приблизний розмір передміхурової залози, її консистенція і болючість при пальпації, вираженість серединної борозенки, рухливість слизової оболонки прямої кишки над залозою і тонус сфінктера прямої кишки.
Серед лабораторних методів дослідження діагностичну цінність має визначення рівня простатоспецифічного антигену сироватки крові (під час першого візиту до лікаря для скринінгу раку передміхурової залози), вимірювання креатиніну сироватки крові, загальний аналіз сечі й крові [1, 17].
Ультразвукове дослідження (у тому числі трансректальне) дозволяє визначити розміри й форму передміхурової залози, виявити її структуру, наявність фіброзу, кальцинатів, гіпо- і гіперехогенних ділянок, об’єм залишкової сечі [20].
Урофлоуметрія є неінвазивним методом, заснованим на визначенні й графічній реєстрації змін об’ємної швидкості сечовипускання. При інфравезикальній обструкції, викликаній ДГПЗ, знижується максимальна й середня об’ємна швидкість потоку сечі й збільшується тривалість сечовипускання. Уродинамічне дослідження тиску струменя сечі рекомендоване, якщо об’єм сечовипускання становить < 150 мл; уретроцистоскопія показана перед ендоурологічними операціями [1, 17, 20].
Медикаментозна терапія ДГПЗ. Місце екстракту Serenoa repens
Метою лікування ДГПЗ є полегшення СНСШ і поліпшення якості життя пацієнта, а також запобігання ускладненням, пов’язаним із ДГПЗ [21]. Для досягнення цих цілей застосовується немедикаментозна терапія — пильне очікування, хірургічне (трансуретральна резекція передміхурової залози) і медикаментозне лікування.
На початковому етапі ДГПЗ, що перебігає з незначною клінічною симптоматикою, традиційно застосовується пильне очікування, що включає обмеження споживання рідини й продуктів, які мають сечогінну дію (чай, кава, алкоголь, фрукти, ягоди, молочні продукти) за 3 години до сну, обов’язкове спорожнення сечового міхура перед сном, використання техніки двохетапного сечовипускання, лікування запорів та інші заходи. Однак у даний час стало відомо, що ця тактика в чоловіків, які мають фактори прогресування, не виправдана. Так, згідно з результатами одного з досліджень, 36 % пацієнтів із ДГПЗ із групи пильного очікування були прооперовані протягом 5 наступних років.
У дослідженні В. Djavan et al. [32] за участю 397 пацієнтів з легкими симптомами ДГПЗ було встановлено, що при пильному очікуванні рівень клінічного прогресування становить 6, 13, 15, 24, 28 і 31 % на 6, 12, 18, 24, 36 і 48-му місяці відповідно. Через рік погіршення симптоматики відзначили 60 % пацієнтів, через два роки — 65 %, а через три й чотири роки — 75 і 84 % відповідно, що свідчить про необхідність використання фармакологічної терапії.
Згідно із сучасними рекомендаціями, поданими Європейською асоціацією урологів у 2021 році, для медикаментозного лікування ДГПЗ можуть бути використані 6 груп препаратів: антагоністи α-1-адренергічних рецепторів (α-1-блокатори), інгібітори 5α-редуктази, антагоністи мускаринових рецепторів, інгібітори фосфодіестерази 5-го типу, аналог вазопресину й рослинні препарати (фітотерапія) [21].
На сьогодні застосування рослинних препаратів в лікуванні ДГПЗ популярне в багатьох країнах Європи та Азії як серед лікарів, так і серед пацієнтів, що пояснюється оптимальним співвідношенням їх ефективності й безпечності, доброю переносимістю й мінімальною кількістю побічних ефектів. Відомо, що в Італії фітопрепарати для лікування СНСШ, обумовлених ДГПЗ, призначаються частіше, ніж α-адреноблокатори й інгібітори 5α-редуктази. У Німеччині й Австрії рослинні препарати є терапією першої лінії при легких СНСШ у чоловіків. За даними G. Bales et al., кожен третій чоловік, який проходить консервативне лікування ДГПЗ, віддає перевагу рослинним засобам [43].
Найбільш вивченими і найчастіше призначуваними є препарати з екстрактом із плодів пальми пилкоподібної (Serenoa repens). На сьогодні існує величезна кількість робіт, присвячених вивченню цих препаратів, що підтвердили їх безпечність і ефективність як при лікуванні СНСШ, так і для профілактики прогресування ДГПЗ, а також загострення хронічного простатиту [22–24].
Найбільш повний метааналіз ефективності екстрактів Serenoa repens наведено в Cochrane report [44]. У ньому було узагальнено понад 30 рандомізованих порівняльних досліджень, що тривали від 4 до 60 тижнів і включали 5222 пацієнти. Згідно із цим звітом, не було виявлено переваг в ефективності за динамікою бала IPSS, максимальної швидкості потоку сечі й об’єму простати порівняно з плацебо, фінастеридом і тамсулозином. Єдиний показник, динаміка якого порівняно з плацебо виявилася позитивною, — це вираженість ніктурії. Однак аналогічні рівні IPSS і показники максимальної швидкості потоку сечі в порівняльних випробуваннях екстрактів Serenoa repens із фінастеридом і тамсулозином можуть свідчити і про еквівалентність терапії. У керівництві з менеджменту СНСШ у чоловіків 2021 року також вказується на провідну роль екстракту Serenoa repens в лікуванні даної патології.
Механізм дії препаратів з екстрактом Serenoa repens комплексний і включає антиандрогенний, антипроліферативний, протизапальний і протинабряковий ефекти [37]. Антиандрогенна дія екстракту Serenoa repens полягає в тому, що він, по-перше, інгібує вироблення ферменту 5α-редуктази I і II типів в епітеліальних клітинах простати, гальмуючи перетворення тестостерону в дигідротестостерон. Причому за ступенем інгібування 5α-редуктази I типу він значно перевершує фінастерид. По-друге, Serenoa repens перешкоджає проникненню молекул дигідротестостерону до ядерних рецепторів клітин передміхурової залози. Завдяки антиандрогенній дії екстракту Serenoa repens зменшується ріст простати [25, 26].
Антипроліферативний ефект екстракту Serenoa repens реалізується шляхом інгібування епідермального й фібробластичного факторів росту, що було показано в дослідженні M. Paubert-Braquet. Це, у свою чергу, сприяє активації апоптозу клітин залозистого епітелію простати й призводить до зменшення об’єму аденоматозних вузлів [27, 29]. У роботі C.W. Bayne [36] було продемонстровано, що екстракт Serenoa repens має високу селективність щодо клітин простати, ініціюючи в них апоптоз, тоді як клітини, отримані з грудної залози, придатків яєчок і нирок, несприйнятливі до нього.
Протизапальний і протинабряковий ефекти екстракту Serenoa repens обумовлені його здатністю інгібувати ферменти арахідонового каскаду в клітинах простати: фосфоліпазу А2 (яка бере активну участь в перетворенні фосфоліпідів мембран в арахідонову кислоту), циклооксигеназу і 5-ліпоксигеназу (що відповідальні за утворення медіаторів запалення — простагландинів і лейкотрієнів) [28].
Додатковими механізмами дії екстракту Serenoa repens вважають інгібування росту простати за допомогою зв’язування пролактину з рецепторами в передміхуровій залозі, антиестрогенний ефект (інгібування ароматази) і вплив на α-1-рецептори, за рахунок чого досягається спазмолітична дія препарату [45].
Екстракт Serenoa repens — доведена ефективність і безпечність у лікуванні СНСШ, викликаних ДГПЗ
Вплив екстракту Serenoa repens на запалення простати при ДГПЗ було показано в дослідженні S. Gravas [30]. У ньому брали участь 97 пацієнтів, яким проводили терапію екстрактом Serenoa repens 320 мг/день або плацебо протягом 6 місяців. Під час дослідження було показано, що в основній групі середня вираженість запалення вірогідно знизилася з 1,55 бала на вихідному рівні до 0,79 бала при подальшій біопсії. У контрольній групі в середньому запалення оцінювалося в 1,44 бала при першій біопсії і 1,23 бала — при другій. Середнє зниження всіх показників запалення було статистично більшим в пацієнтів, які приймали екстракт Serenoa repens, порівняно з контрольною групою. Імуногістохімічне забарвлення показало значну зміну експресії досліджуваних антитіл у пацієнтів, яким проводили терапію екстрактом Serenoa repens, порівняно з першою біопсією. У групі плацебо при другій біопсії не було виявлено істотних відмінностей.
У дослідженні А. Latil et al. [38] вивчався вплив екстракту Serenoa repens 320 мг/добу і тамсулозину 0,4 мг/добу на біомаркери запалення й клінічні симптоми за шкалою IPSS у 206 чоловіків із ДГПЗ і СНСШ протягом 3 місяців. Біомаркери запалення знизилися на 65,4 % у групі екстракту Serenoa repens і на 46,2 % — у групі тамсулозину. Пацієнти з початково вираженим запаленням передміхурової залози, які отримували екстракт Serenoa repens, показали більш значуще зменшення суми балів за шкалою IPSS, ніж ті, хто приймав тамсулозин: –6,4 проти –4,5 відповідно.
У порівняльних дослідженнях показано рівнозначне зменшення вираженості СНСШ, пов’язаних з ДГПЗ, при використанні екстракту Serenoa repens і альфа-блокатора тамсулозину. Так, у рандомізованому дослідженні PERMAL було показано, що ліпідостероловий екстракт Serenoa repens 320 мг/добу перевершував тамсулозин 0,4 мг/добу щодо зменшення виражених СНСШ у хворих на ДГПЗ через 3 і 12 місяців застосування [35].
У подвійному сліпому рандомізованому дослідженні F. Debruyne [39] порівнювалася ефективність екстракту Serenoa repens і тамсулозину в 704 пацієнтів протягом року. Суб’єктивна оцінка проводилася за допомогою IPSS і шкали якості життя (QoL), за допомогою урофлоуметрії визначали Qmax на вихідному рівні й протягом 1 року. Об’єм простати й ПСА вимірювали на початку й у кінці терапії. Аналіз отриманих результатів був виконаний для 542 пацієнтів (тамсулозин: n = 273; екстракт Serenoa repens: n = 269).
Результати дослідження показали, що через 12 місяців показник за шкалою IPSS знизився на 4,4 бала в кожній групі, і ніяких відмінностей не спостерігалося ні щодо поліпшення іритативних, ні щодо поліпшення обструктивних симптомів. Збільшення Qmax було однаковим в обох групах лікування (тамсулозин: +1,9 мл/с; екстракт Serenoa repens: +1,8 мл/с). ПСА залишався стабільним, у той час як об’єм простати трохи зменшився в пацієнтів, які отримували екстракт Serenoa repens. Це дослідження продемонструвало, що екстракт Serenoa repens і тамсулозин були порівнянними за ефективністю при лікуванні СНСШ у чоловіків із ДГПЗ при довготривалій терапії протягом року.
У порівняльному дослідженні Carraro et al. [33] було продемонстровано клінічну еквівалентність екстракту Serenoa repens і фінастериду, однак екстракт Serenoa repens був кращим за фінастерид щодо статевої функції, тому що спричинив значно менше скарг на зниження лібідо й імпотенцію.
У проспективному багатоцентровому дослідженні QUALIPROST [40] оцінювали вплив терапії різними групами препаратів на якість життя і СНСШ/ДГПЗ у реальній клінічній практиці. У ньому взяли участь 1713 пацієнтів: 8,9 % (n = 153) учасників дослідження не отримували лікування (пильне очікування); 70,3 % (n = 1204) призначали монотерапію (α-адреноблокатори; екстракт Serenoa repens; інгібітори 5α-редуктази) і 20,8 % (n = 356) отримували комбіноване лікування — α-адреноблокатори + інгібітори 5α-редуктази або α-адреноблокатори + екстракт Serenoa repens.
У всіх групах дослідження відзначалася ефективність терапії, про що свідчило зменшення СНСШ (за шкалою IPSS) і поліпшення якості життя (за опитувальником QoL). Екстракт Serenoa repens показав ефективність, аналогічну α-адреноблокаторам та інгібіторам 5α-редуктази, як у монотерапії, так і в комбінації з α-адреноблокаторами. Найкраща переносимість і безпечність терапії була виявлена при прийомі препарату з екстрактом Serenoa repens — 0,8 %.
Отже, результати мультицентрових досліджень підтвердили ефективність, високий рівень безпечності й переносимості екстракту Serenoa repens.
Простамол® Уно (спиртовий екстракт Serenoa repens) — доступна й ефективна терапія СНСШ, спричинених ДГПЗ, в Україні
На українському ринку вже понад 20 років використовується препарат Простамол® Уно (виробник «Берлін-Хемі АГ»), що містить 320 мг етанольного екстракту з плодів пальми пилоподібної (Serenoa repens). Простамол® Уно має власні вітчизняні й зарубіжні клінічні дослідження, у яких продемонстрована висока ефективність і безпечність препарату, у тому числі при тривалому безперервному застосуванні протягом 15 років.
Ефективність і безпечність препарату Простамол® Уно в 120 пацієнтів з легкими й помірними СНСШ при ДГПЗ була показана в дослідженні I. Sinescu et al. [41]. У всіх хворих, включених у дослідження, максимальна швидкість потоку сечі не перевищувала 15 мл/с, об’єм залишкової сечі становив не більше ніж 150 мл, а показник ПСА < 4 нг/мл. Усім пацієнтам протягом 24 місяців був призначений екстракт Serenoa repens по 320 мг щодня.
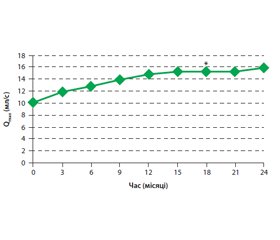
У результаті дослідження виявлено вірогідне поліпшення середнього бала за шкалою IPSS на 5,5; бала за шкалою QoL — на 1,8. Середній показник Qmax поліпшився з 10,3 мл/с під час першого відвідування до 15,9 мл/с під час 10-го відвідування на 24-му місяці. Статистичний аналіз показав значне, але не лінійне поліпшення протягом перших 18 місяців терапії (рис. 1).
Частка пацієнтів, у яких не було залишкової сечі, підвищилася з вихідного показника 21 % до 43 % через 24 місяці лікування. У решти пацієнтів знизився об’єм залишкової сечі, причому тільки в 6 % пацієнтів після сечовипускання в сечовому міхурі залишалося понад 40 мл сечі. Результати свідчили про те, що значні зміни цього показника відбувалися протягом перших 6 місяців (рис. 2).
Середній об’єм простати наприкінці дослідження становив 36 мл порівняно з вихідним об’ємом 39,8 мл. Значних змін показника ПСА за час дослідження не спостерігали. Що стосується сексуальної функції, то середній бал за шкалою IIEF (Міжнародний індекс еректильної функції) протягом перших 12 місяців значно поліпшився (з 44,4 до 50,3 бала). Протягом другого року мали місце лише незначні зміни (з 50,3 до 50,8 бала) (рис. 3).
У перші 12 місяців відсоток пацієнтів, які вибули з дослідження, був нульовим, а за другий рік їх частка досягла 19,2 %. За час лікування в жодного пацієнта не було відзначено побічних реакцій, пов’язаних із призначеною терапією.
Отже, автори дослідження дійшли висновку, що 24-місячна терапія препаратом Простамол® Уно в дозі 320 мг забезпечувала статистично вірогідне поліпшення показників за шкалами IPSS, QoL і Qmax. Вона також зменшувала число пацієнтів із залишковою сечею. Поліпшення показників IPSS обумовлювалось обома субшкалами — іритативною та обструктивною. За 24-місячний період дослідження поліпшення досліджуваних параметрів (QoL і Qmax) досягло статистичної значущості, чого не було відзначено в деяких короткострокових дослідженнях. Простамол® Уно поліпшував сексуальні функції, що супроводжувалось значним підвищенням показників за шкалою IIEF під час першого року лікування.
Застосування екстракту Serenoa repens у пацієнтів із СНСШ/ДГПЗ запобігає прогресуванню захворювання. У відкритому непорівняльному спостережувальному дослідженні, проведеному Ю.Г. Аляєвим і співавт. [34], оцінювалася ефективність і безпечність безперервного застосування препарату Простамол® Уно в дозуванні 320 мг 1 раз на добу протягом 10 років 38 пацієнтами з ризиком прогресування ДГПЗ. За результатами дослідження констатовано відсутність прогресування як за суб’єктивними (сума балів за шкалами IPSS, QoL), так і за об’єктивними критеріями (об’єм простати, швидкість сечовипускання, об’єм залишкової сечі). При цьому в пацієнтів були відсутні небажані ефекти, безпосередньо пов’язані з прийомом досліджуваного препарату.
Це узгоджується з дослідженням А.З. Вінарова [42], у якому протягом 15 років вивчали ефективність і безпечність безперервного щоденного призначення 320 мг Простамол® Уно у пацієнтів з ДГПЗ і ризиком її прогресування. Усього в дослідженні взяли участь 30 пацієнтів віком ≥ 39,9 року з тяжкістю симптомів за шкалою IPSS + QoL — 11,5 ± 1,7 бала. Під час дослідження оцінювалися зміни показників за шкалами IPSS і QoL, а також зміни Qmax, об’єму сечовипускання, залишкового об’єму сечі й об’єму простати.
Дослідження показало відсутність прогресування на підставі як суб’єктивних (сума балів за шкалами IPSS і QoL), так і об’єктивних (об’єм простати, частота сечовипускання, об’єм залишкової сечі) критеріїв. Крім того, у пацієнтів не було побічних ефектів, пов’язаних з досліджуваним препаратом, включно з розвитком раку простати.
Отже, результати 15-річного дослідження показали, що безперервний прийом рослинного екстракту Serenoa repens (Простамол® Уно) в добовій дозі 320 мг був ефективним і безпечним способом запобігання прогресуванню ДГПЗ.
Крім зарубіжних, опубліковано низку вітчизняних робіт з вивчення ефективності й безпечності препарату Простамол® Уно як монотерапії, так і в комбінації з тамсулозином, у тому числі в пацієнтів із СНСШ, які зберігалися після оперативного втручання з приводу ДГПЗ [44, 46–50].
Простамол® Уно призначається по 1 капсулі на день, що робить лікування простим і зручним. Він застосовується щодня в один і той же час. М’яку капсулу ковтають цілком після прийому їжі, запиваючи достатньою кількістю рідини. Тривалість лікування залежить від виду, ступеня тяжкості й перебігу захворювання і не обмежена часом. Регулярне щоденне застосування особливо важливе для успіху лікування. Зменшення вираженості симптомів захворювання можна очікувати тільки через 6 тижнів лікування, а максимальний ефект розвивається через 3 місяці.
У результаті лікування препаратом Простамол® Уно зменшується обструкція сечових шляхів, вираженість симптомів захворювання й значно поліпшується якість життя пацієнтів. Пацієнтам з порушенням сечовипускання унаслідок ДГПЗ доцільно як можна раніше призначати Простамол® Уно для запобігання прогресуванню даної патології і більш вартісному й травматичному хірургічному втручанню.
Висновки
ДГПЗ — одне з найчастіших хронічних захворювань у чоловіків похилого віку, що призводить до збільшення передміхурової залози доброякісного генезу, простатичної обструкції і виникнення СНСШ. Метою лікування ДГПЗ є полегшення СНСШ і поліпшення якості життя пацієнта, а також запобігання ускладненням, пов’язаним з обструкцією вихідного відділу сечового міхура. Для досягнення цих цілей, згідно з керівництвом з менеджменту ненейрогенних СНСШ (2021), може бути рекомендоване фармакологічне лікування зі застосуванням екстракту Serenoa repens.
Екстракт Serenoa repens (Простамол® Уно) має багатовекторну дію — антиандрогенну, антипроліферативну, протизапальну, протинабрякову й спазмолітичну, завдяки чому зменшується обструкція сечових шляхів, вираженість симптомів захворювання, сповільнюється його прогресування й поліпшується якість життя пацієнтів. Ефективність і безпечність препарату Простамол® Уно доведена численними міжнародними й вітчизняними дослідженнями, у тому числі при тривалому його застосуванні, що обумовлює можливість профілактики прогресування ДГПЗ за допомогою цього фітопрепарату.
Список литературы
Список літератури знаходиться в редакції

/3_m.jpg)