Газета «Новости медицины и фармации» №1 (745), 2021
Вернуться к номеру
Ефективність комбінованої терапії препаратами Ксаврон, Тіворель і Реосорбілакт у пацієнтів з пневмонією, спричиненою COVID-19: клінічні випадки
Авторы: Мороз Л.В.
проф., Вінницький національний університет М.І. Пирогова, м. Вінниця, Україна
Ходош Е.М.
д.м.н., доцент кафедри фтизіатрії, пульмонології та сімейної медицини ХМАПО, академік ІА України, завідувач пульмонологічного відділення МКЛ № 13, м. Харків, Україна
Кульчак О.І.
лікар-терапевт Кельменецької центральної районної лікарні, смт Кельменці, Чернівецька обл., Україна
Чишкевич І.В.
к.м.н., лікар-інфекціоніст КП «Центральна міська лікарня», м. Рівне, Україна
Рубрики: Инфекционные заболевания
Разделы: Справочник специалиста
Версия для печати
Вступ
Брак чітких вказівок і протоколів лікування пневмоній, спричинених коронавірусною хворобою COVID-19, зумовлює актуальність пошуку препаратів, для яких ще не накопичено достатньої доказової бази щодо лікування саме пневмоній, але які можуть бути ефективними завдяки своїм механізмам фармакологічного впливу на певні ланки патогенезу COVID-19.
Патогенез COVID-19-асоційованої пневмонії
Основною мішенню вірусу SARS-CoV-2 є епітеліоцити легень. Після зв’язування з рецептором ангіотензинперетворюючого ферменту 2-го типу (AПФ-2) вірус потрапляє в клітини, де відбувається інтерналізація і реплікація вірусу, а потім вивільнення зі зруйнованої клітини нових віріонів, які вражають органи-мішені й індукують розвиток місцевої і системної запальної відповіді.
У дихальних шляхах людии SARS-CoV-2 пригнічує активність мукоциліарного кліренсу, викликає загибель епітеліоцитів, проникає через слизову оболонку носа, гортані й бронхіального дерева в периферичну кров і уражає органи-мішені — легені, травний тракт, серце, нирки.
Пошкоджені клітини продукують прозапальні цитокіни, які рекрутують ефекторні клітини (макрофаги, нейтрофіли) і вивільняють аларміни, що індукують активність інфламасом. Функціонування інфламасом супроводжується вивільненням значної кількості прозапальних цитокінів, які, у свою чергу, підсилюють рекрутинг макрофагів і нейтрофілів, і розвитком так званого цитокінового шторму, що зумовлює надзвичайний рівень запального процесу в легенях [2].
Вивільнення значної кількості цитокінів тісно пов’язане з розвитком відомих клінічних симптомів COVID-19 [3]:
- інтерферон γ викликає лихоманку, озноб, головний біль, запаморочення і втому (синдром ендогенної інтоксикації);
- фактор некрозу пухлини α (ФНП-α) може бути причиною грипоподібних симптомів (лихоманки, загального нездужання й слабкості), може зумовлювати підвищену проникність судин, кардіоміопатію, пошкодження легень і синтез білків гострої фази;
- інтерлейкін (ІЛ) 6 може призводити до підвищення судинної проникності, активації системи комплементу й коагуляційного каскаду, унаслідок чого може розвинутися дисеміноване внутрішньосудинне згортання крові (ДВС-синдром);
- ІЛ-6, імовірно, зумовлює кардіоміопатію, викликаючи дисфункцію міокарда;
- активація ендотеліальних клітин також може бути одною з ознак тяжкого синдрому вивільнення цитокінів, а ендотеліальна дисфункція може призвести до капілярного витоку, гіпотензії і коагулопатії.
Ендотеліальна дисфункція, у свою чергу, спричиняє розвиток запальних процесів і тромбоутворення, що супроводжується порушенням коагуляції, підвищенням рівня фібриногену, зниженням процесів фібринолізу і антикоагуляції. До того ж значно знижується продукція оксиду азоту (NO) внаслідок посиленого його руйнування через дію вільних радикалів, зниження доступності попередника NO — L-аргініну, що призводить до переважання дії вазоконстрикторів і посилення адгезії тромбоцитів. Тому екзогенне надходження L-аргініну як субстрату для синтезу NO є патогенетично обґрунтованим шляхом зменшення проявів ендотеліальної дисфункції [4].
Ураження легень вважається основною причиною як тяжкості перебігу, так і летального кінця при COVID-19 [5]. Тяжким проявом пневмоній, спричинених вірусом SARS-CoV-2, є гострий респіраторний дистрес-синдром (ГРДС), він розвивається приблизно в 15–20 % пацієнтів, особливо в осіб літнього віку і тих, хто страждає від супутніх серйозних захворювань. Хвороба перебігає в тяжкій формі, а ризик летального кінця сягає 4 % [1].
Інфікування вірусом SARS-CoV-2 може пригнічувати активність експресії AПФ-2, що призводить до токсичного надмірного накопичення ангіотензину II, яке викликає ГРДС і розвиток міокардиту [8]. У понад 60 % хворих, які померли від COVID-19, в анамнезі відзначалися артеріальна гіпертензія, серцево-судинні захворювання або цукровий діабет [9].
У пацієнтів з COVID-19 часто розвиваються як артеріальні, так і венозні тромбоемболічні ускладнення. На відміну від класичного ДВС-синдрому в цих хворих ступінь збільшення активованого часткового тромбопластинового часу часто є меншим, ніж подовження протромбінового часу (імовірно, через підвищений рівень фактора VIII). З урахуванням критичної ролі тромбозапалення й ендотеліальної дисфункції в умовах цитокінового шторму на ранніх етапах хвороби слід застосовувати протизапальні препарати [10].
Підходи до лікування пацієнтів з коронавірусною хворобою та її ускладненнями
COVID-19 — нова інфекція, проти якої нині немає специфічних ліків і вакцин. Багато в чому несподіваними виявилися і її ускладнення. Провідні спеціалісти сподіваються, що найближчим часом будуть розроблені вакцини і/або спеціальні терапевтичні препарати для лікування інфекції SARS-CoV-2.
Поки ж цей пошук триває, лікарі у всьому світі пробують застосовувати різні методи терапії і вже існуючі препарати для лікування пацієнтів з COVID-19. Оскільки не існує загальновизнаного й схваленого методу лікування нової коронавірусної інфекції, персонал медзакладів змушений використовувати препарати, не зареєстровані як лікарські засоби терапії саме цієї хвороби, щоб полегшити симптоми пацієнтів. Тобто склалася ситуація, за якої вагомішого значення, ніж принципи доказової медицини, набуває практичний клінічний досвід [11].
Надзвичайної актуальності набуває застосування синдромно-патогенетичного підходу до терапії, який полягає в лікуванні не діагнозу, а його конкретних проявів, синдромів. Так, наприклад, при ураженні ендотелію в легенях відбувається переміщення плазми в міжтканинний простір, надалі утворюються гіалінові мембрани, іде фіброзування. Але навіть якщо фіброзні зміни зберігаються тривалий час, необхідно керуватися синдромним підходом: забезпечувати кисневу підтримку й неінвазивну вентиляцію легень лише в разі дихальної недостатності. Тим більше що застосування апаратів штучної вентиляції легень при COVID-19 асоційоване з високою (до 90 %) смертністю, вентилятор-асоційованими пневмоніями й іншими ускладненнями [12].
Можливості застосування препаратів Ксаврон, Тіворель і Реосорбілакт у комплексній терапії в пацієнтівз коронавірусною хворобою
Ксаврон
Потенційна користь антиоксидантної терапії залежить від правильного вибору препаратів, ключовими вимогами до яких є здатність впливати на мітохондріальну проникність, блокувати сигнальні шляхи початку запалення (ІЛ-1, ІЛ-6, ІЛ-18); діяти в синергізмі з водорозчинними антиоксидантами (в цитоплазмі).
Цим вимогам повною мірою відповідає препарат Ксаврон (едаравон), низькомолекулярний антиоксидантний засіб, що цілеспрямовано взаємодіє з пероксильними радикалами. Завдяки своїй амфіфільності він поглинає як жиро-, так і водорозчинні пероксильні радикали, передаючи радикалу електрон; пригнічує окиснення ліпідів шляхом поглинання водорозчинних пероксильних радикалів, що ініціюють ланцюгові хімічні реакції, а також жиророзчинних пероксильних радикалів, що підтримують даний ланцюг [13].
У 2001 році цей препарат був схвалений у Японії як лікарський засіб для лікування гострого ішемічного інсульту, а у 2015 р. — для лікування бічного аміотрофічного склерозу.
Едаравон здатний швидко нейтралізувати широкий спектр вільних радикалів.
Він активує eNOS і може покращити кровообіг, блокує запальну iNOS; ефективно гальмує перекисне окиснення ліпідів (ПОЛ), захищаючи клітини від руйнування завдяки пригніченню ланцюгової реакції ПОЛ шляхом поглинання пероксильних радикалів.
Едаравон активує ферменти антиоксидантного захисту SOD (супероксиддисмутазу), CAT (каталазу), GSH-Rx (глутатіонпероксидазу).
Едаравон легко проникає через гематоенцефалічний бар’єр на відміну від інших акцепторів вільних радикалів, що зумовлює його виражений лікувальний ефект, захищає ендотелій головного мозку від пошкодження за рахунок захисного ефекту для мікросудин, що зумовлює його можливий терапевтичний вплив при розладах і захворюваннях, пов’язаних з карбонільним стресом [14].
Едаравон зменшує пошкодження гематоенцефалічного бар’єра й гальмує розвиток набряку мозку, прямо й опосередковано зменшує продукування прозапальних цитокінів: ІЛ-6, iNOS, ФНП-α, металопротеїназ.
Едаравон уже протягом майже двадцяти років застосовується для лікування пацієнтів з інсультом (протягом перших 24 год), оскільки завдяки своїм властивостям скевенджера вільних радикалів чинить захисну дію на серце, легені, кишечник, печінку, підшлункову залозу, нирки та інші органи. Нещодавно було продемонстровано, що едаравон корисний для пацієнтів з гострим інфарктом міокарда. Препарат також сприяв збільшенню фракції викиду лівого шлуночка й зниженню частоти повторних госпіталізацій пацієнтів з гострим інфарктом міокарда. У дослідженнях на тваринних моделях було показано, що едаравон знижував кількість ІЛ-1β-позитивних клітин міокарда в щурів з експериментальним автоімунним міокардитом; захищав серцеву функцію і зменшував розмір інфаркту шляхом зниження продукції ФНП-α в міокарді [15].
В експериментальних дослідженнях було показано, що едаравон здатний запобігати розвитку підвищеної проникності ендотеліоцитів мікроциркуляторного русла легень, спричиненої прозапальними цитокінами, імовірно, завдяки посиленню адгезивних контактів, а також інших механізмів. Тож препарат може бути корисним в умовах клінічної практики для лікування пацієнтів із ГРДС і пневмонією внаслідок високопатогенного пташиного грипу, що призводять до тяжкого ураження функції легень. Безпечність едаравону доведено в низці досліджень [16, 17].
У рекомендаціях японських товариств із застосування респіраторної підтримки та інтенсивної терапії едаравон визначений як препарат, який доцільно застосовувати для лікування пацієнтів із ГРДС у відділеннях інтенсивного лікування [18].
Нещодавня публікація H. Zhong et al. (2020) під назвою «Ефективність і безпека сучасних терапевтичних можливостей для лікування COVID-19 — уроки епідемій SARS і MERS, які слід вивчити: систематичний огляд і метааналіз» [19] на сьогодні є одним з найповніших оглядів результатів рандомізованих контрольованих і когортних досліджень потенційних підходів до фармакотерапії COVID-19. Однак, навіть завершивши ретельний метааналіз, автори не змогли визначити жодного конкретного препарату або комбінації препаратів, які можна було б рекомендувати для лікування пацієнтів з COVID-19. Цей висновок свідчить про необхідність виходити за межі порівняно короткого переліку ліків, «перепрофільованих» для терапії COVID-19 завдяки їхній ефективності при інших вірусних інфекціях.
У тяжких випадках COVID-19 може спостерігатися надмірне й нерегульоване вивільнення певних прозапальних цитокінів і хемокінів, що спричиняє запальний синдром. Масштабне системне запалення призводить до поліорганного ураження, недостатності й смерті [20]. Існує гіпотеза, що терапевтичні втручання, які значно послаблюють цю тяжку, згубну запальну реакцію, можуть зменшити частоту ураження органів і смерті. Нині не існує ефективних методів лікування запального синдрому, викликаного COVID-19. Але є дані щодо можливого ефекту застосування едаравону як у монотерапії, так і в комбінації з одним або кількома противірусними препаратами, зокрема лопінавіром і ритонавіром [21].
Едаравон вводять внутрішньовенно для лікування бічного аміотрофічного склерозу й гострої фази ішемічного інсульту. Едаравон — це ліпофільна сполука, що легко проникає в численні тканини й органи і має значну антиоксидантну й протизапальну ефективність [22]. На тваринних моделях доведено, що системне введення едаравону сприяє захисним ефектам при запаленні й травмуванні у випадках хімічного ураження легень, нирок, кишечника, підшлункової залози, мозку й печінки. Едаравон також сприяє зниженню рівнів [15]:
1) певних цитокінів (ІЛ-2, ІЛ-6, ІЛ-1β, ФНП-α) і хемокінів (ІЛ-8, моноцитарний хемоатрактантний протеїн 1, макрофагальні протеїни запалення);
2) активних форм кисню й оксиду азоту;
3) активності печінкових ферментів АСТ і АЛТ.
На думку групи науковців з університетів Сент-Джонс (Квінс) і Толедо, США (Reznik S.E. et al., 2020), ефективність едаравону необхідно продемонструвати шляхом його застосування в рамках подвійного сліпого рандомізованого плацебо-контрольованого дослідження за участю осіб віком від 18 років з COVID-19, підтвердженим лабораторним дослідженням методом ПЛР зі зворотною транскрипцією в реальному часі, і діагностованим на основі критеріїв G. Chen et al. [23] тяжким ступенем COVID-19. Едаравон у дозі 60 мг слід вводити внутрішньовенно 1 раз на добу протягом 1 години впродовж 10 днів особам у тестовій групі, тоді як учасники контролю отримуватимуть внутрішньовенно розчин плацебо. Усім пацієнтам необхідно забезпечити найкращу підтримувальну терапію. Первинною кінцевою точкою для оцінки ефективності має бути оцінка впливу на смертність, а клінічне покращання слід оцінювати так, як описано раніше [24]. Терапія едаравоном може супроводжуватися певними побічними ефектами (контузія, порушення ходи й головний біль) і спричиняти реакції гіперчутливості, тому пацієнти потребують ретельного догляду. Едаравон можна застосовувати пацієнтам з печінковою недостатністю легкого й середнього ступеня, а при нирковій недостатності едаравон не впливає значущо на стан пацієнта. До того ж не повідомлялося, що едаравон здатен викликати імуносупресію [21].
S.E. Reznik et al. (2020) вважають також, що едаравон, якщо його вводити своєчасно, сприятиме зменшенню тяжкості ураження органів, частоти клінічних ускладнень і смерті в пацієнтів з тяжкими формами COVID-19. На думку науковців, слід також перевірити ефективність едаравону при інфекційних захворюваннях, що викликають надмірно сильну запальну реакцію (наприклад, лихоманка Ебола) [21].
Отже, застосування едаравону — препарату, що здатний ефективно «гасити цитокінову пожежу», може сприяти значному покращанню стану пацієнтів з COVID-19, патогенез якого пов’язаний із розвитком ГРДС і різким збільшенням вмісту цитокінів.
Тіворель
Діючі речовини препарату Тіворель — L-аргінін і L-карнітин.
L-аргінін — умовно незамінна амінокислота, що є активним клітинним регулятором численних життєво важливих функцій організму, виявляє протекторні ефекти, важливі для організму в критичному стані.
Аргінін чинить антигіпоксичну, мембраностабілізуючу, цитопротекторну, антиоксидантну, антирадикальну, дезінтоксикаційну дію.
L-аргінін є субстратом для синтезу оксиду азоту і завдяки цьому покращує мікроциркуляцію, сприяє значній вазодилатації, запобігає активації та адгезії лімфоцитів і тромбоцитів.
Фізіологічна дія NO варіює від модуляції судинної системи до регуляції імунних процесів (клітинно-опосередкований імунітет, вплив нейтрофілів на патогенні мікроорганізми, неспецифічний імунний захист) і контролю нейрональних функцій. L-аргінін відновлює вміст NO в легеневій тканині, що зменшує спазм непосмугованої мускулатури бронхів і покращує вазомоторну функцію ендотелію легеневих артерій [25].
L-аргінін ефективно сприяє зниженню артеріального тиску в пацієнтів з артеріальною гіпертензією [26].
В умовах, коли вакцина проти COVID-19 тільки розробляється, а універсального ефективного лікування не існує, перспективним є застосування препаратів, що сприяють загальному зміцненню організму й покращують захисну здатність імунітету. До таких речовин, безумовно, належить L-аргінін [27].
Доцільність такого підходу підтверджує розпочате в Медичному центрі університету штату Огайо, США, клінічне випробування з використанням інгаляційного NO для лікування пацієнтів, у яких діагностовано COVID-19. Метою є уникнення інтенсивної терапії [28].
Отже, збільшення вмісту NO є перспективним напрямом лікування пацієнтів з коронавірусною хворобою, а L-аргінін може з успіхом застосовуватися для досягнення цієї мети.
L-карнітин є природною речовиною, що бере участь в енергетичному метаболізмі, а також метаболізмі кетонових тіл. Він необхідний для транспортування в мітохондрії довголанцюгових жирних кислот (які використовуються як енергетичний субстрат всіма тканинами, за винятком мозку) для їх подальшого β-окиснення й утворення енергії.
Левокарнітин відіграє важливу роль у серцевому метаболізмі, оскільки окиснення жирних кислот залежить від наявності достатньої кількості цієї речовини. Доведено позитивну дію левокарнітину при гострій і хронічній ішемії, декомпенсації серцевої діяльності, серцевій недостатності, спричиненій міокардитом, медикаментозною кардіотоксичністю.
Імуномодулюючий ефект L-карнітину полягає в пригніченні прозапальних цитокінів ФНП-α, ІЛ-6 і IЛ-1 в умовах цитокінового шторму. Препарат є прямим антиоксидантом, запобігає апоптозу клітин, дає кардіопротективний ефект.
Результати двох масштабних метааналізів — DiNicolantonio (2013) і Askarpour M. et al. (2019) — підтверджують ефективність терапії L-карнітином у пацієнтів із серцево-судинними захворюваннями завдяки зменшенню смертності, покращанню якості життя, зниженню рівня холестерину, нормалізації серцевого ритму, зменшенню потреби в нітратах [29, 30].
L-карнітин може бути корисним для пацієнтів з COVID-19 завдяки його імуномодулюючому впливу й пригніченню медіаторів запалення, зокрема С-реактивного білка (СРБ), ФНП-α та ІЛ-6, що може сприяти зменшенню цитокінового шторму [31].
Реосорбілакт
Реосорбілакт — унікальний гіперосмолярний кристалоїдний розчин, що не містить надлишку хлору, а отже, позбавлений основного недоліку таких розчинів — зростання ризику розвитку гіперхлоремії. Важливою відмінністю препарату Реосорбілакт є поєднання як гіперосмолярних властивостей, так і властивостей збалансованих кристалоїдів (набір необхідних іонів Са2+, К+, Na+, Mg2+ в ізоплазматичній концентрації). На відміну від інших гіперосмолярних розчинів іон хлору в складі Реосорбілакту наявний в ізоплазматичній концентрації (112 проти 154 ммоль/л в ізотонічному розчині). Завдяки гіперосмолярності Реосорбілакт спричиняє перехід рідини з міжклітинного сектора в судинне русло, що покращує мікроциркуляцію і перфузію тканин, завдяки потужному осмодіуретичному ефекту сорбітолу, пов’язаному з відсутністю в людини природних механізмів реабсорбції багатоатомних спиртів у проксимальних ниркових канальцях, Реосорбілакт має виражену діуретичну й протинабрякову дію [32].
Основними фармакологiчно активними речовинами препарату є сорбiтол i натрiю лактат. Iзотонiчний розчин сорбiтолу покращує мiкроциркуляцiю i перфузiю тканин, чинить дезагрегантну дiю.
Натрiю лактат сприяє корекцiї метаболiчного ацидозу; натрію хлорид чинить регідратуючу дію, поповнює дефіцит іонів натрію і хлору при різних патологічних станах; кальцію хлорид відновлює вміст іонів кальцію, необхідних для здійснення передачі нервових імпульсів, скорочення скелетних і непосмугованих м’язів, діяльності міокарда, формування кісткової тканини, згортання крові, запобігає розвитку запальних реакцій, підвищує стійкість організму до інфекцій; калію хлорид відновлює водно-електролітний баланс, чинить негативну хроно- і батмотропну дію, помірну діуретичну дію.
У низці досліджень виявлено, що застосування гіпертонічного розчину в пацієнтів з геморагічним шоком унаслідок травми знижує тривалість перебування на штучній вентиляції легень. Установлено також, що застосування гіперосмолярних розчинів у терапії хворих на тяжкий сепсис дозволяє зменшити об’єм інфузії. Такі позитивні ефекти, як зменшення частоти легеневих ускладнень, тривалості перебування на штучній вентиляції легень, об’єму інфузії, є важливими, вагомими й перспективними при застосуванні гіперосмолярних розчинів у хворих на пневмонію, зокрема спричинену COVID-19, коли важливо дотримуватись рестриктивного режиму інфузії [33, 34].
Клінічні випадки
Далі подано серію клінічних випадків пацієнтів із пневмоніями, спричиненими COVID-19, до схеми лікування яких було включено препарати Ксаврон, Тіворель і Реосорбілакт, що дозволило швидко досягти покращання стану пацієнтів і сприяло полегшенню перебігу захворювання.
Випадки з практики професора Л.В. Мороз, Вінницький національний медичний університет ім. М.І. Пирогова
Клінічний випадок 1
Пацієнт М., 63 років, надійшов зі скаргами на загальну слабкість, малопродуктивний кашель, утруднений вдих, задишку при незначному фізичному навантаженні. При обстеженні на момент надходження виявлено, що SatО2 — 88 % (96 % — на кисні); температура тіла — 38 °С. ПЛР на РНК SARS-CoV-2 позитивна. Комп’ютерна томографія (КТ) органів грудної клітки виявила двосторонню полісегментарну пневмонію.
Було призначене лікування: меропенем 1,0 г 3 рази/добу, фраксипарин 0,3 мл 2 рази/добу, лефлоцин 500 мг, інфулган 100 мл. На другу добу перебування в стаціонарі до лікування був доданий Ксаврон 10 мл 2 рази/добу, Тіворель (Tivor-L) 100 мл. На 10-й день лікування SatО2 — 96 %, на СКТ ОГК виявлена позитивна динаміка, ПЛР на РНК SARS-CoV-2 негативна.
Клінічний випадок 2
Пацієнт Р., 56 років, надійшов зі скаргами на загальну слабкість, пітливість, сухість у носі, малопродуктивний кашель і знижений апетит. На момент огляду температура тіла становила 38,4 °С. ПЛР на РНК SARS-CoV-2 позитивна. На КТ органів грудної клітки встановлена двостороння полісегментарна пневмонія. Пацієнту були призначені меропенем 1,0 г 3 рази/добу, атовакс 400,0 мг, фраксипарин 0,3 мл 2 рази/добу, Ксаврон 10 мл 2 рази/добу, Тіворель (Tivor-L) 100 мл. На тлі проведеного лікування через 5 днів SatО2 — 96 % (на кисні — 99 %), ПЛР на РНК SARS-CoV-2 негативна.
Випадки з практики лікаря-пульмонолога Е.М. Ходоша, пульмонологічне відділення Харківської міської клінічної лікарні № 13
Клінічний випадок 3
Пневмонія, спричинена СOVID-19, тяжкий перебіг. Чоловік, 40 років, в анамнезі кашель протягом 2 тижнів. За 2 дні до звернення в нього виникла лихоманка, яка реагувала на парацетамол, потім з’явився очевидний озноб і біль у м’язах, а також задишка при фізичному навантаженні, що стало причиною звернення до відділення. Лихоманка й озноб були значними; життєво важливі показники: частота серцевих скорочень (ЧСС) — 100 уд/хв, частота дихання (ЧД) — 20/хв, сатурація периферичної крові (SpO2) — 80 %, артеріальний тиск (АТ) — 140/90 мм рт.ст., сублінгвальна температура — 39,5 °С. Аускультативно: грубі потріскування над грудною кліткою. Хворий був негайно госпіталізований. У відділенні: назальна оксигенація канюлею (5 л/хв), внутрішньовенне введення рідини й парацетамол.
Результати комп’ютерної томографії (КТ) органів грудної клітки (ОГК): множинні плямисті помутніння за типом матового скла, що локалізуються в периферичних (субплевральних) відділах (рис. 1). У зв’язку з цим пацієнт був негайно ізольований, кілька зразків мазків із зіва були відправлені на дослідження методом полімеразної ланцюгової реакції (ПЛР).
Клінічний аналіз крові: легкий лейкоцитоз без лімфо- і тромбоцитопенії; прокальцитонін не виявлявся. Вміст С-реактивного білка — 13,85 мг/л, феритину — 1209 нг/мл, ІЛ-6 — 147,8 пг/мл, D-димеру — 8,71 мкг FEU/мл (мкг фібриноген-еквівалентних одиниць на 1 мл). Ниркові, печінкові й серцеві маркери були в межах норми. Електрокардіограма (ЕКГ) без гострофазових показників.
Після другого (позитивного) ПЛР-тесту підтверджено діагноз пневмонії, спричиненої COVID-19 (перший тест — негативний).
Лікування: плаквеніл (гідроксихлорохіну сульфат) — 400 мг 2 рази на добу, потім 200 мг 2 рази на добу, азитроміцин — 500 мг 1 раз на добу перорально, Реосорбілакт — 200 мл внутрішньовенно (в/в) краплинно 1 раз на день протягом 14 днів, Тіворель — 100 мл в/в краплинно 1 раз на добу — 14 днів, Ксаврон — 30 мг на 100 мл 0,9% натрію хлориду в/в краплинно 2 рази на добу протягом 14 днів. Пацієнт залишався у фазі плато, лихоманка зникла через 8 днів, назальну оксигенацію припинено. Перед випискою (через 14 днів) відзначалися тільки невелика задишка й легкий непродуктивний кашель. На думку лікаря-пульмонолога, «пацієнтові пощастило, оскільки в багатьох людей з таким перебігом, які перенесли інтубацію, кінцевий результат є поганим».
Клінічний випадок 4
Жінка, 47 років, госпіталізована із задишкою, лихоманкою, кашлем і гіпоксією протягом останніх 4 днів. АТ — 90/64 мм рт.ст., ЧСС — 121 уд/хв, температура — 39,2 °C; ЧД — 24/хв, вдихи неглибокі, SpO2 — 85 % за кімнатної температури. Пацієнтка повідомила, що вона медсестра стаціонару; тестування не проводила, 3 дні тому стала відчувати задишку.
Клінічний і біохімічний аналіз крові: феритин — 1883 нг/мл, ІЛ-6 — 202,3 пг/мл, СРБ — 298,8 мг/л, D-димер — 0,16 мкг FEU/мл. У відділенні взяті мазки для ПЛР-дослідження на грип, стрептокок і COVID-19 — виявлено РНК SARS-CoV-2. Відразу була розпочата інфузійна терапія з метою дезінтоксикації: введено 500 мл Реосорбілакту в/в краплинно. Для підтримки SpO2 приблизно на рівні 92 % розпочато введення O2 (5 л/хв). КТ показала поширену пневмонію (інтерстиціальну) (рис. 2).
Лікування: гепацеф комбі (суміш цефоперазону натрієвої солі й сульбактаму натрієвої солі) — в/в краплинно 2 рази на добу протягом 10 днів, азитроміцин — 500 мг перорально 1 раз на добу, Ксаврон — 30 мг в/в краплинно 2 рази на добу протягом 14 днів, Тіворель — 100 мл в/в краплинно 1 раз на добу протягом 14 днів, фленокс (еноксапарину натрій) — протягом 10 днів. Хвора виписана з клінічним покращанням.
Клінічний випадок 5
Чоловік, 64 років, з гіпертонічною хворобою II ст., цукровим діабетом (ЦД) 2-го типу, госпіталізований на 9-й день хвороби з кашлем, нездужанням і лихоманкою (38,7 °С).
У відділенні: SpO2 залишалася на низькому рівні (82 %) при введенні O2 (5 л/хв), потім погіршилася до 80 %, тому введення O2 збільшили до 10 л/хв, а надалі покращилася до 92 % — до моменту виписки на 11-й день.
Клінічний аналіз крові: лімфопенія, СРБ — 140 мг/л, феритин — 788 пг/мл, D-димер — 3,04 мкг FEU/мл. ПЛР-діагностика — позитивний тест на COVID-19.
Лікування: азитроміцин — 500 мг 1 раз на добу перорально протягом 10 днів, плаквеніл — 200 мг 3 рази на добу, Тіворель — 100 мл в/в краплинно 1 раз на добу протягом 14 днів, Ксаврон — 30 мг в/в краплинно 2 рази на добу протягом 14 днів, Реосорбілакт — 200 мл в/в краплинно 1 раз на добу протягом 14 днів.
На думку пульмонолога, у цьому випадку цікавим моментом є «променевий дисонанс»: рентгенологічні дані на 1-й і 8-й день рівноцінні (рис. 3), однак симптоми й потреба в O2 нівельовані; можна очікувати погіршення стану й потреби в O2-терапії, враховуючи дані рентгену ОГК у динаміці.
Випадки з практики
Клінічний випадок 6
Гостра респіраторна хвороба, спричинена COVID-19. Двобічна негоспітальна полісегментарна вірусно-бактеріальна пневмонія IV клінічної групи. Легенева недостатність (ЛН) ІІ ст.
Жінка, 51 року, захворіла за тиждень до госпіталізації в стаціонар, відколи почався сухий кашель, субфебрилітет, поступово наростала задишка. Лікувалась амбулаторно: азитроміцин, цефтріаксон, дексаметазон. Хвору госпіталізовано з негативною клінічною картиною, наростанням задишки, підвищенням температури тіла до 39–40 °С, ЧД 28/хв, ЧСС 110 уд/хв, АТ 90/60 мм рт.ст., сатурацією 88 %.
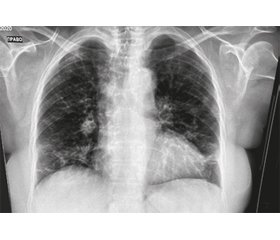
При аускультації: на фоні ослабленого дихання крепітація над середньонижніми відділами обох легень. КТ легень: двобічна полісегментарна пневмонія, імовірно, вірусної етіології (рис. 4). Рівень підозри на COVID-19-асоційовану пневмонію — CO-RADS-5. Результати ПЛР-дослідження: виявлено РНК вірусу SARS-CoV-2. Клінічний аналіз крові: лейкоцити — 3,2 × 109/л, паличкоядерні — 12 %, лімфоцити — 10 %.
Лікування: оксигенотерапія; меропенем — 1 г 3 рази на добу в/в; солу-медрол (метилпреднізолон) — 125 мг в/в краплинно; клексан (еноксапарин натрію) — 0,4 мл 2 рази на добу підшкірно (п/ш), Реосорбілакт — 200 мл в/в краплинно; Тіворель — 100 мл в/в краплинно, Ксаврон — 30 мг на 100 мл фізрозчину в/в краплинно 2 рази на добу. Дану терапію хвора отримувала 14 днів. Значне покращання настало на 6–7-й день терапії. Після 14 днів лікування хвору було виписано зі стаціонару з позитивною лабораторною і рентгенологічною динамікою (рис. 5).
/10_u.jpg)
Клінічний випадок 7
Жінка, 65 років, COVID-19-асоційована гостра респіраторна хвороба. Двобічна негоспітальна полісегментарна вірусно-бактеріальна пневмонія IV клінічної групи. ЛН ІІ ст.
Захворіла за тиждень до госпіталізації в стаціонар, відколи з’явилися сухий кашель, субфебрилітет, поступово наростала задишка. Лікувалась амбулаторно: азитроміцин, цефтріаксон. Хвору госпіталізовано з негативною клінічною картиною з наростанням залишки, підвищенням температури тіла до 39–40 °С, ЧД 30/хв, ЧСС 100 уд/хв, АТ 90/60 мм рт.ст., сатурацією 80 %. При аускультації: на фоні ослабленого дихання крепітація над середньонижніми відділами обох легень. КТ легень: двобічна полісегментарна пневмонія, імовірно, вірусної етіології (рис. 6). Ураження 75 % паренхіми легень. Результати ПЛР-дослідження: виявлено РНК вірусу SARS-CoV-2. Клінічний аналіз крові: лейкоцити — 4,4 × 109/л, паличкоядерні — 17 %, лімфоцити — 10 %. СРБ — 88 мг/л, феритин — 1280 нг/мл, ІЛ-6 — 158,4 пг/мл.
Лікування: оксигенотерапія; актемра (тоцилізумаб) — по 400 мг на 100 мл фізрозчину в/в краплинно 3 рази через 12 год; меропенем — 1 г 3 рази в/в; солу-медрол — від 250 мг в/в краплинно; клексан — 0,4 мл 2 рази п/ш; Реосорбілакт — 200 мл в/в краплинно; Тіворель — 100 мл в/в краплинно; Ксаврон — 30 мг на 100 мл фізрозчину в/в краплинно 2 рази на добу. Дану терапію хвора отримувала протягом 14 днів. Значне покращання настало на 8-й день терапії. Після 14 днів терапії хвору було виписано зі стаціонару з позитивною лабораторною і рентгенологічною динамікою (рис. 7).
/10_u3.jpg)
Клінічний випадок 8
Чоловік, 39 років, госпіталізований у стаціонар на 10-й день хвороби із сухим кашлем, задишкою, лихоманкою до 39 °С, діареєю. Хворіє на ЦД 1-го типу.
ЧД 24/хв, сатурація 88 %, ЧСС 98 уд/хв, АТ 140/90 мм рт.ст. Аускультативно: різко ослаблене дихання над нижніми частками обох легень. КТ легень: двобічна полісегментарна пневмонія із залученням до 35 % паренхіми легень. Клінічний аналіз крові: лейкопенія, лімфопенія; СРБ — 14,80 мг/л; феритин — 100 нг/мл; ІЛ-6 — 136,6 пг/мл; D-димер — 940 нг/мл. Електрокардіограма — дифузні зміни в міокарді. Результати ПЛР: виявлено РНК вірусу SARS-CoV-2.
Лікування: призначено кисневу терапію, плаквеніл — 400 мг 2 рази на добу 2 дні, пізніше по 200 мг 2 рази на добу; азитроміцин — 500 мг, клексан — 0,4 мл 2 рази на добу п/ш; Реосорбілакт — 200 мл в/в краплинно, Тіворель — 200 мл в/в краплинно, Ксаврон — 30 мг на 100 мл в/в краплинно 2 рази на добу. Терапію призначено на 14 днів. Клінічні показники покращилися на 6-й день терапії. Перед випискою зі стаціонару (через 14 днів) залишилися тільки незначний кашель і задишка. Пацієнт задоволений лікуванням.
/10_u5.jpg)
Клінічний випадок 9
Пацієнт, 72 років. Захворів за 14 днів до госпіталізації в стаціонар, відколи з’явилися сухий кашель, біль у спині, біль у м’язах, непостійний субфебрилітет, зникли нюх і відчуття смаку. Хворіє на ішемічну хворобу серця (ІХС). Переніс аортокоронарне шунтування у 2008 році. Госпіталізований у зв’язку з вираженою задишкою при незначному фізичному навантаженні, підвищеною температурою тіла (до 40 °С), ЧД 28/хв, ЧСС 105 уд/хв, АТ 115/90 мм рт.ст., сатурацією 86 %. Аускультативно: крепітація над легеневими полями на фоні ослабленого везикулярного дихання. Результати ПЛР: виявлено РНК вірусу SARS-CoV-2. КТ легень: двобічна полісегментарна пневмонія вірусної етіології (рис. 10). Клінічний аналіз крові: лейкоцитоз — 10,7 × 109/л; паличкоядерні — 10 %; СРБ — 9,8 мг/л; феритин — 220 нг/мл; ІЛ-6 — 110,5 пг/м; D-димер — 790 нг/мл; прокальцитонін — 1,8 нг/мл.
Лікування: оксигенотерапія; меропенем — 1 г 3 рази в/в краплинно на 100 мл фізрозчину; солу-медрол — 125 мг в/в краплинно; парацетамол — 100 мл 2 рази в/в краплинно; клексан — 0,4 мл 2 рази п/ш; Реосорбілакт — 200 мл в/в краплинно; Ксаврон — 30 мг 2 рази в/в краплинно на 100 мл фізрозчину; Тіворель — 100 мл в/в краплинно. Терапія призначена на 14 днів. На 6–7-й день лікування покращилися клінічні дані: нормалізувалася температура тіла, зменшилися кашель, задишка, покращилися лабораторні показники. Пацієнт виписаний після 14 днів лікування з позитивною клінічною і рентгенологічною динамікою; лікар і пацієнт задоволені лікуванням.
Випадок з практики лікаря-терапевта Кельменецької центральної районної лікарні (Чернівецька обл.) О.І. Кульчак
Клінічний випадок 10
Пацієнтка, 62 років, госпіталізована з діагнозом: позагоспітальна двобічна нижньочасткова пневмонія, III клінічна група, ЛН ІІ ст. Коронавірусна хвороба (COVID-19). ІХС. Дифузний кардіосклероз. Гіпертонічна хвороба, 2-га стадія, ступінь 2. Серцева недостатність IIА функціонального класу. ЦД 2-го типу середньої тяжкості. Ожиріння ІІ ст.
Симптоми при госпіталізації: загальна слабкість, швидка втомлюваність, втрата відчуття смаку й нюху, задишка при незначному фізичному навантаженні, підвищення температури тіла до 37,2 °С, сухий кашель, головний біль без чіткої локалізації. Загальний стан середньої тяжкості, SpО2 — 92–94 %; ЧД — 24/хв; ЧСС — 88 уд/хв; АТ — 150/90 мм рт.ст. Рентгенографія ОГК: двобічна нижньочасткова пневмонія. Лабораторні обстеження: клінічний аналіз крові: гемоглобін — 138 г/л; еритроцити — 4,2 × 1012/л, лейкоцити — 6,5 × 109/л, лімфоцити — 32 × 109/л, швидкість осідання еритроцитів (ШОЕ) — 45 мм/год; СРБ — 45,77 мг/л; сечовина — 10 ммоль/л; креатинін — 132 ммоль/л; D-димер — 875 нг/л; феритин — 620 мкг/л; глюкоза крові — 12 ммоль/л. Аналіз сечі: колір — жовтий, прозорість — середньомутна; білок — 0,099 г/л; глюкоза — 2,0 ммоль/л.
Розпочато терапію згідно з протоколом: інсулін за схемою; Тіворель 100 мл в/в краплинно 1 раз на добу, Ксаврон — 20 мг 2 рази на добу в/в краплинно; Реосорбілакт — 200 мл 1 раз на добу в/в краплинно. На 3-й день терапії внаслідок підвищення глікемії до 22 ммоль/л хвора госпіталізована у відділення реабілітації та інтенсивної терапії (ВРІТ), де відкореговано інсулінотерапію; попередню терапію продовжено. В умовах ВРІТ перебувала 3 дні, після зниження показників глікемії до 8 ммоль/л переведена до терапевтичного відділення. Загальний термін перебування в стаціонарі — 10 днів. За цей час стан пацієнтки покращився: зникла задишка, нормалізувалася температура тіла, SpО2 — 96–98 %. Лабораторні показники на 10-й день лікування: клінічний аналіз крові: гемоглобін — 120 г/л; еритроцити — 3,5 × 1012/л, лейкоцити — 6,7 × 109/л, лімфоцити — 27 × 1012/л, ШОЕ — 10 мм/год; глюкоза крові — 7 ммоль/л; СРБ — 4,28 мг/л, D-димер — 591 нг/мл, феритин — 415 мкг/л, сечовина — 7,9 ммоль/л, креатинін — 110 ммоль/л. Аналіз сечі: колір — жовтий, прозорість — прозора, білок — 0,033 г/л, глюкоза — 0,9 ммоль/л. Пацієнтка виписана зі стаціонару в задовільному стані, надані рекомендації, контроль коагулограми, глікемії.
Випадок з практики І.В. Чишкевич, лікаря-інфекціоніста КП «Центральна міська лікарня» м. Рівне, що визначена опорною для лікування пацієнтів, інфікованих COVID-19
Клінічний випадок 11
Пацієнтка, 58 років, госпіталізована із симптомами: температура — 36,4 °С, загальна слабкість, кашель, задишка, головний біль. Загальний стан середньої тяжкості. ЧД — 30/хв, ЧСС — 136 уд/хв, АТ — 140/110 мм рт.ст., сатурація — 85–88 % без кисню. Пацієнтка не перебувала на штучній вентиляції легень. КТ ОГК: в усіх частках обох легень периферично субплеврально визначалися множинні ділянки ущільнення легеневої паренхіми (інтерстицію) середньої інтенсивності за типом матового скла, у товщі яких визначалися потовщені субсегментні гілки легеневих артерій. Корені ущільнені, тяжисті. На КТ були ознаки поліфокального інтерстиційного вогнищевого ураження обох легень — атипової полісегментарної пневмонії. Діагноз: коронавірусна хвороба (COVID-19) середньої тяжкості. Тяжкий перебіг захворювання зумовлений супутнім ЦД 2-го типу, стан декомпенсований. Аліментарно-конституційне ожиріння 1-го ст. Обстеження при госпіталізації: АЛТ — 18 мОд/л, АСТ — 22,5 мОд/л; сечовина — 13,4 ммоль/л, креатинін — 102 ммоль/л, глюкоза — 30 ммоль/л, СРБ — 233 мг/л, ацетон у сечі. Лікування проводили згідно з прийнятими протоколами, додатково включивши до схеми лікування: Реосорбілакт — 200 мл в/в краплинно 1 раз на добу протягом 10 днів; Тіворель — 100 мл в/в краплинно 1 раз на добу протягом 10 днів; Ксаврон — 20 мг 2 рази на добу в/в краплинно протягом 7 днів. Через 2 доби від початку лікування: СРБ — 73,1 мг/л, креатинін — 77 ммоль/л, глюкоза — 10,7 ммоль/л, сечовина — 11 ммоль/л. Через 8 днів лікування: СРБ — 30,7 мг/л, глюкоза — 10,5 ммоль/л; ацетон у сечі зник через 4 дні; сатурація — 97 % на оксигенотерапії.
Через 14 днів стаціонарного лікування пацієнтка переведена до ендокринологічного відділення у зв’язку з декомпенсацією ЦД (глікований гемоглобін — 14 %) для корекції інсулінотерапії.
Висновки
Опис клінічних випадків пацієнтів, які разом з основною терапією пневмонії, спричиненої COVID-19, отримували додаткову терапію препаратами Ксаврон, Тіворель і Реосорбілакт, свідчить про вірогідне покращання низки показників. Зокрема, додаткова терапія сприяла поліпшенню насиченості крові киснем, зниженню температури тіла, а також скороченню перебування пацієнтів у стаціонарі. У пацієнтів значуще покращувалося самопочуття, зменшувалася потреба в оксигенотерапії, знижувалася втомлюваність, поліпшувалися лабораторні показники.
На момент закінчення лікування в пацієнтів значуще знижувався вміст СРБ — маркера активності запального процесу в легенях, підвищення якого коригує з об’ємом ураження легеневої тканини й тяжкістю перебігу захворювання.
Зменшення в пацієнтів на фоні отримання додаткової терапії вмісту D-димеру, який належить до маркерів запального процесу, теж свідчить про покращання їхнього стану.
Збільшення вмісту гострофазового білка феритину відзначають при несприятливому перебігу захворювання і так званому цитокіновому штормі, тож зниження цього показника в пацієнтів після курсу комбінованої терапії препаратами Ксаврон, Тіворель і Реосорбілакт є ще одним доказом ефективності додаткової терапії цими препаратами.
В умовах, коли етіотропні препарати, які діють безпосередньо на збудник COVID-19, ще не розроблені, надзвичайно важливим є комплексний синдромно-патогенетичний підхід до лікування пацієнтів з тяжкими формами COVID-19, при якому будуть враховані індивідуальні особливості й забезпечена максимально ефективна підтримка організму. У цьому контексті застосування комбінованої терапії препаратами Ксаврон, Тіворель і Реосорбілакт є надзвичайно перспективним, оскільки дозволяє покращити стан пацієнтів з COVID-19-асоційованими пневмоніями, запобігає інвалідизації і зниженню якості життя пацієнтів після перенесеної хвороби.
Список литературы
1. Zhang W., Zhao Y., Zhang F. The use of anti-inflammatory drugs in the treatment of people with severe coronavirus disease 2019 (COVID-19): The Perspectives of clinical immunologists from China. Clinical Immunology. 2020. 214. 108393.
2. Абатуров А.Е., Агафонова Е.А., Кривуша Е.Л., Никулина А.А. Патогенез COVID-19. Здоров’я дитини. 2020. 15(2). 133-144.
3. Shimabukuro-Vornhagen A., Gödel P., Subklewe M. et al. Cytokine release syndrome. J. Immunotherapy Cancer. 2018 June 15. 6(1). 56.
4. Снігир Н.В. та ін. Корекція ендотеліальної дисфункції при ішемічній хворобі серця в поєднанні з цукровим діабетом. Ліки України. 2016. № 3. С. 53-56.
5. Xu Z., Shi L., Wang Y. et al. Pathological findings of COVID-19 associated with acute respiratory distress syndrome. Lancet Respir. Med. 2020. 8(4). 420-422.
6. Bell T.J., Brand O.J., Morgan D.J. et al. Defective lung function following influenza virus is due to prolonged, reversible hyaluronan synthesis. Matrix Biol. 2019. 80. 14-28.
7. Heldin P., Lin C.Y., Kolliopoulos C. et al. Regulation of hyaluronan biosynthesis and clinical impact of excessive hyaluronan production. Matrix Biol. 2019. 78-79. 100-117.
8. Chen C., Zhou Y., Wang D.W. SARS-CoV-2: a potential novel etiology of fulminant myocarditis. Herz. 2020. 10.1007/s00059-020-04909-z.
9. Paz Ocaranza M., Riquelme J.A., García L. et al. Counterregulatory renin-angiotensin system in cardiovascular disease. Nat. Rev. Cardiol. 2020. 17(2). 116-129.
10. Thachil J., Tang N., Gando S. et al. Laboratory haemostasis monitoring in COVID-19. J. Thromb. Haemost. 2020 Apr 23.
11. COVID-19: Мир в поиске эффективного лечения. https://www.2000.ua/v-nomere/forum/hroniki-chumnogo-goda_forum/covid-19-mir-v-poiske-effektivnogo-lechenija.htm.
12. Liu Y., Yang Y., Zhang C. et al. Clinical and biochemical indexes from 2019-nCoV infected patients linked to viral loads and lung injury. Sci China Life Sci. 2020. 63(3). 364-374.
13. Perez-Gonz A., Galano A. OH Radical Scavenging Activity of Edaravone: Mechanism and Kinetics. J. Phys. Chem. B. 2011. 115. 1306-1314.
14. Toth A.E., Walter F.R., Bocsik A.S. et al. Edaravone Protects against Methylglyoxal-Induced Barrier Damage in Human Brain. Endothelial Cells. PLoS ONE. 2014. 9(7). e100152.
15. Kikuchi K., Takeshige N., Miura N. et al. Beyond free radical scavenging: Beneficial effects of edaravone (Radicut) in various diseases (Review). Experimental and therapeutic medicine. 2012. 3. 3-8.
16. Saito Y., Fujii Y., Yashiro Y. Inhibitory Effects of Edaravone, a Free Radical Scavenger, on Cytokine-induced Hyperpermeability of Human Pulmonary Microvascular Endothelial Cells: A Comparison with Dexamethasone and Nitric Oxide Synthase Inhibitor. Acta Med. Okayama. 2015. 69(5). 279-90.
17. Kikuchi K., Uchikado H., Miyagi N. еt al. Beyond neurological disease: new targets for edaravone (Review). Int. J. Mol. Med. 2011. 28. 899-906.
18. Hashimoto S., Sanui M., Egi M. et al. The clinical practice guideline for the management of ARDS in Japan. Journal of Intensive Care. 2017. 5. 50.
19. Zhong H., Wang Y., Zhang Z.-L. et al. Efficacy and safety of current therapeutic options for COVID-19 — lessons to be learnt from SARS and MERS epidemic: a systematic review and meta-analysis. Pharmacol. Res. 2020. 157. 104872.
20. Huang C., Wang X., Li L. et al. Clinical features of patients infected with 2019 novel coronavirus in Wuhan, China. Lancet. 2020. 395(10223). 497-506.
21. Reznik S.E., Tiwari A.K., Ashby Jr. C.R. Edaravone: a potential treatment for the COVID-19-induced inflammatory syndrome? Pharmacol. Res. 2020 Oct. 160. 105055.
22. Watanabe T., Tahara M., Todo S. The novel antioxidant edaravone: from bench to bedside. Cardiovasc. Ther. 2008. 26(2). 101-114.
23. Chen G., Wu D., Guo W. et al. Clinical and immunological features of severe and moderate coronavirus disease. J. Clin. Invest. 2020. 130(5). 2620-2629.
24. Grein J., Ohmagari N., Shin D. et al. Compassionate use of remdesivir for patients with severe Covid-19. N. Eng. J. Med. 2020. 382(24). 2327-2336.
25. Gokce N. L-arginine and hypertension. J. Nutr. 2004 Oct. 134(10). 2807S-2811S.
26. Gui S., Jia J., Niu X. Arginine supplementation for improving maternal and neonatal outcomes in hypertensive disorder of pregnancy: a systematic review. J. Renin Angiotensin Aldosterone Syst. 2014. 15(1). 88-96.
27. COVID-19: NO (nitric oxide) pathway useful for inhibiting Coronavirus (Covid-19?) and SARS-Cov; l-arginine, l-citrulline sources. JAMA: March 19, 2020 COVID-19: Can We Expedite Treatment? Gary Ordog, MD, DABMT, DABEM, www.researchgate.net/post/NO_nitric_oxide_pathway_useful_for_inhibiting_Coronavirus_Covid-19_and_SARS-Cob_l-arginine_l-citrulline_sources.
28. Ohio State Testing Nitric Oxide To Treat Coronavirus Patients. https://patch.com/ohio/cleveland/ohio-state-testing-nitric-oxide-treat-coronavirus-patients.
29. DiNicolantonio J.J., Lavie C.J., Fares H. et al. L-carnitine in the secondary prevention of cardiovascular disease: systematic review and meta-analysis. Mayo Clin. Proc. 2013. 88(6). 544-551.
30. Askarpour M., Hadi A., Symonds M.E. Efficacy of L-carnitine supplementation for management of blood lipids: A systematic review and dose-response meta-analysis of randomized controlled trials. Nutr. Metab. Cardiovasc. Dis. 2019 Nov. 29(11). 1151-1167.
31. Haghighatdoost F., Jabbari M., Hariri M. The effect of L-carnitine on inflammatory mediators: a systematic review and meta-analysis of randomized clinical trials. Eur. J. Clin. Pharmacol. 2019 Aug. 75(8). 1037-1046.
32. Ніконов В.В., Лизогуб К.І., Лизогуб М.В. Інфузійна терапія при пневмонії: що нового? Медицина невідкладних станів. 2020. 16(2). 118-123.
33. DuBose J.J., Kobayashi L., Lozornio A. еt al. Clinical experience using 5% hypertonic saline as a safe alternative fluid for use in trauma. J. Trauma. 2010. 68(5). 1172-7.
34. Orbegozo D., Vincent J.-L. Hypertonic Saline in Human Sepsis: A Systematic Review of Randomized Controlled Trials. June 2019. Vol. 128.

/9_u.jpg)
/9_u2.jpg)
/10_u2.jpg)
/10_u4.jpg)
/11_u.jpg)