Газета «Новости медицины и фармации» №8 (726), 2020
Вернуться к номеру
Інфекція Helicobacter pylori та вітамін D
Авторы: Сорокман Т.В., Попелюк Н.О., Остапчук В.Г.
ВДНЗ України «Буковинський державний медичний університет», м. Чернівці, Україна
Рубрики: Гастроэнтерология
Разделы: Справочник специалиста
Версия для печати
На сьогодні першочергове значення у формуванні запально-деструктивних захворювань гастродуоденальної ділянки небезпідставно надається специфічному інфекційному агенту — хелікобактеру пілорі (Helicobacter pylori (H.pylori)) [1]. Даний мікроорганізм вважається найбільш поширеною персистуючою бактеріальною інфекцією (інфікованість сягає 60 % населення земної кулі) [2–5]. Згідно з даними різних дослідників, інфікованість дитячого населення становить від 35–40 до 60–70 % [6, 7]. Така висока контамінація свідчить про те, що найближчим часом буде спостерігатися подальший ріст H.pylori-асоційованих захворювань, передусім гастродуоденітів і виразкової хвороби. На сьогодні H.pylori має місце у 52–55 % дітей із хронічним гастритом і гастродуоденітом, а при ерозивно-виразкових процесах їх число збільшується до 82–98 % [8].
Роль інфекції H.pylori у розвитку запалення слизової оболонки верхніх відділів шлунково-кишкового тракту розглядалася в рамках простої парадигми зараження, оскільки знищення бактерії виявилося передбачуваним результатом анти–біотикотерапії. Різні схеми антихелікобактерної терапії перевищують ефективність ерадикації in vitro більше за 90 %. H.pylori чутливий до багатьох антибіотиків. Однак в організмі людини досягти такого ерадикаційного ефекту не вдається. У загальному клінічному досвіді більш реалістична ефективність становить 60–70 %, при цьому недосягнення ерадикації H.pylori слизової не можна просто пояснити тільки закономірно–стями антибіотикорезистентності [9, 10]. Пул пацієнтів із стійкою інфекцією через невдалу терапію збільшується, і це стає важливою медичною проблемою. Тобто уявлення про H.pylori-асоційовані захворювання в такому випадку є надто спрощеним. На сьогодні достеменно відомо, що важливу роль у розвитку захворювань органів травлення, в тому числі асоційованих з H.pylori, відіграють порушення імунної системи, що забезпечують захист організму й участь у процесі регенерації уражених тканин [11, 12]. Колонізація шлунково-кишкового тракту Н.pylori не завжди призводить до розвитку патологічного процесу. Відповідь організму на Н.pylori залежить від стану імунітету людини, як уродженого, так і адаптивного, кількості рецепторів на поверхні шлунка, що сприяють адгезії мікро–організму, вірулентності Н.pylori тощо [13]. Більшість авторів визначають, що стан захисних механізмів слід розглядати як фактор, що визначає реалізацію патогенних властивостей H.pylori [14–16]. Його патогенність у цьому випадку обмежується активністю місцевого імунітету [17]. Модуляція експресії генів, що індуковані H.pylori-інфекцією, пов’язана з активацією образ–розпізнавальних рецепторів (pattern-recognition receptors — PRR), насамперед Toll-подібних (Toll-like receptor — TLR) і NOD-подібних (Nod-like receptor — NLR, NLR/NOD), а також сигнальних шляхів, що призводять до активації факторів транскрипції (насамперед ядерного фактора транскрипції kВ (nuclear factor kappa-light-chain-enhancer of activated В cells — NF-kВ). Глікопротеїн sCD14 — солютабна форма CD14, локалізована у плазмі, що забезпечує взаємодію H.pylori з епітеліоцитами слизової оболонки шлунка. NT-proBNP та sCD14 також є інтегральними складовими вродженої імунної відповіді на інфекцію H.pylori. Ліпо–полісахариди (lipopolysaccharide — LPS) — структурні компоненти зовнішньої мембрани грамнегативних бактерій — є одними з найвпливовіших патогенасоційованих молекулярних структур мікроорганізмів (pathogenassociated molecular patterns — PAMP), у тому числі H.pylori [18–20].
Період ремісії супроводжується зменшенням ступеня сенсибілізації імунокомпетентних клітин до тканин слизової оболонки. Якщо елімінації H.pylori не виникає, то це призводить до стійкої функціональної неповноцінності лімфоцитів із порушенням їх метаболізму, що в подальшому сприяє більш частому рецидивуванню захворювання та скороченню часу ремісії. Таким чином, можливо припустити, що патогенна дія H.pylori, що виявляється лише за умови недостатності місцевого захисту, є своєрідним маркером імунодефіцитного стану [21]. Встановлено, що при хронічних ерозіях шлунка адекватна імунна відповідь визначається лише у 13,5 % хворих [22]. В епітелії, що вистилає краї ерозій, порушується синтез секреторного IgA, в той час як кількість IgG-продукуючих клітин збільшується. У разі гіперпродукції IgG рецептори Т-супресорів, що здатні регулювати місцеву гуморальну імунну відповідь, заблоковані імунними комплексами. Фіксація імунних комплексів порушує тканинний метаболізм, підвищуючи дистрофічні процеси у слизовій оболонці і гальмуючи регенерацію [23]. Пошкоджена в ділянці виразкового дефекту тканина набуває властивостей автоантигену, що є джерелом авто–агресії. Тому деякі дослідники розглядають виразкову хворобу як автоімунне захворювання [24]. Знання імунних механізмів слизових, що обмежу–ють інфекцію, форми H.pylori визначає законо–мірність клінічного захворювання та ефективність ерадикації. На думку деяких вчених [25], провідним механізмом запалення слизової оболонки у дітей з H.pylori-асоційованими хронічними гастро–дуоденальними захворюваннями є рецепторнезалежна активація фактора транскрипції NF-kB, а рецепторзалежні механізми більшою мірою зумовлюють продукцію NT-proBNP. З огляду на особливості розвитку запального процесу слизової оболонки при інфікуванні H.pylori (а саме на рецепторнезалежну активацію фактора транскрипції NF-kB), автори вважають, що проведення ерадикаційної терапії необхідно поєднувати з призначенням препаратів, які пригнічують активність молекулярних компонентів NF-kB-залежних механізмів запалення. Рекогніція патогенних мікро–організмів, у тому числі і в травному тракті, зумовлена сукупністю різноманітних солютабних, мембранних і цитоплазматичних рецепторів розпізнавання образів (PRR). PRR розпізнають унікальні, що не мають аналогів у макроорганізмі, консервативні молекулярні структури — пато–генасоційовані молекулярні структури (pathogen-associated molecular patterns — РАМР). Найбільш відомими РАМР для H.pylori є ліпо–полісахариди (LPS) — структурні компоненти зовнішньої мембрани H.pylori. Всі види PRR мають здатність розпізнавати РАМР незалежно від стадії життєвого циклу інфекційних агентів і експресуватися клітинами макро–організму незалежно від механізмів імунної пам’яті [18–20]. При взаємодії інфекційних агентів із РАМР PRR активується і розвивається захисна запальна реакція. Відомо, що активація імунокомпетентних клітин є кальцій–залежним процесом [26]. Недостатність або дефіцит холекальциферолу в організмі розглядається як предиктор розвитку багатьох хронічних захворювань, а також інфекцій. Імунорегуляторні ефекти недостатності вітаміну D3 проявляються у вигляді посилення прозапального вектора вроджених та адаптивних імунних реакцій. Причому вплив вітаміну D3 на вказані процеси має дозозалежний ефект. За відсутності або дефіциту вітаміну D3 в організмі відбувається затримка дозрівання лімфоцитів на стадії лімфобластів, від чого значно страждають процеси імунної відповіді на антигенні подразники [27]. Підтвердженням значущості вітаміну D3 в імунній регуляції є результати численних експериментальних і клінічних досліджень, що демонструють зв’язок між низькими рівнями вітаміну D3 і підвищеною сприйнятливістю до різних інфекцій (вірусної, бактеріальної, грибкової етіології), а також до розвитку автоімунної й алергічної патології [28–31]. Дані, наведені M.C. Magnus et al. [32], показали, що частота інфекцій нижніх дихальних шляхів у дітей перших трьох років життя (n = 1248) має обернену залежність навіть від рівня 25(ОН)D у сироватці крові їх матерів у період вагітності. З огляду на те, що однією з основних функцій вітаміну D є регуляція транспорту кальцію в слизовій оболонці кишечника, ниркових канальцях і кістках, при його дефіциті спостерігається порушення кальцієвого обміну, зниження концентрації цього макроелемента в біологічних рідинах і клітинах, що негативним чином може впливати на активацію імунокомпетентних клітин.
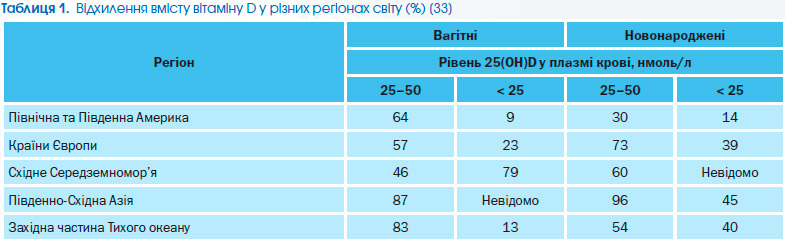
За даними наукових досліджень, у всьому світі спостерігається дефіцит вітаміну D (табл. 1) [33–35]. Вітчизняними дослідженнями як серед дорослого [36], так і серед дитячого населення України [37] було встановлено наявність недостатньої кількості вітаміну D.
Відомо, що дефіцит метаболітів вітаміну D зумовлює розвиток загальносоматичних захворювань, таких як цукровий діабет, захворювання серцево-судинної системи, розсіяний склероз, псоріаз тощо [38, 39]. Впродовж останніх років було глибоко вивчено метаболізм, функції та вплив на організм людини вітаміну D. За допомогою специфічних метаболічних процесів в організмі людини вітамін D перетворюється на високоактивну гормональну форму.
Рецепторні білки до вітаміну D ідентифіковані у клітинах шкіри, серця, легенів, головного мозку, скелетних м’язів, товстого кишечника, шлунка, плаценти, в молочній залозі, підшлунковій та ендо–кринних залозах. Також рецептори вітаміну D містяться на активованих CD4+ і CD8+ Т-лімфоцитах, В-лімфоцитах, нейтрофілах, макрофагах, дендритних клітинах [40, 41].
Вітамін D належить до групи жиророзчинних секостероїдів. Секостероїд — молекула, що дуже подібна до стероїдів, але з розірваним стероїдним кільцем. Вітамін D наявний у двох формах (D2 та D3), що хімічно відрізняються в їх бічних ланцюгах. Ці структурні відмінності змінюють їх зв’язування з білком-носієм, тобто з вітамін-D-зв’язуючим білком (vitamin D binding protein — DBP), та їх метаболізм, але в цілому біологічна активність їх активних метаболітів є подібною.
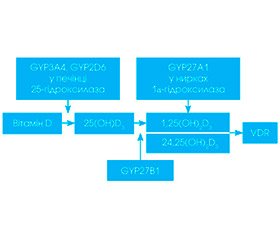
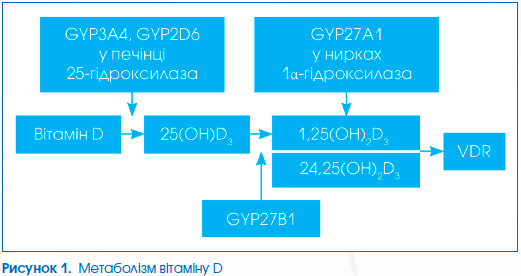
Загальновідомими є три шляхи надходження вітаміну D в організм людини: утворення його у шкірі під дією ультра–фіолетового випромінювання (превітамін D3, основна частина якого зв’язується з сироватковим альфа-2-глобуліном — DBP, утворюючи транспортну форму вітаміну D3, а інша частина при сильному сонячному випроміненні може перетворюватися на неактивні люмістерол і тахістерол, 5,6-транс-холекальциферол, суперстерол I і суперстерол II; таким чином забезпечується від 90 до 100 % потреб організму); харчовий шлях — вітамін D потрапляє в організм з продуктами харчування (жирні види риби: лосось, скумбрія, сом, тунець, сардина, яєчний жовток, теляча печінка, риб’ячий жир, ікра), таким чином забезпечується 10 % потреб організму; медикаментозний — вітамін D потрапляє з медичними препаратами. Циркулюючий у крові вітамін D3 захоплюється купферівськими клітинами печінки, де він піддається подальшому метаболізму під дією мембранного фермента родини цитохрому Р450 25-гідроксилази (CYP27A1) з утворенням 25-гідро–ксихолекальциферолу (25(OH)D3, кальцидіол), а інша його частина фіксується в жирових тканинах і в м’язах та є резервною формою. У нирках під дією –мітохондріального фермента родини цитохрому Р4501 a-гідроксилази (CYP27B1) та 24-гідроксилази відбувається подальше гідроксилювання, що призводить до синтезу високоактивних метаболітів 1a,25-дигідроксихолекальциферолу (1a,25(OH)2D3): 1a,25(OH)2D, кальци–тріол і 24,25(ОН)2D (рис. 1), а також лігування нуклеарних рецепторів вітаміну D (VDR) [42].
Цей процес контролюється та стимулюється паратгормоном, а також кальцитоніном, пролактином, соматотропним гормоном і статевими гормонами. Інші речивини гальмують цей процес: 1a-гідроксилювання кальцієм, фосфатами, фактором росту фібро–бластів, глюкокортикостероїдами тощо. Іншій регуляції піддається позанирковий синтез 1,25(OH)2D (у кератиноцитах, макрофагах), зокрема стимулюється цитокінами (фактор некрозу пухлини альфа (ФНП-a), гамма-інтерферон (ІФ-g)).
Експресія та активність 1a-гідроксилази в позаниркових тканинах ідентична тій, що регулює її у нирці (хромосомний локус 12q13.1 — q13.3). Синтез і катаболізм контролюються місцевими факторами, цитокінами та факторами росту, що оптимізують рівень кальцитріолу для конкретних клітинних дій за допомогою ще не повністю зрозумілих механізмів. Зокрема, експресія 1a-гідроксилази в макрофагах значно стимулюється імунними сигналами, опосередкованими інтерфероном g (IFN-g), ліпополісахаридами і вірусними інфекціями, та в дендритних клітинах, пов’язаних з дозріванням p38 MAPK та NF-kB одних і тих же осередків [43]. Кальцитріол є одним із найважливіших регуляторів генів, і його дія залежить від зв’язування рецептора високої афінності (нуклеарні рецептори вітаміну D). VDR належать до надродини ядерних рецепторів стероїдних гормонів, що модулюють генетичну експресію клітин [44], і міститься у багатьох тканинах.
Усі компоненти метаболізму вітаміну D та VDR об’єднують в ендокринну систему вітаміну D, функції якої полягають у здатності генерувати біологічні реакції у тканинах-мішенях за рахунок регуляції RVD транскрипції генів (геномний механізм — рецептори вітаміну D у ядрах клітин) і швидких позагеномних реакціях, які здійснюються при взаємодії з рецепторами вітаміну D, що локалізуються на мембранах низки клітин (цей механізм схожий на дію механізму стероїдних гормонів). Геномні дії вітаміну D поділяються на класичні та некласичні. Що стосується класичних дій, то вітамін D виступає як основний фактор у взаємодії між ниркою, кісткою, прищитоподібними залозами та кишечником, щоб підтримувати рівень позаклітинного кальцію в межах норми. Серед некласичних геномних дій недавнє відкриття VDR в клітинах імунної системи та факт, що багато з цих клітин мають ферменти, здатні виробляти гормон, свідчать про те, що він має важливі імуно–регуляторні властивості. Розвиток молекулярних досліджень і виявлення VDR у багатьох тканинах, що не беруть участь у метаболізмі кальцію та фосфору, ініціювали еру інтенсивних досліджень інших некласичних або –нескелетних функцій вітаміну D. Ця плейотропна дія вітаміну D дає всі підстави вважати, що вітамін D є надзвичайно важливим для здоров’я людини.
1,25(OH)2D стимулює вроджений імунітет, сприяє вивільненню каталітичного антимікробного протеїну і b-дефенсину, що проявляє антимікробну активність проти A.actinomycetemcomitans, P.gingivalis, F.nucleatum, Сandida, Рapillomavirus. І 1,25(OH)2D, і 25(OH)D мають здатність індукувати експресію кателіцидину в моноцитах/макрофагах та епідермальних клітинах, що містять 25(OH)D гідроксилази [45]. Виявлено, що 1,25(OH)2D стимулює диференціацію моноцитів у макрофаги та збільшує їх хемотаксис і фагоцитарну здатність, пригнічує експресію прозапальних цитокінів ФНП-a, IL-1, -6, -8, -12. 1,25(OH)2D3 і його синтетичні аналоги інгібують диференціацію та дозрівання дендритних клітин, тим самим пригнічуючи їх здатність представляти антиген Т-клітин. Окрім того, сьогодні [46] припускають, що 1,25(OH)2D3 може стимулювати толерантність імунної системи та використовуватись як при автоімунних процесах, так і при трансплантації органів. Існує модулюючий вплив на Т-клітинну проліферацію та продукцію цитокінів: знижується розвиток Th-1 та Th-17, підвищується кількість Th-2, регулюється продукція Т-кілерів. При цьому 1,25(OH)2D3 переважно інгібує Т-хелпери 1 (Th1), що належать до клітинної імунної від–повіді [47].
Зменшення потенційного ушкодження тканин пов’язане з Th1-імунною відповіддю. Вітамін D впливає на фенотип дендритних клітин та їх функцію шляхом зниження експресії молекул CD40, CD80, CD86, цитокіну IL-12 і збільшення рівня цитокіну IL-10. Існує вплив і на В-клітинну ланку імунітету, а саме пригнічення проліферації та утворення імуно–глобулінів і сповільнення проліферації В-клітин у плазматичні клітини. Також було продемонстровано, що 1,25(OH)2D збільшує кількість Th2 за рахунок прямого впливу на нативні CD4 [48]. Тому і Th1, і Th2 регулюються дією агоністів VDR, як щодо їх активації, так і диференціації. Кальцитріол також має потужний і прямий вплив на реакцію В-клітин, викликаючи індукцію апоптозу, гальмування проліферації, генерацію клітин пам’яті В, диференціювання плазматичних клітин і вироблення імуно–глобуліну.
Дослідження, проведені за останнє десятиліття, свідчили про високу поширеність дефіциту та/або недостатності вітаміну D у загальній популяції, і ця низька концентрація корелює зі збільшенням захворюваності на автоімунні захворювання, кісткові патології та рак [49]. Епідеміологічні дослідження чітко показали, що достатня концентрація гормону (> 30 нг/мл) знижує ризик розсіяного склерозу, хронічних кишкових запальних захворювань, ревматоїдного артриту, остео–артриту та системного червоного вовчака, підтверджуючи, що рівень вітаміну D має вплив на поширеність автоімунних захворювань.
Вітамін D безпосередньо або опосередковано контролює сотні генів, що пов’язані з проліферацією, диференціацією клітин, апоптоз та ангіогенез [50]. Останні дані вказують на ризик інфекційного зараження (інфекції сечовивідних шляхів, туберкульоз та інші респіраторні інфекції), що збільшується при дефіциті вітаміну D [51].
Обговорюється зв’язок між дефіцитом вітаміну D та ризиком зараження H.pylori — найпоширенішою хронічною бактеріальною інфекцією людини. За даними дослідження [52], пацієнти з H.pylori-асоційованим гастритом мали більш низький вміст вітаміну D у сироватці крові. Інші дослідження також показали, що дефіцит вітаміну D може бути фактором, що сприяє автоімунному гастриту та раку шлунка [53]. Припускають, що інфекція H.pylori та дефіцит вітаміну D можуть викликати локальну або системну запальну відповідь через запальний цитокін (чутливість С-реактивного білка — HS-CRP) [54].
У дослідженні з Японії повідомлялося про більш високу поширеність інфекції H.pylori серед жінок похилого віку, які проживали в будинках для престарілих та отримували лікування вітаміном D при остеопорозі, порівняно з тими, хто не приймав вітамін D [55]. В іншому дослідженні проведено оцінку зв’язку між дефіцитом вітаміну D та атрофічним гастритом: інфекція H.pylori була частіше діагностована серед пацієнтів з дефіцитом вітаміну D [56]. Крім того, показано, що дефіцит вітаміну D також пов’язаний із гіршими темпами ерадикації H.pylori при лікуванні [57]. Тому вітамін D, здається, є важливим не тільки для захисту від інфекції H.pylori, але й для забезпечення успішного лікування. Дані доклінічних досліджень виявили можливі біологічні механізми, за допомогою яких вітамін D модулює імунну систему. –Зокрема, вказується, що вітамін D чинить свій фізіологічний вплив через внутрішньоклітинні рецептори вітаміну D, індукуючи генну експресію антимікробних пептидів. Ці антимікробні пептиди включають кателіцидин і b-дефенсин [58]. Кателіцидини мають протимікробний вплив на грамнегативні та грампозитивні бактерії, а також віруси, грибки та паразитів [59]. Активна форма вітаміну D (1,25-дигідроксивітамін D) підвищує експресію кателіцидину в епітеліальних клітинах шлунка, інфікованого H.рylori [60].
Інший антимікробний пептид, b-дефенсин, також декретується від зараженого H.pylori епітелію шлунка та підвищує антибактеріальний вплив на поверхню слизової оболонки [61]. Дефіцит вітаміну D може призвести до зниження імунітету через знижену секрецію як кателіцидину, так і b-дефенсину. Це могло б, принаймні частково, пояснити збільшену поширеність інфекції H.pylori серед пацієнтів з низьким вмістом вітаміну D. Крім того, вітамін D може підтримувати внутрішньоклітинне знищення бактерій шляхом індукції секреції оксиду азоту всередині макрофагів [62].
Кілька клінічних досліджень показали, що аналоги вітаміну D можуть мати антимікробні, а саме анти-Н.pylori, ефекти [63–66]. За допомогою цитологічного дослідження також було встановлено, що продукт розпаду вітаміну D3 1 (VDP1) може розчиняти бактеріальні клітини H.pylori, викликаючи розпад клітинної мембрани.
Інші дослідження свідчать про те, що диміристоїл фосфатидилетаноламін (DMPE) є одним із найпоширеніших гліцерофосфоліпідів, що становлять клітинну мембрану H.pylori [67]. VDP1 може викликати лізис бактерій шляхом взаємодії з DMPE мембрани H.pylori [68]. Встановлено, що продукт розпаду вітаміну D (алкілінден) мав ключову конформацію взаємодії з DMPE ді-14: 0 у складі ліпідної мембрани H.pylori, що викликало лізис бактерії. Відсутність алкілу призводить до втрати бактерицидного впливу на H.pylori. Деякі дослідження також виявили, що –рівень вітаміну D у сироватці крові може впливати на ерадикацію H.pylori [69, 70].
Висновки
Вітамін D відіграє важливу роль у регуляції імунної відповіді на інвазію H.pylori, а саме модулює імунну систему, чинить прямий регуляторний вплив на функції В- і Т-лімфоцитів і впливає на фенотип і функцію антиген-презентуючих клітин і на дендритні клітини, полегшуючи індукцію Т-регуляторів. Ця регуляція опосередковується дією вітаміну D на фактори ядерної транскрипції, зокрема NF-AT і NF-kB, або прямою взаємодією з VDRE в промоторних ділянках генів цитокінів.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів та власної фінансової зацікавленості при підготовці даної статті.
Список літератури
знаходиться в редакції