Газета «Новости медицины и фармации» №13 (706), 2019
Вернуться к номеру
Первинний гіперальдостеронізм. Механізми і наслідки патологічного впливу на організм (огляд літератури)
Авторы: Шідловський В.О.(1), Шідловський О.В.(1), Кравців В.В.(2)
(1) — Тернопільський національний медичний університет імені І.Я. Горбачевського, м. Тернопіль, Україна
(2) — Комерційне неприбуткове підприємство Львівської обласної ради «Львівський обласний клінічний лікувально-діагностичний кардіологічний центр», м. Львів, Україна
Рубрики: Эндокринология
Разделы: Справочник специалиста
Версия для печати
Вивчення основних питань патологічного впливу надлишкової автономної секреції альдостерону на організм базується на розумінні його фізіологічних функцій і ролі в ренін-ангіотензин-альдостероновій системі. Фізіологічну роль альдостерону достатньо глибоко вивчено, і відзначено, що крім фізіологічних він має негативні системні та серцеві ефекти, зокрема сприяє запаленню, фіброзу, гіпертрофії та загибелі клітин [1–3].
Ренін-ангіотензин-альдостеронова система відіграє суттєву роль у розвитку артеріальної гіпертензії (АГ) [4]. За фізіологічних умов система регулює внутрішньосудинний об’єм та відновлення тканин шляхом активації запальних і проліферативних механізмів. Спочатку знижена перфузія ниркових юкстагломерулярних клітин призводить до секреції реніну. Ренін розщеплює ангіотензиноген до ангіотензину I, який далі розщеплюється до активного ангіотензину II за допомогою ангіотензинперетворюючого ферменту. У заключній частині цього шляху активний ангіотензин II регулює синтез та виділення альдостерону з кори надниркових залоз, а також сприяє ремоделюванню шлуночків, гіпертрофії міокарда, системній вазоконстрикції і росту гладких м’язів судин через дію на активний ангіотензин II рецептора типу 1 [4–10].
Класична дія альдостерону — стимуляція затримки натрію, особливо в дистальному нефроні, а також у дистальному відділі товстої кишки та потових залозах. Затримка натрію пов’язана з підвищеною секрецією іонів калію та водню [11]. Отже, основними функціями альдостерону є регуляція позаклітинного об’єму, артеріального тиску та контроль гомеостазу калію.
Ці класичні ефекти альдостерону опосередковані мінералокортикоїдними рецепторами (МР), що розташовані в цитозолі епітеліальних клітин, відповідальних за реабсорбцію натрію та секрецію калію, і їх називають геномними, оскільки вони включають ефекти лігандного рецептора, пов’язаного з транскрипцією гена всередині цих клітин [12]. У дистальному нефроні апікальні мембрани цих клітин містять амілоридчутливі канали натрію, що опосередковують реабсорбцію натрію через апікальну мембрану із сечі на цитозоль [13]. Альдостерон призводить до посилення експресії зовнішнього ниркового калієвого каналу на апікальній поверхні дистальних звивистих та збірних проточних клітин, тим самим підвищуючи трубну здатність виділяти калій [14, 15].
Окрім епітеліальних клітин, МР ідентифікували ще й в ендотеліальних клітинах, гладких м’язах, судинах, макрофагах, адипоцитах, кардіоміоцитах та гіпокампі головного мозку [16, 17]. Результати експериментальних досліджень показали, що активація МР у тканинах серця, нирок, судинах сприяє підвищенню артеріального тиску. Надлишок альдостерону призводить до серцево-судинного ушкодження (запалення, фіброзу та ремоделювання серця, судин і нирок) за допомогою прямих механізмів, що не залежать від його впливу на артеріальний тиск (рис. 1) [17].
При первинному гіперальдостеронізмі (ПГА) активація альдостероном МР у межах серцевих ендотеліальних клітин і макрофагів спричиняє запалення та ушкодження серцевого м’яза [18, 19]. Виявлено також негеномні ефекти альдостерону в тканинах судин і нирок, що опосередковані взаємодією з МР або іншими рецепторами (включаючи G-білки рецептора естрогену 1) [20].
Надмірна секреція альдостерону викликає реабсорбцію натрію в ниркових канальцях та збільшення об’єму судинного русла, що в кінцевому підсумку призводить до АГ. Довготривала затримка натрію в дистальних канальцях пов’язана з втратою калію із сечею та може зумовити гіпокаліємію [14, 15]. На цьому фоні може розвиватись метаболічний алкалоз, що є результатом збільшення екскреції водневих іонів із сечею. Крім ефектів, що виникають через надмірну затримку натрію в дистальних канальцях та втрату калію, останнім часом було з’ясовано, що надлишок альдостерону має несприятливі наслідки, пов’язані з надмірною активацією МР в інших тканинах (рис. 2) [20].
На рис. 2 наведено відомі на сьогодні ефекти надлишку альдостерону: наслідки впливу на нирки, центральну нервову та серцево-судинну системи.
Під час експериментальних досліджень і клінічних досліджень на людях встановлено, що альдостерон після взаємодії з МР здатний активувати специфічні внутрішньоклітинні геномні та негеномні шляхи, регулюючи таким чином гомеостаз серцево-судинної системи. Важливо, що за допомогою цього механізму фізіологічної дії альдостерон стає визначальним регулятором функцій і росту різних типів клітин, у тому числі фібробластів, кардіоміоцитів та клітин судин. У разі високих рівнів альдостерону у крові він глибоко змінює фізіологію цих клітин і тому стає основою багатьох серцево-судинних розладів. Доведено, що надлишок альдостерону може індукувати ендотеліальну дисфункцію та ремоделювання судин, посилювати симпатичний тонус і викликати спазм судин, знижувати чутливість барорецепторів (рис. 3) [21].
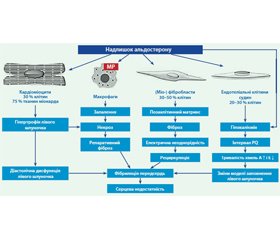
Альдостерон впливає на всі типи клітин, що є первинними компонентами серцевої тканини (кардіоміоцити, фібробласти, ендотеліальні клітини), а також активує макрофаги. Надлишок альдостерону індукує збільшення кількості кардіоміоцитів і ремоделювання серцевого м’яза, що призводить до гіпертрофії лівого шлуночка та до діастолічної дисфункції. Він також активує перехід фібробластів у міофібробласти, що продукують колаген та інші білки позаклітинного матриксу, спричиняючи фіброз. Фіброзна тканина викликає електричну неоднорідність міокарда, тим самим зумовлюючи розвиток миготливої аритмії. Ендотеліальні клітини під впливом надлишку альдостерону переходять у міофібробласти, що сприяють розвитку фіброзу. Активація МР на моноцитах/макрофагах спричиняє запалення, некроз і репаративний фіброз, а згодом і розвиток фібриляцій передсердь. Надлишок альдостерону викликає гіпокаліємію, наслідками якої є пролонгування інтервалу PQ, аномальне наповнення лівого шлуночка та серцева недостатність.
Одним із серйозних ускладнень ПГА є кардіальний фіброз. Розвиток фіброзу серця у пацієнтів з гіпертонічною хворобою опосередковується міофібробластами, що реагують на альдостерон шляхом підвищення синтезу та секреції фібрилярних попередників колагену [22, 23] (рис. 4). Двома більш поширеними попередниками колагену в серці є проколаген типу I і проколаген типу III, яким передують триспіральні проколагенні попередники, що потребують розщеплення кінцевих пропептидів до інтеграції в молекулу колагену. Карбоксикінцевий пропептид проколагену I типу можна кількісно визначити та використати для оцінки кількості колагену і, таким чином, тяжкості фіброзу міокарда [11, 24].
Крім надмірної АГ, надлишок альдостерону індукує запалення, реконструкцію та фіброз у тканинах судин і серця, що в кінцевому результаті спричиняє прогресування АГ, серцевої недостатності та викликає електричне ремоделювання серця, фібриляції передсердь, атеросклероз і фіброз. Порівняно з хворими на есенціальну гіпертензію, які мають однакові показники артеріального тиску, в пацієнтів з ПГА виявляють збільшені розмір лівого шлуночка, товщину інтими сонної артерії та швидкість поширення пульсової хвилі по стегновій артерії, і, що важливо, в них зростає частота серцево-судинних ускладнень, включаючи аритмії, інфаркти міокарда, інсульти, та смертність від них [25–28].
Існування різновидів родинного гіперальдостеронізму з відомими генетичними мутаціями дало унікальну можливість вивчити незалежно від артеріального тиску ефекти надлишку альдостерону. Дослідження членів цих родин дозволило виявити осіб з підтвердженим біохімічним способом ПГА до початку АГ, а отже, й оцінити ефекти надлишку альдостерону незалежно від рівня артеріального тиску [29, 30].
Ехокардіографічні дослідження, проведені в таких нормотензивних індивідів з I фенотипом родинного гіперальдостеронізму, показали збільшення товщини лівого шлуночка та зниження діастолічної функції порівняно з пацієнтами з есенціальною гіпертонічною хворобою, ідентичними за віком і статтю, які мали аналогічні показники цілодобового контролю рівня артеріального тиску [31]. В цих осіб зростав рівень прозапального інтерлейкіну-6 в сироватці крові, що підтверджує уявлення про запалення як ключовий компонент серцево-судинних ушкоджень, які виникають при надлишку альдостерону. В літературі описано генетично залежні випадки ПГА на основі однобічної аденоми надниркової залози одночасно з високою секрецією альдостерону та кортизолу. У цих хворих порівняно частіше виникали серцево-судинні ускладнення, розвивалися фіброз міокарда та судин, цукровий діабет і остеопороз, інфаркт міокарда й інсульти. Крім того, встановлено, що судинні події можуть бути наслідком не лише серцево-судинних ушкоджень, а й посиленого проникнення Ca2+ в тромбоцити з їх подальшими дегрануляцією, агрегацією й адгезією. У кінцевому результаті таке поєднання патологічних змін спричиняє розвиток гострих тромботичних оклюзій після розриву атеросклеротичних бляшок та ішемічних серцево-судинних подій, таких як інфаркт міокарда й ішемічний інсульт [31, 32].
Експериментальні та клінічні дані свідчать про те, що наслідком надлишку альдостерону є також ушкодження нирок через механізми, які не залежать від рівня АГ. Пацієнти з ПГА мають підвищений рівень екскреції альбуміну із сечею порівняно з хворими на есенціальну гіпертензію [33]. Це вказує на те, що альбумінурія відображає стан гломерулярної гіперфільтрації, порушеної внаслідок патологічної дії альдостерону, викликаної затримкою натрію та збільшенням циркулюючого об’єму крові (рис. 1, 2). Встановлено, що після однобічної адреналектомії або лікування із застосуванням спіронолактону суттєво покращилася фільтраційна функція нирок [34, 35].
Клінічні спостереження та спеціальні дослідження дають підстави вважати, що у хворих на ПГА є клінічні ознаки метаболічного синдрому. Аналіз літератури свідчить про активний інтерес до вивчення питання про зв’язок між ПГА та різними компонентами метаболічного синдрому [36]. Встановлено позитивні кореляції між рівнем альдостерону та індексом маси тіла. За даними F. Fallo та співавторів (2006), метаболічний синдром і особливо гіперглікемія були більш поширеними серед пацієнтів з ПГА, ніж у хворих на есенціальну гіпертензію [37]. Виявлено також підвищення інсулінорезистентності та зниження рівня адипонектину у хворих на ПГА порівняно з аналогічною кількістю підібраних пацієнтів з есенціальною гіпертензією [38–41]. Прояви метаболічного синдрому в пацієнтів з альдостерон-продукуючою аденомою після адреналектомії зникають [42].
Наслідки надмірно неадекватної активності альдостерону асоціюються з порушенням якості життя. ПГА створює несприятливі психоемоційні умови для життя, що значно знижують його якість. На його фоні розвиваються депресія, тривога, напади необґрунтованої люті, прояви яких зменшуються або ж зникають після лікування [43]. Можуть бути й інші прояви ПГА, зокрема такі, як розлади загального стану та психіки: сонливість, втомлюваність, знижена здатність зосереджуватись, ніктурія, м’язова слабкість, обструктивне апное уві сні, та відомі ускладнення лікування спіронолактоном (статева слабкість, гінекомастія, розлади менструального циклу). Інтенсивність проявів цих симптомів швидко знижується після адреналектомії з приводу альдостерон-продукуючої аденоми і повільніше та менш повно — при лікуванні блокаторами мінералокортикоїдних рецепторів.
У патогенетичному обґрунтуванні лікування хворих на ПГА важливим вважають питання про те, який напрямок у лікуванні повинен бути пріоритетним: специфічне (хірургічне або медикаментозне) лікування, спрямоване на зниження рівня альдостерону (зменшення його продукування), або лікування антигіпертензивними препаратами, спрямоване на зниження артеріального тиску до норми. Накопичені на сьогодні наукові дані свідчать про те, що хірургічне або специфічне медикаментозне лікування, з огляду на клінічні безпосередні та віддалені результати, істотно перевершує за ефективністю неспецифічне антигіпертензивне лікування. При цьому встановлено, що хірургічне лікування є ефективнішим порівняно з медикаментозною блокадою мінералокортикоїдних рецепторів. Важливо відзначити, що при порівнянні частоти серцево-судинних ускладнень, про які згадувалось вище, вона виявилась суттєво нижчою в разі хірургічного або специфічного медикаментозного лікування [41]. У дослідженні, представленому M. Briet та співавт. (2013), доведено, що при ПГА однобічна адреналектомія або лікування блокаторами МР сприяє покращенню ендотеліальної функції, зменшенню жорсткості артеріальних судин, маси лівого шлуночка порівняно з хворими, яких лікували неспецифічними антигіпертензивними препаратами, при однакових параметрах артеріального тиску [42]. На підставі цих клінічних даних розроблено й обґрунтовано концепцію раннього виявлення та специфічного хірургічного або медикаментозного лікування осіб з ПГА, що забезпечує кращу якість і більшу тривалість життя пацієнтів [43, 44].
Висновки
Наведені дані літератури вказують на те, що первинний гіперальдостеронізм має багатосистемний патологічний вплив на організм. Його наслідками є розвиток артеріальної гіпертензії, серцевої та ниркової недостатності, збільшення частоти інфарктів, інсультів і смертності від них, погіршення якості та скорочення тривалості життя.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів при підготовці даної статті.
Список литературы
Список літератури знаходиться в редакції

/12_m.jpg)
/13_m.jpg)