Газета «Новости медицины и фармации» №4 (686), 2019
Вернуться к номеру
Диета и кишечник: обзор рекомендаций Всемирной гастроэнтерологической ассоциации 2018 года
Разделы: Справочник специалиста
Версия для печати
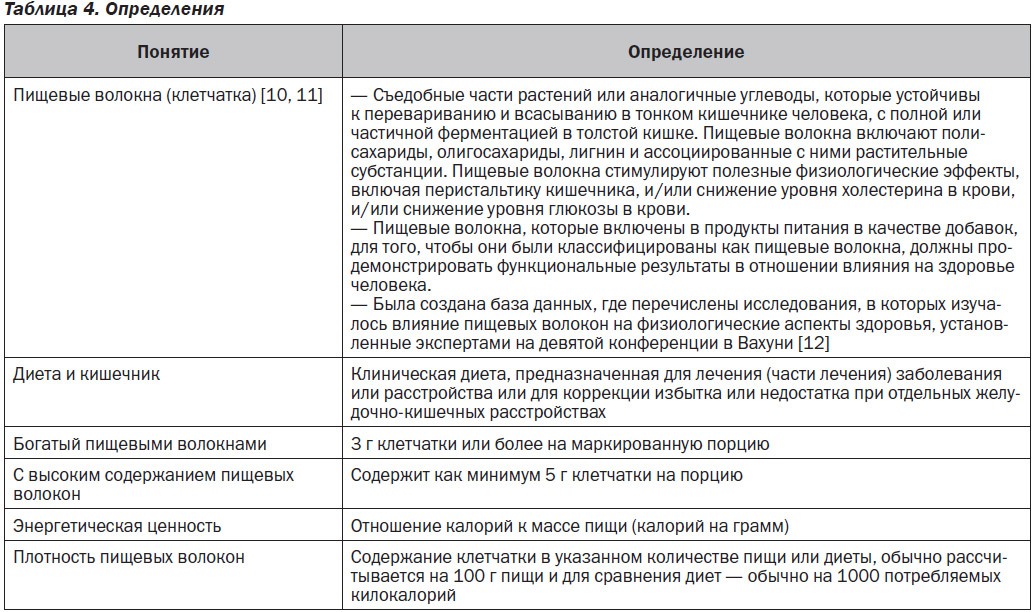
2. Пищевые волокна и диета
2.1. Введение
Пищевые волокна являются углеводами (как натуральными, так и синтетическими), которые не перевариваются в тонком кишечнике человека и приносят физиологическую пользу для здоровья [3, 4]. Клетчатка увеличивает объем рациона, снижает энергетическую ценность пищевых продуктов и может улучшить контроль гликемии и предотвратить или уменьшить запор [3, 5]. Во многих странах большое количество людей не употребляют достаточное количество пищевых волокон для достижения рекомендуемых целей [3, 5]. К продуктам, богатым источниками пищевых волокон, относятся: цельные зерна, орехи и семена, овощи и фрукты [3, 5]. Большее употребление пищевых волокон ассоциируется с более низким риском развития нескольких хронических заболеваний, включая сердечно-сосудистые заболевания и сахарный диабет, и может снизить риск смертности от всех причин [5–9]. Пищевая клетчатка может быть включена в перечень веществ, указываемый на этикетках продуктов питания, и она, как правило, указывается как подгруппа общих углеводов.
2.1.1. Виды пищевых волокон
Пища обычно содержит смесь растворимых и нерастворимых волокон, и оба типа обладают важными преимуществами для здоровья в плане диеты с высоким содержанием клетчатки [3, 5]. Хотя растворимость волокна когда-то определялась его физиологическим эффектом, более поздние исследования показывают, что другие свойства волокна, особенно ферментируемость и вязкость, являются более важными, и растительные компоненты (такие как антиоксидантные соединения), которые ассоциируются с пищевыми волокнами, также могут способствовать снижению риска заболевания [5, 13].
2.1.2. Полезные эффекты пищевых волокон
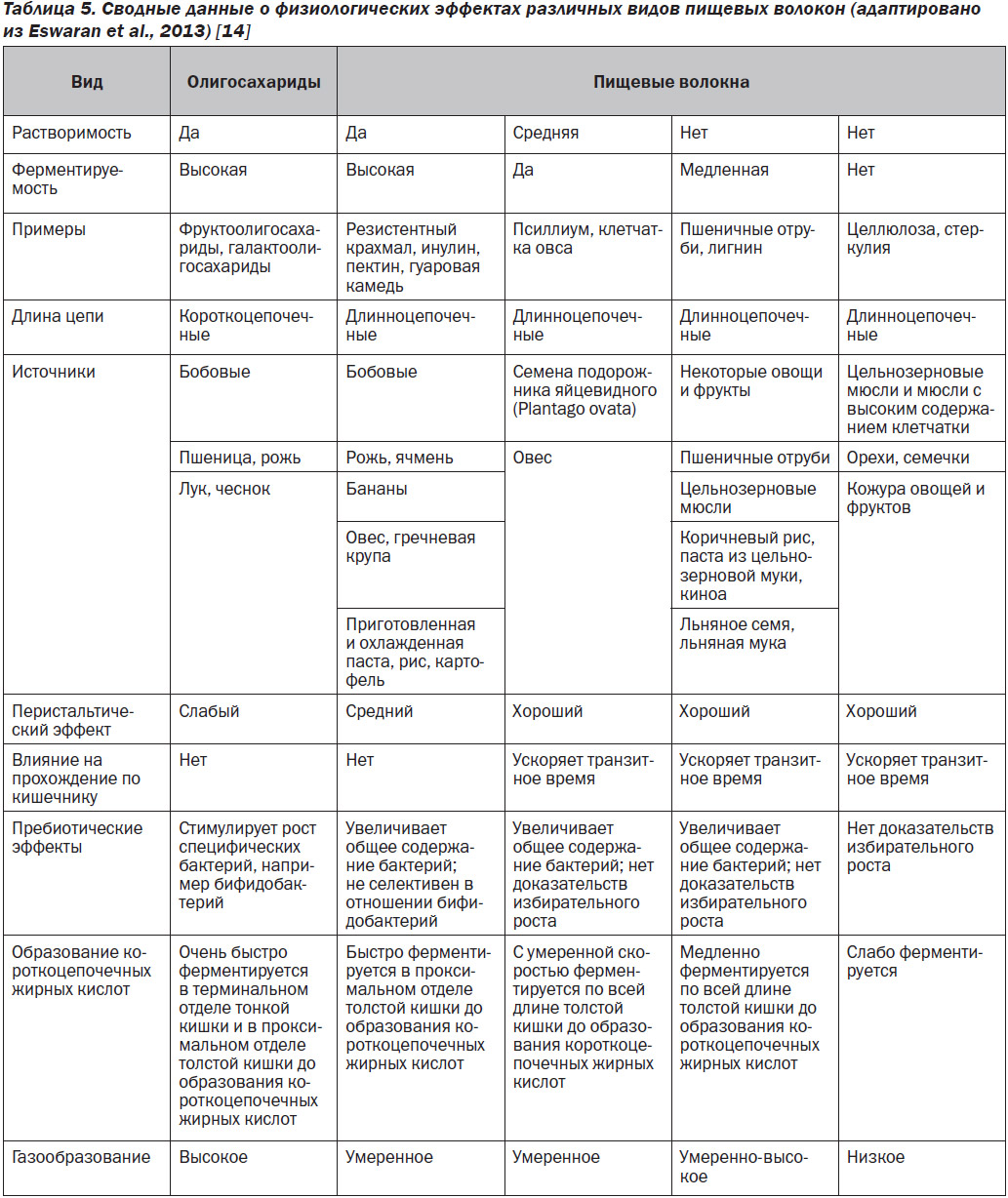
Сводная информация о физических характеристиках и физиологических преимуществах натуральных пищевых волокон приведена в табл. 5. Ниже приводится список хорошо известных полезных физиологических эффектов, связанных с употреблением пищи с высоким содержанием клетчатки [12]:
— снижение уровня общего холестерина в крови
и/или холестерина липопротеинов низкой плотности (ХС ЛПНП);
— снижение постпрандиального уровня глюкозы в крови и/или уровня инсулина;
— увеличение объема стула и/или уменьшение времени прохождения пищи по кишечнику;
— увеличение производства короткоцепочечных жирных кислот из-за ферментации микробиотой толстой кишки.
Кроме того, возможно, имеют место следующие физиологические эффекты пищевых волокон, но они требуют дальнейшего научного обоснования [12]:
— снижение артериального давления;
— повышение насыщаемости;
— снижение массы тела/уменьшение ожирения;
— положительная модуляция микробиоты толстой кишки.
2.1.3. Взаимодействие пищевых волокон с кишечной микробиотой
Употребляемая в пищу клетчатка может влиять на профили микробиоты фекалий, вызывать изменения в сложной желудочно-кишечной среде и способствовать росту бактерий в целом и потенциально полезных бактерий в частности [14–16]. Поэтому олигосахариды, включая фруктоолигосахариды и галактоолигосахариды, инулин и, возможно, другие растворимые пищевые волокна, рассматриваются как пребиотики, которые могут стимулировать преимущественный рост лактобактерий, бифидобактерий и других полезных для здоровья бактерий в толстой кишке [3, 14–16]. Считается, что кишечная микробиота играет решающую роль в обеспечении здоровья человека и профилактике заболеваний с помощью различных механизмов, включая образование короткоцепочечных жирных кислот, которые важны для поддержания гомеостаза в кишечнике и оптимального функционирования иммунной системы [3, 14–16]. Изменения в микросреде кишечника были связаны со многими распространенными состояниями, включая синдром раздраженного кишечника, ожирение, сердечно-сосудистые заболевания и астму [15, 16]. Взаимосвязь между кишечной микробиотой, пищевыми волокнами и показателями состояния здоровья является областью быстро растущего интереса, но для подтверждения их взаимосвязей, отмеченных в испытаниях на животных и эпидемиологических исследованиях, необходимо провести контролируемые исследования у людей [15, 16].
2.2. Роль пищевых волокон в работе желудочно-кишечного тракта
2.2.1. Запоры
— Увеличение содержания клетчатки в рационе долгое время считалось терапией первой линии при запорах [3, 17, 18].
— Увеличение количества жидкости в рационе долгое время считалось терапией первой линии при запорах [3, 17, 18]; доказательства, подтверждающие это, являются разнородными.
— Улучшение перистальтики кишечника может достигаться путем постепенного увеличения количества употребления пищевых волокон (или путем применения добавок с клетчаткой) до целевой суточной дозы 20–30 г общего количества пищевых волокон и/или добавок с клетчаткой. Клетчатка должна вводиться в рацион постепенно в течение нескольких недель, а не дней, чтобы организм мог приспособиться [18, 19].
— Считается, что частота стула нормализуется благодаря растворимым пищевым волокнам за счет увеличения объема и массы стула и благодаря нерастворимым пищевым волокнам за счет ускорения времени прохождения через кишечник, однако для обоих, и особенно для нерастворимых волокон, отсутствуют качественные доказательства [14].
— Наилучшие доказательства по применению добавок клетчатки в лечение хронических запоров получены для псиллиума [18].
— Почти нет доказательств эффективности клетчатки при отдельных подтипах запора, таких как метаболический, неврологический, диетический, миогенный, лекарственный и обусловленный дисфункцией тазовых органов [14].
— У пациентов с обструктивными заболеваниями кишечника следует избегать применения диеты с высоким содержанием клетчатки.
— У пациентов, у которых отмечается ухудшение симптомов, связанных с запорами, при применении клетчатки, может быть замедление транзита пищи в толстом кишечнике или диссинергическая дефекация [17, 20, 21].
Вывод. Диета с высоким содержанием клетчатки может выполнять протективную функцию и оказывать терапевтическое воздействие при запорах. Рекомендуется постепенное увеличение употребления клетчатки и/или добавок, содержащих клетчатку, до 20–30 г/сут с достаточным количеством жидкости. Кроме того, для лечения хронических запоров могут быть полезны добавки с псиллиумом. Роль клетчатки при других видах запора ограниченна, и у некоторых людей диета с высоким содержанием клетчатки может усугубить симптомы.
2.2.2. Синдром раздраженного кишечника
— Влияние клетчатки на симптомы синдрома раздраженного кишечника (СРК) варьирует и зависит от типа клетчатки [14, 22, 23].
— Добавки с растворимыми пищевыми волокнами, включая семя льна, метилцеллюлозу, частично гидролизованную гуаровую камедь и псиллиум, продемонстрировали терапевтическую пользу в ряде клинических испытаний, особенно у пациентов с СРК с преобладанием запоров (СРК-З) [3, 14, 22, 23].
— Высокоферментируемые волокна, такие как олигосахариды, инулин и клетчатка пшеничных отрубей (благодаря содержанию олигосахаридов), могут способствовать увеличению выработки газа, усугубляя такие симптомы, как вздутие живота, метеоризм и дискомфорт в ЖКТ при СРК [14, 22, 23].
— Сокращение употребления высокоферментируемых волокон как часть диетического подхода с низким содержанием FODMAP (см. Раздел 3) рекомендуется для лечения СРК и обеспечивает облегчение симптомов примерно у 75 % пациентов [14, 22].
Вывод. Высокоферментируемые волокна, включая олигосахариды и инулин, а также пшеничные отруби могут усугубить симптомы СРК. Наилучшие доказательные данные свидетельствуют о том, что снижение употребления этих ферментируемых волокон в рамках диетического подхода с низким FODMAP (см. Раздел 3) эффективно для лечения симптомов у большинства пациентов с СРК. И наоборот, добавки с растворимыми пищевыми волокнами, включая псиллиум, льняное семя и метилцеллюлозу, могут быть полезны, особенно в лечении СРК-З.
2.2.3. Воспалительные заболевания кишечника
— Доказательства терапевтического эффекта пищевых волокон при воспалительных заболеваниях кишечника (ВЗК) отсутствуют. Тем не менее ввиду потенциального противовоспалительного и иммуномодулирующего действия клетчатки данный вопрос требует дальнейшего изучения [24].
— Нет необходимости в ограничении употребления пищевых волокон при ВЗК, за исключением случаев выраженного стеноза кишечника [24].
— Сокращение употребления высокоферментируемых волокон как часть диеты с низким содержанием FODMAP может быть полезно при симптоматическом лечении пациентов с ВЗК с сопутствующим СРК (см. Раздел 3) [25, 26].
Вывод. В настоящее время имеется мало доказательств, подтверждающих терапевтическую роль пищевых волокон при ВЗК. Поэтому необходимо дальнейшее проведение высококачественных исследований. Пациентам с ВЗК не следует ограничивать употребление пищевых волокон, за исключением случаев кишечной непроходимости. Пациентам с ВЗК с сопутствующим СРК может быть полезно уменьшение употребления высокоферментируемых волокон в рамках части диеты с низким содержанием FODMAP.
2.2.4. Дивертикулярная болезнь
— Употребление большого количества пищевых волокон может ассоциироваться со сниженным риском развития дивертикулярной болезни [27, 28].
— Не ясно, полезна ли диета с высоким содержанием клетчатки пациентам с дивертикулезом, так как его патогенез многофакторный и сложный. Необходимы дополнительные исследования для оценки роли клетчатки в патогенезе и лечении дивертикулярной болезни [27, 28].
— Несколько исследований низкого качества показали, что клетчатка может улучшить симптомы, связанные с неосложненным дивертикулезом, и снизить риск дивертикулита. Тем не менее отсутствуют доказательства высокого качества [27, 28].
— Во время эпизода острого дивертикулита часто рекомендуется диета с низким содержанием клетчатки, чтобы минимизировать раздражение кишечника [27, 28]. Тем не менее доказательства в поддержку этой стратегии ограниченны.
Вывод. Диета с высоким содержанием клетчатки может предотвратить развитие дивертикулярной болезни, и риск осложнений (дивертикулит) может быть выше у лиц, придерживающихся диеты с низким содержанием клетчатки. В случае дивертикулита может быть показана кратковременная диета с низким содержанием клетчатки. Тем не менее все эти рекомендации подтверждаются лишь ограниченным количеством данных доказательной медицины и мнением экспертов.
2.2.5. Колоректальный рак
— Доказательства того, что клетчатка снижает риск колоректального рака, неоднозначны, и необходимы дальнейшие исследования на эту тему [29].
— Анализ, проведенный в 2012 году в рамках Европейского проспективного исследования рака и питания (EPIC), показал, что общее содержание клетчатки в употребляемой пище обратно пропорционально риску развития колоректального рака, с аналогичными результатами для рака толстой кишки и прямой кишки. Употребление таких источников пищевых волокон, как злаковые, фрукты и овощи, ассоциировалось со сниженным риском развития рака толстой кишки [30]. Со сниженным риском рака прямой кишки ассоциировалось только употребление зерновой клетчатки [30].
— В рандомизированных контролируемых исследованиях (РКИ) отсутствуют данные, свидетельствующие о том, что увеличение употребления пищевых волокон приведет к снижению частоты или рецидива аденоматозных полипов в течение 2–8 лет [31]. Для дальнейшей оценки этого необходимы более длительные исследования с более высоким уровнем употребления клетчатки [31].
Вывод. Данные когортных исследований обычно указывают на протективный эффект диеты с высоким содержанием клетчатки в отношении колоректального рака, однако не ясно, основана ли эта взаимосвязь на причине и эффекте. Для того чтобы выяснить, какова взаимосвязь, и определить потенциальные механизмы действия, необходимо провести дальнейшие высококачественные исследования.
2.2.6. Клинические показания к применению диеты с низким содержанием пищевых волокон
— Прием пищи с низким содержанием клетчатки может помочь уменьшить диарею, газообразование и вздутие в животе путем замедления дефекации и уменьшения ферментации в толстом кишечнике [32].
— Краткосрочное использование диеты с низким содержанием клетчатки (< 10 г/сут) можно рекомендовать для очистки кишечника в дни, предшествующие диагностическим процедурам, таким как колоноскопия, колонография и лапароскопическая гинекологическая хирургия. Исследования показали, что по сравнению с традиционными схемами подготовки кишечника (прием чистой воды, применение слабительных) диета с низким содержанием клетчатки лучше переносится, имеет меньше побочных эффектов и позволяет уменьшить необходимую дозу слабительных средств без ухудшения качества подготовки кишечника [32, 33].
— Диету с низким содержанием клетчатки часто рекомендуют временно после обострения дивертикулита, болезни Крона или язвенного колита или после операции на органах желудочно-кишечного тракта. Тем не менее необходимо провести дополнительные исследования, чтобы выяснить, является ли она реально полезной с терапевтической точки зрения [32]. Несмотря на это, риск от кратковременного использования такой диеты невелик, особенно если она применяется под руководством диетолога [32] и в долгосрочной перспективе в рацион возвращается клетчатка.
— Диетические рекомендации по употреблению рациона с низким содержанием клетчатки могут включать следующее: избегать употребления орехов и семян, употреблять больше рафинированного хлеба и злаков, сокращать употребление фруктов и овощей, где это возможно, и фрукты и овощи при употреблении очищать от кожуры [32].
— В некоторых случаях клетчатка является не единственным диетическим фактором, который следует учитывать, рекомендуя диету с низким содержанием клетчатки. Диетические рекомендации для пациентов со вздутием живота, болью и другими симптомами, похожими на симптомы при СРК, могут включать отказ от острой, жирной пищи, продуктов, вызывающих раздражение кишечника (например, алкоголя и напитков с кофеином), и отдельных продуктов, которые плохо переносятся [19].
Вывод. Объем данных в поддержку использования диеты с низким содержанием клетчатки с лечебной целью в контексте заболеваний ЖКТ и хирургических вмешательств на органах ЖКТ ограничен. Тем не менее этот подход является распространенным явлением в клинической практике, и кратковременное применение такой диеты представляет собой небольшой риск. Диета с низким содержанием клетчатки может быть полезна в контексте подготовки кишечника к диагностическим процедурам и способна улучшить комплайенс и удовлетворенность пациентов.
2.4. Решение проблемы поступления пищевых волокон в кишечник
Адекватное употребление пищевых волокон может быть достигнуто за счет увеличения разнообразия в рационе питания [5]. Употребление в пищу по меньшей мере 400 г или пяти порций фруктов и овощей в день снижает риск хронических заболеваний и помогает обеспечить адекватное ежедневное употребление клетчатки [11, 35]. Увеличение употребления продуктов с высоким содержанием клетчатки, таких как цельнозерновые, бобовые, фрукты и овощи, должно широко поддерживаться профессионалами в области диетологии [5, 35].
Хотя потребители в качестве дополнительных источников клетчатки также применяют различные пищевые добавки, содержащие клетчатку, и слабительные средства, лучший совет — употреблять пищу, богатую клетчаткой. Эффективность пищевых добавок, содержащих клетчатку, в плане их влияния на физиологические процессы, мало изучена [5]. Слишком быстрое увеличение количества клетчатки в рационе может привести к таким симптомам, как повышенное газообразование, вздутие и спазмы в животе, поэтому всегда следует рекомендовать постепенное увеличение употребления пищевых волокон [5].
Источниками большого количества пищевых волокон являются: цельнозерновые продукты, фрукты, овощи, горох и бобовые, а также орехи и семена. Продукты с маркировкой «с высоким содержанием клетчатки» обычно содержат не менее 5 г клетчатки на порцию. Тем не менее требования к маркировке продуктов питания варьируются в зависимости от страны [4, 5].
Примеры распространенных продуктов с высоким содержанием клетчатки [36]:
— 1/2 стакана приготовленной красной фасоли (6,5 г клетчатки);
— 1/2 стакана пшеничных отрубей (9,1 г клетчатки);
— 1 стакан запеченной тыквы (6,6 г клетчатки);
— 1 большой апельсин (7,2 г клетчатки);
— 1 стакан малины (8,0 г клетчатки);
— 1 чашка приготовленных спагетти из цельной пшеницы (5,9 г клетчатки);
— 1 чашка вареной брокколи (5,5 г клетчатки).
Потребители заинтересованы в увеличении употребления клетчатки, но комплайенс и стоимость представляют определенную проблему. Изменения в питании требуют изменений в долгосрочных привычках, и, несмотря на их преимущества, требуются усилия для того, чтобы их выработать. Для того, чтобы придерживаться изменений в рационе питания, необходимы мотивация, поведенческие навыки и благоприятная социальная, а также политическая среда [5, 37].
Возможные затруднения при изменении пищевых привычек и способы их решения [35]:
— трудности в изменении пищевых привычек и образа жизни:
а) неправильное восприятие/неосведомленность о собственном поведении;
б) оптимистическая предвзятость — вера в то, что идеи здорового питания ориентированы на людей, более уязвимых, чем мы;
в) вкусовые предпочтения как барьер для здорового питания;
г) отказ от любимых блюд;
д) недостаток знаний о том, как готовить ту или иную пищу или вообще готовить;
е) практические аспекты: стоимость, приготовление, малодоступность продуктов — многофакторность и сложные взаимодействия. Доход, цены на продукты питания (которые будут влиять на их доступность и доступность здоровых продуктов питания), индивидуальные предпочтения и убеждения, культурные традиции, а также географические, экологические, социальные и экономические факторы — все это сложным образом взаимодействует и формирует индивидуальные привычки питания. Следовательно, создание окружающей среды, в которой доступно здоровое питание, включая системы, которые способствуют разнообразному, сбалансированному и здоровому питанию, требует участия разных секторов и заинтересованных сторон, включая правительство, государственный и частный секторы;
ж) недостаток знаний о важности здорового питания — реальное, но зачастую остающееся незамеченным препятствие к изменению стиля питания;
з) трудности в понимании этикеток на упаковках продуктов питания — размера порций, информации о том, как сбалансировать рацион;
и) отсутствие среды, которая способствует изменению образа жизни и обеспечивает информацию о питании и образовательные инициативы;
— решения для продвижения и внедрения режима здорового питания:
а) содействовать наличию среды здорового питания, в том числе системы питания, которая способствует разнообразному, сбалансированному и здоровому питанию. Это требует участия нескольких секторов и заинтересованных сторон, включая правительство, а также государственный и частный сектор;
б) обеспечить согласованность в национальной политике и инвестиционных планах, включая политику в области торговли, продовольствия и сельского хозяйства, для пропаганды здорового питания и защиты общественного здоровья;
в) поощрять потребительский спрос на здоровую пищу;
г) содействовать надлежащему кормлению детей грудного и раннего возраста;
д) ввести налог на нездоровую пищу (это уже предлагалось в отношении содержания сахара в продуктах);
е) поощрять поставщиков, поддерживающих концепцию здорового питания;
— пути решения вопросов мотивации людей придерживаться сбалансированной диеты после того, как у них возникли проблемы со здоровьем, и вопросов предотвращения нарушений режима питания:
а) индивидуальное обучение — например, повышение осведомленности о здоровом питании, помощь в замене привычно покупаемых продуктов на более здоровые альтернативы, побуждение детей к соблюдению режима здорового питания, поощрение кулинарных навыков;
б) обеспечить консультирование по питанию в учреждениях первичной медико-санитарной помощи;
в) поощрять, защищать и поддерживать концепцию грудного вскармливания в службах здравоохранения и обществе, в том числе в рамках инициативы ВОЗ по созданию больниц, доброжелательных к ребенку (www.who.int/nutrition/topics/bfhi/en/);
г) обеспечить поведенческую терапию, чтобы развить у людей навыки, которые могут помочь предотвратить нарушения в режиме питания.
На эволюцию и форму диетических паттернов влияют многие факторы: доход, цены на продукты питания (наличие и доступность здоровых продуктов питания), индивидуальные предпочтения и убеждения, культурные традиции, а также географические, экологические, социальные и экономические факторы [35].
3. Диета с низким содержанием FODMAP
3.1. Введение
3.1.1. Что такое диета с низким содержанием FODMAP?
Диета с низким содержанием FODMAP была разработана исследователями из Университета Монаш в Мельбурне, Австралия, для помощи пациентам с синдромом раздраженного кишечника [38–40]. Исследования во всем мире подтвердили, что диета эффективна при лечении симптомов СРК [41–45].
FODMAP — это аббревиатура, обозначающая ферментируемые олигосахариды, дисахариды, моносахариды и полиолы (fermentable oligosaccharides, disaccharides, monosaccharides and polyols).
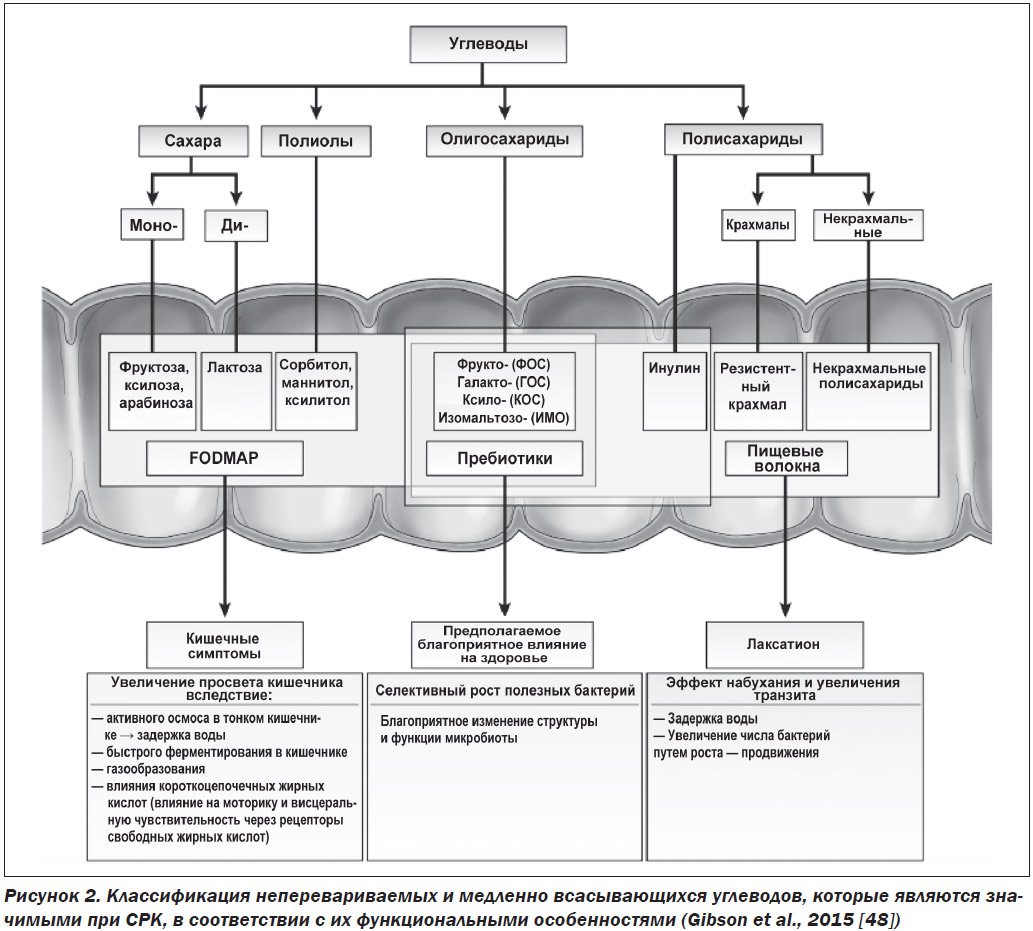
Акроним объединяет определенные типы короткоцепочечных углеводов, которые медленно всасываются или не перевариваются в тонкой кишке. Из-за своей малой молекулярной массы они увеличивают содержание воды в тонком кишечнике за счет осмотического эффекта, и поскольку они легко ферментируются бактериями, их поступление в толстый кишечник приводит к избыточному газообразованию [38, 39, 46]. Таким образом, FODMAP могут раздувать (или растягивать) кишечник. У пациентов с СРК, которые гиперчувствительны к такому растяжению, возникают боль в животе, вздутие живота, чрезмерный метеоризм и изменения моторики кишечника (запор и/или диарея) [47]. На рис. 2 приведена классификация неперевариваемых и медленно усваиваемых углеводов в соответствии с их функциональными свойствами [48].
Диета с низким содержанием FODMAP включает уменьшение употребления с пищей пяти основных подгрупп углеводов:
— фруктозы с избытком глюкозы — например, меда, манго;
— лактозы (при наличии гиполактазии) — например, молока, йогурта;
— сахаросодержащих полиолов (включая сорбит и маннит) — например, авокадо, грибов;
— фруктанов — например, пшеницы, лука, чеснока;
— галактоолигосахаридов — например, бобовых, соевого молока.
Цель диеты с низким содержанием FODMAP — помочь пациентам контролировать симптомы и впоследствии выявлять специфические пищевые триггеры. Это достигается за счет первоначального уменьшения всех FODMAP в рационе с последующим пересмотром стратегии. Затем пациенты могут соблюдать собственную, модифицированную для своего организма диету. Не рекомендуется придерживаться строгой диеты с низким содержанием FODMAP в течение длительного срока.
Содержание FODMAP в широком перечне пищевых продуктов было проанализировано отделом гастроэнтерологии Университета Монаш, результаты были опубликованы в ряде научных статей [49–52]. Полный список продуктов, содержащих FODMAP, классифицированных как продукты с низким, средним и высоким содержанием FODMAP, доступен для населения через разработанное университетом приложение для смартфонов [53].
3.1.2. Как имплементировать диету с низким содержанием FODMAP: пересмотр рациона и проблемы/ограничения
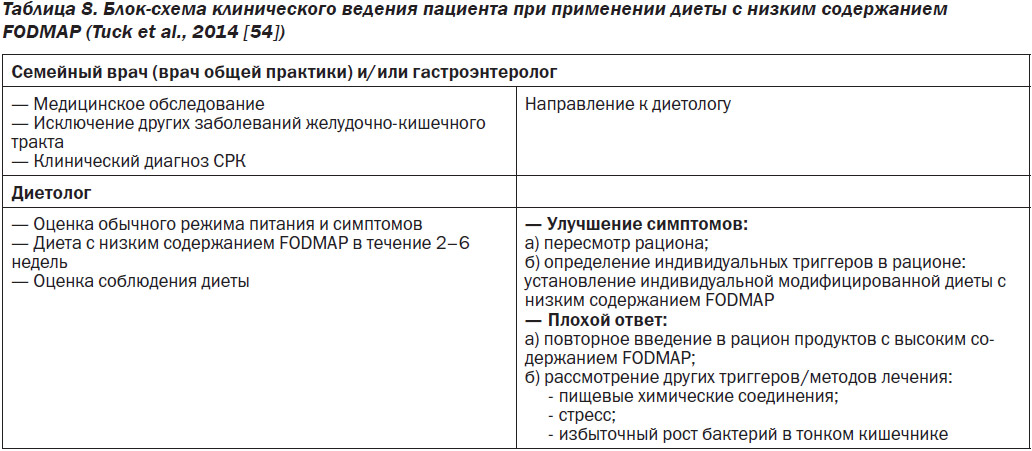
Лучше всего, чтобы диету с низким содержанием FODMAP назначил опытный диетолог. В табл. 8 представлены принципы менеджмента пациента, включая роль семейного врача (врача общей практики) или гастроэнтеролога и диетолога. Диета может быть внедрена к применению в три этапа (табл. 9).
На начальном этапе пациентов нужно идентифицировать как имеющих функциональные симптомы со стороны кишечника и перед тем, как пересматривать режим питания, исключить у них другие причины, например такие, как целиакия. Это важно, поскольку изменения в диете могут повлиять на точность диагностических обследований, например, при целиакии. Пациентов необходимо проинформировать о способах уменьшения (обычно в течение 2–6 недель) употребления продуктов с высоким содержанием FODMAP в рационе [55]. Основной целью этого этапа является улучшение контроля симптомов. Лучше всего, если информацию о содержании FODMAP в продуктах пациентам даст опытный диетолог, который убедится, что они понимают, каких продуктов следует избегать и, что важно, какие продукты следует включать в рацион на начальном этапе. Не следует исключать целые группы продуктов питания; вместо этого следует внести изменения в типы продуктов питания, выбранных в каждой группе. Например, употребление яблок, которые имеют высокое содержание FODMAP, может быть заменено на употребление апельсинов, которые имеют низкое содержание FODMAP. Это важно для поддержания соблюдения адекватности рациона [55]. Для понимания принципов диеты пациенты должны понимать механизмы FODMAP и их эффекты в зависимости от количества.
Второй этап — это этап пересмотра рациона, целью которого является выявление определенных диетических триггеров у каждого человека. Маловероятно, что все продукты с высоким содержанием FODMAP вызывают симптомы у всех людей, и поэтому используется стратегия определения уровней толерантности к каждой подгруппе FODMAP [56]. Рекомендации диетолога помогают пациенту проверить каждую подгруппу FODMAP, включая влияние количества продуктов, частоту их употребления и аддитивный эффект от нескольких продуктов с высоким содержанием FODMAP [56]. Индивидуальная переносимость FODMAP широко варьируется. Переносимость у одного и того же человека также может варьировать в зависимости от других факторов, включая уровень стресса.
Последний этап является поддерживающим. Цель фазы поддерживающей терапии заключается в том, чтобы пациент снова вводил в рацион столько продуктов с высоким содержанием FODMAP, сколько возможно при условии сохранения адекватного контроля симптомов. В рацион должны быть включены любые продукты, которые хорошо переносятся. Продукты с умеренной переносимостью могут периодически вводиться повторно, тогда как употребления продуктов с плохой переносимостью следует избегать [56]. В долгосрочной перспективе пациентам рекомендуется время от времени вводить в рацион продукты, которые они плохо переносят, чтобы пересмотреть толерантность организма к этим продуктам.
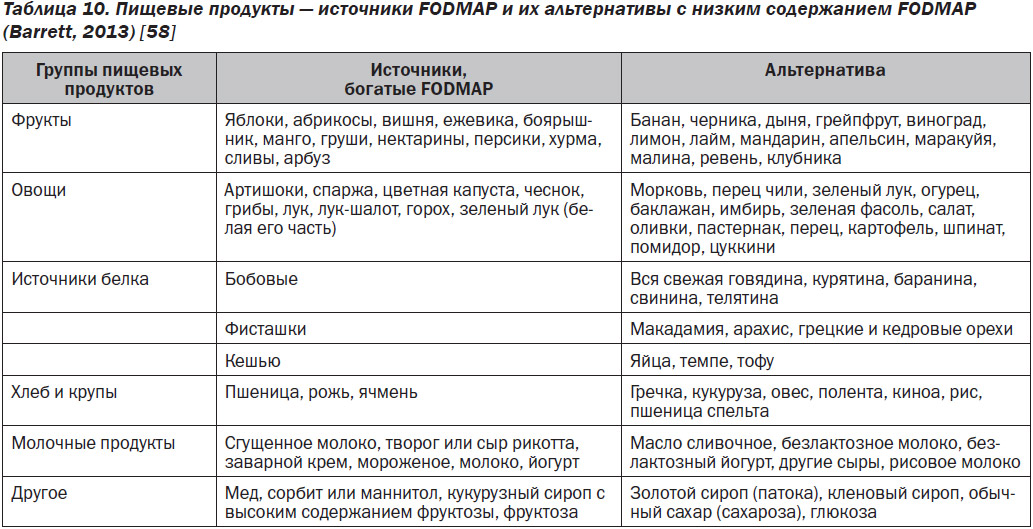
Список продуктов с высоким содержанием FODMAP и альтернативные продукты с низким содержанием FODMAP: из-за продолжающихся и быстро обновляющихся исследований диеты с низким содержанием FODMAP многие доступные списки продуктов — как в печатных источниках, так и on-line — к сожалению, устарели и, следовательно, являются неточными [57]. В табл. 10 перечислены продукты с высоким содержанием FODMAP и их альтернативы с низким содержанием FODMAP [58]. Приложение для смартфонов Университета Монаш для диеты с низким FODMAP является наиболее полезным инструментом, поскольку оно регулярно обновляется [53]. Стоимость приложения составляет 10 долларов США без каких-либо других сборов, включая все обновления.
Потенциальные побочные эффекты диеты с низким содержанием FODMAP. Любые существенные изменения в рационе питания сопряжены с риском развития нежелательных эффектов, таких как уменьшение количества употребляемых пищевых волокон или повышенный риск нутритивной недостаточности в целом. Также необходимо учитывать влияние изменения рациона на качество жизни. Кроме того, продукты, которые употребляются в пищу, являются основным фактором для определения желудочно-кишечной микробиоты [59]. Следовательно, существует вероятность того, что ограничение FODMAP, включая пребиотики-фруктаны и галактоолигосахариды, может заметно влиять на состав микробиоты [60].
На сегодняшний день имеются только ограниченные опубликованные данные об адекватности питания пациентов при кратковременной диете с низким содержанием FODMAP или в долгосрочной перспективе после повторного введения FODMAP для обеспечения их переносимости. Тем не менее считается, что при соответствующем диетологическом консультировании диета может быть адекватной с нутритивной точки зрения. Влияние диеты на адекватность питания при использовании ее в качестве самолечения неизвестно [60]. Исследования, проведенные на сегодняшний день, показывают, что общая энергозатратность, употребление углеводов и кальция могут быть уменьшены в краткосрочной перспективе, хотя употребление клетчатки, по-видимому, не изменяется. В связи с тем, что диета может вызывать изменения в питании, следует контролировать массу тела и употребление пищи на протяжении всего лечения [60].
Диета с низким содержанием FODMAP потенциально может улучшить или ухудшить качество жизни человека, однако большинство данных свидетельствуют о том, что диета с низким содержанием FODMAP не приводит к ухудшению качества жизни и может даже его улучшить [61]. Недавно опубликованное плацебо-контролируемое исследование пациентов с СРК показало, что диета с низким содержанием FODMAP ассоциировалась с адекватным уменьшением числа симптомов и достоверным уменьшением выраженности симптомов по сравнению с плацебо [62].
Из-за этих потенциально вредных последствий изменения рациона долгосрочное соблюдение диеты с низким содержанием FODMAP рекомендуется только пациентам с симптомами тяжелой степени выраженности и требующим постоянного ограничения в питании для адекватного контроля симптомов. Поэтому рекомендуется программа повторного введения в рацион продуктов с высоким содержанием FODMAP для определения порога их переносимости данным пациентом.
3.2. Нарушения функции ЖКТ и диета с низким содержанием FODMAP
3.2.1. Показания к применению диеты с низким содержанием FODMAP
Большая часть доказательной базы на тему применения диеты с низким содержанием FODMAP получена для пациентов с СРК. Как упомянуто выше, важно, чтобы перед назначением диеты с низким содержанием FODMAP пациенту был выставлен клинический диагноз СРК, исключены другие заболевания.
Есть скудная доказательная база по применению диеты с низким содержанием FODMAP у пациентов с ВЗК (болезнь Крона и язвенный колит) [26, 63]. У пациентов с ВЗК обычно возникают СРК-подобные симптомы. Поэтому использование диеты с низким содержанием FODMAP при ВЗК направлено на контроль СРК-подобных симптомов, а не на воспалительный процесс, связанный с самим заболеванием. То же самое может быть и у пациентов с целиакией.
В настоящее время изучается применение диеты с низким содержанием FODMAP при других патологиях, таких как эндометриоз [64], младенческая колика [65], функциональная диспепсия, фибромиалгия [66], склеродермия и синдром хронической усталости. Однако ввиду минимальной доказательной базы по применению диеты с низким содержанием FODMAP при этих заболеваниях на данном этапе ее назначать не рекомендуется.
3.2.2. Диета с низким содержанием FODMAP, функциональная диспепсия и СРК
Симптомы СРК и функциональной диспепсии (ФД) перекликаются между собой. Функциональная диспепсия характеризуется вздутием живота, отрыжкой, болями в эпигастрии и дискомфортом. У многих пациентов одновременно имеется и ФД, и СРК. Хотя данные о влиянии диеты с низким содержанием FODMAP при ФД ограниченны, есть отдельные сообщения о том, что она может использоваться для управления симптомами этого заболевания [67]. Необходимы дополнительные данные для оценки эффективности диеты с низким содержанием FODMAP у пациентов с ФД.
4. Непереносимость углеводов
4.1. Непереносимость лактозы/дефицит лактазы
4.1.1. Дефиниции и терминология
— Лактоза — дисахарид, который обычно содержится в молочных продуктах, самая высокая его концентрация — в молоке и йогурте.
— Лактаза — фермент, необходимый для расщепления лактозы (дисахарида) на моносахариды глюкозу и галактозу.
— Дефицит лактазы: активность лактазы заметно снижена по сравнению с активностью, наблюдаемой у детей.
— Нарушение всасывания лактозы: о нем говорят, когда значительное количество лактозы не абсорбируется в тонкой кишке.
— Непереносимость лактозы: возникает, когда мальабсорбция лактозы вызывает расстройства ЖКТ [68].
4.1.2. Непереносимость лактозы в перспективе: когда это актуально?
Примерно у 65–75 % людей после прекращения грудного вскармливания подавляется продукция лактазы. Мальабсорбция лактозы чаще встречается у населения Азии, Южной Америки и Африки [69]. Устойчивость к лактазе (продолжающаяся продукция лактазы во взрослой жизни) является генетически детерминированным синдромом и чаще всего встречается у населения стран Европы, а также в некоторых странах Африки, Ближнего Востока и Южной Азии [70].
Скорость снижения активности лактазы варьирует в зависимости от этнической принадлежности. У китайцев и японцев активность лактазы снижается на 80–90 % в течение 3–4 лет после прекращения грудного вскармливания, у евреев — в течение 7 лет, а у жителей европейских северных стран — в течение 18–20 лет после прекращения грудного вскармливания [71].
Вторичная непереносимость лактозы может быть вызвана повреждением тонкой кишки как при нелеченной целиакии, так и при вирусном гастроэнтерите. Вторичная непереносимость лактозы, как правило, обратима после лечения основного заболевания [69].
В отличие от непереносимости лактозы аллергия на коровье молоко является воспалительным ответом на молочный протеин. Симптомы непереносимости лактозы и аллергии на коровье молоко частично совпадают, поэтому возможна постановка неправильного диагноза. Аллергия на белок коровьего молока встречается у 2–6 % детей и у 0,1–0,5 % взрослых [72]. В дополнение к симптомам со стороны желудочно-кишечного тракта аллергия на белок коровьего молока может вызвать кожные симптомы (эритему, зуд) и симптомы поражения дыхательной системы (хрипы, одышка) и даже анафилаксию [72]. Из-за сходства некоторых симптомов важно, чтобы медицинские работники знали о различиях между ними. Аллергия на коровье молоко также может быть вызвана молочными продуктами с минимальным содержанием лактозы (такими как твердые сыры).
4.1.3. Симптомы непереносимости лактозы
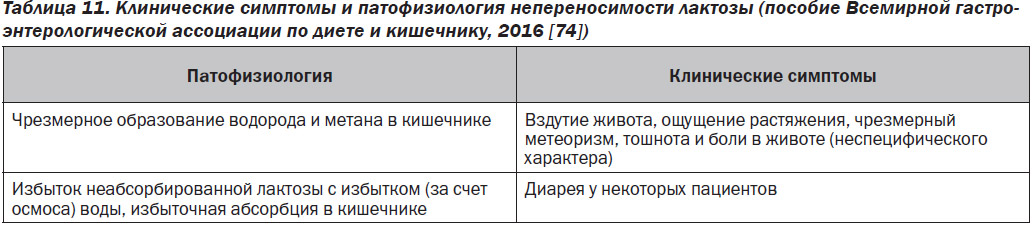
Типичные симптомы непереносимости лактозы следующие: боль в животе, вздутие живота, метеоризм, диарея и урчание. Также могут беспокоить тошнота и рвота, хотя они встречаются реже [69].
В случаях гиполактазии у взрослых количество употребляемой лактозы, необходимое для возникновения симптомов, варьирует от 12 до 18 г, или 8–12 унций молока. Употребление небольших и средних количеств лактозы обычно вызывает вздутие живота, крампи и метеоризм, но не диарею. Прием большего количества лактозы, ускорение опорожнения желудка и прохождения через кишечник способствуют развитию более тяжелых симптомов. Развитие симптомов непереносимости лактозы определяют несколько факторов, таких как содержание лактозы в рационе, время прохождения через кишечник, способность к ферментации кишечного микробиома, висцеральная гиперчувствительность [73] и (возможно) нейропсихологические факторы [74].
4.1.4. Как диагностировать: условия ограниченных и неограниченных возможностей
Диагностика непереносимости лактозы основана на возникновении симптомов [54]. Определение дозы лактозы, которую могут переносить пациенты с ее непереносимостью, имеет решающее значение для определения ее влияния на состояние здоровья пациента [68]. Обычно мальабсорбция лактозы не ассоциируется с развитием симптомов. Только когда мальабсорбция лактозы вызывает симптомы, можно выставить диагноз «непереносимость лактозы».
— Водородный дыхательный тест с лактозой. В настоящее время водородный дыхательный тест с лактозой считается наиболее экономически эффективным, неинвазивным и надежным методом диагностики мальабсорбции лактозы [69]. Дыхательный тест обычно заключается в употреблении 25 или 50 г лактозы с последующим измерением в выдыхаемом воздухе содержания водорода и метана в течение следующих 3–4 часов. Хотя данные в Рекомендациях по диагностике варьируют, увеличение содержания водорода в выдыхаемом воздухе на 20 ч/млн (частей на миллион) выше базовой линии или метана на 10 ч/млн выше базовой линии расценивается как мальабсорбция лактозы [69].
— Тест на толерантность к лактозе [74]. Это анализ крови на дефицит лактазы, а традиционный термин «толерантность» является неправильным. Пациент употребляет 50 г лактозы, растворенной в воде. Концентрацию глюкозы в капиллярной крови определяют за 5 минут до, во время приема лактозы и через 15, 30, 45 и 60 минут после. При наличии мальабсорбции лактозы уровень глюкозы в крови после приема лактозы не повышается, в то время как в норме уровень глюкозы в плазме должен увеличиваться как минимум на 1,4 ммоль/л (25,2 мг/дл); отсутствие повышения уровня глюкозы указывает на мальабсорбцию лактозы. Чувствительность и специфичность теста к дефициту лактазы высоки (> 90 %).
— Генетический тест [74]. Генетический тест идентифицирует единичные нуклеотидные полиморфизмы, связанные с персистенцией/неактивностью лактазы. Например, генотип СС коррелирует с гиполактазией, тогда как генотип ТТ — с персистенцией лактазы. Не у всех людей с генотипом СС будут развиваться симптомы мальабсорбции лактозы. Однако соответствующие мутации зависят от этнической принадлежности популяции.
— Кишечная биопсия. Биопсия тощей кишки может быть использована для оценки активности лактазы, но она менее чувствительна и более инвазивна, чем дыхательный тест с лактозой. Поэтому данный метод исследования не рекомендуется к применению в клинической практике.
— Пищевой тест. Во многих случаях для выявления мальабсорбции лактозы достаточно провести пищевой тест. При этом рекомендуется использовать те продукты, которые предпочитает конкретный пациент. Стандартное исследование включает в себя употребление 1 чашки (250 мл) обезжиренного молока* за один присест с индивидуальным мониторингом реакции на симптомы. Тем не менее данный тест должен быть адаптирован к конкретному человеку. Например, если он редко употребляет такое количество молока и предпочитает употреблять 200 г йогурта, для данного теста следует использовать йогурт из обезжиренного молока* [56].
4.1.5. Как лечить
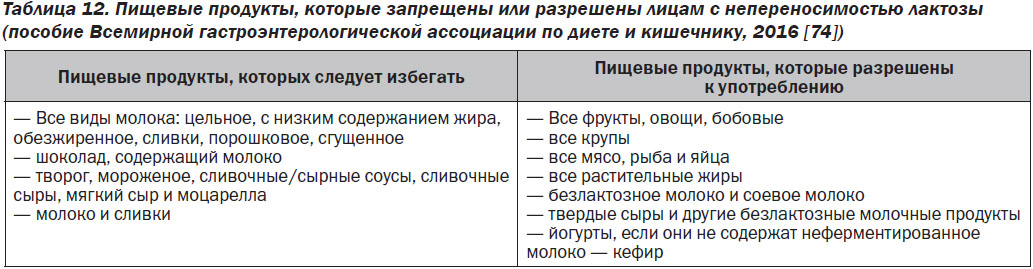
Есть два ключевых способа лечения непереносимости лактозы: либо путем отказа от употребления пищевых продуктов, содержащих значительное количество лактозы (табл. 12), либо с помощью применения β-галактозидазы для гидролиза лактозы, содержащейся в пищевых продуктах.
— Модификация диеты — сокращение употребления большого количества лактозы. Большинство людей с непереносимостью лактозы могут переносить 12–15 г лактозы без развития у них симптомов со стороны желудочно-кишечного тракта [68]. В среднем молочная пища содержит приблизительно 12 г лактозы [75], поэтому небольшое количество лактозы, вероятно, хорошо переносится даже теми людьми, у которых имеется непереносимость лактозы. Коррекция объема употребления лактозы является обязательным условием для ведения пациента с непереносимостью лактозы. Молочные продукты, такие как твердый сыр, отличный источник кальция, содержат < 1 г лактозы, и поэтому их необходимо включать в рацион людей, страдающих непереносимостью лактозы. Для обеспечения адекватного употребления продуктов, богатых кальцием, необходимы соответствующие знания по данной теме.
Следует обратить внимание на сокращение употребления большого количества лактозы. Это можно сделать, уменьшив употребление продуктов с высоким содержанием лактозы и/или используя продукты без лактозы. Молочные продукты, такие как коровье молоко и йогурт, могут быть предварительно обогащены β-галактозидазой для обеспечения гидролиза содержащейся в них лактозы. В некоторых странах растет спрос на безлактозные продукты, что привело к тому, что на потребительском рынке стали доступны безлактозные молоко, йогурт, сыр, сливки и мороженое. Однако потребность в таких продуктах, как безлактозный сыр и сливки, сомнительна, учитывая изначальное минимальное содержание в них лактозы [54].
— Ферментные добавки. Альтернативным способом лечения непереносимости лактозы является фермент-ная добавка с лактазой (β-галактозидаза), которую можно принимать внутрь вместе с пищей. Исследования показали, что она эффективна в снижении содержания водорода в выдыхаемом воздухе и в достижении уменьшения симптомов [76–78], хотя более высокие дозы лактозы, например 50 г, по-видимому, подавляют активность фермента [77].
4.2. Непереносимость фруктозы
4.2.1. Дефиниции и терминология
— Фруктоза — моносахарид, который обычно содержится в меде, манго, яблоке, груше и кукурузном сиропе с высоким содержанием фруктозы.
— Избыток фруктозы: фруктоза и глюкоза обычно совместно присутствуют в пищевых продуктах; избыток фруктозы определяется как наличие фруктозы в большем количестве, чем глюкоза (также называемой свободной фруктозой). Абсорбция избытка фруктозы зависит от путей осуществления абсорбции с низкой пропускной способностью, которые, по-видимому, имеются по всей длине тонкой кишки. В этой ситуации молекулы фруктозы, вероятно, дольше остаются в просвете тонкой кишки и оказывают осмотическое действие на большей части его протяжения, с «перетеканием» в ободочную кишку или без такового (т.е. мальабсорбция фруктозы) [46, 54]. Фруктоза, которая достигает толстой кишки, затем доступна для ферментации в толстой кишке, создавая побочные продукты — водород и метан, которые можно измерить в выдыхаемом воздухе.
— Мальабсорбция фруктозы: неполное всасывание употребленной дозы фруктозы в тонкой кишке, что приводит к попаданию ее в толстую кишку. Было показано, что мальабсорбция фруктозы является нормальным явлением, встречающимся примерно у 35 % здоровых людей [79].
— Непереносимость фруктозы: это происходит, когда употребление фруктозы вызывает развитие симптомов со стороны желудочно-кишечного тракта.
4.2.2. Предположительный механизм
— Было продемонстрировано, что фруктоза обладает осмотическим эффектом, увеличивая содержание воды в просвете тонкого кишечника и приводя к растяжению стенки кишечника. В таком случае (или если имеется висцеральная гиперчувствительность) могут возникнуть боли в животе, вздутие живота и иногда диарея. Было установлено, что данный эффект развивается независимо от степени всасывания фруктозы в тонкой кишке [46]. Поэтому причиной развития симптомов после употребления фруктозы может быть не наличие мальабсорбции, а скорее наличие висцеральной гиперчувствительности (такой, которая наблюдается при функциональных желудочно-кишечных расстройствах) [47].
— Водородный дыхательный тест ранее был популярным методом исследования, который помогал назначать соответствующую диетотерапию; считалось, что пациенты, у которых дыхательный тест с фруктозой был отрицательным, не нуждались в ограничении фруктозы в рационе. Тем не менее симптомы могут развиваться независимо от наличия мальабсорбции с выделением водорода или метана из-за воздействия фруктозы на тонкий кишечник. Поэтому для оценки абсорбции фруктозы больше не рекомендуется водородный дыхательный тест [80].
4.2.3. Употребление фруктозы
Оценки употребления фруктозы показывают, что в последние годы ее общее употребление увеличилось, в основном из-за более широкого использования кукурузных сиропов с высоким содержанием фруктозы. Исследование, проведенное в Соединенных Штатах, в котором сравнивалось употребление фруктозы в периоды 1977–1978 и 1999–2004 годов, показало, что в структуре общей калорийности употребление фруктозы увеличилось только на 1 % , а в структуре общего употребления углеводов — на 41 % [74, 81]. Это дает основания предположить, что увеличение употребления фруктозы не так значительно, как предполагалось. В 1999–2004 гг. основным источником пищевой фруктозы были фрукты и продукты из них [81].
4.2.4. Применение модификаций диеты
Ранние исследования, в которых изучалось влияние избытка фруктозы на возникновение симптомов со стороны желудочно-кишечного тракта, фокусировались только на фруктозе или фруктозе в сочетании с сорбитом. Однако эти случаи, ограниченные избытком только употребления фруктозы, были плохо описаны. Поскольку фруктоза в избыточном количестве часто употребляется вместе с другими короткоцепочечными углеводами, которые оказывают сходное воздействие на кишечник (т.е. FODMAP), в развитии желудочно-кишечных симптомов прослеживается именно комбинированная роль этих специфических углеводов [49–51]. Совокупность этих ферментируемых углеводов как часть диеты с низким содержанием FODMAP была связана с улучшением симптомов у почти 3/4 пациентов с функциональными расстройствами желудочно-кишечного тракта [40, 41, 44, 82].
4.2.5. Рекомендации
— Употребление фруктозы (в избытке глюкозы) модифицируется как компонент диеты с низким содержанием FODMAP. Сокращение употребления всех FODMAP, а не только фруктозы, оказывает более благоприятное влияние на уменьшение выраженности желудочно-кишечных симптомов.
— Мальабсорбция фруктозы не является ни диагнозом, ни состоянием. Скорее употребляемая в пищу фруктоза может вызывать СРК-подобные желудочно-кишечные симптомы, и последствия ее употребления следует учитывать наряду с эффектами других употреб–ляемых FODMAP (см. Раздел 3).
— Клиническое значение дыхательных тестов для диагностики мальабсорбции фруктозы ограниченно.
— Касательно вопроса, употребления каких пищевых продуктов следует избегать, пожалуйста, см. таблицу источников FODMAP (табл. 10).
4.3. Дефицит сахаразы-изомальтазы
Дефицит сахаразы-изомальтазы (также известный как непереносимость сахаразы) обычно проявляется на ранних этапах жизни и может привести к нарушению всасывания углеводов, вызывая диарею, вздутие живота и боли в животе, сходные с симптомами СРК, с преобладанием диареи. Причиной дефицита сахаразы-изомальтазы является снижение активности фермента глюкозидазы в тонком кишечнике. Этот фермент обычно участвует в переваривании крахмала и сахаров. Снижая активность глюкозидазы, углеводы, особенно сахароза, ведут себя как FODMAP, с повышенной осмотической активностью и ферментацией в кишечнике, что может привести к появлению симптомов СРК [83]. Роль дефицита сахаразы-изомальтазы в более поздних стадиях СРК установлена недостаточно.
4.3.1. Врожденный дефицит сахаразы-изомальтазы
При врожденном дефиците сахаразы-изомальтазы мутации в гене сахараза-изомальтазы (SI) приводят к развитию симптомов тяжелой степени выраженности. Это редко встречающееся состояние. Однако недавние исследования выявили множественные вариации гена SI с пониженной функцией. Данные нарушения могут встречаться у около 2–9 % лиц североамериканского и европейского происхождения, и, возможно, масштаб проблемы недооценен [84]. Однако еще предстоит –изучить, есть ли у данного состояния патогенетическая связь с индукцией симптомов у пациентов с функциональными желудочно-кишечными расстройствами.
4.3.2. Вторичный или приобретенный дефицит сахаразы-изомальтазы
Теоретически может развиться вторичный или приобретенный дефицит сахаразы-изомальтазы, но обычно он временный. Исследования на животных показали, что атрофия ворсин стенки кишечника, например, возникающая при нелеченной целиакии, может приводить к дефициту сахаразы-изомальтазы. Но он должен быть обратим при излечении атрофии ворсинок [84].
4.3.3. Диагностика
Диагноз дефицита сахаразы-изомальтазы может быть установлен с помощью биопсии двенадцатиперстной кишки или тощей кишки у детей, выполненной с целью оценки активности сахаразы, лактазы, изомальтазы и мальтазы [84]. Однако образцы биопсии должны быть немедленно заморожены, и из-за сложного процесса замораживания/оттаивания, необходимого для анализа образца, результаты могут быть неточными [85]. Доступны и другие методы диагностики, такие как дыхательный тест с сахарозой, но его проведение у маленьких детей проблематично [85]. Совсем недавно для выявления форм врожденного дефицита сахаразы-изомальтазы стало доступно генетическое секвенирование [84], хотя полученные результаты следует рассматривать в сочетании с клинической картиной. Существует мало данных о диагностической ценности таких тестов у взрослых.
4.3.4. Лечение
Данные о лечении дефицита сахаразы-изомальтазы ограниченны. Варианты лечения включают ограничение употребления сахара и крахмала, хотя это плохо изучено. Сначала проводится начальная рестриктивная фаза лечения с последующим постепенным повторным введением ранее исключенных продуктов для определения их переносимости. Тем не менее такие ограничения в питании являются сложными, и со стороны пациентов часто отсутствует комплайенс [85]. Альтернативой модификации диеты является ферментозамещение сакрозидазой, которая показала хороший эффект в исследованиях с небольшими размерами выборки [85, 86]. Однако данная ферментная добавка является дорогостоящей и может оказаться недоступной по всему миру.
5. Другие рекомендации по диете при СРК
Некоторые продукты питания, в том числе продукты с высоким содержанием FODMAP, вызывают симптомы, которые встречаются у пациентов с СРК. Хотя многие пациенты с СРК считают, что у них имеет место непереносимость определенных продуктов [87], часто непереносимость невозможно воспроизвести при слепом повторном применении этих продуктов питания [88, 89]. Пациенты с СРК часто самостоятельно вносят изменения в рацион, пытаясь облегчить симптомы [88, 90].
Безопасные, надежные и доступные по цене тесты для диагностики пищевой непереносимости отсутствуют. Поэтому клиницисты не могут легко подтвердить, какие пищевые продукты вызывают непереносимость у пациентов, сообщающих о возникновении симптомов, связанных с употреблением тех или иных продуктов [91]. Общие принципы заключаются в следующем:
— следует подумать о целиакии, особенно у пациентов с такими постоянными симптомами, как избыточное газообразование, вздутие живота и диарея, а также у лиц с отягощенным семейным анамнезом по целиакии [91]. Симптомы СРК распространены у пациентов с целиакией;
— следует избегать применения коммерческих тестов, которые дают ложную информацию о том, что они диагностируют пищевую непереносимость на основании анализов крови, кала, волос или ногтей [91];
— лактоза, фруктоза, избыток клетчатки, резистент-ный крахмал, фруктаны и галактоолигосахариды могут усугублять/вызывать симптомы СРК. При отсутствии возможности консультации диетолога одним из подходов является рассмотрение исключения в индивидуальном порядке тех или иных компонентов пищи для уменьшения симптомов [91];
— применение диеты с низким содержанием FODMAP следует рассматривать у пациентов, у которых индивидуальная коррекция рациона оказалась неэффективной или у которых есть возможность получить консультацию опытного диетолога. Достаточно четырехнедельного комплайенса, чтобы определить, эффективна ли диета. Пациент легко обучается применению диеты, если его консультируют опытные практикующие врачи, которые наблюдают его во время важной фазы возвращения в рацион тех или иных продуктов питания и уделяют дополнительное внимание поддержанию адекватности рациона;
— изменения рациона будут нарушать микробиом кишечника. Мало что известно о клинической значимости изменений микробиома, связанных с какой-либо специфической диетой при СРК [91], имеющееся ограниченное количество данных свидетельствует о том, что при применении диеты с низким содержанием FODMAP в фазе возвращения в рацион определенных продуктов в микробиоме нет существенных изменений [92];
— если диета с низким содержанием FODMAP неэффективна, ее следует прекратить. Введению других ограничений в питании должна предшествовать тщательная оценка адекватности питания, особенно если их добавляют к уже имеющимся ограничениям.
Среди других диетических подходов лишь немногие имеют качественную доказательную базу эффективности, безопасности и адекватности. Исключением является безглютеновая диета, которая широко применяется больными СРК в США без какой-либо помощи со стороны медицинских работников.
Можно также сослаться на следующие глобальные руководства WGO [93]:
— «Синдром раздраженного кишечника: глобальная перспектива» (2015 г.) для клинических рекомендаций по диагностике и лечению СРК, поскольку ни эпидемиология, ни клиническая картина данной патологии, ни доступность диагностических и терапевтических ресурсов во всем мире неоднородны, и поэтому нет единого золотого стандарта ведения таких пациентов [94];
— «Глобальные рекомендации WGO: целиакия» (2016) [1]. Обновленное в 2017 году глобальное руководство WGO было опубликовано в «Journal of Clinical Gastroenterology» [2].
Результаты нескольких неконтролируемых исследований показали, что часть пациентов, которые соответствуют критериям СРК, будут отвечать на применение безглютеновой диеты [95–98]. Вопрос о том, являются ли глютен, белок безглютеновой пшеницы или фруктаны вредными компонентами пищи, находится в стадии дискуссии. Есть группа пациентов с СРК или другими функциональными нарушениями кишечника, часто с внекишечными симптомами, которые сообщают о чувствительности к глютену. Тем не менее глютен до сих пор не выделен в качестве причины развития симптомов у таких пациентов. Было показано, что у подгруппы с повышенной плотностью интраэпителиальных лимфоцитов и эозинофилов в слизистой оболочке тонкой и часто толстой кишки развиваются желудочно-кишечные симптомы после двойного слепого плацебо-контролируемого употребления пшеницы и других протеинов [99]. Коррекция рациона, основанная на полученных результатах изучения данной патологии, привела к долгосрочному уменьшению симптомов у этих пациентов [100]. Для обобщения этих результатов и их оценки необходимо проведение дальнейших исследований в других центрах.
У большинства людей, у которых нет вышеуказанных гистопатологических изменений, безглютеновая диета может быть эффективной, но остается спорным вопрос о том, действительно ли пациент нуждается в безглютеновом рационе или является ли глютен маркером для других молекул пшеницы, таких как фруктаны. Недавнее исследование, проведенное в Норвегии, продемонстрировало доказательства того, что фруктаны, но не глютен или протеин пшеницы, были причиной симптомов, расцененных пациентами как чувствительность к глютену [101].
— Группа пациентов с так называемой нецелиакийной чувствительностью к глютену является гетерогенной. Часто эти пациенты страдают СРК и могут иметь не опосредованную иммуноглобулином Е чувствительность к протеину пшеницы. У большинства этих пациентов не будет никаких доказательств того, что они не переносят глютен, — это продемонстрировано в двойном слепом плацебо-контролируемом перекрестном РКИ [102].
— В настоящее время нет биомаркеров чувствительности к глютену. Определение HLA-DQ2/8 в качестве прогностического маркера чувствительности к пшенице не рекомендуется [97].
— При отсутствии биомаркеров для NCGS после исключения целиакии и аллергии на пшеницу лучшим методом диагностики NCGS считалось двойное слепое плацебо-контролируемое исследование для оценки симптомов, вызванных глютеном. Этот подход использовался в некоторых регионах Европы, но редко применялся в остальных странах мира. Тем не менее недавнее европейское исследование [103] продемонстрировало ограничения этого исследования, предполагая, что глютен не является причиной развития симптомов у этих пациентов, что данное исследование не может определить, является ли глютен причиной симптомов, и что этот метод не пригоден для выявления глютен-индуцированных симптомов у отдельных пациентов без целиакии. Однако когда будет разработана стандартизированная и строгая методология оценки NCGS, она будет иметь определенные преимущества.
— Многие пациенты с СРК-подобными симптомами сообщают о чувствительности к глютену, и эти симптомы могут уменьшиться при применении безглютеновой диеты [98]. Согласно недавно опубликованному исследованию в Норвегии [101], уменьшение симптомов, вероятно, связано со снижением количества фруктанов, а не глютена или безглютенового протеина пшеницы.
— Преимущества диеты с низким содержанием FODMAP могут быть выше преимуществ безглютеновой диеты [91].
— Окончательная роль диеты при разных подтипах СРК требует дальнейшего изучения [87].
Несмотря на неопределенность в отношении роли глютена, в частности, в генезе симптомов СРК, применение безглютеновой диеты является целесообразным у пациентов, которые считают, что симптомы у них усиливаются при употреблении глютенсодержащих продуктов.
— Наиболее полезной данная диета может быть для пациентов с СРК, у которых преобладающими симптомами являются боль или вздутие живота [89], и для пациентов с СРК с преобладанием диареи или со смешанным СРК.
— Безглютеновая диета сложна для постоянного применения и не дешева [104].
— Рекомендуется привлечение квалифицированного специалиста-диетолога.
Источник: http://www.worldgastroenterology.org/guidelines/global-guidelines/diet-and-the-gut/diet-and-the-gut-english