Газета «Новости медицины и фармации» Кардиология и ревматология (651) 2018 (тематический номер)
Вернуться к номеру
D-димер как маркер тромбообразования и его применение в клинической практике
Авторы: Мельник А.А., к.б.н.
Cпециализированный медицинский центр «Оптима-фарм», г. Киев, Украина
Рубрики: Кардиология
Разделы: Справочник специалиста
Версия для печати
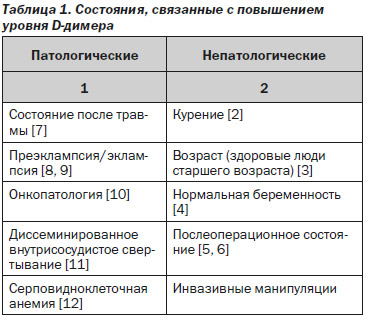
Лабораторный тест для определения D-димера по частоте измерений является одним из самых востребованных методов в практическом исследовании системы свертывания крови. Он занимает четвертое место по количеству назначений после протромбинового времени, активированного частичного тромбопластинового времени и фибриногена. С момента открытия D-димера (1970-е годы) и начала его применения в клинической практике (1990-е годы) анализ крови на D-димер прочно вошел в арсенал часто используемых врачами многих специальностей тестов для диагностики заболеваний, связанных с патологическим тромбообразованием. D-димер является конечным продуктом такого происходящего в организме человека процесса, как фибринолиз. В 1893 г. термин «фибринолиз» предложил использовать французский физиолог Dastre, а в 1905 г. ученый из Германии Morawitz сделал предположение о том, что в фибринолизе принимают участие некоторые ферменты. Это было подтверждено в 1959 г. доктором Sherry (США), который доказал, что активатором фибринолиза является плазмин, образующийся из его предшественника плазминогена. В 1973 г. одновременно две исследовательские группы сообщили об обнаружении уникального фрагмента, полученного при гидролитическом расщеплении белка фибрина ферментом плазмином в сыворотке человека [1]. Позже этот фрагмент получил название «D-димер», и его начали использовать как инструмент для диагностики различных заболеваний. Многие клинические состояния характеризуются увеличением концентрации D-димера в плазме крови (табл. 1).
Механизм образования D-димера
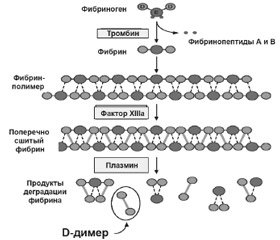
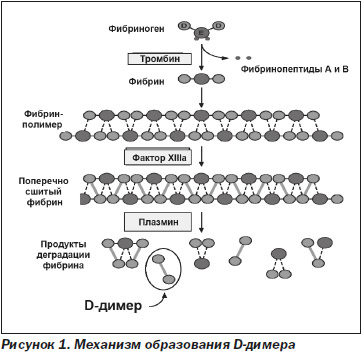 В настоящее время для диагностики тромбоза используются продукты расщепления фибриногена (рис. 1). Фибриноген при действии тромбина образует мономеры фибрина путем расщепления двух небольших фрагментов (фибринопептидов А и В). Во время этого процесса отрицательный заряд Е фибриногена (темно-серые кружочки) преобразуется в положительный заряд, что позволяет спонтанно полимеризоваться мономерам фибрина в полимер, который стабилизируется водородными связями. Тромбин также активирует фактор XIII (фермент трансглутаминаза), который стабилизирует исходный полимер фибрина путем каталитического образования сшитых ковалентных связей между соседними D-доменами (светло-серые кружочки). Под действием тканевого активатора плазминогена (tPA), являющегося сериновой протеазой, из неактивного плазминогена образуется активный плазмин, который расщепляет фибрин на множество мелких фрагментов, называемых продуктами деградации фибрина (ПДФ). D-димер, образованный из двух смежных сшитых мономеров, является одним из основных ПДФ. В отличие от конечных продуктов расщепления фибриногена, которые представлены в виде отдельных фрагментов D и Е, при расщеплении поперечно сшитых фактором ХIIIа волокон фибрина образуются более крупные фрагменты — D-димеры, тримеры D-E-D, поскольку плазмин не способен расщеплять ковалентную связь между D-доменами.
В настоящее время для диагностики тромбоза используются продукты расщепления фибриногена (рис. 1). Фибриноген при действии тромбина образует мономеры фибрина путем расщепления двух небольших фрагментов (фибринопептидов А и В). Во время этого процесса отрицательный заряд Е фибриногена (темно-серые кружочки) преобразуется в положительный заряд, что позволяет спонтанно полимеризоваться мономерам фибрина в полимер, который стабилизируется водородными связями. Тромбин также активирует фактор XIII (фермент трансглутаминаза), который стабилизирует исходный полимер фибрина путем каталитического образования сшитых ковалентных связей между соседними D-доменами (светло-серые кружочки). Под действием тканевого активатора плазминогена (tPA), являющегося сериновой протеазой, из неактивного плазминогена образуется активный плазмин, который расщепляет фибрин на множество мелких фрагментов, называемых продуктами деградации фибрина (ПДФ). D-димер, образованный из двух смежных сшитых мономеров, является одним из основных ПДФ. В отличие от конечных продуктов расщепления фибриногена, которые представлены в виде отдельных фрагментов D и Е, при расщеплении поперечно сшитых фактором ХIIIа волокон фибрина образуются более крупные фрагменты — D-димеры, тримеры D-E-D, поскольку плазмин не способен расщеплять ковалентную связь между D-доменами.
Таким образом, действие фибринолитической системы направлено на лизис фибрина, а при чрезмерной активации — и фибриногена. В результате образуется смесь продуктов деградации фибрина/фибриногена. Продукты деградации фибрина — это крупные фрагменты D-димеры и тримеры, а продукты деградации фибриногена — отдельные олигопептиды с небольшой молекулярной массой. Только продукты деградации поперечно сшитого фибрина содержат D-димеры. При этом действует правило:
Сгусток + фибринолиз = D-димер образуется.
Нет сгустка + фибринолиз ≠ D-димер не образуется.
Нет сгустка + фибринолиз ≠ D-димер не образуется.
D-димер относится к маркерам активации как свертывания и фибринообразования, так и фибринолиза. Период полужизни D-димера составляет примерно 8 часов, клиренс осуществляется через почки и ретикулоэндотелиальную систему. Определение D-димера является наиболее распространенным лабораторным маркером активации свертывания и фибринолиза.
Методы определения D-димера
1. Качественные и полуколичественные методы:
— реакция агглютинации латексных частиц (плазма).
2. Количественные:
— иммунохроматография; Point-of-Care (диагностика по месту лечения);
— ELISA (enzyme-linked immunosorbent assay; ферментсвязанный иммуносорбентный метод);
— иммунодиффузия на порозных мембранах;
— иммунотурбидиметрия.
Краткая характеристика методов
1. Методы определения D-димера, основанные на латексной агглютинации
К плазме, содержащей D-димер, добавляют латексные шарики, покрытые моноклональными антителами против D-димера, и отмечают время появления макроскопической агглютинации на предметном стекле. Это недорогие и легко выполнимые исследования. Они имеют умеренную чувствительность, но более высокую специфичность по отношению к тромбозу глубоких вен (ТГВ) и тромбоэмболии легочной артерии (ТЭЛА).
2. Метод иммунохроматографии
Относительная нечувствительность тестов латексной агглютинации привела к разработке более чувствительных тестов, основанных на иммунохроматографической экспресс-диагностике. Этот метод сочетает в себе скорость проведения исследования (от 2 мин) с высокой чувствительностью. Отмечена особая ценность иммунохроматографического метода при ТГВ.
3. Метод ELISA
ELISA-методы исследования D-димера имеют высокую чувствительность, но относительно низкую специфичность. Низкая специфичность этих методов обусловливает в значительном числе случаев ложноположительные результаты. Метод заключается в добавлении в лунки микропланшетов, покрытых антителами к D-димеру, исследуемой плазмы. После инкубации вносят меченные ферментом антитела и после остановки реакции производят колориметрическое измерение. Этот метод является трудоемким и занимает много времени для его проведения, а также требует специального оборудования. Данные обстоятельства делают его непрактичным для –рутинного использования в клинической практике.
4. Иммунодиффузия на порозных мембранах
За последние годы были разработаны иммунофер–ментные методы определения D-димера, которые позволяют получать результат в течение 10 минут. В них используются порозные мембраны, покрытые антителами, которые захватывают D-димер. Плазму больного фильт–руют через мембрану и затем к фильтрату добавляют меченные антитела, чтобы определить связанный D-димер.
5. Иммунотурбидиметрия
Одним из вариантов латексного метода определения D-димера является метод микролатексной агглютинации, или иммунотурбидиметрический метод. При добавлении плазмы пациента, содержащей D-димер, к реагенту происходит увеличение оптической плотности раствора, которая прямо пропорциональна концентрации D-димера в исследуемом образце. Коммерческие наборы для определения D-димера разработаны для автоматических анализаторов (биохимических и коагулометров), что позволяет выполнять исследования этого аналита в рутинном режиме.
Два типа единиц измерения D-димера
1. D-Dimer Units (DDU) — для методов, использующих очищенный D-димер в качестве калибратора.
2. Fibrinogen Equivalent Unit (FEU) — фибриногенэквивалентные единицы — для методов, использующих в качестве калибратора ПДФ, образующиеся под действием плазмина.
Размерность единиц указывается производителем теста (нг/мл, мкг/мл, мкг/л).
Референтные значения D-димера
Пороговые значения для D-димера в зависимости от единиц измерения:
1. DDU ≤ 0,25 мкг/мл (250 нг/мл или 250 мкг/л).
2. FEU ≤ 0,5 мкг/мл (500 нг/мл или 500 мкг/л).
Числовые значения легко конвертируются друг в друга, так как масса одной единицы FEU равна половине DDU. Например, 0,5 мкг/мл FEU равно 0,25 мкг/мл DDU.
Если концентрация D-димера в плазме меньше указанных пороговых значений, то наличие тромбоза у пациента можно исключить.
Ограничения при определении D-димера
Тест на D-димер является нестандартизированным маркером. На сегодняшний день известно около 30 коммерческих тест-систем для определения D-димера, между которыми наблюдаются определенные различия, так как каждый производитель устанавливает свой собственный метод стандартизации.
Основными причинами ограничения метода являются:
— использование различных моноклональных антител (более 20), отличающихся по специфичности и чувствительности;
— отсутствие Международного референтного стандарта (International Reference Preparation);
— отсутствие стандартного калибратора;
— различные единицы измерения, используемые для различных методов.
Отсутствие стандартизации различных тест-систем для определения D-димера означает, что результаты, референтные интервалы и значения cut-off не могут быть экстраполированы для различных методов. При количественном измерении D-димера одного и того же пациента различными тест-системами получаются различные результаты, сравнивать которые не корректно.
Причины различий в анализах на D-димер
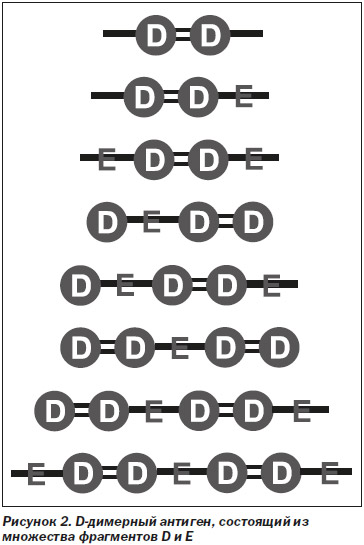
1. D-димерный антиген не является гомогенным, а состоит из соединений, содержащих фрагменты D и Е c различной молекулярной массой (рис. 2).
2. При анализе D-димера используются разные антитела, буферы, измерительная техника, стандарты.
Такая вариабельность в типах и единицах измерения D-димера привела к путанице в некоторых лабораториях, особенно когда необходимо было установить порог значений для исключения венозной тромбоэмболии.
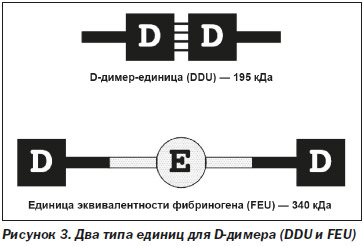
Необходимо помнить, что существует 2 различных типа единиц для D-димера (рис. 3):
1. D-димер-единица — DDU с молекулярной массой 195 кДa.
2. Единица эквивалентности фибриногена — FEU с молекулярной массой 340 кДа.
Поскольку D-димер выражается в массовых единицах, тип вовлеченных единиц очень важен при установлении порога для исключения венозной тромбоэмболии и интерпретации результатов.
Таким образом, методы определения D-димера основаны на его взаимодействии с моноклональными антителами к специфическим эпитопам в D-доменах молекул фибрина. Эти специфические антитела связываются с D-димерами, содержащими D-D-ковалент-ные связи, но не вступают в реакцию с фибриногеном и растворимыми фибрин-мономерами. D-димеры, обнаруживаемые в плазме, — это показатель расщепления фибрина, но не фибриногена и фибрин-мономеров.
Клиническая значимость D-димера
Клиническое применение измерения D-димера показано:
— при исключении венозного тромбоэмболизма (ВТЭ);
— диагностике и мониторинге диссеминированного внутрисосудистого свертывания (ДВС);
— определении длительности антикоагулянтной терапии.
Вопрос использования D-димера остается дискуссионным:
— при прогнозе течения заболеваний сердечно-сосудистой системы;
— прогнозировании неблагоприятных исходов беременности;
— дополнительной оценке риска тромбоэмболии при других патологиях.
1. Венозный тромбоэмболизм
Венозный тромбоэмболизм представляет собой довольно частую патологию, которая объединяет тромбозы глубоких вен и тромбоэмболию легочной артерии. Образование любого тромба в сосудистом русле всегда приводит к активации фибринолиза и появлению в крови продуктов распада фибрина. Чувствительность теста на D-димер в диагностике венозного тромбоэмболизма очень высокая — 90–100 %. Этот анализ может проводиться для подтверждения факта тромбоза. При оценке результатов исследования следует учитывать то, что повышение уровня D-димера в крови только указывает на образование фибрина и его лизис, однако в каком отделе сосудистого русла, в каком объеме и по какой причине это произошло, необходимо решать в каждом конкретном случае с помощью клинических и визуализационных методов (допплер-УЗИ). Уровень D-димера при ТЭЛА практически не зависит от локализации легочного тромба. Тест на D-димер отличается высоким негативным прогностическим уровнем — 97–100 %. Он ценен не столько для подтверждения факта тромбоза, сколько для его исключения. Отрицательный результат анализа практически всегда свидетельствует об отсутствии тромбов в кровеносном русле. Поэтому основной целью исследования D-димера является исключение наличия тромбов в сосудистом русле при дифференциальной диагностике ТГВ и ТЭЛА.
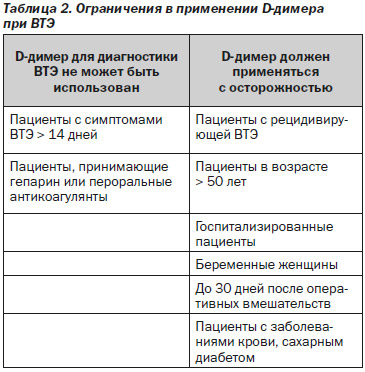
Существуют определенные ограничения в использовании D-димера при ВТЭ [25–27] (табл. 2).
Необходимо отметить, что D-димер может быть отрицательным при ТЭЛА, если сгусток старый (2 недели и более после образования тромба) и если сгусток очень маленький. D-димер может быть ложно повышенным при наличии высокого титра IgM. В случае превышения порогового значения необходимо подтверждение диагноза с помощью допплер-УЗИ, спиральной компьютерной томографии или контрастной венографии. Еще одним стратегическим подходом для диагностики ВТЭ является предварительная оценка по клинико-анамнестическим балльным шкалам (шкала Wells) [28–31].
2. Диссеминированное внутрисосудистое свертывание
Диссеминированное внутрисосудистое свертывание — это распространенная патология с высокой заболеваемостью и смертностью. Характеризуется системной активацией гемостаза с внутрисосудистым образованием фибрина и повышенным фибринолизом [32, 33]. Если пациенты не получают соответствующего лечения, то это приводит к истощению тромбоцитов, факторов свертывания и ингибиторов, результатом чего может быть угрожающее жизни кровотечение и/или тромбоз. ДВС больше всего распространено у пациентов с инфекционными воспалительными заболеваниями, злокачественными новообразованиями, травмами или акушерской патологией. Классификация ДВС разделяет эту патологию на несимптоматическую (преДВС), органную недостаточность, кровотечение и субтипы массивного кровотечения. ISTH (International Society of Thrombosis and Haemostasis) гармонизировало руководство по диагностике и лечению ДВС [34, 35]. Определение уровня D-димера включено в руководство ISTH как рекомендуемый лабораторный тест для оценки пациентов с ДВС-синдромом.
3. Антикоагулянтная терапия
Антикоагулянты непрямого действия
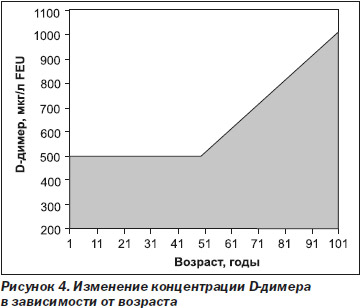
После окончания курса лечения антикоагулянтами непрямого действия (АНД) у пациентов (в том числе пожилых) количественное определение уровня D-димера дает ценную информацию для индивидуальной оценки риска венозного тромбоэмболизма. При использовании статистических методов были определены зависимые от возраста уровни cut-off для D-димера в отношении риска ВТЭ, составляющие при применении различных тест-систем 250–700 мкг/л FEU для пациентов до 70 лет и 450–1000 мкг/л FEU для пациентов старше 70 лет [36] (рис. 4).
Через 30 дней после отмены варфарина нормальный уровень D-димера имел очень высокую отрицательную предсказательную ценность в отношении рецидива ВТЭ, особенно у пациентов с врожденной тромбофилией или впервые развившимся спонтанным тромбозом, а повышенные уровни D-димера соответствовали более высокому риску ВТЭ. При этом отрицательный результат теста на D-димер через 2 недели после окончания 3-месячного курса лечения варфарином был связан с 3,5% риском повторного ВТЭ в течение года, а положительный — с 8,9% риском. Эти данные свидетельствуют о важной роли D-димера в определении оптимальной длительности курса лечения АНД для надежного предупреждения рекуррентных венозных тромбозов.
Гепаринотерапия
Эффективность гепаринотерапии определяется изменением уровня динамики D-димера. Снижение D-димера свидетельствует о правильно подобранной дозе гепарина у пациентов с активацией гемостаза любой этиологии. Тест также информативен при лечении низкомолекулярными гепаринами. Введение клексана в течение 2–3 недель приводит к снижению уровня D-димера в 1,5–2 раза, а 10-дневное применение эноксипарина способствовало снижению уровня этого аналита на 23 %.
4. Сердечно-сосудистая система
Уровни циркулирующего D-димера увеличены у пациентов с коронарной артериальной болезнью, острыми ишемическими событиями, включая инфаркт миокарда и нестабильную стенокардию. У пациентов с грудной болью повышенный уровень D-димера является ранним маркером ишемии коронарных артерий и независимым прогностическим фактором инфаркта миокарда [37]. В исследовании 18 биомаркеров риска ишемической болезни сердца в когорте из более 27 000 женщин в период менопаузы только уровень D-димера был значительно увеличен и являлся независимым от других маркеров фактором риска [38]. В работе R. Marcucci и др. [39] было показано, что содержание D-димеров достоверно выше у больных c хронической сердечной недостаточностью (ХСН) IV функционального класса по сравнению с больными с ХСН II и III функциональных классов. В данном исследовании, в которое включены 214 пациентов с ХСН II–IV функ-циональных классов, убедительно доказано, что повышение D-димеров является значимым предиктором смертности при ХСН.
5. Уровень D-димера при беременности
У беременных женщин вследствие активации синтеза плазменных гемостатических факторов в печени даже в норме наблюдается умеренная тромбофилическая ситуация. К моменту родов уровень D-димера может превышать исходный в 3–4 раза [40] (табл. 3).
Сдвиги параметров гемостаза достигают максимума в 3-м триместре беременности, что имеет физиологическое значение и направлено на уменьшение кровопотери в родах. Положительные результаты D-димера в поздние сроки беременности значительно затрудняют оценку риска и диагностику ТГВ и особенно ТЭЛА. Значительное (в 5–10 раз) повышение уровня D-димера наблюдается при патологиях беременности (привычное невынашивание, гестоз, преждевременная отслойка плаценты). Это приводит к назначению дополнительных диагностических процедур. В таких случаях особое значение приобретает совместное использование УЗИ и анализ на D-димер. Уровень cut-off D-димера в отношении риска венозного тромбоэмболизма у беременных женщин в 3-м триместре оказывается существенно более высоким.
6. Оценка риска тромбоэмболии при других заболеваниях
Повышенные уровни D-димера отмечаются при таких заболеваниях, как доброкачественные и злокачественные опухоли, инфекции, травмы, ишемия, кровотечения или тромбозы. Для многих из этих патологий исследователи пытались использовать уровни D-димера в качестве диагностического и прогностического теста. Например, уровни D-димера изучали как факторы неблагоприятного прогноза и/или риска у пациентов со злокачественными опухолями, желудочно-кишечными кровотечениями и некрозом, внутримозговым кровоизлиянием, серповидноклеточной болезнью, мигренью при сильных головных болях, травме головного мозга, туберкулезе, болезни Кушинга, астме и многих других болезнях. Из всех этих заболеваний наибольший интерес вызвал рак. В целом риск венозного тромбоза у больных раком достигает 7 % из-за протромботического эффекта злокачественных новообразований и связанных с этим факторов риска, таких как иммобилизация, действие лекарственных препаратов и хирургическое вмешательство [41, 42]. В то же время повышенный уровень D-димера у пациентов с раком ограничивает диагностическую ценность результата, если он используется только сам по себе. Многочисленные исследования показали неблагоприятное прогностическое значение повышенных уровней D-димера в плазме у больных раком груди, толстой кишки, легких, яичников, предстательной железы и других органов [43–52].
Заключение
D-димер является надежным и чувствительным тестом на развитие тромбообразования, а увеличение его содержания в плазме крови указывает на наличие тромбов. В клинической практике D-димер используется как маркер способности организма к гиперкоагуляции и эндогенного фибринолиза. Положительный тест на D-димер имеет негативное прогностическое значение для больных с ТГВ и ТЭЛА. Данный тест используется для мониторинга антикоагулянтной терапии и является чувствительным маркером при диагностике ДВС-синдрома. Целесообразно назначать определение D-димера во время беременности для исключения диагноза ТГВ. D-димер играет существенную роль как один из потенциальных маркеров риска развития ишемической болезни сердца. Поэтому D-димер можно рассматривать как один из самых ценных лабораторных тестов для диагностики и мониторинга состояний, связанных с тромбозом.
Список литературы
1. Gaffney P.J. D-dimer. History of the Discovery, Characterisation and Utility of this and other Fibrin Fragments // Fibrinolysis. — l993. — 7 (Suppl. 2). — 2-8.
2. Lowe G.D., Yarnell J.W., Rumley A. et al. C-reactive protein, fibrin D-dimer, and incident ischemic heart disease in the Speedwell Study: are inflammation and fibrin turnover linked in pathogenesis? // Arterioscler. Thromb. Vasc. Biol. — 2001. — 21. — 603-10.
3. Pieper C.F., Rao K.M., Currie M.S. et al. Age, functional status, and racial differences in plasma D-dimer levels in community-dwelling elderly persons // J. Gerontol. Med. Sci. — 2000. — 55. — 649-57.
4. Eichinger S. D-dimer testing in pregnancy // Semin. Vasc. Med. — 2005. — 5(4). — 375-378.
5. Larsen J.F., Ejstrud P., Svendsen F. et al. Randomized study of coagulation and fibrinolysis during and after gasless and conventional laparoscopic cholecystectomy // Br. J. Surg. — 2001. — 88. — 1001-5.
6. Nguyen N.T., Owings J.T., Gosselin R. et al. Systemic coagulation and fibrinolysis after laparoscopic and open gastric bypass // Arch. Surg. — 2001. — 136. — 909-16.
7. Engelman D.T., Gabram S.G.A., Allen L. et al. Hypercoagulability following multiple trauma // World J. Surg. — 1996. — 20. — 5-10.
8. Kobayashi T., Tokunaga N., Sugimura M. et al. Coagulation/fibrinolysis disorder in patients with severe preeclampsia // Semin. Thromb. Hemost. — 1999. — 25. — 451-4.
9. Kobayashi T., Tokunaga N., Sugimura M. et al. Predictive values of coagulation/fibrinolysis parameters for the termination of pregnancy complicated by severe preeclampsia // Semin. Thromb. Hemost. — 2001. — 27. — 137-41.
10. Raimondi P., Bongard O., de Moerloose P. et al. D-dimer plasma concentration in various clinical conditions: Implication for the use of this test in the diagnostic approach of venous thromboembolism // Thromb. Res. — 1993. — 69. — 125-30.
11. Lane D.A., Preston F.E., Van Ross M.E. et al. Characterization of serum fibrinogen and fibrin fragments produced during disseminated intravascular coagulation // Br. J. Haematol. — 1978. — 40. — 609-15.
12. Tomer A., Harker L.A., Kasey S. et al. Thrombogenesis in sickle cell disease // J. Lab. Clin. Med. — 2001. — 137. — 398-407.
13. Di Nisio M., Squizzato A., Rutjes A.W., Buller H.R., Swinderman A.H., Bossuyt P.M. Diagnostic accuracy of D-dimer test for exclusion of venous thromboembolism: a systematic review // J. Thromb. Haemost. — 2007. — 5(2). — 296-304.
14. Acosta S., Nilsson T.K., Björck M. Preliminary study of D-dimer as a possible marker of acute bowel ischaemia // Br. J. Surg. — 2001. — 88. — 385-8.
15. Nakagawa K., Hirai T., Shinokawa N. et al. Relation of fibrillatory wave amplitude with hemostatic abnormality and left atrial appendage dysfunction in patients with chro–nic nonrheumatic atrial fibrillation // Jpn Circ. J. — 2001. — 101. — 13-21.
16. Bayes-Genis A., Mateo J., Santalo M. et al. D-Dimer is an early diagnostic marker of coronary ischemia in patients with chest pain // Am. Heart J. — 2000. — 140. — 379-84.
17. Berge E., Friis P., Sandset P.M. Hemostatic activation in acute ischemic stroke // Thromb. Res. — 2001. — 101. — 13-21.
18. Nina P., Schisano G., Chiapetta F. et al. A study of blood coagulation and fibrinolytic system in spontaneous hemorrhage. Correlation with Hunt-Hess grade and outcome // Surg. Neurol. — 2001. — 55. — 197-203.
19. Koch H.J., Horn M., Bogdahn U., Ickenstein G.W. The relationship between plasma D-dimer concentrations and acute ischemic stroke subtypes // J. Stroke Cerebrovasc. Dis. — 2005. — 14(2). — 75-79.
20. Vreeburg E.M., Levi M., Rauws E.A. et al. Enhanced mucosal fibrinolytic activity in gastroduodenal ulcer hemorrhage and the beneficial effect of acid suppression // Aliment. Pharmacol. Ther. — 2001. — 15. — 639-46.
21. Jimenez Castro D., Perez-Rodriguez E., Montaner L. et al. Diagnostic value of D-dimer in pulmonary embolism and pneumonia // Respiration. — 2001. — 68. — 371-5.
22. Cioni G., Cristani A., Mussini C. et al. Incidence and clinical significance of elevated fibrin(ogen) degradation product and/or D-dimer levels in liver cirrhosis patients // Ital. J. Gastroenterol. — 1990. — 22(4). — 70-74.
23. Noha M., Hiba B. D-dimer Levels in Patients Presenting Chronic Kidney Disease in Sudan // American Journal of Medicine and Medical Sciences. — 2016. — 6(3). — 120-122.
24. Von Kanel R., Bellingrath S., Kudielka B. Association of vital exhaustion and depressive symptoms with changes in fibrin D-dimer to acute psychosocial stress // J. Psychosom. Res. — 2009. — 67(1). — 93-101.
25. Thachil J., Fitzmaurice D.A., Toh C.H. Appropriate use of D-dimer in hospital patients // Am. J. Med. — 2010. — 123(1). — 17-19.
26. Lippi G., Bonfanti L., Saccenti C., Cervellin G. Causes of elevated D-dimer in patients admitted to a large urban emergency department // Eur. J. Intern. Med. — 2014. — 25(1). — 45-48.
27. Spring J.L., Winkler A., Levy J.H. The influence of various patient characteristics on D-dimer concentration in critically ill patients and its role as a prognostic indicator in the intensive care unit setting // Clin. Lab. Med. — 2014. — 34(3). — 675-686.
28. Rodger M.A., Le Gal G., Wells P. et al. Clinical decision rules and D-Dimer in venous thromboembolism: current controversies and future research priorities // Thromb. Res. — 2014. — 134(4). — 763-768.
29. Streiff M.B. Predicting the risk of recurrent venous thromboembolism (VTE) // J. Thromb. Thrombolysis. — 2015. — 39(3). — 353-366.
30. Sartori M., Cosmi B., Legnani C. et al. The Wells rule and D-dimer for the diagnosis of isolated distal deep vein thrombosis // J. Thromb. Haemost. — 2012. — 10(11). — 2264-2269.
31. Novielli N., Sutton A.J., Cooper N.J. Meta-analysis of the accuracy of two diagnostic tests used in combination: application to the ddimer test and the wells score for the diagnosis of deep vein thrombosis // Value Health. — 2013. — 16(4). — 619-628.
32. Levi M. Diagnosis and treatment of disseminated intravascular coagulation // Int. J. Lab. Hematol. — 2014. — 36(3). — 228-236.
33. Wada H., Matsumoto T., Aota T., Yamashita Y. Progress in diagnosis and treatment for disseminated intravascu-lar coagulation // Rinsho Ketsueki. — 2015. — 56(2). — 169-176.
34. Wada H., Thachil J., Di Nisio M. et al. Harmonized guidance for disseminated intravascular coagulation from the International Society on Thrombosis and Haemostasis and the current status of anticoagulant therapy in Japan: a rebuttal // J. Thromb. Haemost. — 2013. — 11(11). — 2078-2079.
35. Wada H., Matsumoto T., Yamashita Y. Diagnosis and treatment of disseminated intravascular coagulation (DIC) according to four DIC guidelines // J. Intensive Care. — 2014. — 2(1). — 15.
36. Lippi G., Favaloro E.J., Cervellin G. A review of the value of D-Dimer testing for prediction of recurrent venous thromboembolism with increasing age // Semin. Throm. Hemost. — 2014. — 40(6). — 634-639.
37. Koenig W., Rothenbacher D., Hoffmeister A., Griesshammer M., Brenner H. Plasma fibrin D-dimer levels and risk of stable coronary artery disease: results of a large case-control study // Arterioscler. Thromb. Vasc. Biol. — 2001. — 21(10). — 1701-1705.
38. Kim H.C., Greenland P., Rossouw J.E. et al. Multimarker prediction of coronary heart disease risk: the Women’s Health Initiative // J. Am. Coll. Cardiol. — 2010. — 55(19). — 2080-2091.
39. Marcucci R., Gori A. et al. Markers of hypercoagulability and infl ammation predict mortality in patients with heart failure // Ibid. — 2006. — Vol. 4. — P. 1017-1022.
40. Abbassi-Ghanavati M., Greer L.G., Cunningham F.G. Pregnancy and laboratory studies: a reference table for clinicians // Obstet. Gynecol. — 2009 Dec. — 114(6). — 1326-31.
41. Arora M., Wun T. Adverse impact of venous thromboembolism on patients with cancer // Semin. Thromb. Hemost. — 2014. — 40(3). — 313-318.
42. Stricker H. Venous thromboembolism and cancer: pathophysiology and incidence // Vasa. — 2014. — 43(4). — 239-243.
43. Blackwell K., Hurwitz H., Liebérman G. et al. Circulating D-dimer levels are better predictors of overall survival and disease progression than carcinoembryonic antigen levels in patients with metastatic colorectal carcinoma // Cancer. — 2004. — 101(1). — 77-82.
44. Kilic M., Yoldas O., Keskek M. et al. Prognostic value of plasma D-dimer levels in patients with colorectal cancer // Colorectal Dis. — 2008. — 10(3). — 238-241.
45. Khoury J.D., Adcock D.M., Chan F. et al. Increases in quantitative D-dimer levels correlate with progressive disease better than circulating tumor cell counts in patients with refractory prostate cancer // Am. J. Clin. Pathol. — 2010. — 134(6). — 964-969.
46. Ay C., Dunkler D., Pirker R. et al. High D-dimer levels are associated with poor prognosis in cancer patients // Haematologica. — 2012. — 97(8). — 1158-1164.
47. Yamamoto M., Yoshinaga K., Matsuyama A. et al. Plasma D-dimer level as a mortality predictor in patients with advanced or recurrent colorectal cancer // Onco–logy. — 2012. — 83(1). — 10-15.
48. Liu L., Zhang X., Yan B. et al. Elevated plasma D-dimer levels correlate with long term survival of gastric cancer patients // PLoS One. — 2014. — 9(3). — 90547.
49. Zhang X., Liu Z.Q., Zhang W., Xu Q. A retrospective analysis of plasma Ddimer dynamic variation in terminal stage cancer patients: implications for disease progression // Int. J. Clin. Exp. Med. — 2014. — 7(8). — 2395-2401.
50. Sakurai M., Satoh T., Matsumoto K. et al. High pretreatment plasma D-dimer levels are associated with poor prognosis in patients with ovarian cancer independently of venous thromboembolism and tumor extension // Int. J. Gynecol. Cancer. — 2015. — 25(4). — 593-598.
51. Wang Y., Wang Z. Predictive value of plasma D-dimer levels in patients with advanced non-small-cell lung cancer // Onco Targets Ther. — 2015. — 8. — 805-808.
52. Fukumoto K., Taniguchi T., Usami N. et al. The preoperative plasma D-dimer level is an independent prognostic factor in patients with completely resected non-small cell lung cancer // Surg. Today. — 2015. — 45(1). — 63-67.