Газета «Новости медицины и фармации» Акушерство и гинекология (620) 2017 (тематический номер)
Вернуться к номеру
Нормальные и специфические иммуноглобулины: насколько клинически важны преимущества специфических иммуноглобулинов к распространенным антигенам?
Авторы: Мальцев Д.В.
Институт экспериментальной и клинической медицины НМУ имени А.А. Богомольца, г. Киев, Украина
Рубрики: Акушерство и гинекология
Разделы: Справочник специалиста
Версия для печати
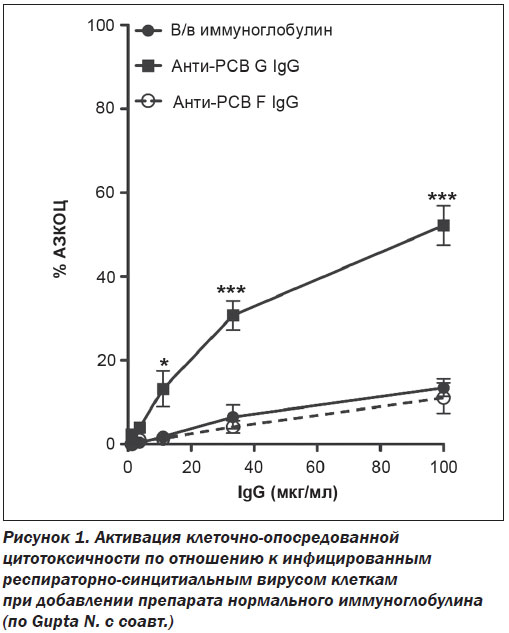
Препараты иммуноглобулинов занимают важное место в современной терапии благодаря хорошо известным антимикробным, противовоспалительным, иммуномодулирующим и иммунозаместительным эффектам [1]. Антимикробные свойства иммуноглобулинов обеспечиваются как прямыми воздействиями, такими как нейтрализация, иммобилизация, агглютинация, преципитация и кэппинг, так и некоторыми непрямыми эффектами, прежде всего — индукцией иммунного фагоцитоза, активацией системы комплемента по классическому пути и реализацией реакций антителозависимой клеточно-опосредованной цитотоксичности. Эти воздействия специфичны, так как основываются на комплементарном взаимодействии между антигенраспознающими сайтами антител и эпитопами антигенов. Прямые нейтрализирующие эффекты в/в нормального иммуноглобулина хорошо продемонстрированы по отношению к экзотоксинам метициллинрезистентного золотистого стафилококка, таким как альфа-гемолизин и лейкоцидин пантона- валентина. На модели кроликов было показано, что мутантные штаммы микроорганизма, нокаутированные по генам указанных экзотоксинов, утратили чувствительность к в/в иммуноглобулину [6]. Непрямые эффекты препаратов иммуноглобулинов, такие как усиление фагоцитарной активности или индукция опсонофагоцитоза, детально охарактеризованы по отношению к гноеродной стрептококковой инфекции [15]. N. Gupta с соавт. показали, что высокоаффинные очищенные IgG к респираторно-синцитиальному вирусу, содержащиеся в препаратах нормального иммуноглобулина, активируют реакции антителозависимой клеточно-опосредованной цитотоксичности, приводящие к апоптотической или некротической гибели меченных антителами инфицированных клеток (рис. 1) [11].
Как известно, различают препараты нормальных иммуноглобулинов, которые содержат антитела различной специфичности, отражающие гуморальный популяционный иммунитет, и специфические иммуноглобулины, которые также содержат полиспецифический набор антител из крови здоровых доноров, но гипериммунизированы к определенному целевому антигену. Гипотетически представляется очевидным, что гипериммунные иммуноглобулины имеют определенные клинические преимущества по сравнению с нормальными при лечении инфекционных заболеваний, однако в реальности наблюдается прямо противоположная тенденция — сокращение количества выпускаемых специфических иммуноглобулинов и уменьшение количества показаний к их применению, поддерживаемых доказательной медициной, на фоне постоянно расширяющегося использования препаратов нормальных иммуноглобулинов человека. Данная статья призвана объяснить причины сложившейся тенденции в современной иммуноглобулинотерапии и определить ниши клинического применения препаратов гипериммунных иммуноглобулинов.
Необходимо понимать, что антигены бывают убиквитарными, или повсеместно распространенными, редкими, что чаще всего связано с антропонозным фактором, т.е. осуществлением антиэпидемических мероприятий, и уникальными, или эндемическими, с которыми контактируют лишь пациенты отдельных географических зон. Иммунитет к убиквитарным микроорганизмам является облигатным компонентом видового иммунитета, тогда как антитела к эндемическим патогенам содержатся в сыворотке крови только представителей отдельных популяций, проживающих на ограниченных территориях распространения инфекции/инвазии. Примерами убиквитарных микроорганизмов могут быть стафило- и стрептококки, кишечная палочка, вирусы семейства герпеса, токсоплазма, вирусы гриппа. Редкими на данный момент являются возбудители чумы, туляремии, холеры, полиомиелита и др. К эндемическим микробам относят вирусы клещевого дальневосточного энцефалита, японского энцефалита, возбудителей малярии, бабезиоза и др. В препаратах нормального иммуноглобулина обычно содержится достаточно большое количество специфических антител к убиквитарным патогенам, поскольку почти все доноры имеют протективный гуморальный иммунитет к таким антигенам на момент сдачи крови для производства иммунобиологического препарата, тогда как наличие антител к редким микроорганизмам представляется сомнительным (если не проводится соответствующая вакцинация в национальном масштабе) ввиду отсутствия естественного контакта с ними в современных условиях, а содержание антител к тем или иным эндемическим микробам зависит от зон проживания доноров, задействованных для получения иммуноглобулина. Нормальные иммуноглобулины, произведенные в разных странах, обычно имеют сходный состав по специфичности антител. Различия в специфичности между ними в основном обусловлены иммунитетом к эндемическим микроорганизмам и несоответствиями в национальных программах искусственной иммунизации.
Таким образом, нормальные иммуноглобулины — это в определенной мере специфические иммуноглобулины к убиквитарным антигенам. Этот тезис многократно подтвержден положительными результатами клинических исследований препаратов нормальных иммуноглобулинов при разнообразных инфекциях, например вызванных стрептококками, цитомегаловирусом, вирусами гриппа, ветряной оспы, простого герпеса, краснухи и др. Так, J.C. Redman с соавт. в двойном слепом плацебо-контролируемом клиническом исследовании показали эффективность местного интрадермального введения нормального иммуноглобулина человека при тяжелом лабиальном герпесе, вызванном простым вирусом 1-го типа [25]. В небольшом конт–-
ролируемом клиническом исследовании продемонстрирована польза от местной иммуноглобулинотерапии нормальным препаратом при опоясывающем герпесе у людей [2]. Результаты классического конт–ролируемого клинического исследования E.E. Petersen с соавт. показали эффективность нормального иммуноглобулина для профилактики краснухи у людей [22]. R.E. Du Bois установил способность нормального иммуноглобулина человека подавлять репродукцию возбудителя при хронической активной Эпштейна — Барр вирусной инфекции [7]. В недавнем исследовании S. Rockman с соавт. выявили способность нормального иммуноглобулина человека снижать вирусную нагрузку в легких, вызванную пандемическим штаммом вируса гриппа H1N1 [26].
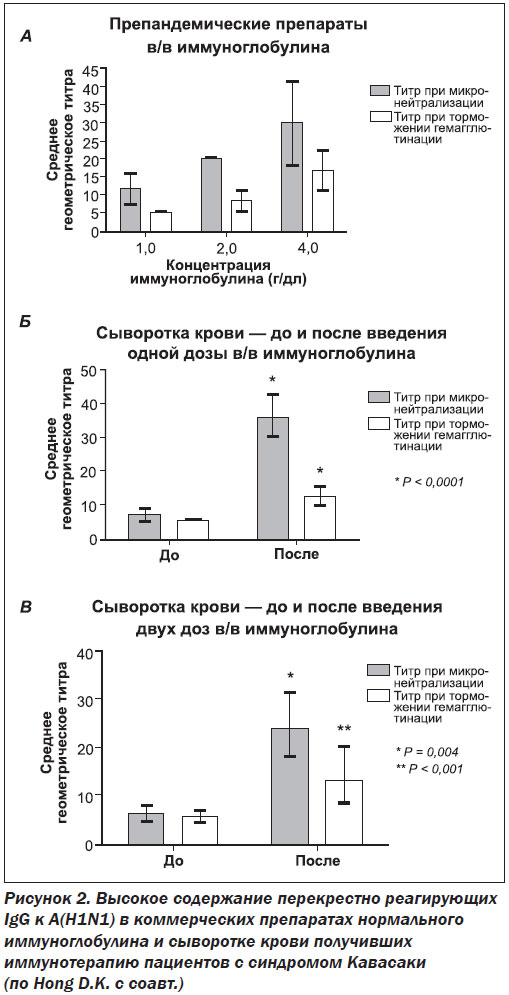
Кроме этого, при первичных и вторичных гуморальных иммунодефицитах достаточно использовать нормальный иммуноглобулин с заместительной целью для восстановления контроля над разнообразными условно-патогенными и оппортунистическими инфекциями. Действительно, при болезни Брутона, общем вариабельном иммунодефиците, изолированных дефицитах субклассов IgG, согласно результатам конт–ролируемых клинических исследований, применяют именно нормальные, а не специфические препараты иммуноглобулинов для предупреждения и лечения ассоциированных бактериальных, вирусных и грибковых инфекций. Так, R.M. Simão-Gurge с соавт. в специально спланированном исследовании обнаружили протективные сывороточные уровни IgG к Streptococcus pneumoniae у пациентов с первичными гуморальными иммунодефицитами (общим вариабельным иммунодефицитом, Х-сцепленной агаммаглобулинемией, гипер-IgM-синдромом), регулярно получающих заместительную иммунотерапию препаратами нормального в/в иммуноглобулина человека [30]. Обескураживающими для сторонников препаратов специфических иммуноглобулинов могут показаться результаты исследования I. Chua с соавт., которые показывают, что достижение высокого титра патогенспецифических антител в сыворотке крови не предоставляет дополнительной выгоды по сравнению с достижением целевого уровня общего IgG в плане профилактики инфекционных эпизодов у пациентов с общим вариабельным иммунодефицитом, получающих заместительную иммуноглобулинотерапию [5]. Частично этот феномен можно объяснить наличием перекрестно реагирующих антител, которые могут связывать не один, а несколько различных антигенов с гомологичными по структуре эпитопами, что в некоторой степени нивелирует эффект специфичности. Такую перекрестную реактивность продемонстрировали S. Jegaskanda с соавт. в специально спланированном исследовании. Авторы показали, что специфические антитела к вирусу гриппа человека A(H1N1), находящиеся в препарате нормального иммуноглобулина, могут эффективно связывать птичьи вирусы A(H5N1) и A(H7N9) и широкий спектр вирусов гриппа человека с отличным антигенным паттерном, запуская реакцию антителозависимой клеточно-опосредованной цитотоксичности [14]. Как показали D.K. Hong с соавт., в сыворотке у 18 из 19 пациентов с синдромом Кавасаки, получивших препандемический нормальный иммуноглобулин для подавления аутоагрессии, появился протективный титр антител к пандемическому вирусу гриппа 2009 года A(H1N1), который был сформирован перекрестно реагирующими антителами к другим, ранее циркулирующим штаммам вируса (рис. 2) [12]. Также описаны условия трансформации специфических антител в полиреактивные иммуноглобулины, способные распознавать различные антигенные детерминанты, что также может объяснить полученные данные о прерогативе общего пула IgG у пациентов с гуморальными иммунодефицитами [3]. Кроме этого, следует учитывать наличие так называемых нормальных (естественных) полиреактивных антител, способных осуществлять шаблонное, а не специфическое распознавание мишеней.
Так же обстоят дела и при вторичных гуморальных иммунодефицитах — гипоиммуноглобулинемии у реципиентов аллогенного костного мозга, при хроническом лимфолейкозе, В-клеточных лимфомах, множественной миеломе, макроглобулинемии Вальденстрема. Более того, даже при селективном дефиците антиполисахаридных антител, так называемом дефиците специфических антител без гипоиммуноглобулинемии, также успешно апробированы и вошли в международные рекомендации именно препараты нормальных иммуноглобулинов, а гипериммунные иммуноглобулины против полисахаридов бактерий так и не были внедрены в широкую клиническую практику.
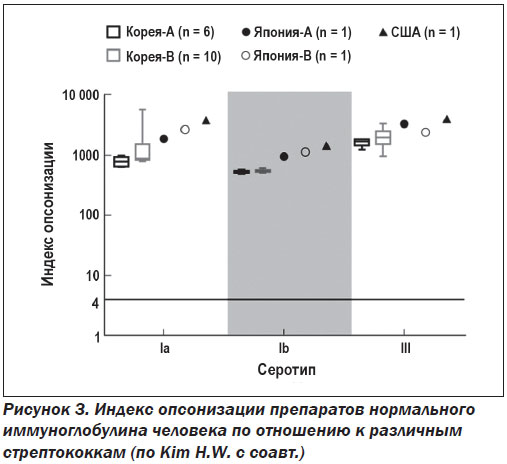
Эффективность нормальных иммуноглобулинов при инфекционных болезнях объясняют большим содержанием специфических антител к распространенным микроорганизмам. Этот феномен многократно подтвержден в соответствующих исследованиях. H.W. Kim с соавт. продемонстрировали наличие высокого титра специфических антител к стрептококкам Ia, Ib и III групп, опосредующих эффективный опсонофагоцитоз, в зарегистрированных препаратах нормальных иммуноглобулинов человека различных производителей (рис. 3) [15]. Как показали S. Lee с соавт., в большинстве препаратов в/в нормального иммуноглобулина содержится достаточное количество специфических IgG к таким условно-патогенным микроорганизмам, как Haemophilus influenzae типа B, Neisseria meningitidis и Streptococcus pneumoniae, для осуществления надлежащего профилактического и лечебного эффекта [16]. Y. Takahashi с соавт. показали одинаковый прирост специфических антител в сыворотке крови людей после вакцинации 13-валентной антипневмококковой вакциной и применения в/в нормального иммуноглобулина человека. Отличалась лишь динамика нарастания титра антител и длительность сохранения иммунитета [31].
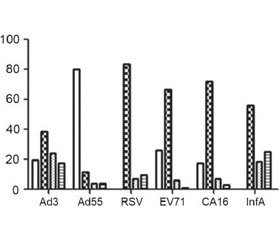
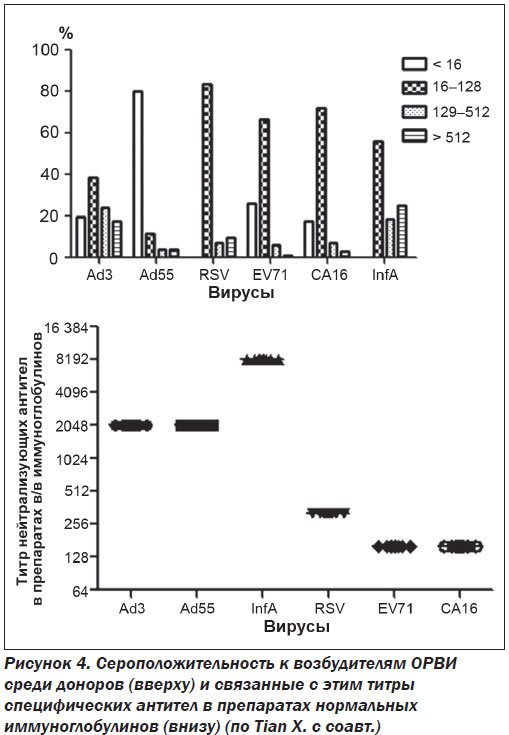
X. Tian с соавт. в специально спланированном исследовании показали достаточно высокий титр специфических антител к вирусу гриппа А и аденовирусу 3-го типа в препаратах нормального иммуноглобулина человека, однако малое содержание IgG к энтеровирусам и респираторно-синцитиальному вирусу. Продемонстрировано, что высокие титры специфических антител были связаны с иммунной памятью к возбудителям респираторных вирусных инфекций у здоровых доноров, чью плазму использовали для производства нормального иммуноглобулина (рис. 4) [32].
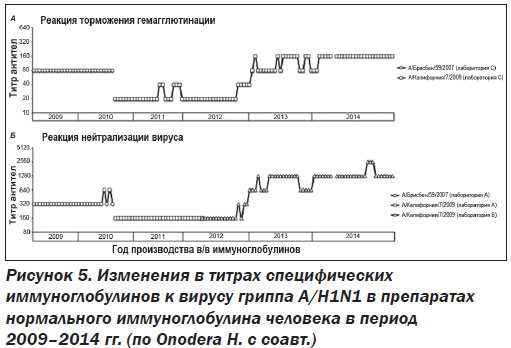
Как известно, нормальный иммуноглобулин человека показан для лечения рецидивирующего энтероколита, вызванного Clostridium difficile. O.H. Negm с соавт. продемонстрировали наличие высокого протективного титра специфических иммуноглобулинов против Clostridium difficile в коммерческих препаратах нормального в/в иммуноглобулина, а также соответствующее повышение титра этих антител в крови пациентов, получивших иммунотерапию [19]. H. Onodera с соавт. в специально спланированном исследовании изучили состав коммерческих препаратов нормального иммуноглобулина человека, произведенных с 1999 по 2014 год включительно. Показано достаточно большое содержание нейтрализующих антител к сезонным в 2015–2016 годах вирусам гриппа A/H1N1, A/H3N2 и B c возрастанием в последние годы, что указывает на универсальность противовирусного эффекта нормальных иммуноглобулинов человека (рис. 5) [20].
Учитывая вышесказанное, легче можно понять неединичные сообщения о сероконверсии к различным инфекционным возбудителям после курса терапии нормальным иммуноглобулином, как, например, доложили V. Luyasu с соавт. по отношению к Borrelia burgdorferi [17]. Считают, что серологические тесты могут давать псевдоположительные результаты даже на протяжении первого полугодия после прекращения иммунотерапии.
Препараты специфических антител представляются как гипериммунные нормальные иммуноглобулины. Если искусственное повышение титра антител к эндемическим или редким микроорганизмам выглядит обоснованным, то повышение и без того высокого содержания иммуноглобулинов к повсеместно распространенным патогенам до сих пор является предметом жарких дискуссий в научных кругах. На данный момент накоплено слишком мало доказательств клинического преимущества препаратов специфических иммуноглобулинов, так как по всем апробированным показаниям к назначению специфических биосимиляров аналогичную эффективность продемонстрировали и нормальные препараты. Так, препарат гипериммунного иммуноглобулина к цитомегаловирусу рекомендуют применять для профилактики цитомегаловирусной инфекции плода во время беременности у сероотрицательных женщин. В то же время E. Polilli с соавт. в контролируемом клиническом исследовании продемонстрировали аналогичную клиническую эффективность препарата нормального иммуноглобулина человека. Авторы пришли к выводу, что нормальный иммуноглобулин эффективен при первичной цитомегаловирусной инфекции у беременных, так как содержит большое количество специфических антител к вирусу в своем составе, полученных от здоровых доноров, которые обычно естественным путем иммунизируются к вирусу в раннем детстве, еще до достижения пятилетнего возраста [23]. M.S. Schampera c соавт. сравнили содержание и функциональную активность специфических IgG к цитомегаловирусу в препарате гипериммунного иммуноглобулина и нескольких брендах нормального иммуноглобулина человека в контролируемом клиническом исследовании. В качестве контроля были использованы сыворотки сероположительных беременных с протективным титром специфических к вирусу антител, которые предотвратили трансплацентарный трансфер цитомегаловируса во время беременности. Показано, что содержание функционально активных специфических IgG было одинаковым у препаратов гипериммунного и нормального иммуноглобулина и соответствовало таковому в сыворотке крови сероположительных беременных. Однако функциональная активность специфических иммуноглобулинов in vitro парадоксально оказалась более высокой у нормальных препаратов по сравнению с гипериммунным иммуноглобулином [28].
Еще одним показанием к назначению гипериммунного иммуноглобулина к цитомегаловирусу является профилактика цитомегаловирусной инфекции и ассоциированной реакции отторжения трансплантата у сероотрицательных реципиентов, получивших аллогенный орган от сероположительных доноров. P. Zikos с соавт. провели рандомизированное контролируемое клиническое исследование в/в имуноглобулинотерапии для профилактики CMV-инфекции у реципиентов аллогенного костного мозга. Одна группа пациентов получала специфический иммуноглобулин для в/в введения в дозе 100 мг/кг (n = 64), а другая — поливалент-ный нормальный иммуноглобулин в дозе 600 мг/кг
(n = 64) с –7-го до +100-го дня трансплантации. Показано, что оба терапевтических подхода одинаково эффективны для профилактики CMV-инфекции и реакции «трансплантат против хозяина», однако отличаются по стоимости [33]. Тем не менее сравнительное исследование S.M. Miescher с соавт. указывает на более высокую нейтрализующую активность по отношению к цитомегаловирусу in vitro у гипериммунного препарата по сравнению с нормальным иммуноглобулином, хотя в ходе исследования не была продемонстрирована клиническая значимость такого преимущества [18]. Данные сравнительного исследования Germer с соавт. также указывают на преимущество специфического иммуноглобулина против цитомегаловируса перед нормальным препаратом по нейтрализующей активности и спектру раcпознаваемых антигенных детерминант вируса, однако, как и в предыдущем случае, остались недоказанными клинические преимущества, например меньшая смертность или более низкая частота реактиваций возбудителя [9]. Тем не менее результаты сравнительного исследования A. Gratwohl с соавт. среди реципиентов аллогенного костного мозга продемонстрировали больший прирост общего пула IgG и специфических IgG1 и IgG2 к цитомегаловирусу в сыворотке крови пациентов при введении нормального иммуноглобулина по сравнению с гипериммунным препаратом. Кроме того, нормальный иммуноглобулин обеспечивал увеличение пула антител к карбогидратному антигену и липополисахаридам стрептококков группы А, что предоставляло дополнительное преимущество и чего вовсе был лишен специфический иммуноглобулин к цитомегаловирусу [10].
Антирезусный специфический иммуноглобулин применяется для профилактики гемолитической болезни плода и новорожденного у резус-отрицательных женщин. S. Isojima с соавт. показали, что нормальный иммуноглобулин человека может быть эффективен в профилактике и лечении гемолитической болезни плода при неэффективности специфического биосимиляра [13]. K.V. Sheth с соавт. сравнили ингибирующую активность 4 брендов нормального иммуноглобулина (сандоглобулин, интраглобин, гаммонатив, гаммагард) по отношению к Fс-рецепторному фагоцитозу покрытых анти-Rh(D)-антителами эритроцитов, показав аналогичные высокие результаты во всех случаях — соответственно 45 ± 14 SD, 41 ± 23 SD, 35 ± 14 SD,
25 ± 13 SD [29]. Исходя из текущей доказательной базы, препараты специфического антирезусного иммуноглобулина используются для профилактики резус-конфликта, а нормального иммуноглобулина — для лечения гемолитической болезни плода и новорожденного, хотя известна перекрестная эффективность обеих групп препаратов.
Неожиданными могут показаться факты выявления высокого титра антител к редким или эндемическим возбудителям в препаратах нормального иммуноглобулина. Так, J. Elsterova с соавт. установили достаточно большое содержание специфических IgG к вирусу клещевого энцефалита в некоторых сериях препаратов нормального иммуноглобулина человека, а также показали способность таких препаратов подавлять развитие нейроинфекции у мышей. Не отмечалось признаков наличия перекрестно реагирующих антител в препаратах [8]. Появление специфических иммуноглобулинов может быть связано с сезонностью забора крови и выборками доноров из эндемических районов, но может отражать и более обширный феномен — наличие большого количества малосимптомных и инаппарантных форм инфекции, создающих широкую иммунную прослойку среди населения. В противном случае нормальный препарат не будет эффективен при редкой инфекции, и необходимо будет использовать гипериммунный биосимиляр. Так, A. Rayamajhi с соавт. недавно провели двойное слепое плацебо-контролируемое клиническое исследование, в котором показали, что специальный препарат в/в иммуноглобулина, обогащенный специфическими нейтрализующими антителами, эффективен в лечении японского энцефалита у людей [24].
Гипериммунизация сопряжена с некоторым снижением иммуномодулирующих эффектов препарата, а клинический эффект иммуноглобулинов, как известно, связан не только с прямым антимикробным воздействием антител, определяемым специфичностью, но и с рядом важных непрямых эффектов, таких как иммунозамещение (при развитии инфекции на фоне гуморального иммунодефицита) и иммуномодуляция, ассоциированная с усилением иммунорезистентности. Иногда иммуномодуляция не менее важна, чем осуществление прямого противомикробного эффекта. Например, у реципиентов аллогенной почки необходимо проводить профилактику цитомегаловирусной инфекции, однако полезен и иммуномодулирующий эффект иммуноглобулина, приводящий к снижению риска развития иммунных реакций отторжения транс-плантата. Так, M.N. Peraldi с соавт. провели рандомизированное контролируемое клиническое исследование с участием 41 пациента, в котором показали, что курс высокодозовой в/в иммуноглобулинотерапии нормальным препаратом в дозе 2 г/кг (5 дней подряд по 500 мг/кг/день), проведенный сразу после повторной пересадки аллогенной почки, оказывает долгосрочный положительный эффект в плане десенсибилизации к антигенам системы HLA с улучшением 5-летней выживаемости пациентов [21]. Хотя были предприняты попытки продемонстрировать иммуномодулирующие эффекты специфических препаратов, на данный момент мы имеем небольшую доказательную базу клинически значимой иммуномодуляции при использовании гипериммунных иммуноглобулинов. Так,
J. Carbone с соавт. показали способность специфического антицитомегаловирусного иммуноглобулина приводить к активации СD4+CD38+DR+-Т-лимфоцитов и CD19+CD27–IgM+IgD+ наивных В-клеток у реципиентов аллогенного сердца, уменьшая тем самым тяжесть вторичного иммунодефицита [4].
Кроме того, гипериммунные препараты оказывают более слабый иммунозаместительный эффект у пациентов с гуморальными иммунодефицитами по сравнению с препаратами нормальных иммуноглобулинов, а на клинические исходы во многих ситуациях может в значительной мере влиять иммунный статус пациента. Так, E. Sarmiento с соавт. в контролируемом клиническом исследовании изучили эффективность в/в иммуноглобулинотерапии у реципиентов аллогенного сердца со вторичной гипоиммуноглобулинемией. Препарат нормального 5% в/в иммуноглобулина вводили по схеме: первые 2 введения в дозе 200 мг/кг на 0-е и 14-е сутки исследования, а затем в дозе 300 мг/кг на 30, 60, 90, 120 и 150-е сутки, если сывороточная концентрация IgG была ниже уровня 7,5 г/л. Показано, что коррекция вторичной гипоиммуноглобулинемии обеспечила уменьшение количества случаев тяжелых бактериальных, грибковых инфекций и эпизодов реактивации цитомегаловируса (22,2 % в группе иммуноглобулина и 66,6 % в контрольной группе с персистирующей гипоиммуноглобулинемией, р = 0,15). Повторные госпитализации и пролонгированные курсы стационарного лечения чаще отмечались именно в группе контроля. Выживаемость на протяжении 6 месяцев наблюдения была одинаковой в обеих группах, что, по-видимому, было связано с неоднократным дополнительным приемом антимикробных химиопрепаратов в группе конт–роля. Серьезных побочных эффектов в/в иммуноглобулина зарегистрировано не было. Гуморальные реакции отторжения трансплантата совсем не развивались у пациентов, принимающих иммунотерапию, хотя таковые регистрировались у некоторых лиц группы контроля, что требовало увеличения дозы иммуносупрессивных лекарств [27].
Специфические препараты обычно дороже, чем нормальные, что связано со сложностью их получения, и имеют меньший коммерческий потенциал из-за узости клинических показаний. Поэтому многие мировые фармацевтические компании уже сняли с производства или, по крайней мере, сократили линейку специфических иммуноглобулинов, а некоторые формы специфических препаратов, продемонстрировав обнадеживающие предварительные результаты, так и не были внедрены в широкую клиническую практику.
Таким образом, препараты нормальных и специфических иммуноглобулинов имеют перекрестные свойства, так как нормальные аналоги содержат большое количество специфических антител к убиквитарным антигенам от иммунизированных доноров, а гипериммунные биосимиляры оказывают иммунозаместительное и иммуномодулирующее действие за счет базисного пула поливалентных антител в препарате. На данный момент препараты нормальных иммуноглобулинов, обладая сходной клинической эффективностью, но более высокой доказательной базой, широким терапевтическим потенциалом и низкой ценой, вытеснили специфические препараты в отдельные терапевтические ниши. Так, FDA одобрила применение специфического иммуноглобулина против вируса варицелла зостер с целью экстренной постконтактной профилактики инфекции у сероотрицательных лиц из групп риска на протяжении первых 10 дней после вероятного заражения. Тем не менее профилактику кори, краснухи и вирусного гепатита А рекомендуют проводить нормальным иммуноглобулином человека для в/м введения. Антирезусный иммуноглобулин рутинно применяют для профилактики резус-конфликта при последующей беременности у резус-отрицательных женщин с резус-положительным плодом. Антицитомегаловирусный иммуноглобулин не зарегистрирован FDA, поскольку имеет меньшую доказательную базу эффективности из-за ряда контрверсионных результатов исследований. Однако во многих авторитетных клинических центрах этот препарат используют у сероотрицательных беременных для профилактики внутриутробной цитомегаловирусной инфекции плода и реципиентов аллогенных органов для предотвращения эпизодов реактивированной инфекции и реакции отторжения трансплантата. В других случаях, к сожалению, пока еще нет убедительных оснований считать гипериммунные иммуноглобулины более эффективными, чем нормальные препараты, изготовленные согласно со–временным фармакопейным требованиям. Основываясь на результатах фундаментальных исследований и здравом смысле, можно предположить, что специфические иммуноглобулины должны иметь определенные клинические преимущества перед нормальными препаратами не только при редких или эндемических, но и при убиквитарных антигенах, поскольку могут обеспечить лучшую прицельность действия, однако эти выгоды должны быть надлежащим образом продемонстрированы в рационально спланированных клинических исследованиях, прежде чем соответствующие терапевтические стратегии смогут быть обоснованно рекомендованы для рутинной практики. А пока будет сохраняться существующая атмосфера неопределенности, мы все так же будем оставаться свидетелями постепенного сокращения клинических показаний к применению специфических иммуноглобулинов человека.
Список литературы
1. Казмирчук В.Е., Мальцев Д.В. Иммуноглобулинотерапия: эффективность и безопасность // Клиническая иммунология, аллергология, инфектология. — 2009. — № 10. — С. 30-38.
2. Мальцев Д.В., Казмирчук В.Е. Местная иммуноглобулинотерапия опоясывающего герпеса // Новости медицины и фармации. — 2007. — № 3 (207). — С. 10.
3. Bobrovnik S.A. Transformation of specific antibo-dies to polyreactive immunoglobulins and their binding to blood vessel walls // Ukr. Biokhim. Zh. (1999). — 2002. — Vol. 74(3). — P. 133-141.
4. Carbone J., Gallego A., Fernandez Yañez J. Potential Immunomodulatory Role of Specific Anticytomegalovirus Intravenous Immunoglobulin in Heart Recipients // Transplant. Proc. — 2016. — Vol. 48 (9). — P. 3027-3029.
5. Chua I., Lagos M., Charalambous B.M. et al. Pathogen-specific IgG antibody levels in immunodeficient patients receiving immunoglobulin replacement do not provide additional benefit to therapeutic management over total serum IgG // J. Allergy Clin. Immunol. — 2011. — Vol. 127(6). — P. 1410-1411.
6. Diep B.A., Le V.T., Badiou C. et al. IVIG-mediated protection against necrotizing pneumonia caused by MRSA // Sci. Transl. Med. — 2016. — Vol. 8 (357). — P. 357ra124.
7. DuBois R.E. Gamma globulin therapy for chro–nic mononucleosis syndrome // AIDS Res. — 1986. — Vol. 2(1). — S191-195.
8. Elsterova J., Palus M., Sirmarova J. et al. Tick-borne encephalitis virus neutralization by high dose intravenous immunoglobulin // Ticks Tick Borne Dis. — 2017. — Vol. 8(2). — P. 253-258.
9. Germer M., Herbener P., Schüttrumpf J. et al. Functional Properties of Human Cytomegalovirus Hyperimmunoglobulin and Standard Immunoglobulin Preparations // Ann. Transplant. — 2016. — Vol. 21. — P. 558-564.
10. Gratwohl A., Doran J.E., Bachmann P. et al. Serum concentrations of immunoglobulins and of antibody isotypes in bone marrow transplant recipients treated with high doses of polyspecific immunoglobulin or with cytomegalovirus hyperimmune globulin // Bone Marrow Transplant. — 1991. — Vol. 8 (4). — P. 275-282.
11. Gupta N., LeGoff J., Chamat S. et al. Affinity-purified respiratory syncytial virus antibodies from intravenous immunoglobulin exert potent antibody-dependent cellular cytotoxicity // PLoS One. — 2013. — Vol. 8 (7). — e69390.
12. Hong D.K., Tremoulet A.H., Burns J.C., Lewis D.B. Cross-reactive neutralizing antibody against pandemic 2009 H1N1 influenza a virus in intravenous immunoglobulin preparations // Pediatr. Infect. Dis. J. — 2011. — Vol. 30(1). — P. 67-69.
13. Isojima S., Hisano M., Suzuki T. et al. Early plasmapheres is followed by high-dose γ-globulintreatmentsaved a severelyRho-incompatiblepregnancy // J. Clin. Apher. — 2011. — Vol. 26 (4). — P. 216-218.
14. Jegaskanda S., Vandenberg K., Laurie K.L. et al. Cross-reactive influenza-specific antibody-dependent cellular cytotoxicity in intravenous immunoglobulin as a potential therapeutic against emerging influenza viruses // J. Infect. Dis. — 2014. — Vol. 210 (11). — P. 1811-1822.
15. Kim H.W., Lee J.H., Cho H.K. et al. Opsonophagocytic Antibodies to Serotype Ia, Ib, and III Group B Streptococcus among Korean Infants and in Intravenous Immunoglobulin Products // J. Korean. Med. Sci. — 2017. — Vol. 32 (5). — P. 737-743.
16. Lee S., Kim H.W., Kim K.H. et al. Functional antibodies to Haemophilusinfluenzae type B, Neisseria meningitidis, and Streptococcus pneumoniae contained in intravenous immunoglobulin products // Transfusion. — 2017. — Vol. 57 (1). — P. 157-165.
17. Luyasu V., Mullier S., Bauraind O., Dupuis M. An unusual case of anti-Borreliaburgdorferi immunoglobulin G seroconversion caused by administration of intravenous gammaglobulins // Clin. Microbiol. Infect. — 2001. — Vol. 7 (12). — P. 697-699.
18. Miescher S.M., Huber T.M., Kühne M. et al. In vitro evaluation of cytomegalovirus-specific hyperimmune globulins vs. standard intravenous immunoglobulins // Vox. Sang. — 2015. — Vol. 109 (1). — P. 71-78.
19. Negm O.H., MacKenzie B., Hamed M.R. et al. Protective antibodies against Clostridium difficile are present in intravenous immunoglobulin and are retained in humans following its administration // Clin. Exp. Immunol. — 2017. — Vol. 188 (3). — P. 437-443.
20. Onodera H., Urayama T., Hirota K. et al. Neutra–lizing activities against seasonal influenza viruses in human intravenous immunoglobulin // Biologics. — 2017. — Vol. 11. — P. 23-30.
21. Peraldi M.N., Akposso K., Haymann J.P. et al. Long-term benefit of intravenous immunoglobulins in cadaveric kidney retransplantation // Transplantation. — 1996. — Vol. 62 (11). — P. 1670-1673.
22. Petersen E.E., Neumann-Haefelin D., Heussler M. Rubella in pregnancy: experimental studies on the value of gamma-globulin after rubella wild virus infection // Dtsch. Med. Wochenschr. — 1978. — Vol. 103 (43). — P. 1695-1700.
23. Polilli E., Parruti G., D'Arcangelo F. et al. Preliminary evaluation of the safety and efficacy of standard intravenous immunoglobulins in pregnant women with primary cytomegalovirus infection // Clin.Vaccine Immunol. — 2012. — Vol. 19 (12). — P. 1991-1993.
24. Rayamajhi A., Nightingale S., Bhatta N.K. et al. A preliminary randomized double blind placebo-controlled trial of intravenous immunoglobulin for Japanese ence-phalitis in Nepal // PLoS One. — 2015. — Vol. 10 (4). — e0122608.
25. Redman J.C., Davis L.E., McLaren L.C., Skipper B.J. Intradermal gamma globulin for herpes labialis? Results of a double-blind study // Postgrad Med. — 1986. — Vol. 79 (8). — P. 315-318.
26. Rockman S., Lowther S., Camuglia S. et al. Intravenous Immunoglobulin Protects Against Severe Pandemic Influenza Infection // EBio Medicine. — 2017. — Vol. 19. — P. 119-127.
27. Sarmiento E., Arraya M., Jaramillo M. et al. Intravenous immunoglobulin as an intervention strategy of risk factor modification for prevention of severe infection in heart transplantation // Clin. Exp. Immunol. — 2014. — Vol. 178 (Suppl. 1). — P. 156-158.
28. Schampera M.S., Schweinzer K., Abele H. et al. Comparison of cytomegalovirus (CMV)-specific neutralization capacity of hyperimmunoglobulin (HIG) versus standard intravenous immunoglobulin (IVIG) preparations: Impact of CMV IgG normalization // J. Clin. Virol. — 2017. — Vol. 90. — P. 40-45.
29. Sheth K.V., al-Sedairy S., Lee J. Effectiveness of four intravenous IgG preparations in prevention of phagocytosis of anti-Rh-(D)-coated erythrocytes by mononuclear phagocytes // Vox Sang. — 1993. — Vol. 65(3). — P. 190-193.
30. Simão-Gurge R.M., Costa-Carvalho B.T., Nobre F.A. et al. Prospective evaluation of Streptococcus pneumoniae serum antibodies in patients with primary immunodeficiency on regular intravenous immunoglobulin treatment // Allergol. Immunopathol. (Madr). — 2017. — Vol. 45 (1). — P. 55-62.
31. Takahashi Y., Ishiwada N., Hishiki H. et al. IgG le–vels against 13-valent pneumococcal conjugate vaccine serotypes in non pneumococcal conjugate vaccine immunized healthy Japanese and intravenous immunoglobulin preparations // J. Infect. Chemother. — 2014. — Vol. 20 (12). — P. 794-798.
32. Tian X., Jiang Z,, Ma Q. et al. Prevalence of neutralizing antibodies to common respiratory viruses in intravenous immunoglobulin and in healthy donors in southern China // J. Thorac. Dis. — 2016. — Vol. 8 (5). — P. 803-812.
33. Zikos P., Van Lint M.T., Lamparelli T. et al. A randomized trial of high dose polyvalent intravenous immunoglobulin (HDIgG) vs. Cytomegalovirus (CMV) hyperimmune IgG in allogeneic hemopoietic stem cell transplants (HSCT) // Haematologica. — 1998. — Vol. 83 (2). — P. 132-137.