Ежегодно более чем у 10 млн человек в мире выявляются онкологические заболевания. В настоящее время применение лекарственной циторедуктивной терапии оправданно у 70 % онкологических больных. Проведение современной химиотерапии позволило существенно повысить шансы больных онкологического профиля на выздоровление. Пациенты со злокачественными новообразованиями многих локализаций, которые ранее считались неизлечимыми, сейчас могут рассчитывать на существенный успех в излечении рака. Повышение эффективности современной химиотерапии достигнуто благодаря интенсификации режимов лечения. Однако ее негативным следствием является увеличение количества побочных эффектов противоопухолевых лекарственных средств, в том числе и тромбоцитопения. Наличие осложнений химиотерапии может стать помехой в достижении максимального лечебного действия применяемых режимов. Поэтому вопросы профилактики и своевременного устранения токсических проявлений химиотерапии становятся одними из самых актуальных для онкологов.
При проведении химиотерапии в наибольшей степени страдает костный мозг как орган с высокой репродуктивной способностью гемопоэтических клеток. Миелотоксический эффект проявляется редукцией всех трех ростков миелопоэза (грануломоноцитарного, эритроидного, мегакариоцитарного). Повреждение костного мозга сопровождается снижением содержания числа лейкоцитов, тромбоцитов и эритроцитов периферической крови. Анемизация и тромбоцитопения представляют серьезную клиническую проблему. В большей степени анемизация характерна для пациентов с гематологическими новообразованиями и с такими солидными опухолями, как рак простаты, яичников и легких (Skillings J.R. et al. // Amer. J. Oncol. 1993; 16: 22-7). Тромбоцитопения и связанные с ней геморрагии также нередко осложняют проведение химиотерапии. Они достаточно опасны сами по себе, а при наличии сопутствующей инфекции опасность тромбоцитопении значительно возрастает.
Тромбоцитопения
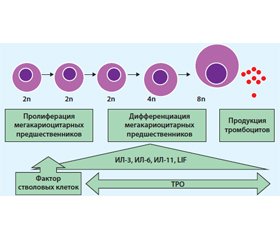
Тромбоциты образуются и появляются в периферической крови в процессе тромбоцитопоэза, в норме составляя от 180 до 320 × 109/л. Образование тромбоцитов осуществляется в костном мозге по мегакариобластическому типу кроветворения. Первой морфологически распознаваемой клеткой этого ряда является мегакариобласт — размером 20 мкм, цитоплазма базофильная, ядро занимает большую часть клетки. Промегакариоцит возникает в результате нескольких эндомитозов. Далее формируется мегакариоцит (60–120 мкм). Тромбоциты формируются в цитоплазме мегакариоцитов и отделяются (отшнуровываются) от них. В результате отшнуровки тромбоцитов ядра мегакариоцитов, лишенные цитоплазмы, распадаются на отдельные фрагменты и удаляются путем фагоцитоза (рис. 1). Тромбоцит представляет собой полиморфное безъядерное цитоплазматическое образование размером 3–4 мкм, окруженное мембраной, имеет центральную зону — грануломер, состоящий из 5–20 азурофильных зерен, и периферическую — гиаломер. При этом происходит 3–5 циклов удвоения хромосом без разделения цитоплазмы. После выхода из костного мозга примерно треть тромбоцитов секвестрируется в селезенке, а оставшиеся две трети 7–10 сут. циркулируют в кровотоке, затем происходит их утилизация ретикулоэндотелиальными клетками селезенки и печени.
/16_m.jpg)
Циркулирующие в крови тромбоциты имеют овальную или округлую форму, гладкую поверхность, активированные — звездчатую форму и нитевидные отростки — псевдоподии. Основная физиологическая роль тромбоцитов — участие в процессах гемостаза — осуществляется благодаря их следующим функциям:
- ангиотрофической — обеспечение жизнеспособности и репарации эндотелиальных клеток («кормильцы» эндотелия) и поддержание нормальной структуры и функции стенок сосудов микроциркуляторного русла;
- адгезивно-агрегационной — участие в первичном гемостазе путем образования тромбоцитарной пробки или белого тромба;
- ангиоспастической — поддержание спазма поврежденных сосудов благодаря образованию серотонина, катехоламинов, В-тромбомодулина;
- коагуляционно-тромбоцитарной — участие в процессах свертывания крови и регуляции фибринолиза — выделение тромбоцитарных факторов;
- репаративной — ростовые факторы тромбоцитов стимулируют размножение и миграцию гладкомышечных клеток и эндотелиоцитов и таким образом участвуют в патогенезе атеросклероза, ишемической болезни сердца, реакции отторжения трансплантата, развитии опухолевых метастазов.
Взаимодействуя с клетками-предшественниками из костного мозга, тромбоциты помогают привлечению их в зоны повреждения сосудов и выделяют большое количество ростовых факторов, влияющих на рост и развитие сосудистой сети (Jurasz P., Santos-Martinez М., Radomska A. et al., 2006; Massberg S., Konrad I., Schurzinger K. et al., 2006).
При уменьшении количества тромбоцитов число, размер и плоидность мегакариоцитов возрастают, что способствует повышению образования тромбоцитов. Этот процесс регулируется тромбопоэтином. Тромбопоэтин стимулирует созревание мегакариоцитов и образование тромбоцитов. Он секретируется постоянно в небольших количествах и связывается с циркулирующими тромбоцитами. Уменьшение общего количества тромбоцитов повышает уровень свободного тромбопоэтина, что стимулирует выработку тромбоцитов. Тромбопоэтин необходим для пролиферации, созревания и окончательной дифференцировки мегакариоцитов. Тромбопоэтин связывается с MPl (CD 110) рецептором на поверхности тромбоцитов и уничтожается. Таким образом уменьшается воздействие тромбопоэтина на мегакариоциты. Следовательно, повышение и понижение концентрации тромбоцитов регулирует уровень тромбопоэтина. Низкий уровень тромбоцитов приводит к увеличению воздействия тромбопоэтина на недифференцированные клетки костного мозга, к дифференцировке и дальнейшему развитию этих клеток. С другой стороны, высокая концентрация тромбоцитов приводит к ингибированию этого воздействия.
Тромбопоэтин, или фактор роста и развития мегакариоцитов, был выделен и получен в рекомбинантной форме как лиганд рецептора MРl в начале 1990-х годов. Рецептор тромбопоэтина также известен как белок миелопролиферативной лейкемии или CD 110 (Cluster of Differentiation 110). Этот цитокин представляет собой полипептид с молекулярной массой 25–31 кД, имеющий некоторое сходство с эритропоэтином: гомологичность первичной структуры составляет 22 % из первых 152 аминокислотных остатков cN-терминала. При добавлении в культуру клеток-предшественников гемопоэза тромбопоэтин вызывает повышение числа колоний мегакариобластов и мегакариоцитов, вследствие чего увеличивается продукция тромбоцитов.
В печени тромбопоэтин производится паренхимными клетками и синусоидальными эндотелиальными клетками; в почках — проксимальными клетками извитых канальцев. Вместе с этим тромбопоэтин производится клетками поперечно-полосатых мышц и стромальными клетками костного мозга. Физиологически именно печень и стромальные клетки костного мозга являются важнейшими участками производства тромбопоэтина. На поверхности мегакариоцитов образовываются тромбоцитарные гранулы и происходит демаркация цитоплазмы на области, которые фрагментируются в зрелые тромбоциты, отделяясь от родительской клетки-мегакариоцита. Начальные этапы дифференцирования тромбоцитов поддерживают интерлейкины ИЛ-3 и ИЛ-5, а отделение тромбоцитов от мегакариоцитов ускоряют ИЛ-6 и ИЛ-11, кроме того, IL-6 приводит к увеличению продукции тромбопоэтина.
Тромбоцитопения — снижение уровня тромбоцитов в крови ниже нормы — отражает общую картину того, в какой степени угнетается кроветворение. Тромбоцитопения составляет проблему не только в онкологии. Содержание тромбоцитов снижено у 5–10 % больных терапевтических отделений и у 30–50 % госпитализированных в отделения реанимации независимо от диагноза.
Тромбоцитопения и дисфункция тромбоцитов, которые наблюдаются при острых гемобластозах, при терминальных бластных кризах хронического миело- и миеломоноцитарного лейкоза, а также при полихимиотерапии, лучевой терапии и последующей трансплантации стволовых клеток костного мозга, являются одной из основных причин развития у больных геморрагического синдрома. Вместе с тем тромбоцитопения — важный компонент таких сложных нарушений гемостаза, как ДВС-синдром и особенно тромботическая тромбоцитопеническая пурпура (ТТП), которые часто осложняют лейкемические процессы.
Генез тромбоцитопении может быть различным, поэтому важно различать ее следующие базисные варианты:
1) гипопродукционные формы, связанные с метаплазией костного мозга, уменьшением в нем общей массы мегакариоцитов. Это нарушение, которое характеризуется амегакариоцитозом костного мозга и выявляется при исследовании трепанатов последнего. Оно может быть обусловлено как самим лейкозным процессом и метаплазией костного мозга, так и вторичной аплазией последнего при интенсивной цитостатической терапии;
2) ретенционные формы, возникающие в связи с повышением депонирования тромбоцитов в увеличенных селезенке и печени, в портальной системе. Чем более увеличены селезенка и печень и чем значительнее симптомы портальной гипертензии или признаки тромбоза печеночных вен (синдром Бадда — Киари), тем более выражена ретенционная тромбоцитопения. Эта форма характеризуется диссоциацией количества тромбоцитов в крови и сосудах портальной системы, где их количество намного превышает таковое в крови, полученной из локтевой вены;
3) тромбоцитопении потребления — формы, связанные либо с развитием острого или подострого ДВС-синдрома, либо тромботическая тромбоцитопеническая пурпура. При этих формах происходит депонирование больших масс функционально наиболее активных тромбоцитов в микроциркуляторном русле, преимущественно в шок-органах, тогда как в циркуляции остаются наименее активные и функционально неполноценные тромбоциты, не способные обеспечивать полноценный гемостаз. Эта тромбоцитопения более выражена и возникает раньше при ТТП, при которой также обнаруживают множество спонтанных агрегатов кровяных пластинок в крови и способность плазмы больных вызывать агрегацию тромбоцитов, выделенных из крови больных. В ряде случаев ТТП возникает вслед за трансплантацией костного мозга, что является серьезным осложнением лечения больных.
При лейкозах наряду с тромбоцитопенией нередко отмечается качественная неполноценность мегакариоцитарно-тромбоцитарного аппарата. В результате такой неполноценности циркулирующие тромбоциты нередко морфологически изменены и утрачивают в той или иной степени свои функциональные свойства. Эти тромбоцитарные нарушения, в свою очередь, способствуют развитию дистрофических процессов в эндотелии (Israels L.J., Israels E.D. Mechanisms in Hematology).
Цитостатические средства позволяют добиваться значительных успехов в лечении ряда злокачественных новообразований. Большинство противоопухолевых средств имеют различные побочные эффекты, которые являются серьезным лимитирующим фактором для проведения полноценных курсов химиотерапии. Наиболее частые осложнения химиотерапии, такие как тошнота, рвота, мукозиты, миелодепрессия, нередко вынуждают врача-онколога отсрочить или прервать курс лечения. Нежелательные симптомы не только ухудшают качество жизни больных, но и зачастую представляют прямую угрозу для жизни (Птушкин В.В., 2004). Осложнения химиотерапии становятся препятствием для проведения самого лечения и конкурируют с основным заболеванием за внимание врачей и жизнь больного.
Лучевая терапия и химиотерапия индуцируют апоптоз мегакариоцитов, а также их предшественников. При воздействии на мегакариопоэз химиотерапевтические препараты более цитотоксичны в отношении ранних клеток-предшественников, чем для клеток CD34 (молекула межклеточной адгезии, играющая роль на ранних этапах кроветворения, влияющая на связывание стволовых клеток с внеклеточным матриксом костного мозга или напрямую со стромальными клетками) и полиплоидных мегакариоцитов (Cancer. Res., 2007).
У пациентов с различными видами онкологических заболеваний также отмечают развитие аутоиммунной тромбоцитопении. Наиболее часто это осложнение выявляют у больных раком легкого и грудной железы, реже — у лиц с почечноклеточным раком и раком яичника (Krauth M.T. Paraneoplastic autoimmune thrombocytopenia in solid tumors, 2012).
Все препараты, используемые для проведения химиотерапии, делятся на 5 классов (степеней) токсичности, начиная от нулевой (уровень тромбоцитов сохраняется выше 100 × 109/л) и заканчивая четвертой степенью (тромбоциты снижаются до 25 × 109/л и менее). Пропорционально степени тромбоцитопении возрастает риск геморрагических осложнений.
Наиболее частая локализация кровотечения — желудочно-кишечный тракт и мочеполовые пути, однако и носовое кровотечение может быть достаточно тяжелым и нередко представляет серьезную проблему. Кровоизлияние в мозг может вызвать локальные очаговые проявления или катастрофическую децеребрацию. Прогноз на выздоровление резко ухудшается, курсы химиотерапии сокращаются или становятся невозможными. Поддержка показателей крови является одним из основных аспектов поддерживающей терапии, поскольку тромбоцитопения или нейтропения ведут к прекращению курса лечения онкологического заболевания.
Методы коррекции тромбоцитопении
Проведение химиотерапии нередко осложняется кровотечениями вследствие тромбоцитопении. Геморрагические осложнения, особенно при наличии сопутствующей инфекции, представляют большую опасность.
Пороговым содержанием тромбоцитов, при котором крайне редко отмечаются спонтанные кровотечения, считается 20 × 109/л. У пациентов с острыми нелимфобластными лейкозами, получающих химиотерапию, не отмечается геморрагических осложнений при содержании тромбоцитов на уровне 5–10 × 109/л, если нет инфекции или коагулопатии. С другой стороны, у пациентов с острыми лимфобластными лейкозами аналогичный уровень безопасности достигается при содержании тромбоцитов более 20 × 109/л. Уровень тромбоцитов более 50 × 109/л обычно достаточен для гемостаза даже при выполнении полостных хирургических вмешательств и не требует проведения трансфузий. При уровне тромбоцитов менее 50 × 109/л хирургические вмешательства у онкологических больных часто осложняются кровотечением. Снижение уровня тромбоцитов менее 10 × 109/л требует обязательного переливания тромбоконцентрата независимо от клинической картины (Kuter D.J., 2015). Тромбоконцентрат получают от донора, у которого за сеанс цитафереза обрабатывается около 5 литров крови. Тромбоконцентрат содержит 3–5 × 1011 тромбоцитов. Особенностью использования тромбоконцентрата является меньший риск аллоиммунизации, так как пациент контактирует с тромбоцитами значительно меньшего числа доноров. Следует учитывать, что помимо аллоиммунизации переливания донорских гемопрепаратов несут риск трансфузиологических реакций, передачи вирусов гепатита и иммунодефицита человека. Кроме того, отсрочка восстановления тромбоцитов также может препятствовать своевременному началу следующего курса химиотерапии, что снижает запланированную интенсивность лечения.
Коррекция тромбоцитопении при проведении химиотерапии в первую очередь направлена на устранение ее причин с возможной модификацией доз вводимых препаратов. Укреплению стенок сосудов и повышению способности крови к свертыванию способствует прием этамзилата. Подобными свойствами обладают гормональные препараты — дексаметазон, преднизолон и др. Используют иммуноглобулин, фолиевую кислоту, при кровотечениях применяют гемостатические средства: агреганты, коагулянты, антифибринолитики.
В лечении тромбоцитопении необходимо обеспечить рост количества тромбоцитов. Попытки клинического использования различных цитокинов (ИЛ-1, ИЛ-6, ИЛ-11, ГМ-КСФ, ИЛ-3), а также их комбинаций для стимулирования продукции тромбоцитов мегакариоцитами и их предшественниками были ограниченно успешными. Применение рекомбинантного ИЛ-11 у больных раком молочной железы, получавших химиотерапию, сопровождалось дозозависимым увеличением количества мегакариоцитов в костном мозге и тромбоцитов периферической крови. Выраженность и длительность тромбоцитопении после химиотерапии снижались. Однако препарат оказался достаточно токсичным. Это стимулировало развитие альтернативных подходов к предотвращению тромбоцитопении. Одним из них является стимуляция тромбоцитарного ростка гемопоэза, что возможно при применении тромбопоэтина.
Открытие и получение в рекомбинантной форме тромбопоэтина (rhTPO) — фактора роста и развития мегакариоцитов — позволило значительно продвинуться в терапии постхимиотерапевтической тромбоцитопении. Человеческий ген тромбопоэтина был клонирован с получением данного миелоцитокина в рекомбинантной форме. Рекомбинантный человеческий тромбопоэтин представляет собой гликозилированную молекулу полной длины.
Первые контролируемые клинические исследования были проведены у больных с прогностически неблагоприятными вариантами неходжкинских лимфом. Кроме иммунологической недостаточности у больных могут развиваться иммунные реакции, обусловленные продукцией антител, направленных против антигенов собственных тканей. Примером этому могут служить случаи развития иммунной гемолитической анемии или иммунной тромбоцитопении у этих больных. Исследования показали, что применение тромбопоэтина после курсов химиотерапии 2-й линии ICE (ифосфамид, карбоплатин и этопозид) снижает выраженность тромбоцитопении и полностью снимает потребность в заместительных трансфузиях тромбоконцентрата (Fanucchi M. et al. // N. Engl. J. Med. 1997; 336: 404-9).
Рекомбинантный тромбопоэтин в клинических исследованиях хорошо переносился, и лечение не сопровождалось образованием нейтрализующих антител. В контролируемом исследовании у больных, получавших интенсивную химиотерапию карбоплатином и паклитакселом в связи с распространенным немелкоклеточным раком легкого, тромбопоэтин снизил потребность в трансфузии тромбоконцентрата с 64 до 17 % (Vadhan-Raj // Seminarsin. Hemat 1998; 35: 261-8).
В ряде исследований было показано, что тромбопоэтин воздействует на мегакариоцитопоэз несколькими способами: вызывает увеличение размеров и повышение числа мегакариоцитов; повышает содержание ДНК в мегакариоцитах в форме полиплоидии; повышает эндомитоз мегакариоцитов; вызывает ускоренное созревание мегакариоцитов; увеличивает процентное содержание клеток-предшественников в костном мозге. Благодаря этому индуцируется увеличение количества тромбоцитов, что позволяет решить проблему тромбоцитопений.
Важную роль в продукции тромбоцитов играет полиплоидизация ядра мегакариоцитов (Ravid К., Lu J., Zimmet J. et al., 2002). Уровень апоптоза мегакариоцитов во время проведения химиотерапии увеличивается. В одном из исследований было изучено антиапоптозное действие тромбопоэтина на мегакариоциты. Без тромбопоэтина продукция мегакариоцитов значительно снижалась, в то же время при введении тромбопоэтина уровень мегакариоцитов прогрессивно увеличивался, тогда как количество апоптозных (греч. аpo — «удаление, прекращение»; греч. рtosis — «падение») клеток в течение всей продолжительности химиотерапии оставалось практически без изменений. Апоптоз проявляется специфической гибелью клеток, активацией нелизосомных эндогенных эндонуклеаз, в результате чего происходит фрагментация и полиплоидизация ДНК (Stem Cells 1996; 14: 330-336; Experimental Hematology 1999; 27: 131-138) (рис. 2).
/18_m.jpg)
Рекомбинантный (полученный с помощью генной инженерии) тромбопоэтин (rhТPО) — гликопротеин, который специфически стимулирует пролиферацию и дифференциацию мегакариоцитов, способствует образованию и высвобождению тромбоцитов, а также восстановлению тромбоцитов периферической крови и общего содержания лейкоцитов. Действуя на тромбоцитарный росток, тромбопоэтин вызывает повышение числа колоний мегакариобластов и мегакариоцитов. Его применение показано в случае тромбоцитопении, индуцированной химиотерапией, у пациентов с солидной опухолью и идиопатической тромбоцитопенической пурпурой. Назначение rh-ТПО патогенетически обосновано при лечении тромбоцитопении у онкологических пациентов, но до недавнего времени его применение в Украине было невозможно в связи с отсутствием зарегистрированных препаратов, в то время как эритропоэтины уже применялись. Сегодня такая возможность появилась. Первым и единственным препаратом на основе рекомбинантного тромбопоэтина человека в Украине является Эмаплаг (Emaplug®), который на украинском фармацевтическом рынке представляет фармацевтическая корпорация «Юрия-фарм».
Эффективность Эмаплага была подтверждена в ряде исследований. Первый случай успешного примения Эмаплага в Украине описан проф. Ю.В. Давыдовой и соавт.
У беременной в сроке 26 недель была диагностирована рефрактерная иммунная тромбоцитопения (ИТП). На момент поступления в клинику уровень тромбоцитов составил 20 000 и постоянно снижался до единичных в поле зрения. На момент поступления в отделение акушерских проблем экстрагенитальной патологии срок беременности составил 28 недель. Беременная получала терапию согласно новейшим рекомендациям. После родоразрешения в сроке 33–34 недели с количеством тромбоцитов на уровне единичных в мазке крови была проведена комплексная терапия тромбоцитопении. Положительного результата менеджмента ИТП во время беременности удалось добиться благодаря использования широкого арсенала препаратов, правильной тактике родоразрешения и профилактике кровотечения, включающей в себя 4T-стратегию и адекватные дозы транексамовой кислоты (sangera) и rhTPO (Эмаплаг). Это был первый успешный опыт применения rhTPO у рожениц с рефрактерной ИТП (Перинатология и педиатрия 2016; 4(68): 12-14).
/18_m2.jpg)
В открытом рандомизированном перекрестном исследовании с самоконтролем изучалась эффективность Эмаплага при тромбоцитопении. В нем приняли участие 59 пациентов с солидными опухолями, у которых минимальный уровень тромбоцитов составлял 50 × 109/л во время первого курса химиотерапии. Через 6–24 часа после проведения химиотерапии вводили Эмаплаг по 300 ЕД/кг 1 раз в сутки в течение 14 дней. В результате исследования было установлено, что Эмаплаг способствует быстрому восстановлению количества тромбоцитов после химиотерапии и повышает критично сниженный уровень тромбоцитов после химиотерапии на 34 %, устраняя риск кровотечений. Было продемонстрировано, что Эмаплаг способствует быстрому восстановлению количества тромбоцитов после химиотерапии, повышая их количество до 200 × 109/л в период с 15-го по 24-й день после ее проведения, тогда как в контрольной группе этот показатель составлял 100–140 × 109/л. Введение препарата уменьшало на 60 % количество переливаний тромбоцитарной массы пациентам после химиотерапии.
По результатам еще одного исследования Эмаплаг после химиотерапии был эффективен в снижении потребности в трансфузии тромбоконцентрата, возникавшей вследствие действия карбоплатина, вызывающего критическое снижение уровня тромбоцитов на поздних этапах. Использование тромбопоэтина до и после химиотерапии требовалось для снижения ранней тромбоцитопении (Seminars in Hematology 2009; 46(1 suppl. 2): S26-32).
Было установлено, что Эмаплаг ускоряет нормализацию содержания тромбоцитов (Jiang Min at al. Recombinant Human Thrombopoietin Improves Platelet Recovery after Allogeneic Hematopoietic Stem Cell Transplantation: A Randomized, Controlled Clinical Trial // Trombosis and Hemostasis 2011; Vol. XVII, Ed. VI).
Эмаплаг специфически стимулирует пролиферацию и дифференциацию мегакариоцитов, способствует образованию и высвобождению тромбоцитов и восстановлению тромбоцитов в периферической крови, а также восстановлению общего содержания лейкоцитов и является эффективным средством в лечении тромбоцитопении при проведении курсов химиотерапии. Взрослым пациентам вводится подкожно через 6–24 часа после химиотерапии. Доза составляет 300 ЕД/кг массы тела один раз в день. Срок лечения — 14 дней. Введение препарата необходимо прекратить, если количество тромбоцитов восстанавливается до ≥ 100 × 109/л в процессе лечения или если абсолютный прирост тромбоцитов ≥ 50 × 109/л.
При возникновении анемии или лейкопении, связанных с химиотерапией, Эмаплаг применяют в сочетании с рекомбинантным эритропоэтином или рекомбинантным человеческим гранулоцитарным колониестимулирующим фактором соответственно для восстановления нарушений гемостаза. Применение Эмаплага для увеличения уровня тромбоцитов способно улучшить качество жизни и в ряде случаев увеличить общую и безрецидивную выживаемость пациентов с онкологическими заболеваниями, поскольку оно направлено на снижение влияния тромбоцитопении. Применение Эмаплага дает возможность завершения проведения курса химиотерапии.

/16_m.jpg)
/18_m.jpg)
/18_m2.jpg)