Статья опубликована на с. 6-8 (Укр.)
Незважаючи на можливості вакцинації й використання досить ефективних противірусних препаратів (озельтамівір, занамівір), лікування грипу й вірусної та вірусно-бактеріальної пневмонії залишається викликом сучасній медицині в усьому світі. Про це свідчать сотні тисяч госпіталізацій у різних країнах світу й понад 500 000 смертельних випадків у всьому світі [1, 2]. Ускладнення від грипу та пов’язана з ним смертність, а також економічні витрати за інвалідністю є серйозною проблемою як у розвинених країнах, так і в тих, що розвиваються. У зв’язку з цим пошук ефективних методів лікування тяжких форм грипу та його ускладнень залишається актуальним. Як засвідчують первинні звіти ВООЗ, CDC [1, 2], епідемія грипу 2009 року, яка була викликана пандемічним штамом грипу А(H1N1) pdm09, характеризувалася несподівано тяжким перебігом, у тому числі серед людей молодого й середнього віку, вагітних, та високим рівнем смертності [3, 4, 7]. Пізніше з’явилися доповіді про те, що рівень смертності від цього штаму наблизився до показників сезонного грипу [1, 2].
В Україні від грипу А(H1N1) pdm09 та його наслідків у сезоні 2009–2010 рр. загинули 1128 людей [5, 6]. У 2010–2011 рр. було відзначено, що підтип А(H1N1)pdm09 уже не є домінуючим у багатьох географічних частинах світу й циркулює поряд з іншими підтипами. Штами грипу варіюють від одного сезону до наступного. Сезон 2015–2016 рр. почався дещо пізніше, ніж попередні три сезони, із запізненням досягнення сезонного піку. На початку сезону 2015–2016 рр. превалював вірус H3N2, а потім до кінця сезону став домінувати вірус H1N1. За даними CDC, цей сезон був м’якшим, ніж попередні 3 сезони, з меншою кількістю госпіталізацій і фатальних ускладнень. Кількість померлих становила 4,9 % порівняно з 8,7 % у 2011–2012 рр. і 11,1 % — у 2012–2013 рр. [3, 4]. За даними Міністерства охорони здоров’я України, у сезоні 2015–2016 рр. жертвами грипу та застуди стали 15 % українського населення. 295 людей (4,5 %) були госпіталізовані. Із 733 тяжких випадків грипу та гострих респіраторних вірусних інфекцій (ГРВІ) 391 закінчився смертю [5, 6].
Клінічна презентація грипу відрізняється від такої в інших сезонних ГРВІ переважанням загальних симптомів (висока лихоманка, слабкість, головний біль та інші алгії) над місцевими катаральними проявами. Катаральні респіраторні симптоми посилюються в наступні години, особливо трахеобронхіти. Ускладнення грипу у вигляді прогресуючих симптомів запалення легень, дихальної недостатності можуть з’являться вже в перші 48 годин, але частіше приєднуються на 3–4-й день хвороби, так що більшість пацієнтів до цього часу лікуються амбулаторно, часто без отримання специфічної противірусної терапії [7]. Після госпіталізації таких хворих у лікарню призначення противірусної терапії нерідко виявляється малоефективним. Застосування найбільш ефективних антибіотиків на тлі масивної полісегментарної запальної інфільтрації й геморагічного набряку в легенях також буває неефективним, особливо у випадках пізнього звернення хворих по медичну допомогу, а також за наявності коморбідних станів (цукровий діабет, ожиріння, серцево-судинні захворювання, вагітність, похилий вік тощо) [5–7].
Вірусна та асоційована з грипом позагоспітальна пневмонія залишається найбільш небезпечним захворюванням із високим ступенем ризику негативного результату [7–10], тому вивчення нових підходів до лікування тяжких форм пневмонії є надзвичайно важливим. Одним із цих нових напрямків лікування грипу й пневмонії є використання внутрішньовенного імуноглобуліну. Е. Prina та співавт. (2016) у своєму огляді зазначили, що, незважаючи на значний прогрес у менеджменті пневмонії, захворюваність і смертність є досить високими. Своєчасне призначення адекватної антибактеріальної терапії залишається наріжним каменем у лікуванні пневмонії [10]. Однак автори відзначили два аспекти, які, на їх думку, негативно впливають на результати лікування. Перший аспект пов’язаний з неконтрольованою запальною реакцією й неадекватною активацією цитокінового профілю. Другий аспект обумовлений недостатністю імунної відповіді. На думку авторів, у таких пацієнтів нерідко виявляли низький рівень імуноглобулінів, особливо у хворих, які в анамнезі мали повторні епізоди пневмонії [11]. Тому використання внутрішньовенного імуноглобуліну може бути доцільним, воно допоможе нейтралізувати ці імунопатологічні механізми та покращити імунну відповідь, особливо в пацієнтів із недостатнім рівнем гуморальних антитіл [9]. Проте автори підсумовують, що необхідні подальші дослідження, щоб продемонструвати вплив такого лікування на результати захворювання й визначити таргетні групи хворих.
На доцільність імуномодулюючої терапії також вказували вітчизняні дослідники [6, 8]. А.И. Гриневич, В.И. Матяш [6] (2011) припускають, що нові підходи до лікування й профілактики повинні включати застосування імуномодулюючих препаратів. Згідно з даними О.А. Пересада, А.Н. Барсукова (2011) [8], в абсолютної більшості пацієнтів із серйозними пневмоніями, викликаними грипом А(H1N1), у загальному аналізі крові виявлено лейкопенію та лімфопенію, що є характерним для вторинного імунодефіциту. З метою корекції автори рекомендують введення внутрішньовенного імуноглобуліну та індуктора інтерферону (циклоферон). Експериментальні роботи Binh An Diep, Vien T.M. Le, Cedric Badiou та співавт. (2016) [13] показали високу ефективність внутрішньовенного імуноглобуліну в лікуванні некротизуючої пневмонії, викликаної метицилінрезистентним штамом золотистого стафілококу. Австралійськими вченими були опубліковані позитивні результати застосування внутрішньовенного імуноглобуліну під час епідемії H1N1 2009 року. Після невдачі противірусної терапії в 5 пацієнтів із задокументованим дефіцитом субкласу IgG2, які перебували на штучній вентиляції легень, була призначена терапія внутрішньовенним імуноглобуліном. 3 пацієнти з 5 видужали. Підґрунтям для цього експериментального лікування стала історія пандемії H1N1 1918 року, коли ще не було противірусних препаратів та антибіотиків і в лікуванні використовувалась сироватка пацієнтів, які одужували, як рятувальна пасивна імунотерапія [14]. Метод пасивної імунотерапії був також застосований у лікуванні високопатогенного й летального пташиного грипу H5N1. Ці дослідження ставлять питання про можливість більш широкого використання внутрішньовенного імуноглобуліну у веденні тяжкого грипу. Міні-огляд останніх досліджень, проведений Qiang Liu, Yuan-hong Zhou, Zhan-qiu Yang (2015), дає авторам підстави вважати, що використання внутрішньовенного імуноглобуліну, а також інших засобів, здатних пригнічувати розвиток «цитокінового шторму» з його тяжкими наслідками у хворих на грип, має перспективи як інноваційна терапія, спрямована на таргетні імунологічні механізми вірусного процесу. Більшість авторів дійшли висновку, що необхідні подальші дослідження й накопичення даних щодо використання внутрішньовенного імуноглобуліну не тільки у хворих із недостатністю IgG2, але також і в пацієнтів з іншими тяжкими формами грипу.
Власне дослідження
Нами було проведено дослідження з оцінки ефективності та переносимості препарату Біовен, 10% розчин для інфузій, виробництва ПрАТ «Біофарма», порівняно з аналогічним лікувальним засобом (АЛЗ) європейського виробника в пацієнтів з тяжким перебігом грипу, ускладненого пневмонією.
Метою проведеного дослідження було отримання власних даних щодо оцінки можливостей використання внутрішньовенного імуноглобуліну у хворих із тяжким перебігом грипу та позалікарняною пневмонією.
Досліджуваний препарат — Біовен, 10% розчин для інфузій, виробництва підприємства «Біофарма». Препарат є імунологічно активною білковою фракцією плазми крові (співвідношення підкласів імуноглобуліну G у препараті: IgG1 — 43–75 %, IgG2 — 16–48 %, IgG3 — 1,7–7,5 %).
Згідно з дизайном у дослідження було включено 60 пацієнтів 18–50 років, які перебували на стаціонарному лікуванні в клініці кафедри інфекційних захворювань Дніпропетровської державної медичної академії. Відбір пацієнтів для дослідження проводився на підставі критеріїв включення/виключення згідно з протоколом дослідження. У дослідження включалися пацієнти, які дали письмову інформовану згоду на участь.
Хворих методом рандомізації було розподілено на дві групи (основна й контрольна), по 30 осіб у кожній. Переважна більшість хворих обох груп надійшли в лікарню на 2–3-й день хвороби. Тривалість спостереження — 19 діб. У всіх хворих було діагностовано та підтверджено лабораторно діагноз грипу А(H1N1), ускладненого позалікарняною полісегментарною пневмонією з тяжким перебігом. Дихальна недостатність різного ступеня виявлялася в 95 % хворих, респіраторний дистрес-синдром — у 15 %, ниркова недостатність — у 20 % хворих. Усім пацієнтам призначалася базисна терапія, що включала: антимікробний засіб з урахуванням протоколу та чутливості до виділеного збудника, інфузійну терапію, симптоматичні засоби. Базисна терапія тривала до повної ліквідації клінічних ознак грипу. Усім хворим призначалася базисна антибіотикотерапія, крім того, хворим основної групи вводився досліджуваний препарат Біовен, 10% розчин для інфузій, виробництва ПрАТ «Біофарма», з розрахунку 0,4 г/кг/добу внутрішньовенно краплинно зі швидкістю 1 мл/хв щодня протягом 4 діб, а пацієнтам контрольної групи призначався АЛЗ європейського виробника за аналогічною схемою. Дане клінічне дослідження проведене як відкрите контрольоване рандомізоване паралельне. У процесі клінічного дослідження для оцінки ефективності досліджуваного й референтного препаратів були вивчені динаміка клінічних показників пневмонії й дані бактеріологічного дослідження мокротиння. Паралельно проводилась оцінка переносимості препаратів з урахуванням частоти проявів і характеру побічних реакцій.
Усі препарати, що використовувалися для супутньої терапії, реєструвалися в історії хвороби й індивідуальній реєстраційній формі: вказувалися назва, доза, спосіб і частота прийому, дати початку й закінчення терапії. У період проведення дослідження не дозволялося призначення засобів, дія яких могла вплинути на результат дослідження: імуномодуляторів, імуносупресорів, глюкокортикостероїдів тощо.
Усі пацієнти пройшли повний курс лікування вказаними препаратами, їх дані були включені в аналіз ефективності та переносимості. Випадків дострокового вибуття з дослідження не було.
Згідно з протоколом дослідження, на візиті 1 (до лікування), візиті 3 (під час лікування) і візиті 4 (після лікування) для кожного пацієнта реєструвалися показники суб’єктивних скарг (кашель, задишка, характер та об’єм мокротиння, самопочуття). Результати аналізу динаміки цих показників методами описової статистики в основній та контрольній групах наведені в табл. 1–6.
Було проаналізовано динаміку суб’єктивних і об’єктивних симптомів захворювання в обох групах хворих під впливом терапії досліджуваним і референтним препаратами.
Результати дослідження
Результати дослідження показали помірне покращення стану та регрес симптомів грипу й пневмонії від візиту до візиту у хворих обох груп. На моніторингових візитах 1–4 відмічалося покращення таких показників:
- кашель (зменшення кількості нападів);
- задишка (зменшення);
- характер мокротиння (покращення);
- самопочуття (зменшення слабкості).
Що ж стосується показника «об’єм мокротиння», то спочатку він дещо зменшувався, а потім трохи зростав.
Результати дослідження симптомів в основній групі (порівняння даних, одержаних під час 3-го й 4-го візиту, з даними 1-го візиту) подані в табл. 1.
Аналогічний аналіз було проведено в контрольній групі (табл. 2).
Наведені в таблицях результати статистичного аналізу дозволяють зробити такий висновок: отримані дані свідчать про ефективність проведеної терапії як в основний, так і в контрольній групах за всіма показниками суб’єктивних скарг, за винятком показника «об’єм мокротиння».
Для порівняння груп за загальною ефективністю лікування був застосований точний критерій Фішера (оскільки передумови для застосування критерію хі-квадрат Пірсона не виконуються). Згідно з отриманими результатами, відмінності між групами щодо загальної ефективності статистично незначущі (р = 0,980). Отже, статистично значущих відмінностей між групами за загальною ефективністю виявлено не було. Оцінка загальної ефективності як в основній, так і контрольній групі була досить високою й становила 96,7 і 100 % відповідно. Клінічна невдача була в 1 пацієнта (1,7 %).
Для аналізу терапевтичної еквівалентності двох препаратів згідно із сучасними вимогами використаний підхід, заснований на довірчих інтервалах (ДІ). Відповідно до цього підходу два препарати є терапевтично еквівалентними, якщо різниця частки для показників, які аналізуються (якщо ці показники категоріальні), разом з 95% довірчим інтервалом повністю потрапляє в зону еквівалентності. Зона еквівалентності задається експертами. Оскільки головною змінною даного дослідження є загальна ефективність, то досліджувані препарати будуть еквівалентними, якщо 95% довірчий інтервал для різниці частки позитивних результатів буде знаходитися в середині зони еквівалентності (20 %). Тобто якщо нижня межа ДІ буде більшою від нижньої межі зони еквівалентності й верхня межа ДІ буде меншою від верхньої межі зони еквівалентності, можна вважати, що досліджуваний препарат є терапевтично еквівалентним до референтного препарату за критерієм загальної ефективності. Статистичний аналіз також підтвердив біоеквівалентність обох препаратів.
Переносимість досліджувалася за лабораторними показниками загального й біохімічного аналізів крові. Згідно з протоколом дослідження, на 1-му й 4-му візиті для кожного пацієнта реєструвалися лабораторні показники загального та біохімічного аналізів крові, а також імунологічні показники (CD4 і CD8), що дозволяло оцінити особливості лабораторної динаміки й імунологічної відповіді у хворих, а також безпеку лікувальних засобів. Результати порівняння деяких лабораторних показників подані в табл. 3–6.
/8_u.jpg)
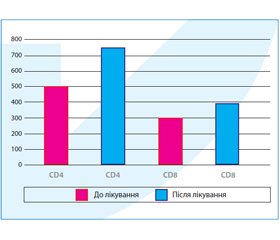
Лабораторні показники мали позитивну динаміку в усіх хворих, у жодному випадку не було негативних змін, у більшості досліджуваних знижувались показники запальної реакції в загальному й біохімічному аналізах крові, а також покращувались показники функціонування серцево-судинної системи, печінки й нирок. Заслуговує на увагу динаміка імунологічних показників — CD4 і CD8 лімфоцитів. У більшості хворих із тяжким перебігом грипу спостерігалась тенденція до зниження рівня CD4 лімфоцитів. На тлі лікування внутрішньовенним імуноглобуліном спостерігалися збільшення абсолютної й відносної кількості CD4 лімфоцитів і нормалізація імунологічних показників (рис. 1).
Не було відзначено жодного випадку загострення наявних хронічних захворювань. Також не спостерігалося алергічної й місцево-подразнюючої реакції шкірних покривів. Отже, ефективність і переносимість досліджуваних препаратів була оцінена як добра в усіх пацієнтів основної та контрольної груп.
Висновки
Грип — серйозна хвороба, відома з давніх часів, і до цього часу вона залишається викликом людству. Стає все більш очевидним, що застосування в лікуванні тільки противірусних препаратів не гарантує одужання хворих з ускладненими пневмонією формами грипу.
На перебіг грипу впливають різноманітні фактори, у тому числі характер імунологічної відповіді організму, яка в тяжких випадках може бути недостатньою, що посилює негативний вплив на прогноз. Проведені на сьогодні дослідження, хоч і нечисленні, свідчать про те, що застосування внутрішньовенного імуноглобуліну у хворих, у яких противірусна й антибактеріальна терапія є неефективною, здатне значно покращити прогноз захворювання. Проведені нами дослідження також продемонстрували ефективність внутрішньовенного імуноглобуліну при його застосуванні в комплексі з базисною терапією у хворих із тяжкими формами грипу та позалікарняною пневмонією. Важливо, що вітчизняний препарат внутрішньовенного імуноглобуліну Біовен за своїми властивостями й показниками біоеквівалентності не відрізняється від препаратів іноземного виробництва, добре переноситься, не викликає побічних ефектів. Однак необхідні подальші мультицентрові дослідження для всебічного вивчення ефектів імуноглобуліну у хворих на грип та пневмонію для обґрунтування показань та схем його застосування.

/6_u.jpg)
/8_u.jpg)
/8_u2.jpg)