Газета «Новости медицины и фармации» 14 (594) 2016
Вернуться к номеру
Патогенетический подход к терапии ишемии сердца
Авторы: Тащук В.К.
доктор медицинских наук, профессор, Буковинский государственный медицинский университет, г. Черновцы, Украина
Рубрики: Кардиология
Разделы: Справочник специалиста
Версия для печати
Статья опубликована на с. 8-10 (Укр.)
Актуальность проблемы
Ишемическая болезнь сердца (ИБС) в последние десятилетия стойко занимает одно из ведущих мест в структуре обращаемости, инвалидизации и смертности при сердечно-сосудистых заболеваниях (ССЗ). В развитых странах Европы на 1 млн населения приходится 30–40 тысяч больных, страдающих данной патологией [1]. Согласно данным S. Sutcliffe et al. (2003), в 46 % случаев первым проявлением ИБС является стенокардия напряжения, в 27 % — инфаркт миокарда (ИМ), в 14 % — внезапная смерть и в 13 % — нестабильная стенокардия [2].
Ежегодно в мире отмечается более 15 млн новых случаев инфаркта миокарда: при этом 35 % больных погибает в 1–7-е сутки; еще 15–20 % — в течение первого года. По данным Американской ассоциации сердца, в течение последующих шести лет после ИМ 18 % мужчин и 35 % женщин переносят повторный инфаркт, у 22 % мужчин и 46 % женщин развивается тяжелая сердечная недостаточность [3].
Вместе с тем, по результатам медико-статистических исследований, представленных ВОЗ, во всем мире пока не наблюдается тенденции к снижению смертности от сердечно-сосудистых заболеваний, в том числе от ИБС. Это определяет актуальность разработки и внедрения в клиническую практику новых подходов к диагностике и лечению этого заболевания.
В последние годы парадигма лечения пациентов с ИБС претерпевает изменения, связанные с эволюцией понимания патогенеза этого заболевания. Поэтому сегодня в фокусе внимания исследователей и врачей находятся не только атеросклеротические изменения в коронарных сосудах, но и степень эндотелиальной дисфункции, недостаток энергетических субстратов в митохондриях кардиомиоцитов, состояние микроциркуляторного русла, которые приводят к ишемическим изменениям, происходящим на клеточном уровне. Соответственно, в стратегии медикаментозного лечения пациентов с ИБС наблюдается смещение акцентов в сторону инновационных подходов, обеспечивающих не только полноценный коронарный кровоток, но и эффективную микроциркуляцию, коррекцию эндотелиальной дисфункции, а также поддержание энергетических процессов на уровне кардиомиоцитов.
Результаты исследований в этой области и основанные на них изменения в официальных рекомендациях свидетельствуют о том, что внедрение таких подходов в клиническую практику в ближайшем будущем будет иметь решающее значение для повышения эффективности терапии пациентов с ИБС [27].
Энергетический обмен в кардиомиоцитах в физиологических и патологических условиях
В физиологических условиях, в состоянии покоя молекулы аденозинтрифосфата (АТФ) в сердце образуются в результате окисления энергетических субстратов, главным образом длинноцепочечных жирных кислот (ДЦ-ЖК), вклад которых в образование АТФ составляет около 70–80 %, а также глюкозы и лактата [28], пирувата, аминокислот и кетоновых тел. Основной путь энергетического обмена связан с β-окислением жирных кислот (ЖК) в митохондриях, а вспомогательный путь представлен гликолизом с последующим окислением в митохондриях пирувата. Биоэнергетические процессы в миокарде в норме обеспечиваются почти исключительно АТФ, вырабатываемым в митохондриях в результате окислительного фосфорилирования при наличии кислорода.
Для преобразования энергии, заключенной в жирных кислотах, в энергию связей АТФ существует метаболический путь окисления жирных кислот до СО2 и воды, тесно связанный с циклом трикарбоновых кислот и дыхательной цепью. Этот путь называется β-окисление, т.к. происходит окисление 3-го углеродного атома жирной кислоты (β-положение) в карбоксильную группу, одновременно от кислоты отщепляется ацетильная группа, включающая С1 и С2 исходной жирной кислоты. Реакции β-окисления происходят в митохондриях большинства клеток организма (кроме нервных клеток). Для окисления используются жирные кислоты, поступающие в цитозоль из крови (из пищи) или появляющиеся при липолизе собственных внутриклеточных триацилглицеролов.
При этом основными энергопродуцирующими соединениями в миокарде являются свободные жирные кислоты (СЖК), на окисление которых используется около 70 % кислорода, потребляемого сердцем. Остальные 30 % расходуются в основном на аэробное окисление углеводов.
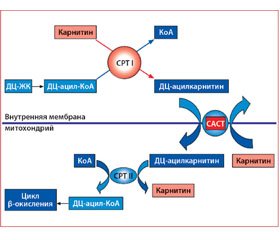
Окисление СЖК начинается с подготовительного этапа — предварительной активации жирной кислоты, что выражается в образовании эфиров жирных кислот с коэнзимом А (КоА) и последующем их взаимодействии с карнитином, в результате чего образуются эфиры карнитина с жирными кислотами. Эти события происходят в цитоплазме клетки во внемитохондриальном пространстве. Соединение карнитина с ЖК способствует переносу СЖК через мембраны внутрь митохондрий с помощью ферментных комплексов — карнитинпальмитинтрансферазы I и II (СРТ I и СРТ II). При этом L-карнитин играет важную роль в энергетическом обмене сердца, так как участвует в транспорте ацильных остатков ЖК с помощью системы «карнитинового челнока». В его состав входят карнитин, СРТ I, расположенная на внешней мембране митохондрий, карнитинацилкарнитинтранслоказа (САСТ), локализованная во внутренней мембране, которая обменивает карнитин митохондрий и ацилкарнитины цитоплазмы, и СРТ II, находящаяся в матриксе митохондрий. Поскольку активированные СЖК в виде ацил-КоА растворимы в воде, а не в липидах, то они не способны проникнуть через внутреннюю мембрану митохондрий. В связи с этим СРТ I катализирует перенос ацильного остатка ЖК с КоА на L-карнитин, в результате образуется эфир — ацилкарнитин, который и транспортируется с помощью молекул-переносчиков — САСТ — через внутреннюю мембрану митохондрий в обмен на свободный карнитин матрикса, который переносится из митохондрий в цито–плазму [5].
В матриксе митохондрий длинноцепочечный ацилкарнитин подвергается воздействию СРТ II и превращается в ацетил-КоА. Последний вступает в цикл β-окисления ЖК, в ходе которого укорачивается его ацильный остаток до длины среднецепочечных ацил-КоА и затем короткоцепочечных, с образованием в каждом витке окисления одного ацил-КоА. Когда поступление ацил-КоА превосходит его потребление в цикле β-окисления, ацил-КоА вновь превращается в ацилкарнитины, которые удаляются из митохондрий в цитоплазму, а затем из клеток — в кровь. Этот процесс предупреждает накопление ацил-КоА в цитоплазме и тормозит развитие липотоксического эффекта [6].
Из ацетил-КоА, образовавшегося в митохондриях и выходящего в цитоплазму, синтезируется малонил-КоА. Он снижает активность ключевого, самого медленного фермента в окислении липидов СРТ I, тем самым тормозится транспорт длинноцепочечных ЖК в митохондриях и их окисление, уменьшая вклад ЖК в синтез АТФ.
Таким образом, наряду с СРТ I, САСТ и СРТ II L-карнитин контролирует скорость окисления длинноцепочечных ЖК, выступая в качестве специфического кофактора, облегчающего их перенос через внутреннюю мембрану митохондрий.
Нарушение функциональной активности митохондрий играет ключевую роль при ряде патологических состояний, включая повреждения, вызываемые ишемией/реперфузией, наблюдающиеся при стенокардии, инфаркте миокарда, сердечной недостаточности, остром коронарном синдроме (ОКС). Вместе с тем известно, что даже при выраженной ишемии, несмотря на усиление процесса утилизации глюкозы, преимущественным субстратом окисления остаются СЖК [7, 8]. Даже при 50% ограничении кардиального кровотока миокард на 50–70 % удовлетворяет свои энергетические потребности за счет окисления СЖК, несмотря на параллельное резкое нарастание продукции лактата [9]. Для понимания природы такого распределения достаточно обратить внимание на эффективность (выраженную в количестве молекул АТФ) получения энергии для кардиомиоцита от аэробного расщепления СЖК в β-окислении или при анаэробном расщеплении глюкозы. Например, при окислении одной молекулы пальмитиновой кислоты образуется 129 молекул АТФ, а при окислении глюкозы до пировиноградной кислоты в процессе гликолиза образуется всего лишь 2 молекулы АТФ.
По мнению ряда авторов, указанное обстоятельство — разбалансированность процессов окисления СЖК и гликолиза — может инициировать цепь молекулярно-клеточных событий, усугубляющих течение ишемии миокарда и приводящих к таким патофизиологическим проявлениям, как реперфузионное повреждение и дисфункция миокарда, развитие опасных нарушений ритма [10, 11].
При ишемии в результате недостатка кислорода тормозится образование АТФ, снижается сократительная активность сердца, возникает симпатоадреналовый стресс, следствием которого является дополнительное высвобождение из адипоцитов большого количества длинноцепочечных ЖК, поступающих из крови в кардиомиоциты для покрытия энергетической недостаточности. Избыточный уровень ацетил-КоА, образующегося в цикле β-окисления ЖК, тормозит активность пируватдегидрогеназы, что затрудняет окисление пирувата в митохондриях и способствует его превращению в молочную кислоту. В результате развивается внутриклеточный ацидоз, нарушается ионный гомеостаз. Удаление избытка ацетил-КоА из митохондрий с помощью образования ацетилкарнитина и активации карнитинацетилтрансферазы приводит к синтезу большого количества ингибитора CРТ I — малонил-КоА, тормозящего окисление длинноцепочечных ЖК в митохондриях. Помимо этого, L-карнитин участвует в удалении избытка длинноцепочечных ЖК из митохондрий, а затем — из цитоплазмы, предупреждая их цитотоксический эффект. В связи с этим становится ясной важная защитная роль L-карнитина при ишемии. Таким образом, очевидно, что достаточно высокое содержание и обмен L-карнитина в организме играет важную роль в поддержании нормального функционирования клеток [12, 13].
L-карнитин в клинических исследованиях у пациентов с сердечно-сосудистыми заболеваниями
Эффект L-карнитина у пациентов со стенокардией изучен и подтвержден в нескольких рандомизированных плацебо-контролируемых исследованиях, различающихся по структуре, длительности приема препарата и используемым дозировкам. Во всех исследованиях показано достоверное увеличение толерантности к физической нагрузке (в среднем на 14 %), времени до возникновения депрессий ST при проведении нагрузочных проб (15–25 %) и нагрузки до начала приступа стенокардии, уменьшение выраженности депрессии сегмента ST [14].
Доказательством того, что L-карнитин ограничивает объем пораженного миокарда при остром ИМ, могут служить данные, полученные в нескольких клинических исследованиях. Так, в плацебо-контролируемом рандомизированном исследовании введение L-карнитина (2 г/сут) к 28-му дню от начала заболевания (101 пациент) обеспечивало достоверно меньшие уровни креатинфосфокиназы (КФК), чем использование плацебо. Меньшим был и индекс QRS на ЭКГ, определенный как сумма зубцов Q и R в отведениях V1-V6 [15]. Аналогично в другом многоцентровом плацебо-контролируемом рандомизированном исследовании (351 пациент с ИМ) при введении L-карнитина в течение 48 ч, начатом в течение 8 ч от начала заболевания, снижение вольтажа зубца R оказалось на 15 % меньше, чем на фоне плацебо [16]. Кроме того, в группе больных, леченных L-карнитином, меньшим было число эпизодов ишемии (17,6 против 36 %) и количество пациентов с сердечной недостаточностью III/IV функционального класса по классификации NYHA в сочетании с увеличением левого желудочка — 23,4 против 36 % пациентов [16].
Двойное слепое плацебо-контролируемое исследование CEDIM с участием 472 пациентов с первичным передним ИМ показало достоверное снижение объемов сердца в группе, получавшей L-карнитин, по сравнению с группой плацебо. L-карнитин вводили в течение 5 дней внутривенно в суточной дозе 9 г, а затем давали в течение 12 мес. внутрь в суточной дозе 6 г [17].
В рандомизированном двойном слепом плацебо-контролируемом исследовании CEDIM-2 приняли участие 2330 пациентов с острым передним ИМ. Одним из наиболее важных результатов этого исследования стало значимое снижение ранней смертности после ИМ — на 5-е сутки острого периода снижение составило 39 % [18].
В другом параллельном двойном слепом плацебо-контролируемом исследовании участвовали 56 пациентов с инфарктом миокарда, которым в течение 36 ч вводили L-карнитин в дозе 100 мг/кг каждые 12 ч в период от 5 до 12 ч от начала заболевания. Было продемонстрировано, что в группе, получавшей L-карнитин, число эпизодов нарушения ритма уменьшилось на 80 % и достоверно сократилось время регистрации мультиформных или парных экстрасистол [19].
Дисфункция эндотелия: L-аргинин как донатор NO
К настоящему времени установлено, что васкулярный эндотелий играет важную роль в трансдукции сигналов различных нейрогуморальных систем на субэндотелиальные структуры, обеспечивая динамическое равновесие между вазодилатирующими и вазоконстрикторными факторами, а также регулирует рост и пролиферацию субэндотелиальных клеток различного происхождения, опосредует тромбоцитарный и коагуляционный гемостаз, сосудистую проницаемость и механические качества сосудистой стенки [20].
Следует отметить, что в физиологических условиях преобладает высвобождение вазорелаксирующих факторов (особая роль принадлежит NO), которые поддерживают состояние вазодилатации [20].
Помимо вазодилатирующей, NO выполняет ряд других важных функций: модулирует высвобождение вазоактивных медиаторов, ингибирует адгезию лейкоцитов, участвует в регуляции ремоделирования сосудистой стенки, подавляет экспрессию провоспалительных генов, адгезию и агрегацию тромбоцитов, ингибирует миграцию и пролиферацию ГМК [21].
Дисфункция эндотелия является одним из наиболее ранних этапов в патогенезе многих сердечно-сосудистых заболеваний, в том числе артериальной гипертензии, ишемической болезни сердца и системного атеросклероза. При этом способность эндотелиальных клеток синтезировать вазодилататоры уменьшается, а синтез сосудосуживающих факторов сохраняется или увеличивается. Нарушения эндотелийзависимой вазодилатации коронарных сосудов, повышение концентрации эндотелина-1 и ангиотензина-2 в плазме крови могут играть существенную роль в реализации механизма остановки кровообращения при ишемии- реперфузии. При этом центральная роль в возникновении дисфункции принадлежит нарушению биодоступности NO вследствие недостаточной его продукции из L-аргинина [20].
Доступность L-аргинина для эндотелиальной NO-синтазы рассматривают как одно из определяющих условий продукции эндогенного NO. В исследовании J.S. Pollock et al. (1991) было выявлено, что L- аргинин способствует улучшению функции эндотелия независимо от причин, вызвавших снижение биодоступности NO [22]. Выявленный феномен получил название «L-аргининовый парадокс» и инициировал исследования, позволившие объяснить его появление [23]. Оказалось, что последний обеспечивается низкими концентрациями метилированного аналога L-аргинина — асимметричным диметиларгинином (ADMA), основная биологическая роль которого сводится к конкурентному ингибированию эндотелиальной NO-синтазы [24]. При этом циркулирующий эндогенный ADMA способствует сдвигу реакции образования L-аргинина в направлении последнего. Причем даже незначительные изменения концентрации ADMA в плазме крови оказались вполне достаточными для манифестации клинически значимого нарушения регуляции сосудистого тонуса [20]. В дальнейшем ADMA метаболизируется диметиларгининдиметиламиногидролазой (ДДАГ) до L-цитруллина и диметиламина.
Установлено, что супрессия изоформ ДДАГ также сопровождается появлением дисфункции эндотелия, повышением сопротивления легочных и периферических артерий, снижением объемной скорости мозгового и почечного кровотока, а также повышением уровня артериального давления, развитием инсулинорезистентности и утолщением интима-медиального сегмента артерий [20, 21].
Кроме того, L-аргинин активирует гуанилатциклазу и повышает уровень циклического гуанидинмонофосфата в эндотелии сосудов, уменьшает активацию и адгезию лейкоцитов и тромбоцитов, угнетает синтез молекул адгезии VCAM-1 и MCP-1, подавляет синтез эндотелина-1, который является мощным вазоконстриктором и стимулятором пролиферации и миграции гладких миоцитов сосудистой стенки. Также он подавляет синтез асимметричного диметиларгинина — мощного эндогенного стимулятора оксидативного стресса [25].
Клинические подтверждения эффективного влияния L-аргинина на эндотелиальную дисфункцию при кардиоваскулярной патологии
Существуют доказательства благоприятного влияния длительного применения L-аргинина на состояние эндотелиальной функции артерий у пациентов пожилого возраста [20], что сопровождалось существенным снижением циркулирующего уровня провоспалительных цитокинов, таких как С-реактивный протеин и интерлейкин-6 (Ellis A.C. et al., 2015).
В 2009 г. V. Bai еt аl. представили результаты метаанализа 13 рандомизированных исследований, выполненных в целях изучения эффекта L-apгининa на функциональное состояние эндотелия. В этих исследованиях изучали эффект L-apгининa при гиперхолестеринемии, стабильной стенокардии, заболеваниях периферических артерий и хронической сердечной недостаточности (длительность лечения — от 3 дней до 6 мес). Метаанализ показал, что назначение L-apгининa даже короткими курсами существенно увеличивает выраженность эндотелийзависимой вазодилатации плечевой артерии по сравнению с показателем при приеме плацебо, что свидетельствует об улучшении функции эндотелия [22]. L-аргинин позитивно влияет на функцию тромбоцитов на фоне гиперхолестеринемии, а именно — снижает агрегацию тромбоцитов и адгезию моноцитов [29].
В анализе 11 рандомизированных двойных слепых плацебо-контролируемых исследований с участием 387 пациентов низкие дозы L-аргинина продемонстрировали защитный эффект при ишемии/реперфузии, обеспечивали более низкую частоту периоперационных инфарктов миокарда и уменьшение длительности пребывания в отделении интенсивной терапии и стационаре [26].
Также получены положительные данные при кратковременном применении L-apгининa у пациентов с хронической ИБС: после инфузии 150 мкмоль/л L-apгининa у пациентов с ИБС отмечено увеличение диаметра просвета сосуда в стенозированном сегменте на 3–24 % [25].
Препарат Тиворель® — донатор оксида азота с усиленным комплексным действием на патогенез ИБС
Учитывая все вышеперечисленное, в целях коррекции энергетического обмена в кардиомиоцитах и эндотелиальной дисфункции фармацевтической компанией «Юрия-Фарм» был создан комбинированный препарат Тиворель®, содержащий 20 мг левокарнитина и 42 мг L-аргинина гидрохлорида в 1 мл раствора для инфузий (100 мл), предназначенный для применения в комплексной терапии ишемической болезни сердца, стенокардии, острого коронарного синдрома.
Левокарнитин играет важную роль в процессе окисления жирных кислот. При этом, выступая в качестве специфического кофактора, контролирует скорость окисления длинноцепочечных ЖК и облегчает их перенос через внутреннюю мембрану митохондрий, а затем из цитоплазмы. Тем самым предупреждает развитие цитотоксического эффекта. В условиях ишемии левокарнитин, удаляя из митохондрий избыток ацильных групп, способствует образованию малонилкоэнзима А. Поэтому достаточный уровень карнитина обеспечивает эффективную работу карнитинового челнока, увеличивая скорость β-окисления ЖК для восстановления энергобаланса клетки.
Аргинин, являясь субстратом для образования фермента NO-синтазы, катализирует синтез оксида азота в эндотелиоцитах, способствует улучшению функции эндотелия. Также уменьшает активацию и адгезию лейкоцитов и тромбоцитов, угнетает синтез молекул адгезии VCAV-1 и MCP-1, подавляет синтез эндотелина-1 — мощного вазоконстриктора и стимулятора пролиферации и миграции гладких миоцитов сосудистой стенки.
Таким образом, комплекс донатора оксида азота — L-аргинин, усиленный действием L-карнитина, представленный в виде готового раствора для инфузии Тиворель®, удовлетворяет потребность влияния на эндотелиальную дисфункцию и фокусировку на энергообеспечении кардиомиоцита, согласно современным взглядам на патогенез ИБС.
Эффективность введения препарата Тиворель® при остром коронарном синдроме без подъема сегмента ST была изучена И.П. Вакалюком (2016) в открытом рандомизированном сравнительном параллельном исследовании с участием 100 пациентов с данной патологией [25].
Пациенты основной группы (n = 50) кроме базисной терапии получали препарат Тиворель® 100 мл внутривенно капельно со скоростью 10 капель в 1 минуту за первые 10–15 мин (затем скорость введения можно было увеличивать до 30 капель в 1 минуту) 1 раз в сутки в течение 10 дней. Пациентам контрольной группы (n = 50) назначали только базисную терапию.
Результаты исследования показали, что препарат Тиворель®, назначенный в составе комплексной терапии, улучшает электрофизиологические свойства миокарда и предупреждает появление временных нарушений ЭКГ. Так, у пациентов основной группы уже в первые сутки после развития ОИМ реже регистрировались поздние потенциалы желудочков (ППЖ) — 9,6 % в сравнении с 19,8 % в контрольной группе. В ходе дальнейшего наблюдения ППЖ в контрольной группе исчезали, а на фоне лечения препаратом Тиворель® — не возникали, что позволило автору сделать вывод о наличии выраженного антиишемического эффекта препарата.
Также после проведенного лечения в основной группе, получающей препарат Тиворель®, достоверно уменьшилось количество желудочковых нарушений ритма, таких как групповая желудочковая экстрасистолия и желудочковая тахикардия; в 3 раза реже, чем в группе контроля, возникали атриовентрикулярные блокады.
Кроме того, автором исследования была отмечена положительная клиническая динамика ОКС: уменьшение частоты и тяжести приступов стенокардии, снижение уровня АД, повышение толерантности к физическим нагрузкам. В группе пациентов, получающих Тиворель®, реже возникали приступы ангинозной боли (20,8 % случаев в основной группе и 32,0 % — в контрольной); снижалась потребность в использовании наркотических анальгетиков — 22,1 и 36,2 % случаев соответственно.
В ходе исследования было установлено, что введение препарата Тиворель® в первые часы на фоне стандартной терапии ОКС без подъема сегмента ST приводит к уменьшению времени достижения пика активности КФК у больных основной группы: 13,5 ± 0,6 мккат/л против 17,1 ± 0,8 мккат/л у больных контрольной группы. Уровень МБ-КФК составил 9,9 ± 0,4 мккат/л и 13,9 ± 0,6 мккат/л соответственно.
Зона некротического поражения при этом была на 26,4 % меньше у больных основной группы по сравнению с контрольной, что было обусловлено сокращением периода нормализации активности КФК и МБ-КФК в сыворотке крови в среднем на 8,1 и 9,4 ч соответственно. Сравнительно раннее наступление пика активности кардиоспецифических ферментов (КФК, МБ-КФК), по мнению автора исследования, свидетельствует о более быстром ограничении зоны ишемии, а сокращение сроков их вымывания — о предупреждении дальнейшего повреждения кардиомиоцитов и распространения зоны некроза у больных основной группы.
Таким образом, ургентная терапия с применением препарата Тиворель® является патогенетически обоснованным методом, позволяющим уменьшить выраженность нарушений метаболизма миокарда при остром коронарном и реперфузионном синдроме. Левокарнитин в условиях гипоксии тормозит β-окисление жирных кислот. Уменьшение скорости их окисления положительно влияет на обмен веществ в ишемизированном миокарде за счет усиления производства альтернативной энергии путем окисления глюкозы. Этот путь позволяет намного эффективнее использовать ограниченное количество кислорода. Удаляя из митохондрий токсичные метаболиты ацетил-КоА, левокарнитин обеспечивает цитопротекторный эффект.
L-аргинин, уменьшая негативное воздействие оксидативного стресса на эндотелий сосудистой стенки и индуцируя образование оксида азота, восстанавливает функцию эндотелия сосудов, улучшает коронарный кровоток.
В исследовании И.П. Вакалюка добавление препарата Тиворель® к базисной терапии способствовало оптимизации ведения больных ОКС без подъема сегмента ST: наблюдался более быстрый регресс клинических проявлений ОКС, стабилизация состояния больных и снижение частоты развития осложнений. Препарат Тиворель® хорошо переносился пациентами, не вызывал серьезных побочных реакций. По критерию общей эффективности терапия с применением препарата Тиворель® превосходила стандартную терапию в лечении больных с ОКС без подъема сегмента ST.
Список литературы
Список литературы находится в редакции

/8_u.jpg)