Газета «Новости медицины и фармации» 13 (589) 2016
Вернуться к номеру
Тразодон у лікуванні депресії після інсульту
Авторы: Орос М.М., Луц В.В., Адамчо Н.Н.
Ужгородський національний університет
Мукачівська центральна районна лікарня
Рубрики: Неврология
Разделы: Справочник специалиста
Версия для печати
Статья опубликована на с. 10-12 (Укр.)
Вступ
Внаслідок мозкового інсульту (МІ) в Україні щорічно помирає від 40 000 до 45 000 осіб. У 2010 р. зареєстровані 39 694 випадки смерті від МІ, що становить 86,7 випадку на 100 тис. населення (в Європі цей показник — 37–47 на 100 тис. населення). Інсульт залишається провідною причиною інвалідизації населення країни. Близько 20 000 хворих щорічно стають інвалідами внаслідок цереброваскулярних захворювань. Інсульт накладає особливі обов’язки на членів сім’ї хворого, значно знижуючи їх працездатний потенціал, і лягає важким соціально-економічним тягарем на суспільство. Тільки 10–20 % хворих після інсульту повертаються до праці. Тому реабілітація після інсульту є дуже важливою для цих пацієнтів. До числа факторів, що негативно впливають на ефективність реабілітаційних заходів для хворих на інсульт, а отже, погіршують функціональний результат захворювання, є зміни в психоемоційної сфері та сфері вищих психічних функцій, такі як депресія й деменція після інсульту [14, 19, 30, 33, 48].
Постінсультна депресія (ПІД) — найбільш важливий предиктор поганого відновлення повсякденної активності та зниження якості життя після інсульту. Одним з основних механізмів негативного впливу депресивних розладів на успішність відновного лікування є зниження мотивації пацієнта щодо участі в реабілітаційних заходах. Більше того, розвиток ПІД знижує виживання після інсульту. Так, смертність пацієнтів із ПІД протягом року після інсульту на 50 % вища, ніж хворих без депресії [11, 51, 52]. ПІД була описана в 1980 р. Labi et al. як одне з можливих ускладнень інсульту. Депресія ускладнює оцінку неврологічного статусу хворого в клініці, значно погіршує якість життя пацієнтів з інсультом і вірогідно знижує ефективність реабілітаційних заходів (Varga et al., 2002; Mayo et al., 2002.) Одним з основних механізмів негативного впливу депресивних розладів на успішність відновного лікування є зниження мотивації пацієнта щодо участі в реабілітаційних заходах. Розвиток депресії, за даними літератури, знижує відсоток виживання після інсульту (Whyte et al., 2002; Charles et al., 2004; Williams et al., 2004).
Діагностика та варіанти постінсультної депресії
У більшості робіт підкреслюються методологічні труднощі в застосуванні об’єктивних шкал, що використовуються в психіатрії, для оцінки депресії у хворих після інсульту. Діагностика депресії повинна проводитися на підставі клінічного спостереження, бесіди з хворим, з урахуванням анамнестичних даних та об’єктивної інформації, отриманої від знайомих і родичів хворого, і на підставі встановлених діагностичних критеріїв МКХ-10 (DSM-5). Неврологи і лікарі загальної практики частіше стикаються з малою депресією або легким депресивним епізодом. При цьому для встановлення діагнозу досить наявності у хворого пригніченого настрою або втрати можливості отримувати задоволення протягом не менше двох тижнів і всього двох із 9 критеріїв. Ускладнюють діагностику ПІД когнітивні розлади, що розвиваються після інсульту, через те, що хворі не можуть самостійно описати свої емоції, сформулювати скарги. Анозогнозія може бути причиною того, що пацієнти заперечують депресивні скарги, незважаючи на те, що багато проявів депресії помітні для оточуючих. Тому Black et al. (1995) вважають за доцільне розширити діагностичні критерії ПІД і стверджувати її наявність тільки після повної оцінки когнітивного та психічного статусу. Іноді депресія після інсульту перебігає в прихованій, атиповій формі, маскуючись різноманітними психовегетативними та соматичними проявами. Іншим варіантом ПІД може бути реактивний стан пацієнта у відповідь на хворобу. Практично будь-яке захворювання, від якого людина страждає, обмежує її можливості, змушує відмовлятися від звичного способу життя, може призвести до розвитку депресивного стану.
Депресія після інсульту може розвинутися й у відповідь на медикаментозну терапію (Мосолов С.Н., 1995; Смулевіч А.Б. та співавт., 1997; Adams R.D.M. et al., 1997). Існує досить велика кількість медикаментозних засобів, що, впливаючи на нейромедіаторні процеси в центральній нервовій системі (ЦНС), призводять до розвитку депресивних станів. Багато з них досить часто використовуються при лікуванні неврологічних хворих (ряд гіпотензивних засобів, кортикостероїди, барбітурати, транквілізатори, нестероїдні протизапальні засоби, серцеві глікозиди та ін.). Останнім часом важливу роль у розвитку саме соматизованого варіанта депресії після інсульту відводять алекситимії (Мосолов С.Н., 1995; Смулевіч А.Б. та співавт., 1997) — невмінню хворого ідентифікувати й описати свої відчуття, тобто вербалізувати свої душевні переживання та емоції. Наявність алекситимії ускладнює спілкування із хворим і навіть виявлення типової депресії. За даними деяких дослідників, алекситимія частіше розвивається у пацієнтів з ураженням недомінантної півкулі головного мозку.
Патогенез постінсультної депресії
Однозначної думки про причини розвитку депресії у хворих з ураженням головного мозку на сьогодні немає. Результати численних досліджень вказують на те, що в основі психічних розладів, очевидно, лежать порушення синаптичної передачі. Головними є катехоламінова (норадреналінова та дофамінова), фенілетиламінова та індоламінова гіпотези. Кожна з них підкреслює переважно функціональну недостатність при депресіях однієї з моноамінових систем, хоча вони зазвичай не виключають супутніх змін в інших моноамінових системах мозку. Норадреналін і серотонін не є ні гальмівними, ні збудливими нейротрансмітерами в класичному варіанті, скоріше, вони чинять нейромодулюючу дію на інтегративні функції нейронів. У вивченні механізмів ПІД є певні труднощі. Так, не існує моделей депресії на лабораторних тваринах з ураженням головного мозку. По-друге, порушення можуть стосуватися не всіх ланок конкретної нейрохімічної системи і, отже, відображати не всі доступні для дослідника параметри. Слід мати на увазі, що скупчення нейронів, що продукують нейротрансмітери, як правило, локалізовані. Так, нервові клітини, що синтезують серотонін, розташовані в ядрах шва довгастого мозку, норадренергічні нейрони — в ділянці блакитної плями, дофамін-продукуючі клітини — в чорній субстанції і мезолімбічній ділянці. Ці структури мозку людини малодоступні для дослідження: наприклад, внаслідок малих розмірів і глибинного розташування вони не справляють помітного впливу на електричну активність головного мозку (ЕЕГ), так що прямо виявити їх дисфункцію елекрофізіологічними методами не є можливим (єдиною перспективною альтернативою є позитронно-емісійна томографія, ПЕТ). Більше того, допускається, що ключові нейротрансмітери, що відіграють первинну роль у походженні депресивних розладів, ще не знайдені, а медикаментозні впливи на норадреналін- і серотонінергічні системи лише модулюють чутливість внутрішньоклітинних месенджерів (цикло-АМФ) до цих сполук, у складі яких можуть бути названі деякі амінокислоти (насамперед гліцин), пептиди (ендорфін, пептид дельта-сну), паратгормон, а також гормони (адренокортикотропний гормон, адреналін, мелатонін) та інші моноаміни.
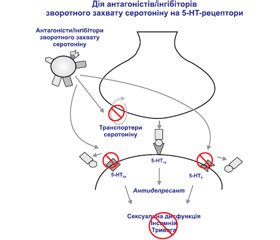
У наш час з’явилися неінвазивні методики, що дозволяють оцінити нейрохімічний статус головного мозку in vivo (SPECT, ПЕТ). За допомогою SPECT у ряді досліджень (Staley et al.) виявлено зниження рівня серотоніну в середньому мозку у пацієнтів із тяжкою депресією після інсульту. При проведенні ПЕТ виявлено, що концентрація 5-НТ2-рецепторів не змінюється при депресії, але значно збільшується у відповідь на антидепресивну терапію. Виявлено вірогідний кореляційний зв’язок із підвищенням концентрації 5-НТ2-рецепторів і редукцією депресивних симптомів. Не вирішено завдання вивчення серотонінергічного синапсу (оцінка синаптичного рівня 5-НТ, пресинаптичного і постсинаптичного маркерів — 5-НТ1А- і 5-НТ2А-рецепторів) (рис. 1).
Нейротрофічний фактор мозку (BDNF) разом із фактором росту нервів (NGF) бере участь у регуляції пластичності допамінергічних, холінергічних та серотонінергічних нейронів; зниження вмісту даних факторів у певних відділах мозку після інсульту також може бути причиною розвитку депресії.
У генетичних дослідженнях останніх років виявлена значуща кореляція між наявністю промоутерної зони транспортера серотоніну (serotonin transporter-linked promoter region, 5-HTTLPR) — варіантом геному і розвитком депресії після інсульту у хворих (Ramasubbu et al., 2006).
У ряді нейрохімічних досліджень було доведено, що при розвитку депресії після інсульту має місце підвищення продукції прозапальних цитокінів, таких як IL-1-бета, TNF-альфа, IL-18, у лімбічній ділянці, активація індоламін-2,3-діоксигенази, що призводить до виснаження серототіну в паралімбічній ділянці, вентролатеральних відділах лобової частки, полюсі скроневої частки і базальних гангліях (Spalletta et al., 2006).
Термін (період) інсульту як фактор ризику ПІД обговорюється в роботах багатьох авторів. Проведені дослідження показали наявність депресії вже в гострому періоді інсульту: у 25,6 % хворих — через 7–10 днів від початку захворювання, за даними Ramasubbu et al. (1998), до 27 %, за даними Berg et al. (2001). У ранньому відновному періоді інсульту (через 3–4 місяці) частота депресії збільшується до 30–53 % і зберігається високою через рік захворювання — до 42 % (Pohjasvaara et al., 1998; Kauhanen et al., 1999; Huff et al., 2001).
Тенденцію до розвитку депресії після 6 місяців захворювання відзначають більшість дослідників. Багатьма авторами описана вірогідна кореляція появи депресивних розладів залежно від терміну інсульту (найбільший відсоток ПІД діагностований у пізньому відновному періоді — 6–12 місяців після інсульту). За даними І.Б. Сорокіної (2005), Є.І. Гусєва та співавт. (2001), найбільша частота депресії (до 72,2 %) виявлена у хворих у пізньому відновному періоді інсульту.
Лікування постінсультної депресії
ПІД є частим ускладненням інсульту, але рідко діагностується і ще рідше корегується медикаментозно. Медикаментозна терапія депресії повинна розглядатися як складова частина процесу реабілітації в усіх хворих, які перенесли інсульт. Основним методом сучасного лікування депресії є призначення антидепресантів або тімоаналептиків. До антидепресантів зараховують засоби, здатні ліквідувати болісно знижений настрій і загальмованість психічної діяльності. Основне завдання будь-якого антидепресанту з урахуванням сучасної концепції депресії полягає в усуненні дефіциту моноамінів, в основному серотоніну, в ЦНС.
Ефективне застосування антидепресантів, зокрема трициклічних антидепресантів (ТЦА), у хворих із ПІД описано в 1990 р. Robison et al., що було доведено і в подальших дослідженнях — Gonzalez-Torracillas et al. (1995), W. Huff et al. (2001). Удосконалення підходів до лікування ПІД відбувається відповідно до розвитку моноамінової гіпотези депресивних станів, пов’язаних із дефіцитом серотоніну і норадреналіну в синаптичній щілині. Основною проблемою застосування ТЦА є побічні ефекти, тому для неврологів важливим питанням є підбір адекватного та безпечного антидепресанту.
У наш час найчастіше використовуються селективні інгібітори зворотного захвату серотоніну (СІЗЗС) при лікуванні депресій у хворих з інсультом, оскільки даний клас антидепресантів викликає менше несприятливих, а іноді й небезпечних побічних ефектів, властивих ТЦА, що пов’язані з антихолінергічною дією (затримка сечовипускання, запори, сплутаність свідомості, а також кардіотоксичність, ортостатична гіпотензія, потенційна летальність при передозуванні).
У пацієнтів із ПІД, як і у пацієнтів із депресією загалом, однією із найбільш частих причин страждань є безсоння, або порушення сну, що включає в себе як порушення засинання, так і раннє пробудження. Тому при призначенні препарату лікар повинен враховувати цей розлад. Відповідно до рекомендацій FDA, одним із найбільш оптимальних препаратів для лікування цих пацієнтів є тразодон. Це специфічний серотонінергічний антидепресант, що характеризується помірним інгібуванням зворотного захвату серотоніну і сильною блокадою серотонінових рецепторів (рис. 1). Крім антидепресивного впливу, він справляє дуже добрий анксіолітичний ефект, що можна порівняти з таким у хлордіазепоксиду та діазепаму, та ефективний вже в дозі 50 мг/день. З огляду на седативні властивості та сприятливий вплив на структуру сну застосовується також як снодійне переважно тоді, коли прийом снодійних препаратів бензодіазепінового ряду пов’язаний з підвищеним ризиком. Тразодон подовжує загальний час сну і час повільної фази сну, знижує кількість і тривалість нічних пробуджень і подовжує латентний період REM-фази сну (рис. 2).
Тразодон позитивно впливає на параметри сну, що змінюються при депресії. Його антидепресивна ефективність при короткочасному і довготривалому лікуванні порівнянна із СІЗЗС і ТЦА. Препарат приймають одноразово в добовій дозі на ніч. Клінічні дослідження попередніх років показують, що завдяки поєднаному впливу на різні групи рецепторів тразодон має значно менш виражені побічні ефекти та швидку терапевтичну відповідь. Дія препарату у третини хворих розвивається протягом першого тижня прийому, у 75 % — протягом двох тижнів. Важливим фактором є можливість використовувати тразодон в осіб похилого віку. Серед осіб похилого віку з депресією проводився порівняльний аналіз ефективності тразодону і ТЦА (амітриптиліну) (Altamura et al., 1989). У двох подвійних сліпих рандомізованих дослідженнях, проведених з метою порівняльного аналізу тразодону і СІЗЗС (флуоксетину), у двох препаратів також відзначалася аналогічна антидепресивна ефективність (Beasley et al., 1991; Falk et al., 1984). Крім того, при застосуванні флуоксетину була більша частота виникнення побічних ефектів (збудження, тривога, нервозність та безсоння) порівняно з тразодоном (Beasley et al., 1991). Однак седативну дію найчастіше відзначали у тразодону, ніж у флуоксетину (Beasley et al., 1991). За результатами ряду досліджень, зокрема Kaspera еt al., тразодон не поступається за ефективністю СІЗЗС, дані останнього огляду Saletu-Zyhlarz et al., проведеного на великій популяції хворих (n = 300–400), показали, що при помірній депресії монотерапія тразодоном характеризувалася такою ж ефективністю, що й комбінована терапія тразодоном із СІЗЗС. Ці режими приводили до однакового зниження бальності за шкалою HAM-D через 2 і 6 тижнів лікування (рис. 3).
Пацієнти з депресією можуть часто страждати від додаткових тривожних розладів, наприклад панічного і посттравматичного стресового розладу (ПТСР) (Wittchen et al., 1999). Фармакологічна терапія таких тривожних розладів включає два основні класи препаратів: бензодіазепіни й антидепресанти. Завдяки наявності снодійного/седативного ефекту тразодон протягом багатьох років став предметом досліджень у терапії тривожних розладів.
Відзначено, що тразодон ефективний у лікуванні пацієнтів із генералізованим тривожним розладом (Gale, 2002). У подвійному сліпому рандомізованому плацебо-контрольованому дослідженні спостерігалася аналогічна ефективність при прийомі тразодону, іміпраміну та діазепаму (Rickels et al., 1993) (рис. 4).
Хоча препаратами для терапії першої лінії при ПТСР є СІЗЗС, що не мають холіноблокуючої активності, і такий засіб, як тразодон, може використовуватися у разі неефективності або непереносимості СІЗЗС. У невеликому дослідженні, що включало 6 пацієнтів із ПТСР внаслідок бойових дій, тразодон у дозі 50–400 мг надавав поліпшення за загальною клінічною шкалою оцінки посттравматичного стресового розладу і самооцінкою пацієнтів за шкалою Девідсона для оцінки травми порівняно з вихідними значеннями (Hertzberg et al., 1999). У дослідженні за участю 60 осіб із ПТСР терапія тразодоном у дозі 50–200 мг сприяла зменшенню частоти нічних кошмарів і поліпшенню процесу засинання та підтримання сну (Warner et al., 2001).
Крім того, оцінювали ефективність тразодону ТКВ у пацієнтів похилого віку з депресією (Bayer et al., 1989). Через чотири тижні від початку терапії тразодоном ТКВ і ТНВ (обидві форми призначалися в добовій дозі одноразово на ніч, починаючи зі 100 мг, зі збільшенням до 200 мг/добу залежно від переносимості) відзначався аналогічний ефект, який оцінювався за змінами показників за HDRS і загальної оцінки тяжкості депресії порівняно з вихідними значеннями [55]. Протягом першого тижня лікування у пацієнтів, які отримували тразодон ТКВ, було зареєстровано меншу кількість побічних ефектів.
Висновок
Високий рівень інтраверсії і нейротизму взаємопов’язані між собою і сприяють розвитку депресивних порушень у постінсультних пацієнтів. Преморбідні риси, що призводять до депресивних розладів, проявляються в меланхолійних, дистимічних та емоційно-лабільних акцентуаціях особистості.
Депресія обтяжує перебіг інсульту, уповільнює відновлення порушених функцій у хворих, погіршує соціальну адаптацію, знижує якість життя пацієнтів. У ранній період інсульту поряд зі стандартним неврологічним обстеженням потрібно психіатричне обстеження, орієнтоване насамперед на виявлення депресивних симптомів, розпізнавання депресії як клінічних розладів. Депресія при інсульті вимагає самостійної терапії антидепресантами, психотерапії або їх поєднання. Лікування ПІД на фоні базисної терапії інсульту дозволяє знизити ступінь вираженості, тяжкість симптомів і скоротити тривалість постінсультного періоду. Три-чотирирічний катамнез пацієнтів із ПІД, які отримували антидепресанти, показав у цій групі осіб підвищення якості життя, полегшення тягаря хвороби і зниження показників смертності. Багатофункціональні властивості та механізми дії тразодону дають можливість застосовувати його для лікування ряду симптомів, пов’язаних із депресією, уникаючи при цьому таких побічних ефектів, як безсоння і тривога, що часто виникають або зберігаються при терапії СІЗЗС. Хоча тразодон часто призначається пацієнтам із депресією в малих дозах як седативний і снодійний засіб (у вигляді монотерапії або в комбінації з іншими антидепресантами), а також при станах, відмінних від депресії (наприклад, при первинному безсонні), клінічних доказів, що підтверджують його застосування в цих випадках, недостатньо, і ця можливість активно вивчається в даний час. Тразодон цінується в усьому світі завдяки не тільки своїй клінічній ефективності при широкому спектрі симптомів депресії, але також відсутності негативних впливів на сон як при монотерапії, так і в комбінації з іншими препаратами.
Вперше опубліковано в «Міжнародному неврологічному журналі», 2015, № 6
Список литературы
Список літератури знаходиться в редакції

/11_u.jpg)
/12_u.jpg)
/12_u2.jpg)