Газета «Новости медицины и фармации» Кардиология и ревматология (601) 2016 (тематический номер)
Вернуться к номеру
Уніфікований клінічний протокол первинної, вторинної (спеціалізованої) та третинної (високоспеціалізованої) медичної допомоги. Фібриляція передсердь. 2016
Рубрики: Ревматология, Кардиология
Разделы: Официальная информация
Версия для печати
Статтю опубліковано на с. 15-53
ЗАТВЕРДЖЕНО
Наказ Міністерства охорони здоров’я України
15.06.2016 № 597
Вступ
Уніфікований клінічний протокол первинної, вторинної (спеціалізованої) та третинної (високоспеціалізованої) медичної допомоги (УКПМД) «Фібриляція передсердь», розроблений з урахуванням сучасних вимог доказової медицини, розглядає особливості проведення діагностики та лікування фібриляції передсердь (ФП) в Україні з позиції забезпечення наступності видів медичної допомоги. УКПМД розроблений на основі адаптованої клінічної настанови «Фібриляція передсердь», яка ґрунтується на принципах доказової медицини з урахуванням сучасних міжнародних рекомендацій, відображених в клінічних настановах — третинних джерелах, а саме:
1. «Guidelines for the management of atrial fibrillation», ESC, 2010.
2. «2012 focused update of the ESC Guidelines for the management of atrial fibrillation», ESC, 2012.
Ознайомитися з адаптованою клінічною настановою можна за посиланням http://www.dec.gov.ua/mtd/reestr.html.
За формою, структурою та методичними підходами щодо використання вимог доказової медицини УКПМД відповідає вимогам «Методики розробки та впровадження медичних стандартів (уніфікованих клінічних протоколів) медичної допомоги на засадах доказової медицини», затвердженої наказом МОЗ України № 751 від 28 вересня 2012 року, зареєстрованої в Міністерстві юстиції України 29.11.2012 за № 2001/22313.
УКПМД розроблений мультидисциплінарною робочою групою, до якої увійшли представники різних медичних спеціальностей: лікарі загальної практики — сімейні лікарі, лікарі-терапевти, лікарі-кардіологи, лікарі-хірурги, лікарі-неврологи.
Відповідно до ліцензійних вимог та стандартів акредитації у закладі охорони здоров’я (ЗОЗ) має бути наявний Локальний протокол медичної допомоги (ЛПМД), що визначає взаємодію структурних підрозділів ЗОЗ, медичного персоналу тощо (локальний рівень).
Перелік скорочень
ААП — антиаритмічні препарати
АВК — антагоніст вітаміну K
АВ — атріовентрикулярний
АГ — артеріальна гіпертензія
АЛТ — аланінамінотрансфераза
АПТВ — активований парціальний тромбопластиновий час
АСК — ацетилсаліцилова кислота
АСТ — аспартатамінотрансфераза
АТ — артеріальний тиск
АЧТЧ — активований частковий тромбопластиновий час
БРА — блокатор рецепторів ангіотензину
в/в — внутрішньовенно
ЕІТ — електроімпульсна терапія
ЕКГ — електрокардіограма
ЕхоКГ — ехокардіографія
ІАПФ — інгібітор ангіотензинперетворюючого ферменту
ІХС — ішемічна хвороба серця
ЗОЗ — заклад охорони здоров’я
КМП — клінічний маршрут пацієнта
КПС — кардіоверсія постійним струмом
ЛП — ліве передсердя
ЛПМД — локальний протокол медичної допомоги
ЛШ — лівий шлуночок
МКХ-10 — Міжнародна статистична класифікація захворювань та пов’язаних порушень стану здоров’я (10-те видання)
МНВ — міжнародне нормалізоване відношення
МОЗ — України Міністерство охорони здоров’я України
НПАК — нові пероральні антикоагулянти
н/з — не застосовується
ПАК — пероральні антикоагулянти
ПТІ — протромбіновий індекс
СН — серцева недостатність
ТЕ — тромбоемболія
ТЕ-ЕхоКГ — трансезофагеальна ехокардіографія
ТП — тріпотіння передсердь
УКПМД — уніфікований клінічний протокол медичної допомоги
ФК — функціональний клас
ФП — фібриляція передсердь
ХОЗЛ — хронічне обструктивне захворювання легень
ЧСЕхоКГ — черезстравохідна ехокардіографія
ЧСС — частота серцевих скорочень
ЧШС — частота шлуночкових скорочень
EHRA — Європейська асоціація з питань серцевого ритму (European Heart Rhythm Association)
NYHA — Нью-Йоркська асоціація кардіологів (New York Heart Association)
І. Паспортна частина
1.1. Діагноз: фібриляція і тріпотіння передсердь
1.2. Код МКХ-10: І48.0 — фібриляція і тріпотіння передсердь
• пароксизмальна (ритм відновлюється самостійно в межах 7 діб)*
— брадисистолічна (частота шлуночкових скорочень менше 60 за хвилину)**
— тахісистолічна (частота шлуночкових скорочень більше 110 за хвилину)**
• персистуюча (епізод, що триває понад 7 діб, коли для відновлення синусового ритму необхідне втручання)*
— брадисистолічна (частота шлуночкових скорочень менше 60 за хвилину)**
— тахісистолічна (частота шлуночкових скорочень більше 110 за хвилину)**
• тривало персистуюча (епізод, що триває 1 рік та більше, коли синусовий ритм доцільно відновлювати)*
— брадисистолічна (частота шлуночкових скорочень менше 60 за хвилину)**
— тахісистолічна (частота шлуночкових скорочень більше 110 за хвилину)**
• постійна (коли синусовий ритм відновити неможливо або недоцільно)*
— брадисистолічна (частота шлуночкових скорочень менше 60 за хвилину)**
— тахісистолічна (частота шлуночкових скорочень більше 110 за хвилину)**
* — Усі форми можуть бути такими, що вперше виникли.
** — Вказується при клінічно значимому стані.
1.3. Протокол призначений для лікарів загальної практики — сімейних лікарів, лікарів-терапевтів, лікарів-кардіологів, лікарів інсультних відділень стаціонарів та відділень інтенсивної терапії, лікарів-неврологів, лікарів-нейрохірургів, лікарів-хірургів, лікарів з лікувальної фізкультури, лікарів-фізіотерапевтів, лікарів, що провадять господарську діяльність з медичної практики як фізичні особи — підприємці, середнього медичного персоналу, інших медичних працівників, які залучаються до медичної допомоги пацієнтам з фібриляцією передсердь, керівників закладів охорони здоров’я різних форм власності та підпорядкування.
1.4. Мета протоколу: організація надання медичної допомоги пацієнтам з фібриляцією передсердь, зменшення смертності та інвалідності внаслідок цього захворювання, покращення якості життя пацієнтів.
1.5. Дата складання протоколу: травень 2016 року.
1.6. Дата наступного перегляду: травень 2019 року.
1.7. Розробники:
Кравченко Василь Віталійович — директор Медичного департаменту МОЗ України, голова робочої групи;
Жарінов Олег Йосипович — завідувач кафедри функціональної діагностики Національної медичної академії післядипломної освіти імені П.Л. Шупика МОЗ України, д.мед.н., професор, головний позаштатний спеціаліст МОЗ України зі спеціальності «Функціональна діагностика», заступник голови з клінічних питань;
Талаєва Тетяна Володимирівна — Генеральний директор Державного підприємства «Державний експертний центр Міністерства охорони здоров’я України», д.мед.н., професор, заступник голови з координації діяльності мультидисциплінарної робочої групи;
Ліщишина Олена Михайлівна — директор Департаменту стандартизації медичних послуг Державного підприємства «Державний експертний центр Міністерства охорони здоров’я України», cт.н.с., к.мед.н., заступник голови з методологічного супроводу;
Божко Ляна Іванівна — заступник директора Центру екстреної медичної допомоги та медицини катастроф міста Києва;
Горова Елла Володимирівна — заступник начальника управління — начальник відділу контролю якості медичної допомоги управління ліцензування та якості медичної допомоги МОЗ України;
Гетьман Таїсія В’ячеславівна — старший науковий співробітник відділу аритмій серця Державної установи «Національний науковий центр «Інститут кардіології імені академіка М.Д. Стражеска» НАМН України», к.мед.н.;
Залевський Валерій Павлович — завідувач відділення хірургії складних порушень серцевого ритму і електрокардіостимуляції з рентгенопераційною Державної установи «Національний інститут серцево-судинної хірургії імені М.М. Амосова НАМН України», д.мед.н., професор;
Карпенко Юрій Іванович — завідувач кафедри внутрішньої медицини і серцево-судинної патології Одеського національного медичного університету, д.мед.н., професор;
Кіржнер Геннадій Давидович — доцент кафедри сімейної медицини Національного медичного університету ім. О.О. Богомольця;
Клименко Ліліана Вікторівна — асистент кафедри сімейної медицини та амбулаторно-поліклінічної допомоги Національної медичної академії післядипломної освіти імені П.Л. Шупика, к.мед.н.;
Матюха Лариса Федорівна — завідувач кафедри сімейної медицини і амбулаторно-поліклінічної допомоги Національної медичної академії післядипломної освіти імені П.Л. Шупика, д.мед.н., професор, головний позаштатний спеціаліст МОЗ України зі спеціальності «Загальна практика — сімейна медицина»;
Нетяженко Василь Захарович — завідувач кафедри пропедевтики внутрішніх хвороб № 1 Національного медичного університету імені О.О. Богомольця, член-кор. НАМН України, д.мед.н., професор, головний позаштатний спеціаліст МОЗ України зі спеціальності «Терапія»;
Острополець Наталія Андріївна — начальник відділу високоспеціалізованої медичної допомоги управління надання медичної допомоги дорослим Медичного департаменту Міністерства охорони здоров’я України;
Романова Олена Миколаївна — старший науковий співробітник відділу аритмій серця Державної установи «Національний науковий центр «Інститут кардіології імені академіка М.Д. Стражеска» НАМН України», к.мед.н.;
Руденко Костянтин Володимирович — заступник головного лікаря Державної установи «Національний інститут серцево-судинної хірургії імені М.М. Амосова НАМН України», д.мед.н., головний позаштатний спеціаліст МОЗ України зі спеціальності «Хірургія серця і магістральних судин у дорослих»;
Сичов Олег Сергійович — завідувач відділу аритмії серця, вчений секретар Державної установи «Національний науковий центр «Інститут кардіології імені академіка М.Д. Стражеска» НАМН України», головний спеціаліст НАМН України за спеціальністю «Функціональна діагностика», д.мед.н., професор;
Стичинський Олександр Сергійович — завідувач відділення електрофізіології та рентгенхірургічного лікування серцевих аритмій Державної установи «Національний інститут серцево-судинної хірургії імені М.М. Амосова НАМН України», д.мед.н., професор;
Титова Тетяна Анатоліївна — доцент кафедри сімейної медицини та амбулаторно-поліклінічної допомоги Національної медичної академії післядипломної освіти імені П.Л. Шупика, к.мед.н.;
Хіміон Людмила Вікторівна — завідувач кафедри сімейної медицини Національної медичної академії післядипломної освіти імені П.Л. Шупика;
Яблучанський Микола Іванович — завідувач кафедри внутрішньої медицини Харківського національного університету імені В.Н. Каразіна, д.мед.н., професор;
Ягенський Андрій Володимирович — керівник Волинського обласного центру кардіоваскулярної патології, д.мед.н., професор.
Методичний супровід та інформаційне забезпечення
Горох Євгеній Леонідович — начальник Відділу якості медичної допомоги та інформаційних технологій Державного підприємства «Державний експертний центр Міністерства охорони здоров’я України», к.техн.н.;
Мельник Євгенія Олександрівна — начальник Відділу доказової медицини Державного підприємства «Державний експертний центр Міністерства охорони здоров’я України»;
Мігель Олександр Володимирович — завідувач сектора економічної оцінки медичних технологій Державного підприємства «Державний експертний центр Міністерства охорони здоров’я України»;
Нетяженко Нонна Василівна — експерт Відділу доказової медицини Державного підприємства «Державний експертний центр Міністерства охорони здоров’я України»;
Шилкіна Олена Олександрівна — начальник Відділу методичного забезпечення новітніх технологій у сфері охорони здоров’я Державного підприємства «Державний експертний центр Міністерства охорони здоров’я України».
Адреса для листування: Департамент стандартизації медичних послуг Державного підприємства «Державний експертний центр МОЗ України», м. Київ. Електронна адреса: medstandards@dec.gov.ua.
Електронну версію документа можна завантажити на офіційному сайті Міністерства охорони здоров’я України: http://www.moz.gov.ua та на сайті http://www.dec.gov.ua.
Рецензенти:
Дзяк Георгій Вікторович — ректор Дніпропетровської медичної академії, д.мед.н., професор, академік НАМН України;
Долженко Марина Миколаївна — завідувач кафедри кардіології Національної медичної академії післядипломної освіти імені П.Л. Шупика, д.мед.н., професор;
Середюк Нестор Миколайович — професор кафедри внутрішньої медицини № 2 та медсестринства Державного вищого навчального закладу «Івано-Франківський національний медичний університет», д.мед.н., професор;
Тащук Віктор Корнійович — завідувач кафедри внутрішньої медицини, фізичної реабілітації, спортивної медицини та фізичного виховання Вищого державного навчального закладу України «Буковинський державний медичний університет», д.мед.н., професор.
1.8. Епідеміологія
Від фібриляції передсердь (ФП) страждають 1–2 % популяції, і ця цифра, ймовірно, зростатиме у наступні 50 років. У пацієнтів з гострим інсультом систематичне електрокардіографічне (ЕКГ) моніторування може дозволити виявити ФП у 1 з 20 пацієнтів, що значно більше тієї кількості осіб з ФП, яких можна було б виявити за допомогою стандартної ЕКГ у 12 відведеннях. Але ФП може тривалий час залишатися не діагностованою («німа» ФП), і багато пацієнтів з ФП ніколи не будуть госпіталізовані. Таким чином, істинна поширеність ФП, імовірно, ближче до 2 % популяції.
Поширеність ФП зростає з віком, збільшуючись від < 0,5 % серед осіб віком 40–50 років до 5–15 % серед осіб віком 80 років. Захворювання частіше зустрічається у чоловіків, ніж у жінок. Після досягнення 40-річного віку пожиттєвий ризик розвитку ФП у майбутньому становить близько 25 %. Поширеність та захворюваність на ФП у популяціях людей, які не належать до представників білої раси, вивчені гірше. Захворюваність на ФП зростає (13 % в останні два десятиріччя).
За даними популяційного дослідження, проведеного в ННЦ «Інститут кардіології імені академіка М.Д. Стражеска», встановлено, що за даними ЕКГ, зареєстрованої під час проведення епідеміологічного обстеження, поширеність ФП/тріпотіння передсердь (ТП) серед міського населення складає 1,2 %. Стандартизований показник поширеності ФП/ТП в міській популяції України становить 0,9 % (серед чоловіків — 0,9 %, серед жінок — 1,0 %). З урахуванням даних анкетування та аналізу медичної документації, зокрема, наданих пацієнтами ЕКГ, стандартизований показник поширеності ФП/ТП складає 2,5 % (2,7 % серед чоловіків і 2,4 % серед жінок). За даними, отриманими при однократній реєстрації ЕКГ, ФП/ТП в два рази частіше реєструється в міській популяції, ніж у сільській (1,2 і 0,6 % відповідно, р < 0,05). Результати аналізу двох досліджень, проведених з інтервалом 25 років, свідчать про шестикратне збільшення поширеності ФП/ТП серед міського населення України (від 0,2 до 1,2 %) і трикратне — в сільській популяції (від 0,2 до 0,6 %).
ІІ. Загальна частина
Особливості процесу надання медичної допомоги
ФП є найбільш поширеним хронічним порушенням ритму серця, яке зустрічається у 1–2 % людей в загальній популяції. На сьогодні від цієї аритмії страждають понад 6 мільйонів європейців, і очікується, що за наступні 50 років захворюваність на ФП стане принаймні удвічі вищою, враховуючи постаріння населення. Основною метою даного уніфікованого клінічного протоколу є створення ефективної системи надання медичної допомоги пацієнтам з ФП.
ФП у 5 разів збільшує ризик розвитку інсульту, і кожен п'ятий випадок інсульту обумовлений цією аритмією. Ішемічні інсульти на фоні ФП часто фатальні, а ті пацієнти, які виживають, зазвичай залишаються з більш вираженою інвалідністю через наслідки інсульту та більш схильні до повторних інсультів, ніж пацієнти, в яких інсульт виник через інші причини. Ризик смерті від інсульту, обумовленого ФП, удвічі більший, а вартість лікування такого пацієнта зростає у 1,5 раза. За останні роки була проведена масштабна дослідницька робота з вивчення підходів до профілактики інсульту, й отримані результати вплинули на рекомендації, наведені у цьому уніфікованому клінічному протоколі.
У більшості пацієнтів відбувається неминуче прогресування ФП до персистуючої або постійної форми, що асоційоване з подальшим погіршенням перебігу захворювання, яке може лежати в основі аритмії. За останній час дещо покращилося наше розуміння динаміки перебігу ФП від доклінічних порушень («аритмія, що формується») до її найбільш вираженого вияву — рефрактерної до лікування аритмії, асоційованої із серйозними несприятливими серцево-судинними подіями. Почала використовуватися найновіша стратегія «upstream» терапії (терапії «проти течії»), яка переслідує мету сповільнення або припинення прогресування ФП через вплив на серцево-судинне захворювання, яке лежить в її основі. Але на сьогодні отримані лише обмежені підтвердження успіху такої терапії, що і було відображене у цьому протоколі.
У багатьох клінічних дослідженнях показано, що стратегічна мета підтримання синусового ритму не має очевидних переваг порівняно з контролем частоти скорочень шлуночків (ЧШС). Не було виявлено також переваг жорсткого контролю частоти серцевих скорочень (ЧСС). З іншого боку, за даними реєстрів та ретроспективних аналізів баз даних клінічних досліджень, ФП асоціюється з тяжкими ускладненнями, а збереження синусового ритму серця — з покращенням виходів.
Проблема ранньої діагностики ФП суттєво ускладнюється часто «німим» характером порушень серцевого ритму. Приблизно у третини всіх пацієнтів з цим типом аритмії пацієнти не знають про її наявність через відсутність симптомів. Якомога більш раннє виявлення аритмії дає можливість своєчасно почати лікування, щоб захистити пацієнта не лише від безпосередніх наслідків аритмії, а й від формування рефрактерної до лікування ФП.
В останнє десятиріччя досить активно розроблялися різні нефармакологічні методи втручання з метою контролю виникнення ФП або обмеження її проявів, й у цьому напрямку були отримані суттєві досягнення. Була доведена ефективність у лікуванні ФП методик абляції, які зазвичай виконуються черезшкірно за допомогою катетера, особливо за рахунок зменшення тягаря симптомів, асоційованих з цією аритмією, причому у деяких пацієнтів такі втручання обумовлювали стійке запобігання рецидивам ФП. Застосування цих методик разом із впровадженням нових розробок у сфері медикаментозної терапії ФП, таких як нові пероральні антикоагулянти (НПАК) та більш безпечні протиаритмічні засоби, що зараз починають з’являтися, має допомогти покращити клінічні наслідки у пацієнтів з ФП.
ІІІ. Основна частина
3.1. Первинна медична допомога
3.1.1. Первинна профілактика
Положення протоколу
Пацієнти з ФП підлягають амбулаторному обстеженню та лікуванню за місцем проживання. Обстеження може проводитись у районних поліклініках, а при необхідності додаткових обстежень — у міських кардіологічних диспансерах та діагностичних центрах. При необхідності відновлення синусового ритму при персистуючій формі аритмії за неефективності амбулаторного лікування рутинними заходами та/або при порушеннях гемодинаміки, або для планової електроімпульсної терапії (ЕІТ) пацієнти підлягають госпіталізації в кардіологічний стаціонар, за відповідними показаннями — у відділення інтенсивної терапії.
Необхідні дії
Лікарю на етапі першого контакту з пацієнтами, які мають ту чи іншу форму ФП, необхідно вирішити декілька досить складних питань:
1. Чи потребує даний пацієнт відновлення синусового ритму, чи йому потрібна медикаментозна корекція ЧШС (враховується форма ФП, її тривалість, розміри лівого передсердя (ЛП), наявність тромбоемболічних ускладнень в анамнезі, наявність електролітних розладів і захворювань щитовидної залози тощо).
2. Оцініть безпеку відновлення синусового ритму на догоспітальному етапі:
— наявність клапанних вад серця, тяжких структурних уражень міокарда (постінфарктний кардіосклероз, дилатаційна кардіоміопатія, виражена гіпертрофія міокарда), захворювань щитовидної залози (гіпер- і гіпотиреоз), наявність і тяжкість хронічної серцевої недостатності.
3. Якщо пацієнт потребує відновлення синусового ритму, то чи потрібно це робити на догоспітальному етапі, чи ця процедура повинна проводитися в плановому порядку в стаціонарі після необхідної підготовки.
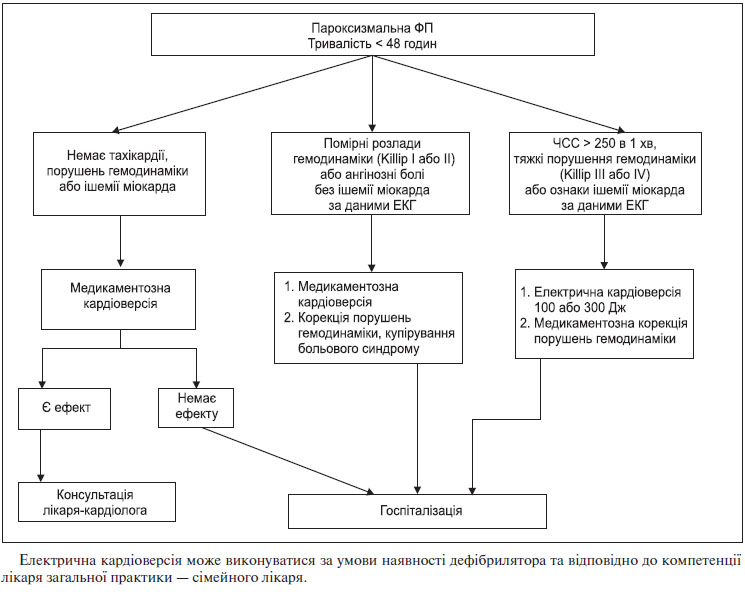
4. Якщо пацієнт потребує відновлення синусового ритму на догоспітальному етапі, необхідно вибрати спосіб його відновлення: медикаментозна або електрична кардіоверсія або ЕІТ (за умови наявності дефібрилятора та відповідно до компетенції лікаря загальної практики — сімейного лікаря).
Вирішення питання про необхідність відновлення синусового ритму на догоспітальному етапі залежить в першу чергу від поєднання 2 факторів: форми ФП і наявності та тяжкості розладів гемодинаміки та/або ішемії міокарда.
Показання до відновлення синусового ритму на догоспітальному етапі:
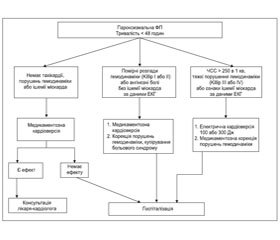
1. Тривалість ФП < 48 годин (Розділ 4, п. 4.1).
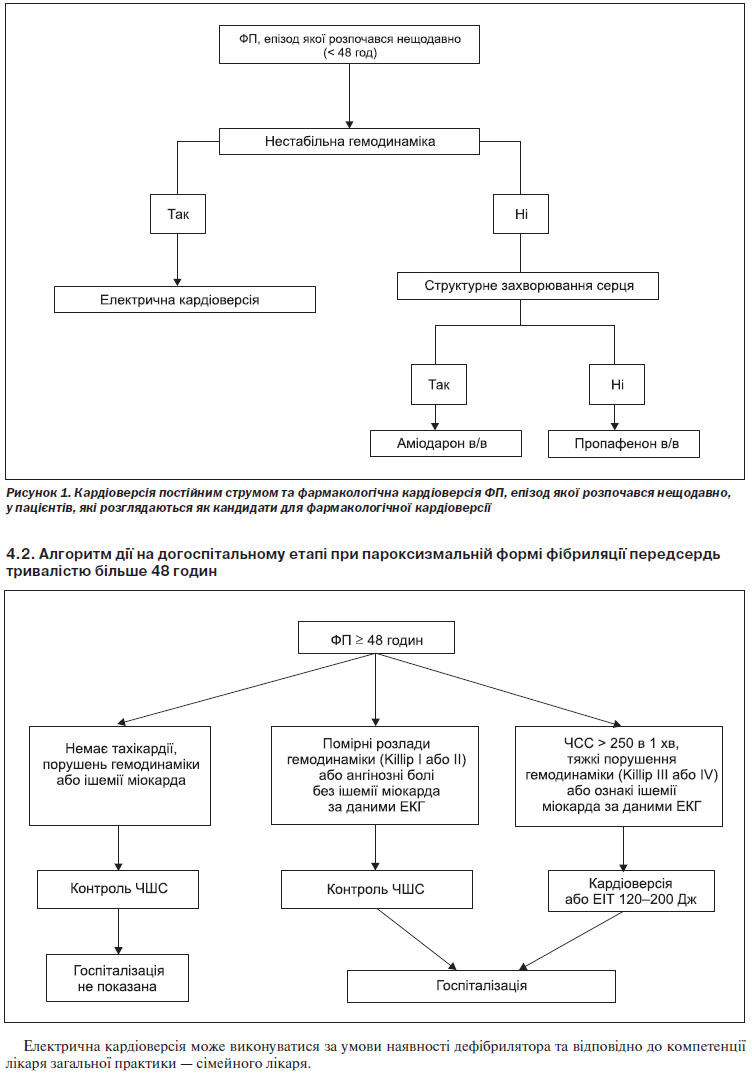
2. Тривалість ФП > 48 годин у поєднанні з: (Розділ 4, п. 4.2)
• вираженою задишкою і вологими хрипами в легенях;
• артеріальною гіпотензією < 90/60 мм рт.ст., спричиненою тахіаритмією;
• ангінозними болями, ознаками ішемії міокарда на ЕКГ (депресія сегмента ST, елевація ST, негативний зубець Т);
• ЧШС > 250 за 1 хв.
Показання до госпіталізації:
1. Вперше виявлена ФП.
2. Пароксизмальна ФП, коли немає ефекту препаратів, застосованих для відновлення синусового ритму.
3. Пароксизмальна ФП, що супроводжувалася розладами гемодинаміки або ішемією міокарда, яку вдалося зняти медикаментозно або за допомогою електричної кардіоверсії.
4. У випадку виникнення ускладнень антиаритмічної терапії.
5. Часто рецидивуючі пароксизми ФП (з метою підбору антиаритмічної терапії).
6. При постійній формі ФП госпіталізація показана при високій тахісистолії, посиленні проявів серцевої недостатності (для корекції медикаментозної терапії).
3.1.2. Діагностика
Положення протоколу
Обов’язкові дослідження:
1. Збір скарг та анамнезу;
2. Клінічний огляд;
3. Вимірювання АТ;
4. Лабораторне обстеження (загальні аналізи крові та сечі, АЛТ, АСТ, білірубін, креатинін, ліпідограма, тригліцериди, глюкоза крові, гормони щитовидної залози і гіпофізу (тиреотропний гормон), коагулограма, МНВ, АЧТЧ);
5. ЕКГ в 12 відведеннях;
6. ЕхоКГ;
7. Проба з фізичним навантаженням (за показаннями);
8. Добовий моніторинг ЕКГ або моніторинг подій.
Додаткові дослідження:
1. Електрофізіологічне дослідження;
2. ЧСЕхоКГ;
3. Рентгенографія органів грудної клітки;
4. Лабораторне обстеження: гормони щитовидної залози і гіпофізу (Т3, Т4), маркери запального процесу в міокарді.
Обґрунтування
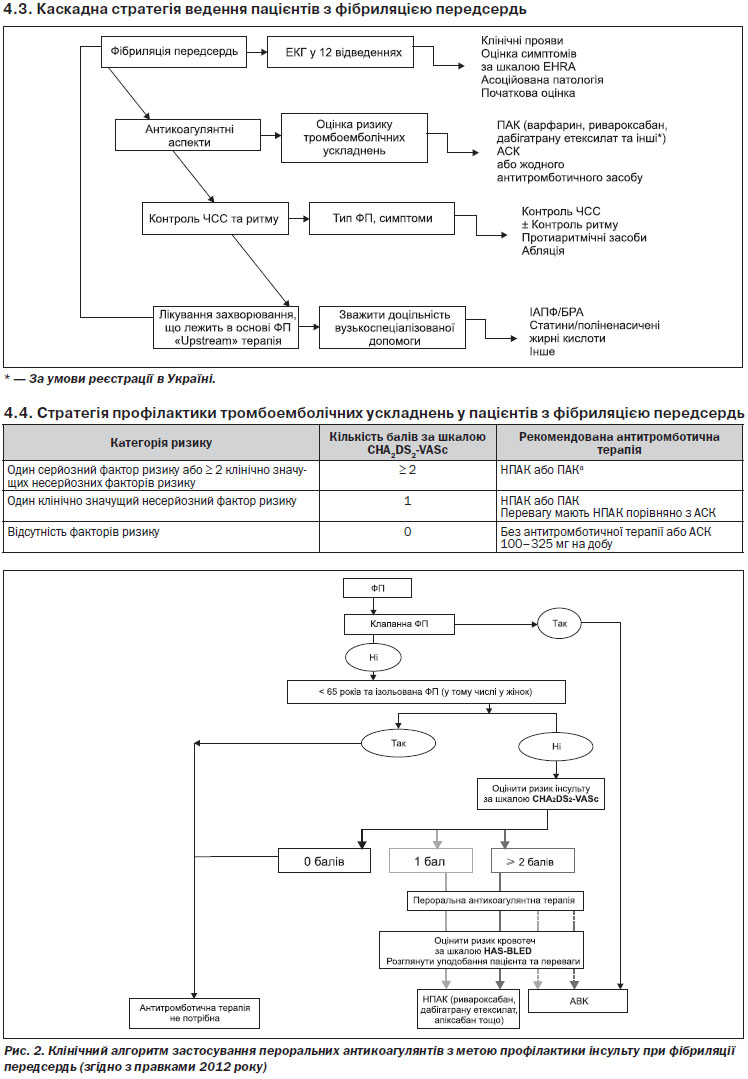
Ведення пацієнтів з ФП має на меті зменшення симптоматики та попередження тяжких ускладнень, асоційованих з ФП. Ці терапевтичні завдання повинні виконуватися паралельно, особливо при початковій маніфестації (вперше виявленої ФП). Профілактика пов’язаних з ФП ускладнень проводиться за допомогою антитромботичної терапії, контролю ЧШС та належного лікування супутніх серцевих захворювань. Ці методи лікування вже самі по собі можуть зменшувати симптоматику, але іноді для полегшення симптомів необхідне застосування додаткових методів лікування, що забезпечують контроль серцевого ритму, таких як кардіоверсія, прийом антиаритмічних препаратів (ААП) або абляція (рисунок 1).
Необхідні дії
Каскадна стратегія ведення пацієнтів з ФП — див. Розділ 4, п. 4.3.
Стратегія антитромботичної терапії
ФП — часта причина інсультів і тромбоемболії. Ризик смерті, інвалідність, рецидиви інсульту частіше виникають при інсультах на тлі ФП, ніж при інсультах іншої етіології. Тактика ведення пацієнтів з ФП має бути спрямована на оцінку ризику інсульту і використання відповідних засобів тромбопрофілактики.
3.1.3. Лікування
Положення протоколу
Алгоритм стратегії профілактики тромбоемболічних ускладнень у пацієнтів з ФП — див. Розділ 4, п. 4.4.
Пацієнти повинні отримувати комплексну терапію:
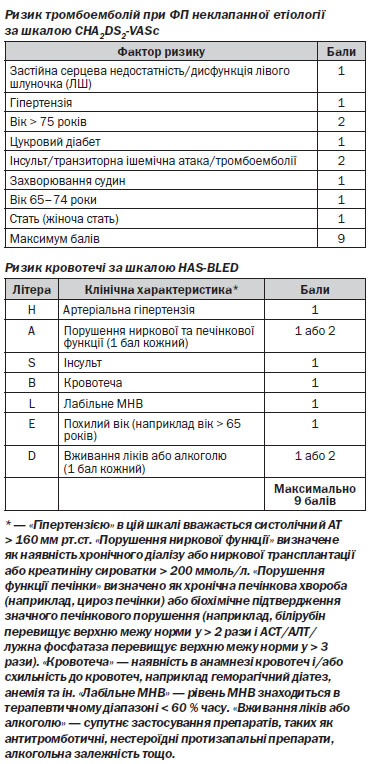
1. Антикоагулянтна терапія показана всім пацієнтам з ФП (СHА2DS2-Vasc ≥ 1) невизначено довго.
2. Надавати перевагу НПАК (СHА2DS2-Vasc ≥ 1).
3. Цільові рівні МНВ при застосуванні непрямих антикоагулянтів:
— Вік ≥ 60 років, цукровий діабет, ішемічна хвороба серця (ІХС) — МНВ 2,0–3,0, цільовий рівень 2,5;
— Вік ≥ 75 років, жіноча стать — МНВ 2,0–3,0, цільо-вий рівень 2,5;
— Хронічна серцева недостатність та/чи фракція викиду ≤ 35 % — МНВ 2,0–3,0, цільовий рівень 2,5;
— Тиреотоксикоз — МНВ 2,0–3,0, цільовий рівень 2,5;
— Артеріальна гіпертензія (АГ) — МНВ 2,0–3,0, цільовий рівень 2,5;
— Ревматичний мітральний стеноз — МНВ 2,5–3,5, цільовий рівень 3;
— Протезовані клапани серця — МНВ 2,5–3,5, цільовий рівень 3;
— Тромбоемболії в анамнезі — МНВ 2,5–3,5, цільовий рівень 3;
— Тромбоутворення в порожнинах серця за даними трансторакальної ЕхоКГ та ЧСЕхоКГ — МНВ 2,5–3,5, цільовий рівень 3.
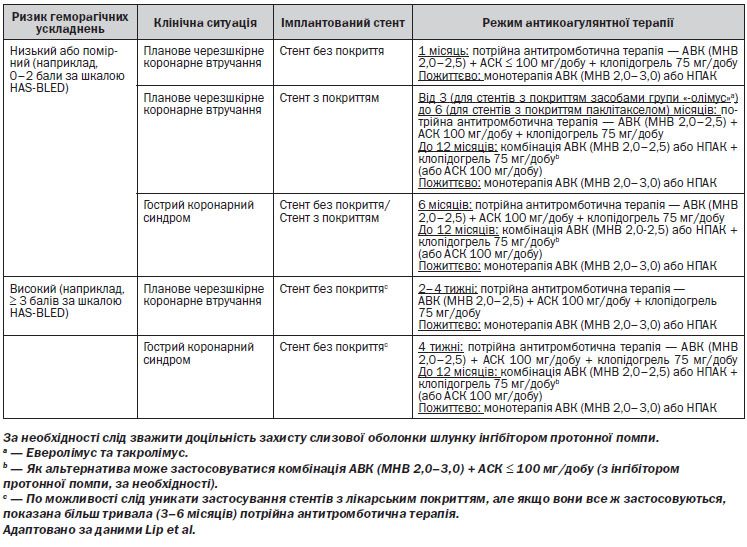
Профілактична антикоагулянтна терапія антагоністом вітаміну K (АВK) (варфарин) або НПАК показана пацієнтам з персистуючою формою ФП (тривалістю понад 48 годин), яким запланована медикаментозна або електрична кардіоверсія протягом трьох тижнів до (якщо у пацієнта при ЧСЕхоКГ не було виявлено тромбів, то цей строк може бути скорочений) і чотирьох тижнів після кардіоверсії. Коли наявні фактори високого ризику тромбоемболічних ускладнень у пацієнтів з постійною формою ФП, показана профілактична антикоагулянтна терапія НПАК або АВK. У пацієнтів з підвищеним ризиком кровотеч (HAS-BLED ≥ 3) потрібно надавати перевагу НПАК (апіксабан, ривароксабан, дабігатрану етексилат).
Коли неможливе використання варфарину або НПАК, можливий прийом комбінації клопідогрелю 75 мг та ацетилсаліцилової кислоти (АСК) 75 мг.
3. Для контролю ЧШС при ФП:
— у пацієнтів без додаткового шляху проведення — в/в β-адреноблокатори або недигідропіридинові блокатори кальцієвих каналів (верапаміл, дилтіазем);
— при серцевій недостатності — β-адреноблокато-ри ± дигоксин, аміодарон + дигоксин; β-адрено-блокатори + аміодарон;
— у пацієнтів з додатковим шляхом проведення — аміодарон;
— у пацієнтів з ХОЗЛ — дилтіазем, верапаміл, препарати наперстянки, селективні β-адреноблокатори;
1. ААП, показані для відновлення синусового ритму: пропафенон, аміодарон.
2. Фонове лікування після відновлення синусового ритму: ІАПФ/БРА/статини, β-блокатори за показаннями.
3. ААП, показані для збереження синусового ритму:
— При ідіопатичній ФП (у пацієнтів без структурних захворювань серця) — дронедарон, пропафенон, етацизин, соталол, при неефективності цих препаратів — аміодарон.
— При ФП у пацієнтів з АГ при відсутності гіпертрофії ЛШ — пропафенон, етацизин, соталол, при відсутності ефекту — аміодарон. При наявності значної гіпертрофії ЛШ — аміодарон.
— При ФП на тлі ІХС — дронедарон, соталол, аміо-дарон.
— При хронічній серцевій недостатності — аміодарон.
4. Препарати, що застосовуються при постійній формі ФП для контролю ЧШС:
— дигоксин — у пацієнтів з серцевою недостатністю та систолічною дисфункцією ЛШ, а також пацієнтам, які ведуть малорухомий (неактивний) спосіб життя (переважно в комбінації з β-адреноблокаторами);
— β-адреноблокатори — при ІХС, АГ, серцевій недостатності (за необхідності, в комбінації з дигоксином);
— недигідропіридинові антагоністи кальцію — при АГ, ІХС, ХОЗЛ, за наявності протипоказань до β-блокаторів;
— соталол, аміодарон — при неефективності вказаних препаратів або при наявності додаткових шляхів проведення.
5. Електрична кардіоверсія.
1) Планова електрична кардіоверсія показана:
— при неефективності медикаментозної терапії у пацієнтів з персистуючої ФП;
— непереносимості ААП або при ризику, пов’язаному з їх призначенням;
— прогресуванні серцевої недостатності, погіршенні кровопостачання серця, мозку, нижніх кінцівок, що спричинені тахіаритмією;
— наявності даних про те, що лише кардіоверсія була раніше ефективна для відновлення синусового ритму при ФП.
2) Невідкладна електрична кардіоверсія показана:
— при пароксизмі ФП з високою ЧШС на тлі гострого інфаркту міокарда, нестабільної стенокардії;
— при пароксизмі ФП, який супроводжується симптоматичною гіпотензією, гострою або прогресуючою хронічною серцевою недостатністю;
— тяжкому пароксизмі ФП, який не піддається медикаментозному лікуванню.
6. Черезстравохідна електрокардіостимуляція — з метою припинення епізоду ТП (за умови насичення ААП).
7. В амбулаторних умовах введення прокаїнаміду для відновлення синусового ритму протипоказане.
8. Пацієнтам, які не переносять АСК, замість неї показані тієнопіридинові антитромбоцитарні препарати.
9. Імплантація кардіостимулятора у відповідному режимі при наявності супутніх порушень АВ-провідності та синдрому слабості синусового вузла.
10. Катетерне лікування:
— при неефективності медикаментозної терапії в адекватних дозах;
— аритмогенній дії ААП;
— симптомних нападах ФП і ТП;
— поєднанні ФП із синдромом передчасного збудження шлуночків;
— ізольованому ТП.
11. Пацієнти потребують адекватного лікування супутніх захворювань, АГ, уражень щитовидної залози та цукрового діабету.
Обґрунтування
Невідкладна допомога: контроль частоти серцевих скорочень та серцевого ритму
Невідкладні заходи при пароксизмі ФП спрямовані на забезпечення захисту від тромбоемболічних подій та швидке покращення функції серця. Залежно від тяжкості спричинених ФП симптомів обирається тактика невідкладного відновлення синусового ритму (у тяжких пацієнтів із скомпрометованою гемодинамікою) або інтенсивної терапії з контролем ЧСС (у більшості інших пацієнтів).
Контроль частоти серцевих скорочень
Неадекватна частота скорочень шлуночків та нерегулярний серцевий ритм можуть обумовлювати симптоми та тяжкі гемодинамічні порушення у пацієнтів з ФП. Пацієнти з частою відповіддю шлуночків зазвичай потребують невідкладної терапії з контролем ЧСС. У стабільних пацієнтів такий контроль може бути досягнутий пероральним застосуванням β-блокаторів або недигідропіридинових блокаторів кальцієвих каналів. У тяжких пацієнтів із скомпрометованою гемодинамікою дуже корисними для швидкого сповільнення проведення імпульсів через атріовентрикулярний вузол можуть бути верапаміл або метопролол у внутрішньовенній формі. У невідкладній клінічній ситуації цільовою ЧШС зазвичай є 80–100 за хвилину. В окремих пацієнтів може застосовуватися аміодарон, особливо у випадку зниженої функції ЛШ. ФП із низькою ЧШС може відповідати на атропін (0,5–2 мг в/в), але багато пацієнтів з симптомною брадіаритмією можуть потребувати кардіоверсії або імплантації тимчасового водія ритму з електродом у правому шлуночку.
Після невідкладного початку терапії з контролем ЧСС завжди необхідно передбачити стратегію подальшого контролю ЧСС.
Медикаментозна кардіоверсія
Багато епізодів ФП завершуються спонтанно в перші години або дні після свого початку. За наявності медичних показань (наприклад, у тяжких пацієнтів із скомпрометованою гемодинамікою) у пацієнтів, які залишаються симптомними, незважаючи на адекватний контроль ЧСС, або у пацієнтів, для яких показана терапія з контролем серцевого ритму, може бути здійснена медикаментозна кардіоверсія ФП за допомогою болюсного введення протиаритмічного препарату.
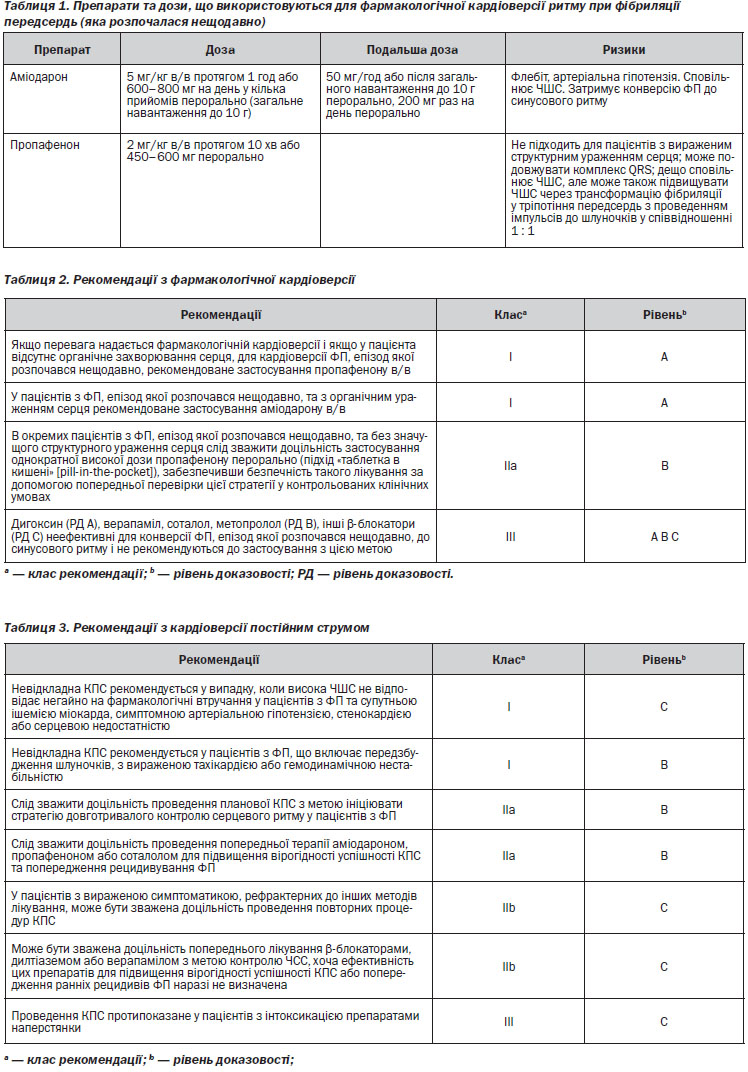
Частота успішних конверсій ритму при застосуванні протиаритмічних препаратів є нижчою, ніж на фоні ЕІТ, але в цьому випадку не потрібне седування пацієнта або застосування наркозу; надалі це може сприяти вибору стратегії лікування ААП для попередження рецидиву ФП. Більшість пацієнтів, яким виконується медикаментозна кардіоверсія, потребують постійного медичного нагляду та ЕКГ-моніторування під час інфузії препарату та протягом певного періоду часу після її завершення (зазвичай протягом терміну, який відповідає приблизно половині періоду напіввиведення цього препарату) для виявлення проаритмічних подій, таких як шлуночкова проаритмія, відмова синусового вузла або атріовентрикулярна блокада. В окремих амбулаторних пацієнтів може бути прийнятною повторна пероральна фармакологічна кардіоверсія (підхід «таблетка в кишені» [pill-in-the-pocket]), оскільки раніше була показана безпечність такого втручання. Для проведення фармакологічної кардіоверсії можуть бути використані декілька препаратів (таблиця 1, розділ 4).
У кількох плацебо-контрольованих рандомізованих дослідженнях була показана ефективність пропафенону для відновлення синусового ритму при пароксизмі ФП. Через кілька годин після в/в введення препарату (2 мг/кг протягом 10–20 хв) очікувана частота кардіоверсії становила від 41 до 91 %. Відповідна частота успішних конверсій у пацієнтів, які отримували плацебо, становила 10–29 %. Водночас пропафенон виявляв лише обмежену ефективність щодо конверсії персистуючої ФП та ТП. Слід уникати призначення пропафенону пацієнтам із серцевими захворюваннями, при яких спостерігається порушення функції ЛШ та ішемія міокарда. Крім того, беручи до уваги слабкі β-блокуючі властивості пропафенону, слід уникати його призначення при тяжких обструктивних захворюваннях легень. Час від введення препарату до конверсії коливається від 30 хв до 2 год. Пропафенон також ефективний при пероральному застосуванні (конверсія відбувається за період часу від 2 до 6 год).
При застосуванні аміодарону кардіоверсія відбувається кількома годинами пізніше, аніж при застосуванні пропафенону. Приблизна частота успішних кардіоверсій за період 24 год у пацієнтів, які отримували плацебо, становила 40–60 %, у той час як після застосування аміодарону вона зростала до 80–90 %. Аміодарон не дає можливості виконати кардіоверсію у короткі або середні строки. Але через 24 год цей препарат продемонстрував кращу ефективність у порівнянні з конт-ролем за результатами деяких, хоча і не всіх, рандомізованих досліджень.
Інші препарати
В одному дослідженні, де порівнювалася ефективність плацебо та двох різних доз соталолу, частота успішних конверсій становила 14 % (2/14 пацієнтів), 11 % (2/11 пацієнтів) та 13 % (2/16 пацієнтів). Ця різниця між групами не була статистично значущою.
В одному дослідженні, в якому взяли участь 79 пацієнтів з ФП (без групи контролю), після в/в введення β-блокатора (метопрололу) конверсія до синусового ритму відбулася у 13 %. Не було опубліковано яких-небудь значущих даних щодо такого ефекту для атенололу, карведилолу, бісопрололу, пропранололу або есмололу.
До цього часу не було опубліковано результатів жодного рандомізованого контрольованого дослідження з достатньою кількістю учасників, в якому порівнювалися б верапаміл та плацебо. У дослідженнях, в яких верапаміл порівнювався з флекаїнідом, есмололом або пропафеноном, конверсія до синусового ритму відбулася відповідно у 6, 12 та 14 % з 17, 24 та 29 пацієнтів, які отримали верапаміл.
Дигоксин не ефективний для припинення ФП. В одному дослідженні, де взяли участь 239 пацієнтів з ФП, епізод якої тривав < 7 діб, частота успішних конверсій за 16 год становила 46 % у групі плацебо та 51 % серед пацієнтів, які отримували дигоксин; у двох інших дослідженнях, де взяли участь 40 та 82 пацієнти, частота успішних конверсій після застосування плацебо та дигоксину становила 40 % проти 47 % і 14 % проти 32 % відповідно.
Таким чином, існують достатньо чіткі підтвердження того, що дигоксин не є ефективним для відновлення синусового ритму. Хоча отримані для верапамілу доказові дані менш переконливі, вони свідчать про незначну ефективність препарату щодо відновлення ритму. В одному дослідженні була показана відсутність ефективності соталолу. Метопролол не виявляв ефективності у жодному дослідженні, і не було отримано яких-небудь доказових даних з цього питання для інших β-блокаторів.
Підхід «таблетка в кишені» [pill-in-the-pocket]
У стаціонарних умовах пероральне застосування пропафенону дозволяло виконати кардіоверсію у 55 з 119 (45 %) пацієнтів протягом 3 год після прийому препарату у порівнянні з 22 з 121 (18 %) пацієнтами з групи плацебо. У менших дослідженнях подібний ефект було продемонстровано як для пропафенону, так і для флекаїніду.
За результатами одного дослідження з середньою кількістю учасників, пероральні препарати пропафенону (450–600 мг) або флекаїніду (200–300 мг) можуть безпечно (1/569 епізод конверсії до ТП зі швидким проведенням імпульсу) та ефективно (94 %, 534/569 епізоди конверсії до синусового ритму) прийматися пацієнтом в амбулаторних умовах.
Цей підхід може використовуватися в окремих пацієнтів з вираженою симптоматикою та нечастими (наприклад, від одного разу на місяць до одного разу на рік) епізодами ФП. Для запровадження підходу «таблетка в кишені» [pill-in-the-pocket] необхідно проводити скринінг серед пацієнтів щодо показань та протипоказань та перевірити ефективність та безпечність цієї стратегії перорального лікування в стаціонарних умовах. Пацієнтів слід інструктувати приймати пропафенон при появі симптомів ФП.
Кардіоверсія постійним струмом
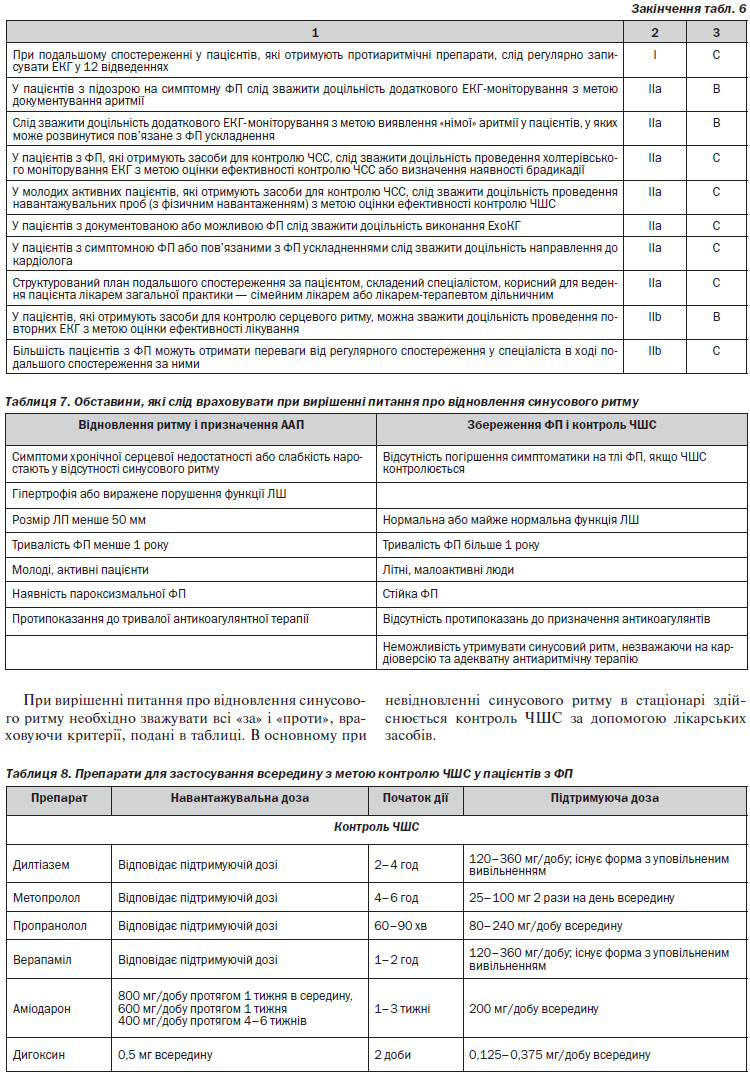
Кардіоверсія постійним струмом (КПС) є ефективним методом конверсії ФП до синусового ритму.
Процедура
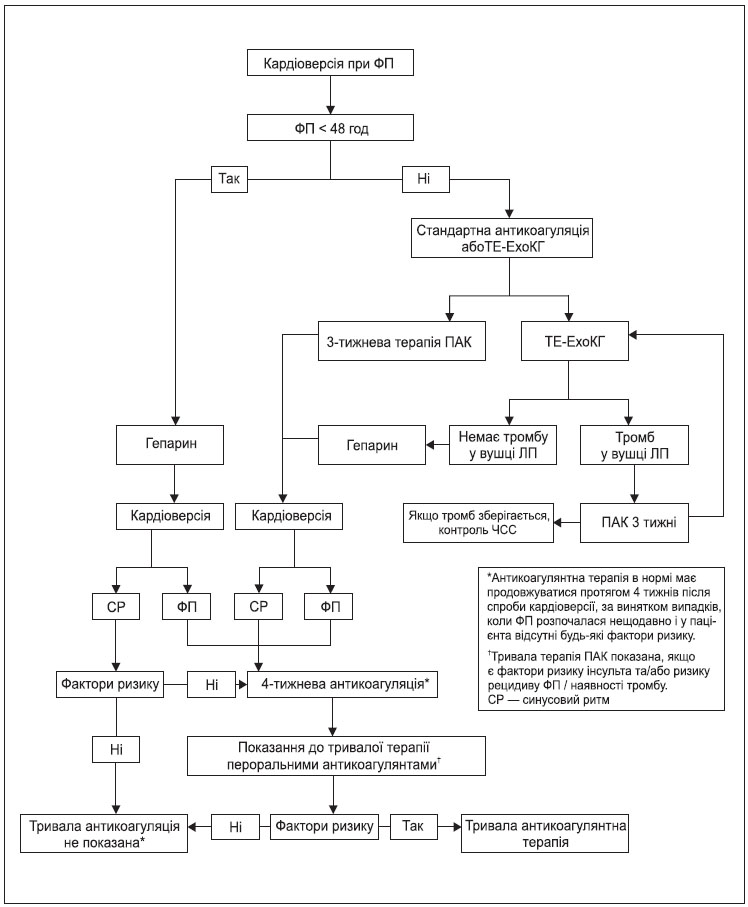
За винятком випадків, коли за 3 тижні до процедури пацієнту була проведена адекватна і задокументована антикоагулянтна терапія або коли епізод ФП розпочався < 48 год тому, слід виконати ТЕ-ЕхоКГ для виключення наявності тромбу у передсерді (див. рисунок 5). У випадку виникнення асистолії або брадикардії може знадобитися катетер з електродами водія ритму або зовнішній водій ритму.
Успішна КПС, як правило, визначається припиненням ФП, що документується при наявності двох або більше послідовних зубців P після електричного розряду. Доказові дані свідчать на користь використання зовнішніх біфазних дефібриляторів, враховуючи те, що вони вимагають застосування менш сильних електричних імпульсів та мають більшу ефективність у порівнянні з монофазними дефібриляторами. У дослідженнях було продемонстровано статистично значуще зростання частоти успішної конверсії після першого електричного розряду при КПС у пацієнтів з ФП при застосуванні біфазних імпульсів.
На сьогодні зазвичай застосовуються дві традиційні схеми розміщення електродів. У кількох дослідженнях було показано, що передньозаднє розміщення електродів є більш ефективним, ніж передньобічне. Якщо перший електричний розряд не успішний щодо припинення аритмії, слід змінити розміщення електродів і повторити спробу кардіоверсії.
КПС може проводитися амбулаторно у пацієнтів, у яких стабільна гемодинаміка та відсутні тяжкі захворювання серця. Після процедури необхідне моніторування ЕКГ та гемодинамічних показників протягом принаймні 3 год, перш ніж пацієнту буде дозволено залишити клініку.
Внутрішня кардіоверсія може бути корисною у деяких особливих клінічних ситуаціях, наприклад, коли пацієнту проводиться інвазивне втручання і катетери для проведення кардіоверсії можуть бути введені без виконання додаткових судинних доступів, але такий метод практично не застосовується з метою кардіоверсії, за винятком випадків, коли наявні імплантовані дефібрилятори.
Ускладнення
Ризики та ускладнення кардіоверсії асоційовані головним чином з тромбоемболічними подіями, післякардіоверсійними аритміями та ризиками, обумовленими загальним знеболюванням. Процедура асоційована з ризиком тромбоемболічних ускладнень на рівні 1–2 %, який може бути зменшений за допомогою належної антикоагулянтної терапії протягом кількох тижнів перед кардіоверсією або за допомогою виключення наявності тромбу у ЛП перед процедурою. Частим ускладненням є опіки шкіри. У пацієнтів з дисфункцією синусового вузла, особливо у пацієнтів похилого віку з органічними ураженнями серця, може виникнути пролонгована відмова синусового вузла без адекватного замісного ритму. На фоні гіпокаліємії, інтоксикації препаратами наперстянки або незадовільної синхронізації можуть виникнути небезпечні для життя аритмії, такі як шлуночкова тахікардія та фібриляція шлуночків. Через седацію пацієнт може перенести гіпоксію або гіповентиляцію, але артеріальна гіпотензія і набряк легень зустрічаються рідко.
Кардіоверсія у пацієнтів з імплантованими водіями ритму та дефібриляторами
Пластинка електроду має бути розміщена на відстані не менше 8 см від батареї водія ритму і рекомендоване передньозаднє розташування пластинок. Перевагу мають біфазні електричні розряди. У пацієнтів, залежних від роботи імплантованого водія ритму, слід передбачити можливе зростання порогу стимуляції. Цим пацієнтам показане ретельне моніторування. Після кардіоверсії імплантований прилад слід перевірити та оцінити на предмет забезпечення його нормального функціонування.
Рецидиви ФП після кардіоверсії
Рецидиви ФП після КПС можна розділити на три фази:
(1) Негайні рецидиви, які виникають у перші кілька хвилин після КПС.
(2) Ранні рецидиви, які виникають у перші 5 днів після КПС.
(3) Пізні рецидиви, які виникають пізніше.
До факторів, що сприяють рецидивуванню ФП, належать вік, тривалість ФП до проведення кардіоверсії, кількість попередніх рецидивів, збільшені розміри ЛП або погіршена функція ЛП та наявність коронарного атеросклерозу або ураження клапана легеневої артерії чи мітрального клапана. Передсердні ектопічні скорочення з послідовністю «довгий-короткий», більш висока ЧСС та варіації передсердного проведення підвищують ризик рецидивування ФП.
Попереднє лікування протиаритмічними препаратами, такими як аміодарон, соталол та пропафенон, збільшує ймовірність відновлення синусового ритму.
У деяких пацієнтів з вираженою симптоматикою, в яких епізоди ФП розвиваються нечасто (наприклад, один або два рази на рік), настійно рекомендується надавати перевагу проведенню повторних кардіоверсій як довготривалої стратегії контролю серцевого ритму перед вибором стратегії контролю ЧСС або інших підходів до контролю ритму, які можуть бути незручними для таких пацієнтів.
Найчастіше при вперше виявленій ФП застосовується наступна тактика:
1. Контроль ЧШС у міру необхідності, найчастіше за допомогою β-адреноблокаторів та/або дигоксину.
2. Антикоагулянти (варфарин) або дезагреганти (АСК) для профілактики тромбоемболічних ускладнень.
3. Обговорення питання антиаритмічної терапії.
4. Обговорення питання про доцільність відновлення синусового ритму (див. Розділ 4, таблиця 7).
Після відновлення синусового ритму на 1 місяць призначається ААП з метою попередження рецидиву ФП (тривала терапія не потрібна) та антикоагулянти або дезагреганти.
Необхідні дії
Алгоритм фармакотерапії ФП, що виникла вперше — див. Розділ 4, п. 4.5.
3.1.4. Диспансерне спостереження
Ведення пацієнта на початковому етапі
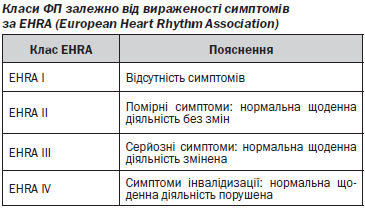
У пацієнта, в якого є підозрювана або відома ФП, необхідно ретельно вивчити медичний анамнез (таблиця 5). Ведення пацієнта у гострому періоді ФП повинно бути направленим на полегшення симптомів та оцінку ризику, асоційованого з ФП. Клінічне обстеження має включати визначення класу проявів аритмії за шкалою EHRA, оцінку ризику інсульту та діагностичний пошук станів, які сприяють ФП, та ускладнень аритмії. Необхідно вивчити дані ЕКГ у 12 відведеннях для виявлення ознак органічної патології серця (наприклад, гострого або перенесеного раніше інфаркту міокарда, гіпертрофії ЛШ, блокади ніжки пучка Гіса або шлуночкового передзбудження, ознак кардіоміопатії або ішемії).
3.2. Вторинна (спеціалізована) медична допомога
3.2.1. Профілактика
Положення протоколу
Спеціаліст, який займається веденням пацієнта з ФП, повинен не тільки проводити початкову оцінку його стану та призначити належне лікування, але також розробити структурований план подальшого спостереження за пацієнтом.
Нижче перераховані важливі фактори, які слід брати до уваги при подальшому спостереженні за пацієнтом з ФП:
• Чи змінився профіль ризику пацієнта (наприклад, у випадку розвитку цукрового діабету або АГ, яких раніше не було), особливо у контексті призначення антикоагулянтної терапії?
• Чи необхідна зараз антикоагулянтна терапія — чи не з’явилися у пацієнта нові фактори ризику або чи не зникла необхідність в антикоагулянтах, наприклад, після кардіоверсії у пацієнта з низьким тромбоемболічним ризиком?
• Чи зменшується симптоматика пацієнта на фоні терапії; якщо ні, то чи слід зважити доцільність іншої стратегії лікування?
• Чи є які-небудь ознаки проаритмії або ризик проаритмії; якщо так, то чи слід зменшити дозу протиаритмічного засобу або перейти до іншої стратегії лікування?
• Чи прогресувала пароксизмальна ФП до персистуючої/постійної форми, незважаючи на прийом протиаритмічних засобів; у такому випадку чи слід зважити доцільність застосування іншої стратегії лікування?
• Чи ефективний застосовуваний підхід контролю ЧСС; чи досягнутий цільовий рівень ЧСС у стані спокою та при фізичному навантаженні?
На візитах подальшого спостереження слід виконувати ЕКГ у 12 відведеннях для документування ритму та ЧСС та оцінки прогресування захворювання. Для пацієнтів, які приймають протиаритмічні засоби, важливо оцінювати потенційні ЕКГ-провісники проаритмії, такі як подовження інтервалів PR, QRS або QT, нестійка шлуночкова тахікардія або паузи (випадіння одного або кількох суміжних шлуночкових комплексів, епізоди асистолії). Якщо у пацієнта спостерігається погіршення симптоматики, слід зважити доцільність проведення повторних аналізів крові, тривалої ЕКГ-реєстрації та повторних ЕКГ.
Пацієнт повинен бути повністю інформований про переваги і недоліки різних методів лікування — антикоагулянтної терапії, засобів для контролю ЧСС, протиаритмічних засобів або інтервенційного лікування. Також доречно повідомити пацієнту з ізольованою або ідіопатичною ФП про сприятливий прогноз, якщо буде виключена наявність серцево-судинного захворювання.
Необхідні дії
Рекомендації з діагностики та початкового ведення ФП — див. Розділ 4, таблиця 6.
3.2.2. Діагностика
Необхідні дії
Програма діагностики фібриляції (тріпотіння) передсердь
1. Збір скарг та анамнезу.
2. Клінічний огляд.
3. Вимірювання АТ.
4. Лабораторне обстеження:
• загальний аналіз крові;
• загальний аналіз сечі;
• АЛТ;
• АСТ;
• білірубін;
• креатинін;
• ліпідограма та тригліцериди;
• глюкоза крові;
• гормони щитовидної залози і гіпофізу (Т3, Т4 вільний, тиреотропний гормон);
• коагулограма та МНВ, АЧТЧ.
5. ЕКГ у 12 відведеннях.
6. ЕхоКГ.
7. Проба з фізичним навантаженням.
8. Добовий моніторинг ЕКГ або реєстрація випадків.
9. Електрофізіологічне дослідження.
10. ЧСЕхоКГ.
11. Рентгенографія органів грудної клітки.
12. Маркери запального процесу в міокарді.
3.2.3. Лікування
Положення протоколу
Перелік та обсяг медичних послуг обов’язкового асортименту
Пацієнти повинні отримувати комплексну терапію із застосуванням:
1. АСК показана всім пацієнтам протягом невизначено тривалого часу при відсутності показань до прямих антикоагулянтів.
2. Непрямі антикоагулянти під контролем МНВ (ПТІ при неможливості визначення МНВ) за наявності:
— Вік ≥ 60 років, при наявності цукрового діабету, ІХС (МНВ 2,0–3,0, цільова величина 2,5);
— Вік ≥ 75 років, жіноча стать (МНВ 2,0–3,0, цільова величина 2,5);
— Хронічна серцева недостатність та/чи фракція викиду ≤ 35% (МНВ 2,0–3,0, цільова величина 2,5);
— Тиреотоксикоз (МНВ 2,0–3,0, цільова величина 2,5);
— АГ (МНВ 2,0–3,0, цільова величина 2,5);
— Ревматичний мітральний стеноз (МНВ 2,5–3,5, цільова величина 3);
— Протезовані клапани серця (МНВ 2,5–3,5, цільова величина 3);
— Тромбоемболії в анамнезі (МНВ 2,5–3,5, цільова величина 3);
— Тромбоутворення в порожнинах серця за даними трансторакальної ЕхоКГ та ЧСЕхоКГ (МНВ 2,5–3,5, цільова величина 3).
Профілактична антикоагулянтна терапія АВК (варфарин) показана пацієнтам з персистуючою формою ФП (тривалістю понад 48 годин), яким запланована медикаментозна або електрична кардіоверсії, протягом трьох тижнів до і чотирьох після кардіоверсії. При наявності факторів високого ризику тромбоемболічних ускладнень у пацієнтів з постійною формою ФП показана профілактична антикоагулянтна терапія АВК. У пацієнтів з підвищеним ризиком кровотечі, але при відсутності протипоказань для проведення антикоагулянтної терапії (з цільовими показниками МНВ 2,0–3,0) цільове значення МНВ повинно відповідати інтервалу 1,6–2,5.
Оцінку МНВ необхідно проводити щотижня з початку пероральної антикоагулянтної терапії та щомісяця після досягнення необхідного рівня МНВ.
Обов’язковий 3-тижневий період застосування пероральних антикоагулянтів (ПАК) перед процедурою кардіоверсії може бути скорочений, якщо при ТЕ-ЕхоКГ не виявлені тромби в ЛП або вушці ЛП.
ТЕ-ЕхоКГ може не лише виявити тромби у вушці ЛП або будь-де в іншій ділянці порожнини ЛП, але також й ідентифікувати спонтанний ехо-контраст або ускладнену аортальну атеросклеротичну бляшку. Стратегія кардіоверсії під контролем ТЕ-ЕхоКГ рекомендована як альтернатива кардіоверсії з попередньою 3-тижневою антикоагулянтною терапією, якщо доступні досвідчений персонал та належне устаткування, а також при необхідності раннього проведення кардіоверсії за умови, якщо попередня терапія ПАК не може бути використана через відмову пацієнта приймати таке лікування або через високий ризик геморагічних ускладнень, чи при наявності високого ризику утворення тромбу в ЛП/ вушці ЛП.
Якщо при ТЕ-ЕхоКГ тромб у ЛП не виявляється, перед процедурою кардіоверсії необхідно розпочати введення нефракціонованого гепарину або низькомолекулярного гепарину і продовжувати введення цього препарату до того часу, поки ПАК не дозволить досягнути цільового рівня МНВ. Як альтернатива при проведенні кардіоверсії можливе використання НПАК (ривароксабану, дабігатрану етексилату тощо).
Якщо при ТЕ-ЕхоКГ виявляється тромб у ЛП або у вушці ЛП, показаний принаймні 3-тижневий прийом АВК (МНВ 2,0–3,0) або НПАК, після чого виконується повторна ТЕ-ЕхоКГ. Якщо при цьому підтверджується зникнення тромбу, можна виконати кардіоверсію, після якої пожиттєво призначається ПАК. Якщо тромб все ще залишається, стратегія контролю серцевого ритму може бути змінена на стратегію контролю ЧСС, особливо якщо симптоми ФП контролюються, оскільки у таких пацієнтів відзначається високий ризик тромбоемболічних ускладнень у випадку проведення кардіоверсії. Про високий ризик тромбоемболій свідчить наявність феномену спонтанного контрастування 3+...4+ за даними ТЕ-ЕхоКГ.
3. Для контролю ЧШС при ФП:
— у пацієнтів без додаткового шляху проведення — в/в β-адреноблокатори та недигідропіридинові блокатори кальцієвих каналів (верапаміл, дилтіазем);
— при серцевій недостатності — в/в β-адреноблокатори + дигоксин, аміодарон + дигоксин;
— у пацієнтів з додатковим шляхом проведення — пропафенон, аміодарон;
— у пацієнтів з ХОЗЛ — дилтіазем, верапаміл, препарати наперстянки, селективні β-адреноблокатори.
4. ААП, показані для відновлення синусового ритму: пропафенон, аміодарон.
1. ААП, показані для збереження синусового ритму:
• При ідіопатичній ФП (у пацієнтів без структурних захворювань серця) — профілактика ремоделювання, ІАПФ/БРА/статини, β-блокатори за показаннями, дронедарон, пропафенон, етацизин, соталол, при неефективності цих препаратів — аміодарон.
• При ФП у пацієнтів з АГ за відсутності гіпертрофії ЛШ — пропафенон, етацизин, соталол, за відсутності ефекту — аміодарон. При наявності значної гіпертрофії ЛШ — аміодарон.
• При ФП на тлі ІХС — соталол, аміодарон.
• При хронічній серцевій недостатності — аміодарон.
2. Препарати, що застосовуються при постійної формі ФП для контролю ЧШС:
— дигоксин — у пацієнтів з серцевою недостатністю та дисфункцією ЛШ, а також у пацієнтів, які ведуть малорухомий (неактивний) спосіб життя (в комбінації з β-адреноблокаторами);
— β-адреноблокатори — при ІХС, АГ, серцевій недостатності (в комбінації з дигоксином);
— недигідропіридинові антагоністи кальцію — при АГ, ІХС, ХОЗЛ;
— соталол, аміодарон — при неефективності препаратів або при наявності додаткових шляхів проведення.
3. Електрична кардіоверсія:
1) Планова електрична кардіоверсія показана:
— при неефективності медикаментозної терапії;
— непереносимості ААП або при ризику, пов’язаному з їх призначенням;
— прогресуванні серцевої недостатності, погіршенні кровопостачання серця, мозку, нижніх кінцівок, пов’язаному з тахіаритмією;
— наявності даних про те, що лише кардіоверсія була раніше ефективна для відновлення синусового ритму при ФП.
2) Невідкладна електрична кардіоверсія показана:
— при пароксизмі ФП, з високою ЧШС, на тлі гострого інфаркту міокарда, нестабільної стенокардії;
— пароксизмі ФП, який супроводжується симптоматичною гіпотензією, гострою або прогресуючою хронічною серцевою недостатністю;
— тяжкому пароксизмі ФП, який не піддається медикаментозному лікуванню.
4. Черезстравохідна електрокардіостимуляція при ТП з метою його купірування (за умови насичення ААП).
5. В амбулаторних умовах введення прокаїнаміду для відновлення синусового ритму протипоказане.
Перелік медичних послуг додаткового асортименту
1. Пацієнтам, які не переносять АСК, замість неї показані тієнопіридинові антитромбоцитарні препарати.
2. Імплантація кардіостимулятора у відповідному режимі при наявності супутніх порушень АВ-провідності та синдрому слабості синусового вузла.
3. Катетерне лікування:
• при неефективності медикаментозної терапії, що проводиться в адекватних дозах;
• аритмогенній дії ААП;
• нападах ФП і ТП з погіршенням гемодинаміки;
• поєднанні ФП із синдромом передчасного збудження шлуночків;
• ізольованому ТП.
4. Пацієнти потребують адекватного лікування супутніх захворювань, АГ, уражень щитовидної залози та цукрового діабету.
Обґрунтування
Завдання стаціонарного етапу:
1. Лікування ускладнень, пов’язаних з тахіаритмією (зменшення ознак серцевої недостатності та ішемії
міокарда, якщо такі мали місце).
2. Вирішення питання про доцільність відновлення синусового ритму для кожного пацієнта індивідуально.
3. Підбір адекватної (можливо комбінованої) антиаритмічної терапії для утримання синусового ритму (див. Розділ 4, таблиця 7).
4. Підготовка пацієнта до планової електричної кардіоверсії.
Необхідні дії
Тривалий контроль частоти шлуночкових скорочень
Нерегулярний ритм та висока ЧШС при ФП можуть викликати різні симптоми, такі як відчуття посиленого серцебиття, задишка, підвищена втомлюваність та запаморочення. Адекватний контроль ЧШС може зменшити цю симптоматику та покращити гемодинаміку, забезпечуючи достатньо часу для наповнення шлуночків та попереджаючи розвиток тахікардіоміопатії.
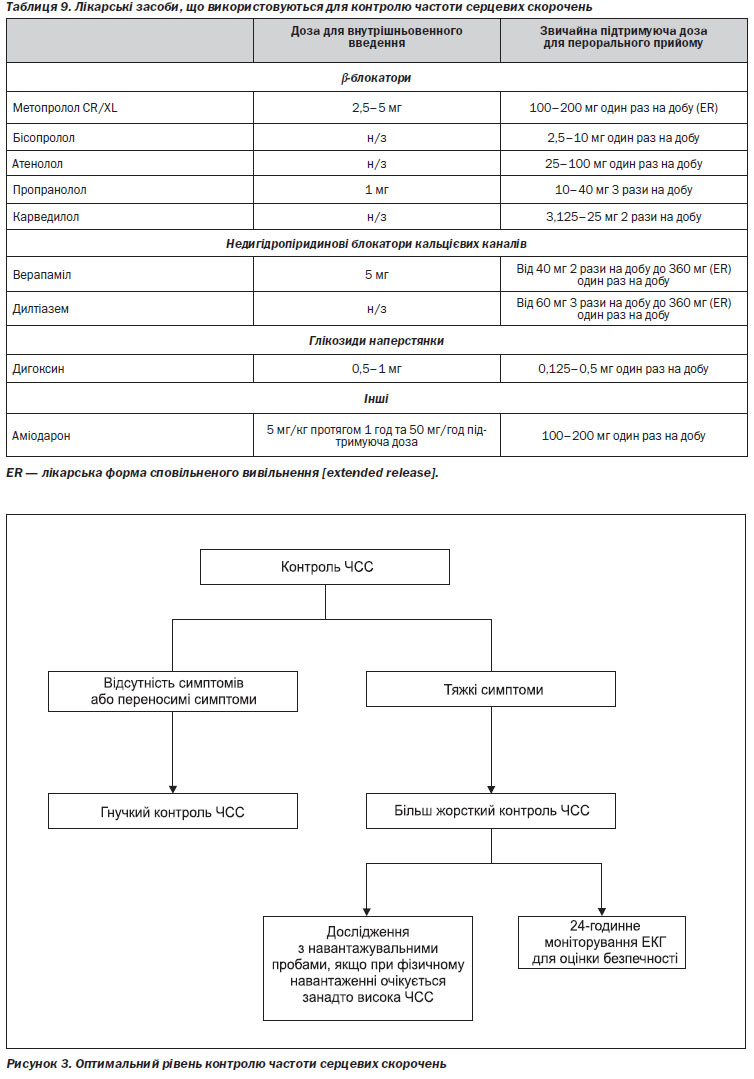
Інтенсивність контролю частоти серцевих скорочень
Рівень контролю ЧСС, який є оптимальним щодо захворюваності, смертності, якості життя та симптоматики, наразі невідомий. У попередніх настановах рекомендувався жорсткий контроль ЧСС, який має на меті забезпечити ЧСС на рівні 60–80 уд/хв у стані спокою та 90–115 уд/хв під час помірного фізичного навантаження, що ґрунтувалося на типі терапії, що застосовувалася у дослідженні AFFIRM.
Фармакологічний контроль частоти серцевих скорочень
Лікарські засоби, що використовуються для фармакологічного контролю частоти серцевих скорочень
Головними факторами, які визначають ЧШС при ФП, є характер проведення імпульсу, рефрактерність атріовентрикулярного вузла та тонус симпатичної і парасимпатичної нервової системи. Часто використовуються такі лікарські засоби, як β-блокатори, недигідропіридинові блокатори кальцієвих каналів і препарати наперстянки. Може виявитися необхідним застосування комбінацій різних препаратів. Аміодарон може бути корисним для деяких пацієнтів, у яких ЧСС рефрактерна до інших лікарських засобів. У пацієнтів з серцевою недостатністю може мати переваги застосування комбінації β-блокатора та препарату наперстянки.
До лікарських засобів, які дозволяють контролювати ЧСС, належать наступні:
1. β-Блокатори можуть бути особливо корисними на фоні високого адренергічного тонусу або при симптоматичній ішемії міокарда, що розвивається при ФП. У кількох дослідженнях, де β-блокатори порівнювалися із плацебо та дигоксином, було показано ефективність та безпечність тривалого лікування цими препаратами. У дослідженні AFFIRM β-блокатори широко застосовувалися з метою жорсткого контролю ЧСС. Дози β-блокаторів, які застосовуються найчастіше, представлені у таблиці 8, 9.
2. Недигідропіридинові блокатори кальцієвих каналів (верапаміл та дилтіазем) ефективні для контролю ЧСС при ФП як у гострому періоді, так і для тривалої терапії ФП. Цих лікарських засобів слід уникати у пацієнтів з систолічною серцевою недостатністю з огляду на їх негативний інотропний ефект.
3. Дигоксин ефективний для контролю ЧСС у стані спокою, але не під час фізичного навантаження. У комбінації з β-блокатором він може бути ефективним у пацієнтів як з серцевою недостатністю, так і без неї. Дигоксин може викликати (небезпечні для життя) побічні ефекти і тому повинен призначатися з обережністю. При застосуванні цього препарату можуть спостерігатися лікарські взаємодії з іншими засобами.
4. Аміодарон є ефективним лікарським засобом для контролю ЧСС. Внутрішньовенне застосування аміо-дарону є ефективним та добре переноситься пацієнтами з порушеннями гемодинаміки. Аміодарон також може призначатися для тривалого лікування ФП, коли звичайні підходи виявляються неефективними, але він може викликати тяжкі екстракардіальні побічні ефекти, такі як дисфункція щитоподібної залози та брадикардія. Аміодарон, який зазвичай призначається для контролю серцевого ритму, може при цьому ненавмисно продовжувати використовуватися і для контролю ЧСС при прогресуванні захворювання до постійної ФП. У такій клінічній ситуації аміодарон слід відмінити, за винятком випадків, коли більш безпечні лікарські засоби не можуть бути призначені.
Інші протиаритмічні препарати I класу неефективні для контролю ЧСС. Соталол не повинен використовуватися для контролю ЧСС як монотерапія, хоча його додаткові ефекти щодо контролю ЧСС можуть бути корисними, якщо він використовується в першу чергу для контролю ритму.
Як здійснювати контроль частоти серцевих скорочень
Результати, отримані у дослідженні RACE II, та раніше зроблені спостереження за даними нерандомізованих досліджень свідчать про те, що спочатку слід використовувати гнучкий контроль ЧСС, спрямований на утримання ЧСС на рівні < 110 уд/хв у стані спокою. Дози лікарських засобів, які використовуються для контролю ЧСС, можуть збільшуватися, і ці препарати можуть комбінуватися один з одним, поки цей цільовий рівень не буде досягнутий. Якщо при цьому пацієнт продовжує залишатися симптомним, особливо якщо скарги пов’язані із надмірною ЧСС або нерегулярністю серцевого ритму, необхідно орієнтуватися на більш жорсткі цільові рівні ЧСС. ЧШС має зменшуватися, поки не зникнуть симптоми або поки симптоми не стануть такими, що легко переносяться, або поки не стане зрозумілим, що симптоми обумовлені супутнім захворюванням, а не ЧСС чи серцевим ритмом. Якщо застосовується стратегія жорсткого контролю ЧСС (цільова ЧСС < 80 уд/хв у стані спокою та < 110 уд/хв при помірному фізичному навантаженні), слід виконати 24-годинне холтерівське моніторування для оцінки наявності пауз (випадіння одного або кількох суміжних шлуночкових комплексів, епізодів асистолії) та брадикардії. Якщо симптоми пов’язані з фізичним навантаженням, необхідно виконати дослідження з навантажувальними пробами (рисунок 3). Вибір лікарських засобів для контролю ЧСС залежить від віку пацієнта, наявності серцевого захворювання та цілей лікування (рисунок 4). У пацієнтів, які залишаються симптомними при застосуванні стратегії жорсткого контролю ЧСС, може бути розглянута доцільність застосування терапії, орієнтованої на контроль серцевого ритму.
Тривалий контроль серцевого ритму
Протиаритмічні лікарські засоби, які використовуються для підтримання синусового ритму
Головною метою терапії, спрямованої на контроль серцевого ритму, є покращення симптомів, обумовлених ФП. Навпаки, асимптомні пацієнти (або ті, які стають асимптомними при адекватному контролі ЧСС) зазвичай не повинні отримувати протиаритмічних лікарських засобів.
Нижче представлені принципи лікування протиаритмічними препаратами з метою підтримання синусового ритму при ФП:
1) Лікування обумовлене спробою полегшити пов’язані з ФП симптоми.
2) Ефективність протиаритмічних препаратів у підтриманні синусового ритму є невеликою.
3) Клінічно ефективна терапія протиаритмічними препаратами може зменшити ймовірність рецидивів ФП, але не усунути їх зовсім.
4) Якщо один протиаритмічний препарат виявляється неефективним, клінічно прийнятна відповідь може бути отримана при застосуванні іншого препарату.
5) Часто зустрічаються індукована лікарськими препаратами проаритмія або екстракардіальні побічні ефекти застосування таких препаратів.
6) При виборі протиаритмічного препарату слід орієнтуватися у першу чергу на його безпечність, аніж на ефективність.
Окремі лікарські препарати обговорюються нижче, їх основні недоліки представлені у таблиці 10.
Вибір протиаритмічних препаратів
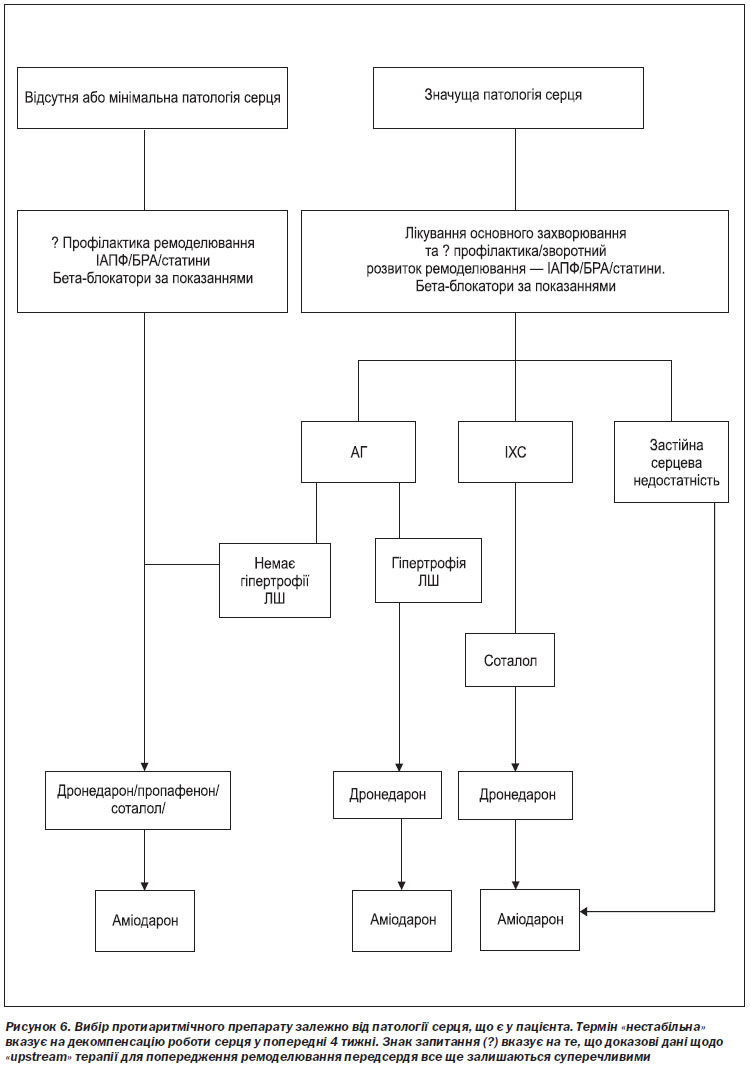
Стратегію протиаритмічної терапії рецидивуючої ФП рекомендується розробляти на основі вибору безпечнішого, хоча, можливо, і менш ефективного лікарського засобу, відмовляючись від більш ефективного, але менш безпечного лікування. ФП, яка розвивається у пацієнтів без серцево-судинного захворювання або з невираженим ураженням серця, може лікуватися за допомогою майже будь-якого протиаритмічного препарату, схваленого для терапії ФП. Більшість пацієнтів з ФП будуть спочатку отримувати β-блокатори для контролю ЧСС. Аміодарон є резервним препаратом для тих пацієнтів, у яких лікування іншими ААП виявилося неуспішним або які мають виражене органічне ураження серця.
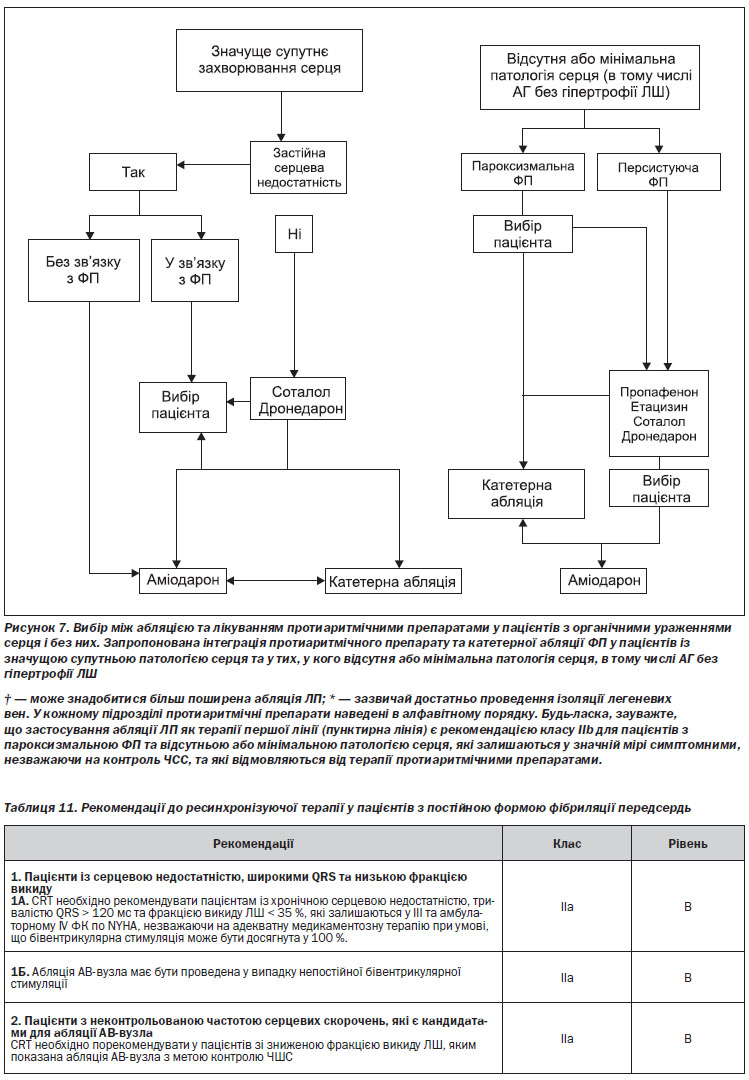
Пацієнти із ФП та мінімальною або відсутньою патологією серця (ізольована ФП). У пацієнтів з мінімальною або відсутньою патологією серця призначення β-блокаторів є логічною першою спробою профілактики рецидивів ФП, коли аритмія чітко пов’язана з психічним або фізичним перенапруженням (адренергічна ФП). Оскільки β-блокатори не дуже ефективні у багатьох інших пацієнтів з «ізольованою ФП», зазвичай призначаються пропафенон, соталол або дронедарон (рисунок 5).
Пацієнти із захворюваннями серця. Серцево-судинне захворювання традиційно включає в себе різноманітні патофізіологічні субстрати: гіпертрофію, ішемію та застійну серцеву недостатність (рисунок 6). При кожному з цих уражень рекомендується уникати певних лікарських засобів. У дослідженнях за участю пацієнтів з ФП або іншими аритміями було показано значну токсичність флекаїніду та пропафенону, яка була визначена як наслідок проаритмічного та/або негативного інотропного ефектів цих препаратів. Відомо, що соталол подовжує інтервал QT та сприяє виникненню torsades de pointes у вразливих пацієнтів, до яких, імовірно, відносяться особи з вираженою гіпертрофією ЛШ та серцевою недостатністю. Дослідження за участю пацієнтів, які перенесли інфаркт міокарда, показали, що соталол може відносно безпечно застосовуватися у пацієнтів з коронарним атеросклерозом. Для більшості пацієнтів із значущими органічними захворюваннями серця, особливо з серцевою недостатністю та гіпертрофією ЛШ, в Україні доступний лише аміодарон. Починають з’являтися дані про те, що аміодарон може не бути безпечним для довготривалого застосування у пацієнтів з серцевою недостатністю III ФК за NYHA.
3.2.4. Госпіталізація
Положення протоколу
Госпіталізація проводиться при необхідності відновлення синусового ритму при персистуючій формі аритмії за неефективності амбулаторного лікування рутинними заходами та/або при порушеннях гемодинаміки, або для планової ЕІТ, а також при відсутності ефекту від антиаритмічної терапії.
Обґрунтування
Якщо медикаментозно в стаціонарі не вдалося відновити синусовий ритм, але є обставини на користь проведення планової електричної кардіоверсії, то:
1. Пацієнт виписується з клініки з подальшим наглядом лікаря-терапевта дільничного та/або лікаря-кардіолога.
2. Триває лікування основного захворювання і призначається ААП для контролю за ЧШС.
3. Триває розпочате в стаціонарі лікування варфарином протягом 3–4 тижнів (МНВ у межах 2,0–3,0) або НПАК до проведення кардіоверсії і 4 тижні після її проведення.
4. Перед проведенням планової електричної кардіоверсії або ЕІТ обов’язкове ЧСЕхоКГ дослідження.
Що робити, якщо пацієнт прийшов до терапевта і давність ФП невідома?
1. Якщо існують обставини на користь відновлення синусового ритму, то планувати проведення планової електричної кардіоверсії.
2. Обов’язкове проведення ЧСЕхоКГ дослідження.
3. Призначається ААП для контролю за ЧШС і лікується основне захворювання (цільові рівні АТ, стабілізація ФК стенокардії або хронічної серцевої недостатності тощо).
4. Призначається варфарин протягом 3–4 тижнів (МНВ у межах 2,0–3,0) до проведення кардіоверсії або НПАК і 4 тижні після її проведення.
Коли можна проводити електричну кардіоверсію (ЕІТ), якщо ФП триває більше 48 годин?
1. За умови відсутності тромбів за даними ЧСЕхоКГ.
2. У разі екстреної кардіоверсії (нестабільна гемодинаміка).
3. Болюсно вводиться гепарин в дозі 5–10 тис. ОД з наступним його введенням в дозі, необхідній для подовження АЧТЧ (АПТВ) в 1,5–2 рази від контрольних значень (в нормі 25–42 с).
4. Після відновлення ритму на 3–4-му тижні призначають варфарин (МНВ 2,0–3,0) або НПАК.
Коли можна проводити електричну кардіоверсію (ЕІТ) без ЧСЕхоКГ?
1. Якщо ФП триває менше 48 годин і немає факторів ризику розвитку тромбоемболічних ускладнень.
2. В/в болюсно вводиться гепарин в дозі 5–10 тис. ОД з наступним його введенням в дозі, необхідній для подовження АЧТЧ (або АПТВ) в 1,5–2 рази від конт-рольних значень (в нормі від 25–42 с).
3. Після відновлення ритму на 3–4-му тижні призначають варфарин (МНВ 2,0–3,0) або НПАК.
Рекомендації з антитромботичної терапії при ТП та ІХС:
1. Антитромботична терапія при ТП, як правило, така ж, як при ФП.
2. Вибір антитромботичного препарату за одними і тими ж критеріями незалежно від типу ТП.
3. Лікувати пацієнтів з ІХС непрямими антикоагулянтами на основі тих же самих критеріїв, що використовуються у пацієнтів без ІХС.
Досить часто задається питання про те, як вчинити з пацієнтом, який має постійну ФП і якому планується хірургічне втручання з приводу ІХС.
Проведення операцій на коронарних артеріях у пацієнтів з ІХС та ФП
1. Спеціальних клінічних досліджень по цих пацієнтах не проводилося!
2. При черезшкірних втручаннях на коронарних артеріях зазвичай доводиться переривати антикоагулянтну терапію або знижувати її інтенсивність.
3. Скасувати варфарин за 1 тиждень до операції.
4. Після операції на коронарних артеріях призначається клопідогрель, що забезпечує прохідність коронарних артерій.
5. Приєднання АСК до варфарину підвищує ризик більшою мірою, ніж має користь.
6. При збереженні ФП лікування варфарином слід відновити якомога швидше.
7. Використовується клопідогрель 75 мг/добу + варфарин (МНВ 2,0–3,0) терміном 9–12 місяців.
8. У подальшому може бути продовжена монотерапія варфарином.
Необхідні дії
Див. алгоритм дії на догоспітальному етапі при пароксизмальній формі ФП тривалістю менше 48 годин — див. Розділ 4, п. 4.1.
Алгоритм дії на догоспітальному етапі при пароксизмальній формі ФП тривалістю більше 48 годин — див. Розділ 4, п. 4.2.
3.2.5. Виписка
Положення протоколу
ЧШС вважається контрольованою, коли вона варіює між 60 і 80 ударами в хвилину в стані спокою і 90–110 ударів у хвилину — при помірному фізичному навантаженні.
Якщо у пацієнта відновився синусовий ритм або він госпіталізований у стаціонар з таким, то при виборі ААП рекомендується діяти згідно з такими алгоритмами, оскільки пацієнти з ФП і відновленим синусовим ритмом можуть бути віднесені до тієї чи іншої групи.
Обґрунтування
Алгоритм дій для вибору стратегії профілактичної антиаритмічної терапії при ФП:
Група I: Пацієнти з першим або вперше виявленим пароксизмом ФП
А. У пацієнта відбулося спонтанне відновлення синусового ритму.
Б. Пароксизм ФП купіруваний за допомогою фармакологічної або електричної кардіоверсії.
Коментар: імовірність рецидиву ФП не відома, тривала антиаритмічна терапія не виправдана.
• Таким пацієнтам на 1 місяць призначається ААП з метою утримання синусового ритму.
• На 1 місяць призначається антитромботичний препарат, за умови відсутності ризик-факторів тромбоемболії, про які буде сказано нижче. Якщо ризик тромбоемболічних ускладнень високий або середній, то застосування непрямих антикоагулянтів довічне.
Група II: Пацієнти з рецидивуючими пароксизмами ФП (без попередньої антиаритмічної терапії)
А. Пацієнти з безсимптомними пароксизмами ФП (за результатами холтерівського моніторування ЕКГ).
Коментар: роль антиаритмічної терапії в профілактиці рецидивів пароксизмів ФП/ТП достовірно не визначена, але рекомендується постійний прийом антитромботичної терапії.
Б. Пацієнти з епізодами ФП, що супроводжується клінічною симптоматикою, але рідше 1 разу на 3 місяці.
Коментар: купірування нападу ФП або контроль ЧШС (див. таблицю 7).
С. Пацієнти з нападами ФП і клінічною симптоматикою, але частіше 1 разу на 3 місяці.
Коментар: виправдано тривале призначення антиаритмічної терапії для профілактики пароксизмів ФП, антикоагулянти або розглядається хірургічне лікування.
Група III: Пацієнти з рецидивуючими пароксизмами ФП і неефективною антиаритмічною терапією
А. Пацієнти з безсимптомними пароксизмами ФП.
Коментар: спроба підбору більш ефективних ААП? (клінічні дослідження проводяться), антикоагулянти, можливо хірургічне лікування.
Б. Пацієнти з пароксизмами і клінічною симптоматикою під час ФП, але рідше 1 разу на 3 місяці.
Коментар: спроба підбору ААП, антитромботична терапія, доцільне хірургічне лікування.
С. Пацієнти з пароксизмами ФП частіше 1 разу на 3 місяці, що супроводжуються клінічною симптоматикою.
Коментар: необхідне хірургічне лікування, антитромботична терапія. При неможливості хірургічного лікування — контроль ЧШС.
Якими препаратами найкраще утримувати синусовий ритм?
Метааналіз 35 рандомізованих досліджень з використанням восьми ААП показав, що найбільшу ефективність для профілактики пароксизмів ФП мають аміодарон, соталол і пропафенон. При тривалому призначенні зазначених лікарських засобів слід пам’ятати про побічні ефекти (особливо при терапії аміодароном) і разом з регулярним ЕКГ-моніторуванням контролювати стан органів-мішеней препарату.
Необхідні дії
При виборі препарату необхідно враховувати основне захворювання, яке стало причиною ФП, а також його перебіг і ускладнення, пов’язані з ним (інтервал QT до призначення ААП, порушення внутрішньошлуночкової провідності, ФК хронічної серцевої недостатності тощо).
1. Якщо ФП виникла у пацієнтів без патології серця або з його мінімальними структурними змінами (наприклад, пролапс мітрального клапана, вегетативно-дизоваріальна кардіоміопатія тощо), то профілактичну антиаритмічну терапію слід починати з ААП 1С класу пропафенону.
2. Якщо ААП не запобігає рецидивам ФП або його використання супроводжується побічними ефектами, потрібно переходити до призначення аміодарону або комбінованої антиаритмічної терапії, або обговорювати питання хірургічного лікування тахіаритмії.
3. Лікування ФП і ТП у пацієнтів з ІХС та застійною серцевою недостатністю, як правило, обмежується використанням аміодарону.
4. АГ, що призводить до гіпертрофії міокарда ЛШ, збільшує ризик розвитку поліморфної шлуночкової тахікардії «torsade de pointes». У зв’язку з цим для попередження рецидивів ФП віддається перевага ААП 1С класу, наприклад пропафенону, який істотно не впливає на тривалість реполяризації та інтервал QT.
5. Алгоритм фармакотерапії при ФП і АГ уявляється таким: 1) якщо гіпертрофія міокарда ЛШ > 1,4 см, то слід використовувати аміодарон; 2) якщо гіпертрофії міокарда ЛШ немає або вона менше 1,4 см, то починати лікування з пропафенону, а при його неефективності використовувати аміодарон або соталол.
3.2.6. Реабілітація
Положення протоколу
Вимоги до режиму праці, відпочинку, реабілітації
Не рекомендується перебування під прямими сонячними променями пацієнтам, які вживають аміодарон. При наявності частих пароксизмів та пароксизмів з порушенням гемодинаміки пацієнти потребують направлення на медико-соціальну експертну комісію для визначення можливості продовжувати професійну діяльність.
Пацієнтам з пароксизмальною або персистуючою формами ФП/ТП після відновлення синусового ритму та підбору адекватної протирецидивної терапії, з нападами порушень ритму не частіше 2 разів на місяць, призначають санаторно-курортне лікування.
Обґрунтування
Специфічної реабілітації пацієнти з ФП не потребують.
Необхідні дії
Реабілітація основного захворювання.
Вимоги до дієтичних призначень і обмежень
Пацієнти повинні отримувати дієту з обмеженням солі до 6 г на добу, обмежується вживання тваринних жирів та продуктів, які містять холестерин. При зайвій вазі обмежується енергетична цінність їжі, нормалізація індексу маси тіла.
При наявності шкідливих звичок — відмова від тютюнопаління, обмеження вживання алкоголю, кофеїну.
3.2.7. Диспансерне спостереження
Положення протоколу
При нападах ФП частіше ніж 1 раз на 3 місяці пацієнти потребують постійного щоденного застосування препаратів.
Пацієнти повинні знаходитись на диспансерному спостереженні за місцем проживання.
Обґрунтування
Перед лікарем-терапевтом дільничним та/або лікарем-кардіологом можуть стояти кілька завдань з ведення пацієнтів з ФП на амбулаторному етапі:
1. Перш за все це лікування основного захворювання, що стало причиною ФП.
2. Утримання синусового ритму якомога довше.
3. Контроль ЧШС при постійній формі ФП.
4. Активне використання критеріїв обставин у вирішенні питання про відновлення синусового ритму.
5. Дотримання послідовності в рекомендаціях, які були дані в стаціонарі (наприклад, прийняте рішення про відновлення синусового ритму за допомогою планової електричної кардіоверсії).
6. Використовувати алгоритми з тактики і тривалості застосування ААП і можливостях хірургічного лікування пацієнтів.
Необхідні дії
Щорічне обов’язкове обстеження, при необхідності обстеження і корекція терапії частіше, ніж 1 раз на рік.
Обов’язковий регулярний контроль МНВ (ПТІ при неможливості визначення МНВ) (щотижня):
Треба підраховувати час у терапевтичному діапазоні (TTR) на кожному візиті:
— використовувати валідовані методі виміру (наприклад, метод Rosendaal) для комп’ютеризованого підрахунку дозування;
— % вимірів у терапевтичному діапазоні при ручному підрахунку;
— виключати показники за перші 6 тижнів використання АВK;
— враховувати дані принаймні за 6 місяців.
Оптимальне міжнародне нормалізоване відношення
На сьогодні рівень антикоагуляції при застосуванні АВK оцінюється за допомогою величини МНВ, яка є відношенням дійсного протромбінового часу пацієнта та протромбінового часу стандартизованої контрольної сироватки.
Враховуючи необхідність збалансування ризику інсульту, який зростає із зниженням МНВ, та ризику геморагічних ускладнень, який зростає при підвищенні МНВ, було визначено, що оптимальним діапазоном для профілактики інсульту та системного емболізму у пацієнтів з неклапанною ФП вважається МНВ на рівні 2,0–3,0.
Однією з багатьох проблем, з якою доводиться зустрічатися при антикоагулянтній терапії за допомогою АВK, є високі міжіндивідуальні та внутрішньоіндивідуальні варіації рівнів МНВ. Крім того, при застосуванні АВK спостерігаються суттєві взаємодії цих препаратів з іншими лікарськими засобами, харчовими продуктами та алкоголем. За даними контрольованих клінічних досліджень, пацієнти можуть утримуватися в межах цільового діапазону МНВ 2,0–3,0 в середньому протягом 60–65 % всього часу лікування, але багато з досліджень з вивчення пацієнтів у реальних клінічних умовах показують, що ця цифра може становити < 50 %. В дійсності лікування пацієнтів з утриманням МНВ в межах терапевтичного діапазону протягом < 60 % часу може повністю нівелювати всі переваги застосування АВК.
Хоча для пацієнтів похилого віку були запропоновані більш низькі рівні діапазону МНВ (1,8–2,5), цей висновок не отримав доказового обґрунтування в жодному великому дослідженні. Когортні дослідження продемонстрували 2-кратне зростання ризику інсульту при МНВ 1,5–2,0, тому утримання МНВ на рівні < 2,0 не рекомендується.
На підтримання МНВ у межах цільового діапазону, а також на безпечність та ефективність цього діапазону при терапії АВK можуть впливати фармакогенетичні фактори, зокрема ген цитохрома P450 2C9 (CYP2C9) та субодиниця 1 гена менадіону епоксид-редуктазного комплексу (VKORC1). Генотипи CYP2C9 та VKORC1 можуть справляти вплив на потребу пацієнта у дозі варфарину, у той час як генотипи CYP2C9 варіанта асоційовані з геморагічними ускладненнями. Систематичне генотипування зазвичай не потрібне, оскільки воно навряд чи буде задовольняти належному співвідношенню «вартість/ефективність» для типових пацієнтів з неклапанною ФП, але це співвідношення може бути сприятливим у пацієнтів з високим ризиком геморагічних ускладнень, які починають приймати АВK.
Протромбіновий індекс
Для оцінки стану системи згортання крові при застосуванні АВK показник МНВ є надійнішим, ніж ПТІ, тому що не залежить від якості реагенту. На жаль, документація, яка додається до тромбопластинів, що використовуються сьогодні в більшості українських лабораторій, не містить інформацію відносно чутливості реагенту. Тому ПТІ залишається єдиним показником, по якому може здійснюватися контроль антикоагулянтної терапії. Його традиційно розраховують за формулою: ПТІ = (контрольний протромбіновий час/протромбіновий час пацієнта) × 100 %. Для профілактики інсульту і системних емболій у пацієнтів з неклапанною ФП оптимальний ПТІ складає 50–60 %, що приблизно відповідає МНВ 2,0–3,0.
3.3. Третинна (високоспеціалізована) медична допомога
3.3.1. Профілактика
Положення протоколу
Спеціаліст, який займається веденням пацієнта з ФП, повинен не тільки проводити початкову оцінку його стану та призначити належне лікування, але також розробити структурований план подальшого спостереження за пацієнтом.
Нижче перераховані важливі фактори, які слід брати до уваги при подальшому спостереженні за пацієнтом з ФП:
• Чи змінився профіль ризику пацієнта (наприклад, у випадку розвитку цукрового діабету або АГ, яких раніше не було), особливо у контексті призначення антикоагулянтної терапії?
• Чи необхідна зараз антикоагулянтна терапія — чи не з’явилися у пацієнта нові фактори ризику або чи не зникла необхідність в антикоагулянтах, наприклад, після кардіоверсії у пацієнта з низьким тромбоемболічним ризиком?
• Чи зменшується симптоматика пацієнта на фоні терапії; якщо ні, то чи слід зважити доцільність іншої стратегії лікування?
• Чи є які-небудь ознаки проаритмії або ризик проаритмії; якщо так, то чи слід зменшити дозу протиаритмічного засобу або перейти до іншої стратегії лікування?
• Чи прогресувала пароксизмальна ФП до персистуючої/постійної форми, незважаючи на прийом протиаритмічних засобів; у такому випадку чи слід зважити доцільність застосування іншої стратегії лікування?
• Чи ефективний застосовуваний підхід контролю ЧСС; чи досягнутий цільовий рівень ЧСС у стані спокою та при фізичному навантаженні?
На візитах подальшого спостереження слід виконувати ЕКГ у 12 відведеннях для документування ритму та ЧСС і оцінки прогресування захворювання. Для пацієнтів, які приймають протиаритмічні засоби, важливо оцінювати потенційні ЕКГ-провісники проаритмії, такі як подовження інтервалів PR, QRS або QT, нестійка шлуночкова тахікардія або паузи (випадіння одного або кількох суміжних шлуночкових комплексів, епізоди асистолії). Якщо у пацієнта спостерігається погіршення симптоматики, слід зважити доцільність проведення повторних аналізів крові, тривалої ЕКГ-реєстрації та повторних ЕКГ.
Пацієнт повинен бути повністю інформований про переваги і недоліки різних методів лікування — антикоагулянтної терапії, засобів для контролю ЧСС, протиаритмічних засобів або інтервенційного лікування. Також доречно повідомити пацієнту з ізольованою або ідіопатичною ФП про сприятливий прогноз, якщо буде виключена наявність серцево-судинного захворювання.
Необхідні дії
Рекомендації з діагностики та початкового ведення ФП — таблиця 6.
3.3.2. Діагностика
Необхідні дії
1. Збір скарг та анамнезу.
2. Клінічний огляд.
3. Вимірювання АТ.
4. Лабораторне обстеження:
• загальний аналіз крові;
• загальний аналіз сечі;
• АЛТ;
• АСТ;
• білірубін;
• креатинін;
• ліпідограма та тригліцериди;
• глюкоза крові;
• гормони щитовидної залози і гіпофізу (Т3, Т4 вільний, тиреотропний гормон);
• коагулограма та МНВ, АЧТЧ.
5. ЕКГ у 12 відведеннях.
6. ЕхоКГ.
7. Проба з фізичним навантаженням.
8. Добовий моніторинг ЕКГ або реєстрація випадків.
9. Електрофізіологічне дослідження.
10. ЧСЕхоКГ.
11. Рентгенографія органів грудної клітки.
12. Маркери запального процесу в міокарді.
3.3.3. Лікування
Положення протоколу
1. Пацієнти повинні отримувати комплексну терапію із застосуванням антиаритмічних, антикоагулянтних препаратів.
2. За необхідності проведення запланованої медикаментозної або електричної кардіоверсії.
3. Доцільно чітко визначити необхідність ТЕ-ЕхоКГ для пацієнта молодого віку за прийняття рішення про планову дефібриляцію для центрів без можливості ТЕ-ЕхоКГ і/тобто обов’язковість спрямування такого пацієнта до центру з можливістю ТЕ-ЕхоКГ.
4. Препарати для профілактики ремоделювання, ІАПФ/БРА/статини.
5. Радіочастотна абляція ектопiчного вогнища.
6. При наявності пацієнти потребують адекватного лікування супутніх хвороб (ІХС, АГ, уражень щитовидної залози, цукрового діабету або інших соматичних захворювань).
7. Імплантація кардіостимулятора у відповідному режимі при наявності супутніх порушень АВ-провідності та синдрому слабості синусового вузла.
Катетерна абляція лівого передсердя
Стратегії лікування, що ґрунтуються на проведенні абляції, були розроблені з метою «виліковування» ФП в окремих популяціях пацієнтів. Тривале подальше спостереження за цими пацієнтами свідчить про те, що у той час як синусовий ритм після цієї процедури зберігається краще, ніж при застосуванні протиаритмічних препаратів, пізні рецидиви ФП не є рідкісним явищем. При цьому у більшості з відповідних досліджень брали участь пацієнти з симптомною пароксизмальною ФП та відсутньою або мінімальною органічною патологією серця.
Показання
У цілому катетерна абляція має бути резервним методом лікування пацієнтів, у яких ФП залишається симптомною, незважаючи на оптимальну медикаментозну терапію, що включає стратегії контролю ЧСС і серцевого ритму. Для вирішення питання про доцільність проведення процедури абляції у симптомного пацієнта слід взяти до уваги наступне:
1) стадію ураження передсердя (тобто тип перебігу ФП, розміри ЛП, анамнез ФП);
2) наявність та тяжкість супутніх серцево-судинних захворювань;
3) можливі альтернативні методи лікування (протиаритмічні препарати, контроль ЧСС);
4) уподобання самого пацієнта.
Для кожного конкретного пацієнта з симптомною ФП необхідно отримати достатньо потенційних переваг цього втручання, щоб виправдати складну процедуру абляції, що може бути асоційована з тяжкими ускладненнями. Досвід лікаря, який виконує цю процедуру, є важливим фактором, який слід враховувати при прийнятті рішення про доцільність проведення абляції. Дослідження, результати яких стали обґрунтуванням для рекомендацій щодо виконання абляції, майже виключно проводилися за допомогою лікарів з великим досвідом проведення цієї процедури і досвідченого персоналу, що працює в спеціалізованих клініках, але в реальній клінічній практиці в багатьох клініках до виконання цього втручання можуть бути причетні менш досвідчені лікарі та молоді спеціалісти.
Доказові дані з прямого порівняння лікування протиаритмічними препаратами та катетерної абляції як терапії першої лінії у пацієнтів з симптомною пароксизмальною ФП є обмеженими, але окремі аналізи ефективності протиаритмічних препаратів та катетерної абляції ЛП при ФП свідчать про більші переваги абляції. Проте, зважаючи на потенціал катетерної абляції ФП щодо досягнення контролю серцевого ритму у симптомних пацієнтів з пароксизмальною ФП та мінімальною або відсутньою патологією серця, а також на відносну безпечність процедури за умови її виконання досвідченими лікарями, абляція може розглядатися як стартовий метод лікування в окремих пацієнтів (рисунок 7).
Для пацієнтів з персистуючою або тривалою персистуючою ФП та відсутньою або мінімальною органічною патологією серця стратегії лікування та співвідношення «користь/ризик» для катетерної абляції на сьогодні вивчені гірше. У таких пацієнтів можуть знадобитися поширені та часто повторювані процедури абляції, і видається доцільним рекомендувати перед прийняттям рішення щодо застосування абляції впевнитися у тому, що вони рефрактерні до лікування протиаритмічними препаратами. Оскільки лікування аміодароном може бути асоційоване з серйозними та частими побічними ефектами, особливо при тривалому лікуванні, доцільно зважити можливість застосування катетерної абляції як альтернативи терапії аміодароном у пацієнтів молодшого віку.
Для симптомних пацієнтів з пароксизмальною та персистуючою ФП та зі значущими органічними захворюваннями серця перед застосуванням катетерної абляції рекомендовано призначити лікування протиаритмічними препаратами. У таких пацієнтів більш складно досягти успіху при абляції. Виправдати необхідність проведення цієї процедури може наявність серйозних симптомів, асоційованих з аритмією. Абляція персистуючої та тривалої персистуючої ФП асоційована з варіабельними, але досить оптимістичними рівнями ефективності, але дуже часто вимагає повторних процедур. Ці процедури тривалі та технічно складні й асоційовані з більшим ризиком, ніж лише ізоляція легеневих вен. У кожного окремого пацієнта слід ретельно оцінити, слід йому призначити терапію аміо-дароном чи катетерну абляцію після неефективності лікування менш токсичними протиаритмічними препаратами. До інших факторів, які необхідно враховувати при цьому, належать вік пацієнта, тип та тяжкість органічної патології серця, розміри ЛП, супутні захворювання та уподобання пацієнта. Існують доказові дані на користь того, що у пацієнтів із супутніми захворюваннями, пов’язаними з ФП, можна отримати переваги від застосування абляції як первинної стратегії лікування; наприклад, пацієнти із серцевою недостатністю отримують переваги від абляції ЛП, оскільки при цьому можуть значно покращитися фракція викиду і функціональні показники, такі як переносимість фізичного навантаження.
Переваги абляції ФП не були продемонстровані для асимптомних пацієнтів.
Показання до ресинхронізуючої терапії у пацієнтів з постійною формою фібриляції передсердь
Імплантація пристрою для кардіоресинхронізації показана пацієнтам з ФП, які мають прояви застійної серцевої недостатності III та IV ФК за NYHA, тривалість QRS > 120 мс та фракцію викиду ЛШ < 35 % за умови, що бівентрикулярна стимуляція може бути досягнута у 100 %. З метою досягнення 100% бівентрикулярної стимуляції таким пацієнтам виконують абляцію АВ-вузла. Також при недостатньому медикаментозному контролі ЧШС пацієнтам з метою контролю ЧШС може бути запропонована комбінована терапія: абляція АВ-вузла та імплантація CRT (таблиця 11).
Можливе проведення заміни штучного водія ритму на CRT пристрій у пацієнтів із симптомами серцевої недостатності, фракцією викиду < 35 % та високим відсотком шлуночкової стимуляції, у яких залишається III, IV ФК за NYHA, незважаючи на адекватну медикаментозну терапію.
Алгоритм ведення пацієнтів з серцевою недостатністю та постійною фібриляцією передсердь — див. Розділ 4, п. 4.6.
Обґрунтування
Доказові дані з прямого порівняння лікування протиаритмічними препаратами та катетерної абляції як терапії першої лінії у пацієнтів із симптомною пароксизмальною ФП є обмеженими, але окремі аналізи ефективності протиаритмічних препаратів та катетерної абляції ЛП при ФП свідчать про більші переваги абляції. Проте, зважаючи на потенціал катетерної абляції ФП щодо досягнення контролю серцевого ритму у симптомних пацієнтів з пароксизмальною ФП та мінімальною або відсутньою патологією серця, а також на відносну безпечність процедури за умови її виконання досвідченими лікарями, абляція може розглядатися як стартовий метод лікування в окремих пацієнтів (рисунок 8).
Необхідні дії
Електрична планова кардіоверсія при фібриляції передсердь
ФП — порушення ритму, з яким досить часто доводиться зустрічатись у клінічній практиці. Частота виникнення ФП збільшується з віком і за наявності органічної патології серця. Так, поширеність ФП складає 0,4 % серед дорослого населення, зростаючи від 0,5 % в осіб віком 50–59 років до майже 9 % в осіб віком 80–89 років. Також з віком збільшується ризик розвитку тромбоемболічних ускладнень — від 1,5 % у віці 50–59 років до 23,5 % до 80–89 років.
Розрізняють основні форми ФП: пароксизмальну, персистуючу, тривало персистуючу та постійну. Кожна з цих форм може бути вперше зареєстрованою. Пароксизмальна — повторні епізоди ФП тривалістю до доби, при яких відновлення синусового ритму відбувається спонтанно; персистуюча — один або більше пароксизмів ФП тривалістю більше доби, відновлення синусового ритму відбувається після медикаментозного лікування або електричної кардіоверсії; тривало персистуюча — епізод, що триває 1 рік та більше, коли синусовий ритм доцільно відновлювати; постійна — коли відновлення ритму не планується або протипоказано.
Перебіг ФП асоціюється з виникненням таких небезпечних ускладнень, як розвиток тромбоемболій, дестабілізація гемодинаміки, зниження систолічної функції серця і, як наслідок, підвищення рівня летальності пацієнтів.
Головною метою терапії персистуючої форми ФП є утримання синусового ритму та відновлення синусового ритму. Припинення ФП призводить до відновлення АВ-синхронізації і фізіологічного контролю за ритмом, нормальних співвідношень між провідністю і рефрактерністю (зникнення дисперсії електрофізіологічних показників), поліпшення гемодинаміки, запобігання розвитку дилатації ЛП і дисфункції ЛШ, усунення загрози тромбоемболічних ускладнень, підвищення толерантності до фізичних навантажень і поліпшення якості життя пацієнтів.
Відновлення синусового ритму можливе за допомогою електричної або фармакологічної кардіоверсії, а також їх поєднання. Всі ААП, що використовуються для фармакологічної кардіоверсії, є потенційно небезпечними і можуть викликати різні серйозні кардіальні та некардіальні побічні ефекти. Фармакологічна кар-діоверсія буває ефективною лише у 40–70 % пацієнтів. Крім того, для відновлення синусового ритму зазвичай потрібен тривалий час. Електрична кардіоверсія є найбільш ефективним та керованим методом відновлення синусового ритму, ефективність методу понад 90 % пацієнтів із ФП.
Показання до відновлення синусового ритму:
1) всі пацієнти з першим епізодом, у яких не відбувається спонтанне відновлення синусового ритму протягом 48 годин;
2) пацієнти, у яких ФП, імовірно, викликана гострою патологією (наприклад, пневмонією, гіпертиреозом,
вживанням алкоголю або інших токсичних продуктів, електролітними порушеннями);
3) пацієнти, у яких після відновлення синусового ритму існує вибір способу підтримки синусового ритму.
Успіх кардіоверсії сумнівний, якщо є наступні маркери зменшення ймовірності досягнення та/або підтримання синусового ритму: ЛП збільшено в діаметрі понад 50 мм; швидкість вигнання з вушка ЛШ менше 20 мм/с, тривалість хронічної ФП більше 12 місяців; наявність тяжкої лівошлуночкової недостатності; вади серця; хвороби легенів; похилий вік; документована дисфункція синусового вузла.
Показання до електричної кардіоверсії:
1. Непереносимість ААП;
2. Відсутність ефекту медикаментозної антиаритмічної терапії;
3. Прогресуюча внаслідок тахіаритмії серцева недостатність, симптоми погіршення кровопостачання серця, головного мозку, порушення периферичного кровообігу;
4. Вказівка в анамнезі на позитивний ефект ЕІТ при лікуванні тахіаритмії.
Протипоказання до процедури:
1) Можливий тромб у ЛП:
— тривалість ФП > 48 часів без застосування антикоагулянтів;
— відсутні дані ЧСЕхоКГ (тривалість ФП > 48 год без застосування антикоагулянтів).
2) Електролітний дисбаланс.
3) Глікозидна інтоксикація.
4) Протипоказання до анестезії з боку дихальної системи.
5) Маніфестний гіпертиреоз.
6) Алкогольна інтоксикація.
7) Гостра інфекція.
8) Декомпенсація застійної серцевої недостатності.
9) Документований синдром слабості синусового вузла без штучного водія ритму.
10) Безперервно рецидивуюча ФП.
Підготовка до процедури
Антикоагулянтна терапія
Проведення кардіоверсії може ускладнюватися системними емболіями (так звані «нормалізаційні» емболії), які можуть виникати як у момент нанесення розряду, так і протягом декількох тижнів після кардіоверсії. З метою зменшення ризику розвитку тромбоемболій пацієнтам перед плановою кардіоверсією призначається антикоагулянтна терапія, призначення якої викладено у відповідних методичних рекомендаціях.
Черезстравохідна ехокардіографія
При підготовці пацієнтів до кардіоверсії виявлення тромбів, феномену спонтанного контрастування в порожнині серця за допомогою ЧСЕхоКГ дозволяє оцінити ризик пацієнта та уникнути тривалої антикоагулянтної терапії, допускаючи замість цього використання антикоагулянтів безпосередньо перед кардіоверсією і продовження терапії протягом 4 тижнів після кардіоверсії до відновлення механічної функції передсердь. ЧСЕхоКГ дозволяє також визначити швидкість вигнання з вушка ЛП, яка є незалежним маркером утримання синусового ритму.
Мультиспіральна комп’ютерна томографія
З метою верифікації тромбоутворення в порожнинах серця може бути використана мультиспіральна комп’ютерна томографія з контрастуванням, яка також дозволяє скоротити час підготовки до процедури.
При підготовці до планової кардіоверсії необхідно попередньо відмінити серцеві глікозиди. Тривалість скасування залежить від дози прийнятих серцевих глікозидів: при повній (насичувальній) терапевтичній дозі серцеві глікозиди відміняють за 3–4 дні до кардіоверсії, при невеликих дозах дигоксину кардіоверсію можна проводити після одно-, дводенної паузи. Також за кілька днів припиняють прийом препаратів, що змінюють електролітну і кислотно-лужну рівновагу. Всередину або внутрішньовенно вводяться препарати калію, оскільки при гіпокаліємії кардіоверсія менш надійна і більш небезпечна. Необхідно відмінити препарати, що погіршують функцію синусового вузла та АВ-вузла.
Метод зовнішньої електричної кардіоверсії
Електрична кардіоверсія проводиться кардіологом в умовах палати, що оснащена електричним дефібрилятором, апаратом ШВЛ, тимчасовим зовнішнім штучним водієм ритму, монітором ЕКГ, ларингоскопом. Бригада лікарів-кардіологів повинна володіти навичками інтубації та ШВЛ, нав’язування ритмоведення за допомогою тимчасового водія ритму серця.
Антифібриляторний механізм кардіоверсії обумовлений одночасною деполяризацією «критичного» числа кардіоміоцитів, що виникає після нанесення електричного розряду, і призводить до відновлення контролю над частотою водія ритму I порядку — синоатріального вузла.
Електрична кардіоверсія може бути здійснена кількома способами. Найбільш поширеним є зовнішня (трансторакальна) кардіоверсія, застосовувана з 1960-х років. При передньозадньому методі обидва електроди розміщують на грудну клітку, один з яких — на область проекції правого передсердя, другий — на спину нижче лівої лопатки. Успішне відновлення синусового ритму при використанні передньозадньої позиції досягає понад 90 %. Сучасні зовнішні дефібрилятори розраховані на проведення кардіоверсії передньобоковим методом, коли один електрод накладається на бокову стінку грудної клітки, дещо нижче області верхівки серця, другий на проекцію правого передсердя, ефективність 80–90 %.
Кардіоверсія може бути неефективною, якщо високий поріг дефібриляції. Це може бути пов’язано з хронічним ремоделюванням передсердь (стійке зменшення ефективного рефрактерного періоду і швидкості проведення), високим грудним імпедансом. Використання передньозадньої позиції розташування електродів дозволяє зменшити грудний імпеданс. У деяких пацієнтів дуже важливим фактором можуть бути особливості будови грудної клітки, хоча і у цих пацієнтів спочатку рекомендується застосувати передньозадню позицію. Грудний імпеданс значно зменшується при повному видиху. Слід намагатись, щоб вектор деполяризації проходив через міокард передсердь.
У ряді проведених досліджень показано, що ААП IА і III класів (за класифікацією Vaughan — Williams) мають тенденцію до зниження порогу дефібриляції, а препарати 1С класу — до його підвищення. У цих ситуаціях, якщо кардіоверсія неефективна, слід припинити прийом небажаного препарату і повторити кардіоверсію, коли препарат буде повністю виведений.
Нанесення розряду необхідно синхронізувати з комплексом QRS, оскільки у випадках його потрапляння на зубець Т можливе виникнення фібриляції шлуночків. Бажано також уникати проведення кардіо-версії при призначенні серцевих глікозидів, оскільки збільшується ризик виникнення шлуночкової аритмії. У пацієнтів з виявленим або удаваним синдромом тахібрадіаритмій на випадок постконверсійної асистолії необхідно підготувати тимчасовий електрокардіостимулятор.
У разі проведення планової кардіоверсії пацієнт повинен не їсти протягом 6–8 годин для уникнення можливої аспірації.
Зважаючи на біль під час процедури і наявність страху у пацієнта, застосовують загальну анестезію (наприклад, пропофол у дозі 10 мг/кг маси тіла або тіопентал в середній дозі 4–5 мг/кг маси тіла, максимальна — 8 мг/кг маси тіла) або внутрішньовенну анальгезію та седацію (наприклад, фентаніл у дозі 1 мкг/кг, потім діазепам 5–10 мг; літнім або ослабленим пацієнтам — 10 мг тримеперидину). При вихідному пригніченні дихання використовують ненаркотичні анальгетики.
Послідовність дій при проведенні електричної дефібриляції:
Пацієнт повинен перебувати в положенні, що дозволяє, при необхідності, проводити інтубацію трахеї (видалити зубні протези, що знімаються) і закритий масаж серця. Не допускається контакт з водою або металевою поверхнею. Повністю звільнити грудну клітку (видалити трансдермальні лікарські форми).
Обов’язковий надійний доступ до вени пацієнта, моніторинг ЕКГ, сатурація кисню, моніторинг АТ.
Зручніше працювати з двома ручними електродами. Встановити електроди на передній поверхні грудної клітки: один електрод встановлюють над зоною серцевої тупості (у жінок — назовні від верхівки серця, за межами молочної залози), другий — під правою ключицею, а якщо електрод спинний, то під лівою лопаткою.
Електроди можуть розташовуватися в передньозадньому положенні (вздовж лівого краю грудини в області 3-го і 4-го міжреберних проміжків і в лівій підлопатковій області).
Електроди можуть розташовуватися в передньобоковому положенні (у проміжку між ключицею і 2-му міжребер’ї вздовж правого краю грудини і над 5-м і 6-м міжреберним проміжком, в області верхівки серця). Запобігайте розташуванню електродів над штучним водієм ритму.
Для максимального зниження електричного опору при ЕІТ шкіру під електродами знежирюють спиртом або ефіром. При цьому використовують марлеві прокладки, добре змочені розчином натрію хлориду 0,9%, або спеціальні пасти.
Електроди притискають до грудної стінки щільно і з силою (приблизно 10 кг). Попередьте присутній персонал про початок кардіоверсії. Впевніться, що ніхто з присутніх не торкається пацієнта або ліжка.
Розряд наносять у момент повного видиху пацієнта.
Рекомендовані параметри кардіоверсії — дефібриляції у дорослих:
— при ФП для першого впливу досить розряду в 100 Дж;
— при збереженні аритмії у кожному наступному розряді енергію збільшують на 50–100 Дж до максимальної 360 Дж.
Проміжок часу між спробами повинен бути мінімальний і потрібний лише для оцінки ефекту дефібриляції і набору, у разі необхідності, наступного розряду. Відразу після ЕІТ слід спостерігати за пацієнтом до виходу з седації, оцінити ритм і в разі його відновлення зареєструвати ЕКГ у 12 відведеннях.
Після проведення кардіоверсії пацієнт повинен зберігати режим мінімальних навантажень упродовж доби після кардіоверсії.
Ускладнення та їх ведення
1. Дія електричного струму на персонал:
— звичайно призводить до тимчасового дискомфорту;
— кращим лікуванням є профілактика.
2. Тимчасове або постійне порушення роботи штучного водія ритму:
— після успішного проведення і стабілізації гемодинаміки може з’явитися потреба у заміні штучного водія ритму;
— при необхідності розпочати черезшкірну або тимчасову трансвенозну кардіостимуляцію.
3. Опіки шкіри:
— звичайно це опіки першого ступеня, однак вони можуть бути глибокими;
— проведіть лікування відповідно до ступеня опіку.
Збереження синусового ритму після електричної кардіоверсії не гарантовано. За даними контрольованих досліджень встановлено, що протягом 1 року тільки у 30 % пацієнтів, які отримували плацебо, зберігається синусовий ритм, отже, після відновлення синусового ритму може виникнути необхідність в антиаритмічній терапії.
3.3.4. Госпіталізація
Положення протоколу
Госпіталізація проводиться при необхідності відновлення синусового ритму при персистуючій формі аритмії та неефективності амбулаторного лікування рутинними заходами та/або порушеннях гемодинаміки або для планової ЕІТ, а також при відсутності ефекту від антиаритмічної терапії на амбулаторному етапі.
Необхідні дії
Якщо медикаментозно в стаціонарі не вдалося відновити синусовий ритм, але є обставини на користь проведення планової електричної кардіоверсії, то:
1. Пацієнт виписується з клініки з подальшим наглядом лікаря-терапевта дільничного та/або лікаря-
кардіолога.
2. Триває лікування основного захворювання і призначається ААП для контролю ЧШС.
3. Триває розпочате в стаціонарі лікування варфарином протягом 3–4 тижнів (МНВ в межах 2,0–3,0) або НПАК до проведення кардіоверсії і 4 тижні після її проведення.
4. Перед проведенням планової електричної кардіоверсії або ЕІТ обов’язкове ЧСЕхоКГ дослідження.
Що робити, якщо пацієнт прийшов до терапевта і давність ФП невідома?
1. Якщо існують обставини на користь відновлення синусового ритму, то слід планувати проведення планової електричної кардіоверсії.
2. Обов’язкове проведення ЧСЕхоКГ.
3. Призначається ААП для контролю ЧШС і лікується основне захворювання (цільові рівні АТ, стабілізація ФК стенокардії або хронічної серцевої недостатності тощо).
4. Призначається варфарин протягом 3–4 тижнів (МНВ у межах 2,0–3,0) до проведення кардіоверсії або НПАК і 4 тижні після її проведення.
Коли можна проводити електричну кардіоверсію (ЕІТ), якщо ФП триває більше 48 годин?
1. За умови відсутності тромбів за даними ЧСЕхоКГ.
2. У разі екстреної кардіоверсії (нестабільна гемодинаміка).
3. Болюсно вводиться гепарин в дозі 5–10 тис. ОД з наступним його введенням в дозі, необхідній для подовження АЧТЧ (АПТВ) в 1,5–2 рази від контрольних значень (в нормі 25–42 с).
4. Після відновлення ритму на 3–4-му тижні призначають варфарин (МНВ 2,0–3,0) або НПАК.
Коли можна проводити електричну кардіоверсію без ЧСЕхоКГ?
1. Якщо ФП триває менше 48 год і немає факторів ризику розвитку тромбоемболічних ускладнень.
2. В/в болюсно вводиться гепарин в дозі 5–10 тис. ОД з наступним його введенням в дозі, необхідній для подовження АЧТЧ (або АПТВ) в 1,5–2 рази від конт-рольних значень (в нормі від 25–42 с).
3. Після відновлення ритму на 3–4-му тижні призначають варфарин (МНВ 2,0–3,0) або НПАК.
Рекомендації з антитромботичної терапії при ТП та ІХС:
1. Антитромботична терапія при ТП, як правило, така ж, як при ФП.
2. Вибір антитромботичного препарату за одними і тими ж критеріями незалежно від типу ТП.
3. Лікування пацієнтів на ІХС непрямими антикоагулянтами на основі тих же самих критеріїв, які використовуються у пацієнтів без ІХС.
Досить часто задається питання про те, як вчинити з пацієнтами, які мають постійну ФП і яким планується хірургічне втручання з приводу ІХС.
Проведення операцій на коронарних артеріях у пацієнтів з ІХС та ФП
1. Спеціальних клінічних досліджень з цими пацієнтами не проводилося!
2. При черезшкірних втручаннях на коронарних артеріях зазвичай доводиться переривати антикоагулянтну терапію або знижувати її інтенсивність.
3. Скасування варфарину за 1 тиждень до операції.
4. Після операції на коронарних артеріях призначається клопідогрель, що забезпечує прохідність коронарних артерій.
5. Приєднання АСК до варфарину підвищує ризик більшою мірою, ніж користь.
6. Але якщо зберігається ФП, лікування варфарином слід відновити якомога швидше.
7. Використовується клопідогрель 75 мг/добу + варфарин (МНВ 2,0–3,0) терміном 9–12 місяців.
8. У подальшому може бути продовжена монотерапія варфарином.
При планових черезшкірних коронарних втручаннях застосування стентів з покриттям має обмежуватися деякими клінічними ситуаціями та/або анатомічними особливостями, наприклад ураження досить великих фрагментів артерій, ураження дрібних судин, наявність цукрового діабету тощо, коли від застосування таких стентів очікуються суттєві переваги у порівнянні із звичайними металевими стентами без покриття; при цьому потрійна антитромботична терапія (АВK або НПАК, АСК та клопідогрель) повинна призначатися протягом 4 тижнів. Після черезшкірних коронарних втручань з використанням стентів без покриття пацієнти з ФП та стабільним коронароатеросклерозом повинні отримувати тривалу терапію (протягом 12 місяців): ПАК плюс клопідогрель 75 мг/добу або як альтернатива АСК ≤ 100 мг/добу плюс гастропротективні засоби — інгібітори протонної помпи, в залежності від ризиків геморагічних та тромботичних ускладнень у кожного окремого пацієнта. Потрійна антитромботична терапія (ПАК, АСК та клопідогрель) повинна призначатися протягом принаймні 1 місяця після імплантації стенту без покриття, але значно довше після імплантації стенту з покриттям (≥ 3 місяців для стентів з покриттям засобами групи «-олімус» [еверолімус, такролімус] та принаймні протягом 6 місяців для стентів з покриттям паклітакселом), після чого призначається комбінація ПАК та клопідогрелю 75 мг/добу або як альтернатива АСК ≤ 100 мг/добу плюс може продовжувати застосовуватися гастропротективна терапія.
Якщо у пацієнтів з ФП, які отримують антикоагулянтну терапію, спостерігається помірний або високий ризик тромбоемболічних ускладнень, при виконанні черезшкірних коронарних втручань можна надати перевагу стратегії безперервної антикоагулянтної терапії, і навіть на фоні терапевтичної антикоагуляції (МНВ 2,0–3,0) як втручання першого вибору слід використовувати черезшкірне коронарне втручання з радіальним доступом.
3.3.5. Виписка
Положення протоколу
Виписка зі стаціонару здійснюється при наступних умовах:
— відсутність або суттєве зменшення пароксизмів ФП і ТП (при пароксизмальній та персистуючій формах):
— відсутність порушень гемодинаміки під час нападу;
— контроль ЧШС;
— відсутність прогресування хронічної серцевої недостатності (при постійній формі ФП).
ЧШС вважається контрольованою, коли вона варіює між 60 і 80 ударами в хвилину в стані спокою і 90–110 ударі у хвилину при помірному фізичному навантаженні.
Якщо у пацієнта відновився синусовий ритм або він госпіталізований у стаціонар з таким, то при виборі ААП рекомендується діяти згідно з такими алгоритмами, оскільки пацієнти з ФП і відновленим синусовим ритмом можуть бути віднесені до тієї чи іншої групи:
Обґрунтування
Алгоритм дій для вибору стратегії профілактичної антиаритмічної терапії при ФП
Група I: Пацієнти з першим або вперше виявленим пароксизмом ФП
А. У пацієнта відбулося спонтанне відновлення синусового ритму.
Б. Пароксизм ФП купіруваний за допомогою фармакологічної або електричної кардіоверсії.
Коментар: імовірність рецидиву ФП не відома, тривала антиаритмічна терапія не виправдана.
• Таким пацієнтам на 1 місяць призначається ААП з метою утримання синусового ритму;
• На 1 місяць призначається антитромботичний препарат, за умови відсутності факторів ризику тромбоемболії, про які буде сказано нижче. Якщо ризик тромбоемболічних ускладнень високий або середній, то застосування непрямих антикоагулянтів довічне.
Група II: Пацієнти з рецидивуючими пароксизмами ФП (без попередньої антиаритмічної терапії)
А. Пацієнти з безсимптомними пароксизмами ФП (за результатами холтерівського моніторування ЕКГ).
Коментар: роль антиаритмічної терапії в профілактиці рецидивів пароксизмів ФП/ТП достовірно не визначена, але рекомендується постійний прийом антитромботичної терапії.
Б. Пацієнти з епізодами ФП, що супроводжується клінічною симптоматикою, але рідше 1 разу на 3 місяці.
Коментар: купірування нападу ФП або контроль ЧШС (див. таблицю 7).
С. Пацієнти з нападами ФП і клінічною симптоматикою, але частіше 1 разу на 3 місяці.
Коментар: виправдане тривале призначення антиаритмічної терапії для профілактики пароксизмів ФП, антикоагулянти або розглядається хірургічне лікування.
Група III: Пацієнти з рецидивуючими пароксизмами ФП і неефективною антиаритмічною терапією.
А. Пацієнти з безсимптомними пароксизмами ФП
Коментар: спроба підбору більш ефективних ААП? (клінічні дослідження проводяться), антикоагулянти, можливо хірургічне лікування.
Б. Пацієнти з пароксизмами і клінічною симптоматикою під час ФП, але рідше 1 разу на 3 місяці.
Коментар: спроба підбору ААП, антитромботична терапія, доцільне хірургічне лікування.
С. Пацієнти з пароксизмами ФП частіше 1 разу на 3 місяці, що супроводжуються клінічною симптоматикою.
Коментар: необхідне хірургічне лікування, антитромботична терапія. При неможливості хірургічного лікування — контроль ЧШС.
Якими препаратами найкраще утримувати синусовий ритм?
Метааналіз 35 рандомізованих досліджень з використанням восьми ААП показав, що найбільшу ефективність для профілактики пароксизмів ФП мають аміодарон, соталол і пропафенон. При тривалому призначенні зазначених лікарських засобів слід пам’ятати про побічні ефекти (особливо при терапії аміодароном) і разом з регулярним ЕКГ-моніторингом контролювати стан органів-мішеней препарату.
Необхідні дії
При виборі препарату необхідно враховувати основне захворювання, яке стало причиною ФП, а також його перебіг і ускладнення, пов’язані з ним (інтервал QT до призначення ААП, порушення внутрішньошлуночкової провідності, ФК хронічної серцевої недостатності тощо).
1. Якщо ФП виникла у пацієнтів без патології серця або з його мінімальними структурними змінами (наприклад, пролапс мітрального клапана, вегетативно-дизоваріальна кардіоміопатія тощо), то профілактичну антиаритмічну терапію слід починати з ААП 1С класу пропафенону.
2. Якщо ААП не запобігає рецидивам ФП або його використання супроводжується побічними ефектами, потрібно переходити до призначення аміодарону або комбінованої антиаритмічної терапії, або обговорювати питання щодо хірургічного лікування тахіаритмії.
3. Лікування ФП і ТП у пацієнтів з ІХС та застійною серцевою недостатністю, як правило, обмежується використанням аміодарону.
4. АГ, що призводить до гіпертрофії міокарда ЛШ, збільшує ризик розвитку поліморфної шлуночкової тахікардії типу «пірует». У зв’язку з цим для попередження рецидивів ФП віддається перевага ААП 1С класу, наприклад пропафенону, що істотно не впливає на тривалість реполяризації та інтервал QT.
5. Алгоритм фармакотерапії при ФП і АГ є наступним: 1) якщо гіпертрофія міокарда ЛШ > 1,4 см, то використовується аміодарон; 2) якщо гіпертрофії міокарда ЛШ немає або вона менше 1,4 см, то лікування слід розпочинати з пропафенону, а при його неефективності використовувати аміодарон або соталол.
3.3.6. Реабілітація
Положення протоколу
Вимоги до режиму праці, відпочинку, реабілітації
Не рекомендується перебування під прямими сонячними променями пацієнтам, які вживають аміодарон. При наявності частих пароксизмів та пароксизмів з порушенням гемодинаміки пацієнти потребують направлення на медико-соціальну експертну комісію для визначення можливості продовжувати професійну діяльність.
Пацієнтам з пароксизмальною або персистуючою формами ФП/ТП після відновлення синусового ритму та підбору адекватної протирецидивної терапії, з нападами порушень ритму не частіше 2 разів на місяць, призначають санаторно-курортне лікування.
Обґрунтування
Специфічної реабілітації пацієнти з ФП не потребують.
Необхідні дії
Реабілітація основного захворювання.
Вимоги до дієтичних призначень і обмежень
Пацієнти повинні дотримуватись дієти із обмеженням солі до 6 г на добу, обмеженням вживання тваринних жирів та продуктів, які містять холестерин. При зайвій вазі обмежується енергетична цінність їжі.
При наявності шкідливих звичок — відмова від тютюнопаління, обмеження вживання алкоголю.
3.3.7. Диспансерне спостереження
Положення протоколу
При нападах ФП частіше ніж 1 раз на 3 місяці пацієнти потребують постійного щоденного застосування препаратів.
Пацієнти повинні знаходитись на диспансерному спостереженні за місцем проживання. Проходити щорічне обов’язкове обстеження, при необхідності корекція терапії частіше ніж 1 раз на рік. Обов’язковий регулярний контроль МНВ (ПТІ при неможливості визначення МНВ).
Обґрунтування
Перед лікарем-терапевтом дільничним та/або лікарем-кардіологом можуть постати кілька завдань з ведення пацієнтів з ФП на амбулаторному етапі:
1. Перш за все це лікування основного захворювання, що стало причиною ФП.
2. Утримання синусового ритму якомога довше.
3. Контроль ЧШС при постійній формі ФП.
4. Активне використання критеріїв обставин у вирішенні питання про відновлення синусового ритму.
5. Дотримуватися послідовності в рекомендаціях, які були дані в стаціонарі (наприклад, прийняте рішення про відновлення синусового ритму за допомогою планової електричної кардіоверсії).
6. Використання алгоритмів з тактики і тривалості застосування ААП і можливостей хірургічного лікування пацієнтів.
Необхідні дії
Щорічне обов’язкове обстеження, при необхідності обстеження і корекція терапії частіше ніж 1 раз на рік.
Обов’язковий регулярний контроль МНВ (ПТІ при неможливості визначення МНВ) (кожен тиждень).
Необхідно підраховувати час у терапевтичному діапазоні (TTR) на кожному візиті:
— використовувати валідовані методі виміру (наприклад, метод Rosendaal) для комп’ютеризованого підрахунку дозування;
— % вимірів у терапевтичному діапазоні при ручному підрахунку;
— виключати показники за перші 6 тижнів використання АВK;
— враховувати дані принаймні за 6 місяців.
IV. Опис етапів медичної допомоги
4.1. Алгоритм дії на догоспітальному етапі при пароксизмальній формі фібриляції передсердь тривалістю менше 48 годин
V. Ресурсне забезпечення виконання протоколу
На момент затвердження цього уніфікованого клінічного протоколу засоби матеріально-технічного забезпечення дозволені до застосування в Україні. При розробці та застосуванні локальних протоколів медичної допомоги (клінічних маршрутів пацієнтів) (ЛПМД (КМП)) необхідно перевірити реєстрацію в Україні засобів матеріально-технічного забезпечення, які включаються до ЛПМД (КМП), та відповідність призначення лікарських засобів Інструкції для медичного застосування лікарського засобу, затвердженій Міністерством охорони здоров’я України. Державний реєстр лікарських засобів України знаходиться за електронною адресою http://www.drlz.com.ua/.
1. Первинна медична допомога
1.1. Кадрові ресурси
Лікарі загальної практики — сімейні лікарі, лікарі-терапевти дільничні. В сільській місцевості допомога може надаватись фельдшерами (сестрами медичними загальної практики-сімейної медицини).
1.2. Матеріально-технічне забезпечення
Оснащення. Відповідно до табеля оснащення.
Лікарські засоби (наведені в алфавітному порядку)
Аміодарон, апіксабан, ацетилсаліцилова кислота, варфарин, верапаміл, дабігатрану етексилат, дигоксин, дилтіазем, клопідогрель, метопролол, препарати наперстянки, пропафенон, ривароксабан, соталол.
2. Вторинна та третинна медична допомога
2.1. Кадрові ресурси
Лікар-кардіолог, лікар інсультних відділень стаціонарів та відділень інтенсивної терапії, лікар-невролог, лікар-нейрохірург, лікар-хірург, лікар з лікувальної фізкультури, лікар-фізіотерапевт.
2.2. Матеріально-технічне забезпечення
Оснащення. Відповідно до табеля оснащення.
Лікарські засоби (наведені в алфавітному порядку)
Аміодарон, Апіксабан, Атенолол, Атропін, Ацетилсаліцилова кислота, Бісопролол, Верапаміл, Варфарин, Гепарин, Дабігатрану етексилат, Дигоксин, Дилтіазем, Діазепам, Дронедарон, Еверолімус, Есмолол, Етацизин, Карведилол, Клопідогрель, Метопролол, Натрію хлорид, Паклітаксел, Прокаїнамід, Пропафенон, Пропофол, Пропранолол, Ривароксабан, Соталол, Такролімус, Тіопентал, Тримеперидин, Фентаніл.
VI. Індикатори якості медичної допомоги
Форма 025/о — Медична карта амбулаторного хворого (Форма 025/о), затверджена наказом Міністерства охорони здоров’я України від 14 лютого 2012 року № 110 «Про затвердження форм первинної облікової документації та інструкцій щодо їх заповнення, що використовуються у закладах охорони здоров’я незалежно від форми власності та підпорядкування», зареєстрованим у Міністерстві юстиції України 28 квітня 2012 р. за № 661/20974.
Форма 030/о — Контрольна карта диспансерного нагляду (Форма 030/о), затверджена наказом МОЗ України від 14 лютого 2012 року № 110 «Про затвердження форм первинної облікової документації та інструкцій щодо їх заповнення, що використовуються у закладах охорони здоров’я незалежно від форми власності та підпорядкування», зареєстрованим у Міністерстві юстиції України 28 квітня 2012 року за № 661/20974.
6.1.1. Наявність у лікуючого лікаря, який надає первинну медичну допомогу, локального протоколу ведення пацієнта з фібриляцією передсердь.
6.1.2. Наявність у лікуючого лікаря, який надає вторинну (спеціалізовану) та третинну (високоспеціалізовану) медичну допомогу, локального протоколу ведення пацієнта з фібриляцією передсердь.
6.1.3. Відсоток пацієнтів з фібриляцією передсердь, для яких лікарем загальної практики-сімейним лікарем було отримано інформацію про медичний стан протягом звітного періоду.
6.2. Паспорти індикаторів якості медичної допомоги
6.2.1. А) Наявність у лікуючого лікаря, який надає первинну медичну допомогу, локального протоколу ведення пацієнта з фібриляцією передсердь
Б) Зв’язок індикатора із затвердженими настановами, стандартами та протоколами медичної допомоги
Індикатор ґрунтується на положеннях Уніфікованого клінічного протоколу первинної, вторинної (спеціалізованої) та третинної (високоспеціалізованої) медичної допомоги «Фібриляція передсердь».
В) Зауваження щодо інтерпретації та аналізу індикатора
Даний індикатор характеризує організаційний аспект запровадження сучасних медико-технологічних документів (ЛПМД) в регіоні. Якість медичної допомоги пацієнтам, відповідність надання медичної допомоги вимогам ЛПМД, відповідність ЛПМД чинному УКПМД даним індикатором висвітлюватися не може, але для аналізу цих аспектів необхідне обов’язкове запровадження ЛПМД в ЗОЗ.
Бажаний рівень значення індикатора:
2016 рік — 90 %.
2017 рік та подальший період — 100 %.
Г) Інструкція з обчислення індикатора
а) Організація (ЗОЗ), яка має обчислювати індикатор: ЗОЗ, структурні підрозділи з питань охорони здоров’я місцевих державних адміністрацій.
б) Дані надаються лікуючими лікарями, які надають первинну медичну допомогу, розташованими на території обслуговування, до структурних підрозділів з питань охорони здоров’я місцевих державних адміністрацій.
в) Дані надаються поштою, в тому числі електронною поштою.
г) Метод обчислення індикатора: підрахунок шляхом ручної або автоматизованої обробки. Індикатор обчислюється структурними підрозділами з питань охорони здоров’я місцевих державних адміністрацій після надходження інформації від всіх лікуючих лікарів, які надають первинну медичну допомогу, зареєстрованих на території обслуговування. Значення індикатора обчислюється як відношення чисельника до знаменника.
ґ) Знаменник індикатора складає загальна кількість лікуючих лікарів, які надають первинну медичну допомогу, зареєстрованих на території обслуговування. Джерелом інформації є звіт структурних підрозділів з питань охорони здоров’я місцевих державних адміністрацій, який містить інформацію про кількість лікуючих лікарів, які надають первинну медичну допомогу, зареєстрованих на території обслуговування.
д) Чисельник індикатора складає загальна кількість лікуючих лікарів, які надають первинну медичну допомогу, зареєстрованих на території обслуговування, для яких задокументований факт наявності локального протоколу ведення пацієнта з фібриляцією передсердь (наданий екземпляр ЛПМД). Джерелом інформації є ЛПМД, наданий лікуючим лікарем, який надає первинну медичну допомогу.
е) Значення індикатора наводиться у відсотках.
6.2.2. А) Наявність у лікуючого лікаря, який надає вторинну (спеціалізовану) та третинну (високоспеціалізовану) медичну допомогу, локального протоколу ведення пацієнта з фібриляцією передсердь
Б) Зв’язок індикатора із затвердженими настановами, стандартами та протоколами медичної допомоги
Індикатор ґрунтується на положеннях Уніфікованого клінічного протоколу первинної, вторинної (спеціалізованої) та третинної (високоспеціалізованої) медичної допомоги «Фібриляція передсердь».
В) Зауваження щодо інтерпретації та аналізу індикатора
Даний індикатор характеризує організаційний аспект запровадження сучасних медико-технологічних документів (ЛПМД) в регіоні. Якість медичної допомоги пацієнтам, відповідність надання медичної допомоги вимогам ЛПМД, відповідність ЛПМД чинному УКПМД даним індикатором висвітлюватися не може, але для аналізу цих аспектів необхідне обов’язкове запровадження ЛПМД в ЗОЗ.
Бажаний рівень значення індикатора:
2016 рік — 90 %.
2017 рік та подальший період — 100 %.
Г) Інструкція з обчислення індикатора
а) Організація (ЗОЗ), яка має обчислювати індикатор: ЗОЗ; структурні підрозділи з питань охорони здоров’я місцевих державних адміністрацій.
б) Дані надаються лікуючими лікарями, які надають вторинну (спеціалізовану) та третинну (високоспеціалізовану) медичну допомогу, розташованими на території обслуговування, до структурних підрозділів з питань охорони здоров’я місцевих державних адміністрацій.
в) Дані надаються поштою, в тому числі електронною поштою.
г) Метод обчислення індикатора: підрахунок шляхом ручної або автоматизованої обробки. Індикатор обчислюється структурними підрозділами з питань охорони здоров’я місцевих державних адміністрацій після надходження інформації від всіх лікуючих лікарів, які надають вторинну (спеціалізовану) та третинну (високоспеціалізовану) медичну допомогу, зареєстрованих на території обслуговування. Значення індикатора обчислюється як відношення чисельника до знаменника.
ґ) Знаменник індикатора складає загальна кількість лікуючих лікарів, які надають вторинну (спеціалізовану) та третинну (високоспеціалізовану) медичну допомогу, зареєстрованих на території обслуговування. Джерелом інформації є звіт структурних підрозділів з питань охорони здоров’я місцевих державних адміністрацій, який містить інформацію про кількість лікуючих лікарів, які надають вторинну (спеціалізовану) та третинну (високоспеціалізовану) медичну допомогу, зареєстрованих на території обслуговування.
д) Чисельник індикатора складає загальна кількість лікуючих лікарів, які надають вторинну (спеціалізовану) та третинну (високоспеціалізовану) медичну допомогу, зареєстрованих на території обслуговування, для яких задокументований факт наявності локального протоколу ведення пацієнта з фібриляцією передсердь (наданий екземпляр ЛПМД). Джерелом інформації є ЛПМД, наданий лікуючими лікарями, які надають вторинну (спеціалізовану) та третинну (високоспеціалізовану) медичну допомогу.
е) Значення індикатора наводиться у відсотках.
6.2.3. А) Відсоток пацієнтів з фібриляцією передсердь, для яких лікарем загальної практики — сімейним лікарем було отримано інформацію про медичний стан протягом звітного періоду
Б) Зв’язок індикатора із затвердженими настановами, стандартами та протоколами медичної допомоги.
Індикатор ґрунтується на положеннях Уніфікованого клінічного протоколу первинної, вторинної (спеціалізованої) та третинної (високоспеціалізованої) медичної допомоги «Фібриляція передсердь».
В) Зауваження щодо інтерпретації та аналізу індикатора.
При аналізі індикатора слід враховувати неприпустимість формального та необґрунтованого віднесення до чисельника індикатора тих хворих, для яких не проводилося медичного огляду лікарем загальної практики — сімейним лікарем/лікарем-терапевтом дільничним (амбулаторією сімейної медицини, центром первинної медичної (медико-санітарної) допомоги) протягом звітного періоду. В первинній медичній документації мають бути задокументовані факти медичного огляду пацієнта, а також наявність або відсутність прогресування захворювання. Пацієнти, для яких такі записи в медичній документації відсутні, не включаються до чисельника індикатора, навіть у випадку, якщо лікар має достовірну інформацію про те, що пацієнт живий та перебуває в районі обслуговування (за відсутності даних медичного огляду).
Цільовий (бажаний) рівень значення індикатора на етапі запровадження УКПМД не визначається заради запобігання викривленню реальної ситуації внаслідок адміністративного тиску.
Г) Інструкція з обчислення індикатора
а) Організація (заклад охорони здоров’я), яка має обчислювати індикатор: лікар загальної практики — сімейний лікар/лікар-терапевт дільничний (амбулаторія сімейної медицини, центр первинної медичної (медико-санітарної) допомоги). Структурні підрозділи з питань охорони здоров’я місцевих державних адміністрацій.
б) Дані надаються лікарями загальної практики — сімейними лікарями (амбулаторіями сімейної медицини, центрами первинної медичної (медико-санітарної) допомоги), розташованими в районі обслуговування, до структурних підрозділів з питань охорони здоров’я місцевих державних адміністрацій.
в) Дані надаються поштою, в тому числі електронною поштою.
г) Метод обчислення індикатора: підрахунок шляхом ручної обробки. При наявності автоматизованої технології закладу охорони здоров’я, в якій обробляються формалізовані дані щодо медичної допомоги в обсязі, що відповідає Медичній карті амбулаторного хворого (форма 025/0) або Контрольній карті диспансерного нагляду (форма 030/о) — автоматизована обробка.
Індикатор обчислюється лікарем загальної практики — сімейним лікарем (амбулаторією сімейної медицини, центром первинної медичної (медико-санітарної) допомоги), шляхом ручного або автоматизованого аналізу інформації Медичних карт амбулаторного хворого (форма 025/0) або Контрольних карт диспансерного нагляду (форма 030/о).
Індикатор обчислюється регіональним управлінням охорони здоров’я після надходження від всіх лікарів загальної практики — сімейних лікарів (амбулаторій сімейної медицини, центрів первинної медичної (медико-санітарної) допомоги), зареєстрованих в районі обслуговування, інформації щодо загальної кількості пацієнтів, які складають чисельник та знаменник індикатора.
ґ) Знаменник індикатора складає загальна кількість пацієнтів з фібриляцією передсердь, які перебувають під диспансерним наглядом у лікаря загальної практики — сімейного лікаря (амбулаторії сімейної медицини, центру первинної медичної (медико-санітарної) допомоги).
Джерелом інформації є:
Медична карта амбулаторного хворого (форма 025/о);
Контрольна карта диспансерного нагляду (форма 030/о).
д) Чисельник індикатора складає загальна кількість пацієнтів з фібриляцією передсердь, які перебувають під диспансерним наглядом у лікаря загальної практики — сімейного лікаря (амбулаторії сімейної медицини, центру первинної медичної (медико-санітарної) допомоги), для яких наведена інформація про медичний стан пацієнта із зазначенням відсутності або наявності проявів захворювання. Джерелом інформації є:
Медична карта амбулаторного хворого (форма 025/о);
Контрольна карта диспансерного нагляду (форма 030/о).
е) Значення індикатора наводиться у відсотках.
Директор Медичного департаменту
МОЗ України
В. Кравченко
VII. Перелік літературних джерел, використаних при розробці Уніфікованого клінічного протоколу медичної допомоги
1. Електронний документ «Адаптована клінічна настанова, заснована на доказах. Фібриляція передсердь», 2016.
2. Наказ МОЗ України від 14.03.2015 р. № 183 «Про затвердження восьмого випуску Державного формуляра лікарських засобів та забезпечення його доступності».
3. Наказ МОЗ України від 27.12.2013 р. № 1150 «Про затвердження Примірного табеля матеріально-технічного оснащення Центру первинної медичної (медико-санітарної) допомоги та його підрозділів».
4. Наказ МОЗ України від 28.09.2012 р. № 751 «Про створення та впровадження медико-технологічних документів зі стандартизації медичної допомоги в системі Міністерства охорони здоров’я України», зареєстрований в Міністерстві юстиції України 29.11.2012 р. за № 2001/22313.
5. Наказ МОЗ України від 14.02.2012 р. № 110 «Про затвердження форм первинної облікової документації та інструкцій щодо їх заповнення, що використовуються у закладах охорони здоров’я незалежно від форми власності та підпорядкування», зареєстрований в Міністерстві юстиції України 28.04.2012 за № 661/20974.
6. Наказ МОЗ України від 31.10.2011 р. № 734 «Про затвердження табелів оснащення медичною технікою та виробами медичного призначення структурних підрозділів лікарні планового лікування».
7. Наказ МОЗ України від 31.10.2011 р. № 735 «Про затвердження табелів оснащення медичною технікою та виробами медичного призначення структурних підрозділів лікарні інтенсивного лікування».
8. Наказ МОЗ України від 31.10.2011 р. № 739 «Про затвердження табелів оснащення медичною технікою та виробами медичного призначення структурних підрозділів консультативно-діагностичного центру».
9. Наказ МОЗ України від 02.03.2011 р. № 127 «Про затвердження примірних табелів оснащення медичною технікою та виробами медичного призначення центральної районної (районної) та центральної міської (міської) лікарень».
10. Наказ МОЗ України від 05.07.2005 р. № 330 «Про запровадження ведення електронного варіанту облікових статистичних форм в лікувально-профілактичних закладах».
11. Наказ МОЗ України від 28.10.2002 р. № 385 «Про затвердження переліків закладів охорони здоров’я, лікарських, провізорських посад та посад молодших спеціалістів з фармацевтичною освітою у закладах охорони здоров’я», зареєстрований в Міністерстві юстиції України 12.11.2002 за № 892/7180.
12. Наказ МОЗ України від 23.02.2000 р. № 33 «Про примірні штатні нормативи закладів охорони здоров’я».
VIII. Додатки до уніфікованого клінічного протоколу медичної допомоги
Додаток 1
до Уніфікованого клінічного протоколу первинної,
вторинної (спеціалізованої) та третинної (високоспеціалізованої)
медичної допомоги «Фібриляція передсердь»
Кардіоверсія при гемодинамічно стабільній ФП, місце кардіоверсії під контролем ТЕ-ЕхоКГ
та подальша стратегія антикоагулянтної терапії
Додаток 2
до Уніфікованого клінічного протоколу первинної,
вторинної (спеціалізованої) та третинної (високоспеціалізованої)
медичної допомоги «Фібриляція передсердь»
Стратегії антитромботичної терапії після стентування коронарних артерій у пацієнтів з ФП та помірним або високим ризиком тромбоемболічних подій (тих, кому показана терапія пероральними антикоагулянтами)