Газета «Новости медицины и фармации» 11 (585) 2016
Вернуться к номеру
Стратегія лікування неускладнених інфекцій нижніх сечовивідних шляхів
Авторы: Григоренко В.М., Ромащенко О.В., Білоголовська В.В., Волков С.С. - ДУ «Інститут урології НАМН України», м. Київ, Україна
Разделы: Справочник специалиста
Версия для печати
Статья опубликована на с. 9-12 (Укр.)
Інфекції сечовивідних шляхів (ІСВШ) належать до найпоширеніших захворювань як в амбулаторній, так і в стаціонарній практиці лікаря, вони обумовлені запальним процесом, передусім бактеріального генезу, що розвивається в різних анатомічних ділянках сечовивідної системи, від ниркової фасції до зовнішнього отвору уретри [1].
Щорічно тільки в США понад 7 млн людей із симптомами ІСВШ звертаються за спеціалізованою медичною допомогою, причому на них припадає близько 15 % усіх призначень антибіотиків. Аналогічна статистика притаманна й країнам Європи [1, 2].
Більш схильними до ІСВШ є жінки, переважно репродуктивного віку. За визначенням ВООЗ, репродуктивним періодом життя жінки слід вважати вік від 15 до 49 років у країнах з низькою народжуваністю та від 15 до 45 років — з високою народжуваністю.
Майже половина всіх жінок хоча б один раз за своє життя перенесли епізод ІСВШ, причому одна з трьох — у віці до 24 років, а в періоді між 20 та 50 роками цистит у жінок зустрічається в 50 разів частіше, ніж у чоловіків. За таких умов відмічено 6–8 епізодів гострого циститу (ГЦ) упродовж року на 10 000 чоловіків віком від 21 до 50 років, що потребує урологічного обстеження та диференціальної діагностики стосовно переліку захворювань урогенітального тракту, необхідності виключення можливої обструкції сечових шляхів [3].
Значимість проблеми гострого циститу в умовах сьогодення, окрім значної поширеності, урологічних та соматичних негараздів, обумовлена частотою розвитку рецидивів захворювання. У 25–50 % жінок, які перенесли хоча б один епізод ГЦ, існує висока ймовірність розвитку рецидиву циститу впродовж року.
Останнім часом зростання частоти хронічних інфекцій сечової системи саме в пацієнток репродуктивного віку є загальновизнаним: щорічно у світі виявляється понад 1 % хворих з досліджуваною патологією (Доповідь Комітету експертів ВООЗ № 133, 2014 р.).
Слід зазначити, що тривалий перебіг даних захворювань призводить до порушення уродинаміки, функціональної активності нирок та тубулоінтерстиціальних змін, що трактується як хронічна хвороба нирок. Як наслідок, розвивається вторинно-зморщена нирка та хронічна ниркова недостатність. Отже, актуальність проблеми інфекційного ураження сечових шляхів і нирок обумовлена значною поширеністю та високим ризиком хронізації процесів.
Традиційно ІСВШ класифікують відповідно до клінічних симптомів, лабораторних даних та результатів мікробіологічного дослідження й виділяють неускладнені, ускладнені ІСВШ та сепсис.
Ініціативною групою Американського товариства з інфекційних хвороб (IDSA) та Європейського товариства з клінічної мікробіології та інфекційних захворювань (ESCMID) запропоновано класифікацію з урахуванням номенклатури ІСВШ. Відповідно до клінічних рекомендацій Європейської асоціації урологів така класифікація має враховувати:
- анатомічний рівень ушкодження;
- ступінь тяжкості інфекції;
- супутні фактори ризику;
- мікробіологічні фактори (EAU, 2015) [4].
Відповідно до анатомічної класифікації ІСВШ розподіляються на інфекції нижніх, верхніх сечовивідних шляхів та уросепсис.
Інфекції нижніх сечовивідних шляхів (ІНСВШ) — цистит та уретрит, а верхніх — пієлонефрит.
Залежно від ступеня тяжкості розвитку запального процесу ІСВШ розподіляють так:
- низького ступеня тяжкості: асимптоматична бактеріурія (не потребує лікування), цистит;
- пієлонефрит середнього ступеня тяжкості;
- пієлонефрит тяжкий зі встановленою етіологією;
- уросепсис із синдромом системної запальної відповіді;
- уросепсис з органною дисфункцією;
- уросепсис з органною недостатністю.
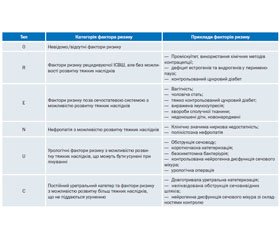
Розподіл відповідно до факторів ризику подано в табл. 1.
Відмічено, що неускладнені ІСВШ зустрічаються порівняно частіше, вони виникають за умови відсутності обструкції в нирках та сечовивідних шляхах, тяжких супутніх захворювань, інших факторів ризику. У більшості випадків неускладнені ІНСВШ не потребують стаціонарного лікування, таким хворим надається необхідна медична допомога в амбулаторному режимі лікарем загальної практики.
Ускладнені ІСВШ найчастіше виникають на тлі різних обструктивних уропатій (сечокам’яна хвороба, полікістоз нирок, аномалії розвитку та розташування нирок, стриктури сечовивідних шляхів тощо), а також за наявності тяжких супутніх захворювань. Ускладнені ІСВШ можуть призводити до розвитку гнійно-септичних ускладнень та уросепсису з порушенням функції життєво важливих органів, що потребує проведення адекватної терапії в умовах спеціалізованого стаціонару.
Отже, численність неповторних клінічних варіантів ІСВШ та передумов їх виникнення свідчать про необхідність визначення індивідуальних підходів та тактики лікування в кожному випадку окремо.
За таких умов при неускладнених циститах, відсутності значимих факторів ризику та ймовірності формування ускладнень цілком доречно проводити лікування в амбулаторному режимі лікарем загальної практики.
В інших випадках слід проводити спеціалізоване обстеження та, за необхідності, лікування у лікаря-уролога, в окремих випадках — у спеціалізованому стаціонарі.
Епідеміологія
У структурі ІСВШ гострий цистит (запалення слизової оболонки сечового міхура) зустрічається найчастіше. Поширеність гострого циститу в Україні становить 314 хворих на 100 тис. населення, хронічного циститу — 135 на 100 тис. населення.
Зазначають, що хворіють жінки репродуктивного віку з відсутністю характерних структурних і функціональних порушень у межах сечовивідних шляхів, захворювання нирок або супутніх захворювань, які б могли спричинити перелік ускладнень та потребували б додаткової уваги [5–8].
Хронічного характеру перебіг набуває після трьох місяців захворювання [9]. Якщо впродовж 6 місяців спостерігають понад два епізоди загострень або три та більше упродовж року, перебіг циститу є рецидивуючим.
Ймовірність виникнення циститів у жінок репродуктивного віку зростає з моменту дебюту статевих стосунків, при проміскуїтеті, нехтуванні засобами запобігання інфекціям, що передаються статевим шляхом (ІПСШ), а також за умови використання певних сперміцидів та діафрагм [10, 11].
Етіологія та патогенез
Виникнення циститу обумовлене наявністю патогенних мікроорганізмів та дистрофічних конгестивних процесів у стінці сечового міхура.
Найбільш частими збудниками є кишкові аероби, передусім кишкова паличка (Escherichia coli), що спричиняє в 75–90 % випадків захворювання, рідше збудником виявляється грампозитивна флора, а саме ентерококи, стафілококи (Staphylococcus saprophyticus), що характерні для хронічних латентних процесів [12]. Однак в умовах сьогодення перелік етіологічних чинників запального процесу з боку сечовивідних шляхів продовжує поповнюватись і визначається віковими особливостями, шляхом поширення, а також неповторністю сценарію (феномен vis-à-vis), що формується в кожному випадку індивідуально між макро- та мікроорганізмом. У 0,4–30 % випадків у сечі хворих не виявляється ніякої патогенної мікрофлори (Durier, 1995). Роль урогенітальних інфекцій в етіології уретритів, циститів у жінок безсумнівна. Етіологічним чинником можуть також бути віруси (аденовіруси, ентеровіруси, віруси герпетичної групи (1–5) і парагрипу), найпростіші (Trichomonas vaginalis), гельмінти, гриби, внутрішньоклітинні збудники (Chlamydia trachomatis, Ureaplasma urealiticum, Mycoplasma genitalium, Mycoplasma hominis) та зоонозні інфекції.
У жінок репродуктивного віку переважає висхідний шлях інфікування, нерідко в асоціації зі збудниками інфекцій, що передаються статевим шляхом, умовно-патогенною мікрофлорою [10]. Захворювання органів статевої системи нерідко призводить до патологічних змін з боку сечовивідних шляхів [13]. Слід зазначити, що статеві органи та органи сечової системи в процесі ембріогенезу розвиваються з єдиного зародкового листка (мезодерми), вони мають тісний анатомо-фізіологічний зв’язок, спільне кровопостачання та лімфатичну систему. Уретра, сечовий міхур та сечоводи, як і органи репродуктивної системи, є органами-мішенями щодо дії статевих гормонів [14].
Останнім часом відмічено зростання частоти випадків поєднаних форм запальних захворювань органів сечової та статевої систем у жінок репродуктивного віку [15, 16]. Хронічні запальні захворювання геніталій у поєднанні з ІСВШ, за даними різних авторів, зустрічаються в 42 % пацієнток [17–20]. У 66,7 % хворих як у виділеннях з піхви, так і в сечі виявляються ідентичні мікроорганізми [18, 21]. При цьому причиною ІСВШ у цілому та циститу зокрема часто є не один, а декілька збудників — число випадків поєднання класичної кишкової палички з протозойними або внутрішньоклітинними інфекціями зростає, особливо в жінок репродуктивного віку. У такій ситуації слід брати до уваги передумови виникнення запальних захворювань сечової системи з урахуванням особливостей гормонального гомеостазу та стану локального, системного імунітету.
Так, за часів Дедерлейна існувала думка, що мікрофлора піхви та слизової сечових шляхів є однорідною та постійною мікроекосистемою. Втілення в практику високоінформативних методик культивації мікроорганізмів показало, що слизові сечових шляхів, піхва, шийка матки заселені популяціями різних мікроорганізмів, що перебувають між собою в постійному антагонізмі та синергізмі.
Колонізаційна резистентність піхви та слизових сечових шляхів забезпечує стабільність нормального мікробіоценозу, запобігає заселенню патогенними мікроорганізмами та швидкому розмноженню умовно-патогенної мікрофлори [21].
Слід враховувати, що мікроекосистема статевих та сечових шляхів значною мірою залежить від морфофункціональних та анатомічних особливостей жіночого організму. При вивченні проблеми запальних захворювань геніталій та сечових шляхів важливо знати їх природну мікрофлору в різні вікові періоди життя жінок.
Система самоочищення піхви функціонує протягом тривалого часу — від дитячого віку до постменопаузи. Епітелій піхви та шийки матки в різні фізіологічні періоди жінки перебуває під впливом дії статевих гормонів і якісно змінюється відповідно до їх концентрації. Естрогени сприяють активному росту та дозріванню багатошарового плоского епітелію, насиченого глікогеном. Під впливом естрогенів слизова пробка цервікального каналу збагачується бактерицидними ензимами та спроможна виконувати функцію бар’єра, своєрідного фільтру, перешкоджаючи потраплянню патогенних збудників (специфічної або неспецифічної інфекції) у верхні відділи урогенітального тракту та генералізації запального процесу. Аналогічно естрогенам проліферативний вплив стосовно епітелію піхви чинять андрогени.
Прогестерон сповільнює дозрівання багатошарового плоского епітелію. За умови підвищення рівнів даного гормона в крові клітини дозрівають лише до проміжного прошарку. Під дією прогестерону відбуваються цитоліз та десквамація багатошарового плоского епітелію зі звільненням у порожнину піхви глікогену.
З глікогену під впливом клітинних ферментів утворюються цукор, мальтоза та декстроза, що є харчовим середовищем для молочнокислих бактерій (лактобацил).
Лактобактерії являють собою поліморфні грампозитивні палички з притаманною їм високою антагоністичною здатністю, що запобігає активному розмноженню умовно-патогенної флори. Продуктом життєдіяльності лактобацил є α-оксипропіонова молочна кислота, що створює кисле середовище вмісту піхви. Безпосередньо кисле середовище піхви, а також продукти, що утворюються в результаті життєдіяльності лактобацил (перекис водню, лізоцим та інші гліколітичні ферменти), перешкоджають розвитку патогенних мікроорганізмів. Лактобактерії стимулюють фагоцитарну активність нейтрофілів та макрофагів, продукцію інтерферонів та секреторних імуноглобулінів, визначаючи активність компонентів локального імунного захисту [22]. У жінок репродуктивного віку грампозитивні лактобацили є домінуючими бактеріями середовища піхви та становлять 95–98 % його біотопу. У піхві та слизовій уретри здорових жінок виділено 9 видів лактобактерій аеробного та анаеробного походження, титр яких може досягати 108–109 КУО/мл. Естрогензалежна здатність лактобацил до адгезії на епітеліальних клітинах, продукції перекису водню та антибіотикоподібних продуктів перешкоджає розмноженню ацидофобних бактерій та росту умовно-патогенних мікроорганізмів, кількість яких у здорових жінок на 2–5 рівнів нижче, ніж домінуючої групи лактобацил.
Крім того, встановлено, що в здорових жінок репродуктивного віку лактобацили є домінуючою мікрофлорою не лише в піхві, але й в уретрі, що запобігає колонізації нижніх відділів сечостатевого тракту уропатогенами та їх висхідній транслокації [23].
Серед умовно-патогенних мікроорганізмів найбільш часто виявляються непатогенні грампозитивні коринебактерії та коагулазонегативні стафілококи. Здатність до локальної продукції каталази допомагає виживанню коринебактерій у перекисному середовищі, створеному лактобацилами. У популяції облігатно-анаеробних бактерій звертають увагу на групу бактероїдів та пептострептококів, що зустрічаються в низьких титрах у 55 % здорових жінок репродуктивного віку [19]. Важливим симбіонтом лактобацил є ще один представник групи Döderlein, що належить до роду Bifidobacterium. Ці грампозитивні аспорогенні анаероби активно зброджують глікоген з утворенням пропіонової й оцтової кислот, ефективно пригнічують ріст потенційних патогенів (гарднерел, стафілококів, ешерихій, клебсієл, грибів та інших умовно-патогенних мікроорганізмів) [24, 25]. Крім того, пропіоновокислим бактеріям притаманні антиоксидантні, антимутагенні, антивірусні, антиканцерогенні, імуностимулюючі й вітаміносинтезуючі властивості.
Інфекційні захворювання піхви, на частку яких припадає понад половину всієї гінекологічної патології, тісно пов’язані з дисбіотичними порушеннями в даному біотопі, що перш за все проявляється значним зниженням концентрації клітин бактерій групи Döderlein і різким збільшенням на цьому тлі концентрації умовно-патогенних мікроорганізмів. Порушення такого характеру можуть призводити до висхідної транслокації інфекційних мікробів в органи верхнього відділу статевої системи й генералізації запального процесу.
Як уже зазначалось, мікробіоценоз статевих та сечових шляхів має певну циклічність, визначену функціональною активністю яєчників. Ризики загострення запальних захворювань сечостатевої системи зростають з 25-го по 6-й день менструального циклу. Даний період перед менструацією та впродовж менструації слід розглядати як критичний та сприятливий для поширення інфекції у верхні відділи геніталій, уретру, сечовий міхур, нирки. Менструальні виділення, що накопичуються в піхві, сприяють створенню пасивного середовища для активації умовно-патогенної флори та реалізації агресивних властивостей збудників. Дефекти ендометрія та рефлюкс менструальної крові сприяють поширенню аеробних та анаеробних бактерій у верхні відділи сечової системи та генітального тракту [26]. До того ж, на думку А. Grazziotti, «менструація — це генітальний прояв системної ендокринної та локальної запальної події в супроводі складної взаємодії статевих стероїдів, цитокінів, задіяних у чітко скоординованих процесах деградації, регенерації та репарації функціонального прошарку ендометрія» [27]. Поява менструації спричинена різким зниженням рівнів гормонів — естрогенів, прогестерону за умови регресії жовтого тіла. Доведено, що зменшення рівнів прогестерону — тригер, що задіяний у механізмах запуску деградації/відторгнення і паралельно процесів подальшої репарації функціонального прошарку ендометрія. Саме ці процеси в ендометрії визначають як гіпоксію та запалення [28, 29].
Анатомо-топографічні особливості статевої та сечової системи у жінок створюють сприятливі умови для колонізації вегетуючою мікрофлорою прошарку уретри та періуретральної зони.
За даними багатьох авторів, існує патофізіологічний взаємозв’язок між частотою виникнення хронічних рецидивуючих пієлонефритів, циститів, вульвовагінітів та дисбактеріозом кишечника. Дисбактеріоз кишечника свідчить про наявність значної кількості мікробів у тонкій кишці та зміну мікробного складу товстої кишки [30].
Хронічні запальні захворювання геніталій у поєднанні з нефроурологічною патологією, за даними М.С. Шушунової, зустрічаються в 42 % пацієнток із запальними процесами органів сечової системи. У 66,7 % хворих як у виділеннях із піхви, так і в сечі виявляються ідентичні мікроорганізми [31]. Одночасно в товстій кишці змінюється загальна кількість та якість мікроорганізмів, посилюється їх інвазивність та агресивність. Дисбактеріоз кишечника часто розвивається в результаті антибактеріальної терапії, що активно призначається при хронічному пієлонефриті, циститі, запальних захворюваннях геніталій.
Після проведення протизапальної терапії локальна імунна відповідь слизових оболонок організму пригнічена, посилюються ознаки запального процесу слизової оболонки кишечника, спричиненого розмноженням сапрофітної флори, що сприяє виникненню запальних змін з боку слизової оболонки піхви, уретри, сечового міхура, тобто формується порочне коло [31].
У жінок із запальними захворюваннями органів сечової системи та геніталій, що перебігають на фоні дисбактеріозу кишечника, при бактеріологічному обстеженні найчастіше виявляється масивний ріст гемолізуючих штамів кишкової палички, ентерококів та стафілококів; рідше висіваються протей та ентеробактерії.
Численні дослідження переконують, що піхва жінок з рецидивуючими інфекціями сечових шляхів більш часто колонізована уропатогенами, ніж у тих, які не страждають від рецидивуючих інфекцій сечових шляхів.
Кандидурія досить часто зустрічається в пацієнток із запальними процесами органів сечової системи в репродуктивному віці. Виявлення Candida spp. у сечі може свідчити про різні патологічні стани: колонізацію нижніх відділів сечових шляхів, кандидозний цистит, вульвовагініт, кольпіт та гострий дисемінований кандидоз з ураженням нирок. Тому диференціальна діагностика цих патологічних станів потребує ретельного проведення спеціальних сучасних діагностичних та лікувальних заходів.
Гриби роду Candida становлять 80–94 % усіх грибів, які виявляються при мікологічному дослідженні сечі та виділень з піхви, цервікального каналу. Слід відмітити, що одночасне виявлення різних мікроорганізмів, причому представників різних таксономічних груп, можливе одночасно як у сечі, так і у виділеннях із піхви, цервікального каналу шийки матки. Найбільш часто кандидурія виникає після катетеризації сечового міхура, що спричинено ретроградною міграцією по сечовому катетеру Candida spp. з промежини. Крім того, кандидурія та кандидоз сечових шляхів і геніталій нерідко розвиваються у хворих з анатомічними та функціональними аномаліями сечових шляхів, геніталій.
Епізод інфекцій сечових шляхів в юному віці та перенесені в минулому хронічні захворювання органів сечової системи сприяють підвищенню ризику рецидивів інфекцій сечових шляхів у декілька разів у більш зрілому віці та розцінюються як вагомий фактор ризику хронізації захворювання.
Певні анатомічні особливості таза також можуть сприяти рецидивному перебігу запальних захворювань органів сечової системи. Так, при обстеженні 100 жінок із хронічними рецидивуючими запальними процесами органів сечової системи встановлено, що відстань від уретри до ануса була значно коротшою, ніж у 100 жінок порівняльної контрольної групи (4,8 проти 5 см відповідно, р < 0,03). Отримані дані свідчать про те, що особливості будови миски можуть також сприяти вторинному поширенню інфекцій на органи сечової системи у жінок.
Останнім часом зазначене зростання запальних захворювань геніталій, спричинених інфекціями, що передаються статевим шляхом, саме серед жінок раннього репродуктивного віку (від 15 до 35 років) не могло не вплинути на особливості мікробіоценозу сечової системи, розвиток, перебіг та наслідки запальних процесів при цьому. Лібералізація статевих стосунків, особливо серед жінок юного віку, є однією з провідних причин зростання частоти запальних захворювань органів як сечової, так і статевої системи, особливо серед молоді. За таких умов в епіцентрі уваги перебуває вікова категорія жінок віком до 18 років (дівчата-підлітки), саме серед них запальні захворювання органів сечової та статевої систем, спричинені інфекційними чинниками, що передаються статевим шляхом, зустрічаються в 2–3 рази частіше, ніж серед жінок зрілого фертильного віку.
За таких умов етіологічний спектр даних захворювань поєднує як патогенні, так і умовно-патогенні мікроорганізми. Несвоєчасна діагностика та лікування цих захворювань можуть спричинити хронізацію запального процесу з боку органів сечової та статевої систем, сприяти формуванню хронічного тазового болю, безплідності, позаматкової вагітності, сексуальної дисфункції, психоемоційних ускладнень та інших локальних і системних змін.
При обстеженні пацієнток з рецидивуючими запальними захворюваннями сечової системи у анамнезі як провідний фактор ризику щодо поширення інфекцій сечової системи та геніталій відзначено зростаючу частоту статевих стосунків з численними статевими партнерами. Використання сперміцидів (особливо з умістом ноноксилону-9) впродовж тривалого часу (понад рік) також пов’язане з високою ймовірністю виникнення запальних захворювань як геніталій, так і органів сечової системи.
В етіологічному спектрі чинників запальних захворювань урогенітального тракту з притаманною клінічною симптоматикою виділяють трихомонадну, гонококову, хламідійну, мікоплазмену, уреаплазмену, а також вірусні інфекції.
Якщо роль трихомонад у виникненні запальних захворювань геніталій добре досліджено, то причетність даного агента до розвитку запальних змін з боку органів сечової системи продовжує активно вивчатися.
У 2002 році на сторінках American Journal Nephrology були висвітлені сучасні погляди на роль трихомонад у розвитку «нетипових» запальних процесів з боку органів сечової системи. Слід зазначити, що перші повідомлення з приводу причетності трихомонад до виникнення запальних процесів з боку органів сечової системи було зроблено ще в 1934 році P. Procaccini при обстеженні пацієнтів, у яких було виявлено тривалу макро- та мікрогематурію, альбумінурію, спричинену амебоподібними мікроорганізмами. Такий патологічний стан, визначений спочатку як нефроамебіаз, з часом було інтерпретовано як пієлонефрит, спричинений трихомонадами.
Значна питома вага в групі етіологічних чинників запальних захворювань як органів сечової системи, так і геніталій належить Chlamydia trachomatis. Хламідії відрізняються високим тропізмом до клітин циліндричного епітелію, а саме цервікального каналу, уретри, прямої кишки. Вони не розмножуються в клітинах плоского епітелію піхви.
Зміни рН піхви, що спостерігаються при гормональному дисбалансі, сприяють колонізації хламідій у слизовому прошарку циліндричного епітелію. Саме тому первинним вогнищем ураження в жінок можуть бути цервікальний канал та уретра, де збудник перебуває протягом декількох місяців або років, спричиняючи перелічені патологічні процеси. Вірогідність одночасного ушкодження цервікального каналу шийки матки та уретри за таких умов становить від 49 до 63 %. Однак ураження уретри даним чинником у багатьох випадках не враховується своєчасно.
Проблеми своєчасної детекції збудника урогенітального хламідіозу пов’язані з наявністю поєднаних хламідійно-уреаплазмових, хламідійно-гонококових, хламідійно-трихомонадних та інших інфекцій, що передаються статевим шляхом, а також можливістю існування латентних або персистуючих форм. Ці форми можуть не відрізнятись за клінічними ознаками захворювання, однак є результатом порушення життєвого циклу хламідій у різних фазах.
Латентні форми хламідій спостерігаються при пригніченні їх життєвого циклу на стадії вступу в новий цикл розвитку. Пригнічення переходу внутрішньоклітинних ретикулярних тілець призводить до появи персистуючих атипових включень з ретикулярними тільцями, що діляться.
Існування персистуючих форм ускладнює діагностику урогенітального хламідіозу та потребує комплексного підходу при лабораторному обстеженні пацієнтів з урахуванням давності захворювання та наявності відповідної симптоматики, нерідко навіть мікросимптоматики, усіх джерел інфікування.
У переліку інших чинників запальних захворювань як геніталій, так і органів сечової системи на особливу увагу заслуговують молікути (мікоплазми та уреаплазми). В експерименті А.В. Руденко було доведено причетність M.hominis до розвитку запальних захворювань органів сечової системи, а також причетність M.hominis до процесів уролітіазу.
Уреазопродукуючі інфекції розкладають сечовину до аміаку, бікарбонату й карбонату, підвищуючи рН у лужний бік. Підвищення концентрації аміаку в крові сприяє ушкодженню уроепітеліального глюкозамінгліканового прошарку, створюючи сприятливі умови для внутрішньоклітинного паразитування інфекційних чинників.
Слід зазначити, що в умовах сьогодення переоцінюється роль мікоплазм та уреаплазм у формуванні запальних змін з боку урогеніталій. Існує думка про те, що дані бактерії не є безумовно патогенними й можуть проявляти свою активність при певному чисельному навантаженні та за умови їх асоціації з іншими бактеріями. За таких умов необхідно проводити аналіз якісного та кількісного складу мікрофлори у зіставленні з клінічними характеристиками запальних захворювань як геніталій, так і сечових шляхів.
Зростаюча занепокоєність поширенням інфекцій, що передаються статевим шляхом з ураженням геніталій та органів сечової системи, останнім часом спричинена зростанням інфікування вірусом простого герпесу типу 2.
Цитомегаловірусна інфекція залишається однією з найбільш актуальних проблем нефрології, гінекології та інфектології. Захворювання, спричинені цитомегаловірусом, належать до поширених антропонозних вірусних інфекцій та характеризуються розмаїттям клінічних ознак (від латентного перебігу до генералізованих форм з ураженням нервової системи та внутрішніх органів). Після первинного інфікування цитомегаловірус тривалий час може існувати в організмі, перебуваючи у латентному стані. За будь-яких умов може відбуватися реактивація вірусу. Доведено, що провідну роль у латентному перебігу запальних захворювань органів сечової системи, спричинених герпес-вірусами, у тому числі й цитомегаловірусами, відіграють клітини, що беруть участь у гемопоезі. При латентному перебігу запального процесу з боку урогеніталій цитомегаловірус може локалізуватись у будь-якому з органів.
Отже, дані, наведені вище, свідчать про зміни, що відбулись в етіологічній структурі запальних захворювань органів сечової системи останнім часом; про складність клініко-лабораторної діагностики бактеріальних та вірусних інфекцій урогеніталій, що обумовлено одночасним ушкодженням сечових та статевих шляхів двома-трьома та більше патогенними збудниками.
Без сумніву, зниженню рівня захворюваності органів сечової системи, зменшенню рецидивів перебігу ІСВШ та запобіганню виникненню запальних захворювань органів малого таза з переліком віддалених наслідків інфекційного ураження геніталій (неплідність та невиношування вагітності) сприятимуть їх раннє виявлення та своєчасне раціональне лікування.
Клініка та діагностика
За відсутності факторів ризику головними скаргами для гострого неускладненого циститу є часте та болісне сечовипускання (як правило, наприкінці сечовипускання), часто з імперативними позивами та нетриманням сечі, біль у ділянці сечового міхура за відсутності виділень з піхви або подразнення слизової [7, 22]. Цистит у жінок при відсутності адекватного лікування набуває тенденції до частих рецидивів, ускладнюється розвитком висхідного пієлонефриту, що супроводжується температурною реакцією та симптомами інтоксикації.
Слід розмежовувати цистит та безсимптомну бактеріурію; саме остання вважається не інфекцією, а скоріше синантропною колонізацією і, як правило, не потребує призначення атибіотикотерапії [32].
У жінок репродуктивного віку особливості клінічного перебігу запальних захворювань органів сечової системи обумовлені етіологічним чинником, а також наявністю або відсутністю патологічних змін з боку геніталій. Саме тому розвиток запальних захворювань сечової та статевої систем слід розглядати в єдиному контексті.
Клінічний аналіз перебігу захворювань показує, що запальні процеси геніталій сприяють у 79,6 % випадків виникненню або загостренню патологічних змін з боку органів сечової системи. Пацієнти при цьому спочатку звертаються до урологів, нефрологів із приводу циститу, пієлонефриту. Лише додаткове спеціалізоване гінекологічне обстеження дозволяє виявити одночасно запальні зміни з боку геніталій, які часто слід розглядати як первинне вогнище захворювання.
З урахуванням частого поєднання запальних уражень геніталій та органів сечової системи найбільша частота циститів припадає на жінок раннього репродуктивного віку (15–35 років). За таких умов запалення сечового міхура, на відміну від паренхімних органів, не супроводжується фебрильною температурою.
Головною диференціально-діагностичною ознакою, що відрізняє інфекції верхніх сечових шляхів від інфекцій нижніх, є прояви системної реакції на запалення (фебрильна температура тіла, інтоксикація, нейтрофільний лейкоцитоз, позитивний С-реактивний білок).
Пієлонефрит належить до інфекцій верхніх сечових шляхів і має екстраренальні (фебрильна температура тіла, інтоксикація, біль у ділянці живота або попереку, нейтрофільний лейкоцитоз, збільшення ШОЕ) та ренальні ознаки (бактеріурія понад 104 КУО, нейтрофільна лейкоцитурія, мікропротеїнурія, рН > 6,5, позитивний тест на нітрати, позитивний тест на естеразу лейкоцитів, наявність бактерій, вкритих антитілами).
Лабораторне дослідження хворих на цистит згідно з чинними протоколами та надання медичної допомоги включає:
- загальний аналіз крові: зсув лейкоцитарної формули вліво свідчить про запальний процес;
- загальний аналіз сечі (ЗАС): сечу для аналізу збирають після звичайного гігієнічного туалету, без спеціальної обробки зовнішнього отвору уретри, із середньої порції сечі, без зупинок сечовипускання. При циститі в ЗАС відмічається значна кількість лейкоцитів та бактерій. Лейкоцитурія без бактеріурії свідчить про уретрит. Наявність еритроцитурії також є свідченням циститу;
- бактеріологічне дослідження сечі. Питання посіву сечі розглядається з огляду на співвідношення ціна/якість. Встановлено, що бактеріологічний посів сечі при циститах у два рази збільшує вартість лікування, не покращуючи його результати. До того ж з урахуванням часу, необхідного для росту колоній, що становить зазвичай 5–7 днів, у деяких випадках проведення бактеріального посіву сечі недоцільне, показана емпірична терапія. Згідно з рекомендаціям Європейської асоціації урологів, ЗАС є цілком придатною альтернативою бактеріологічному дослідженню [33, 34].
Обов’язкове проведення бактеріологічного посіву сечі рекомендують за таких умов:
- при підозрі на розвиток гострого пієлонефриту;
- за наявності симптомів, що не зникають або повторюються впродовж 2–4 тижнів після завершення лікування (можлива резистентність збудника);
- за наявності атипових симптомів;
- при вагітності жінки;
- при високій ймовірності ІПСШ.
Діагностична концентрація колоній бактерій, що дозволяє встановити діагноз циститу, становить ≥ 104 КУО/мл [35].
Критерії встановлення діагнозу ІСШ відповідно до протоколів IDSA/ESCMID подано в табл. 2.
Настанови визначають такі діагностичні рівні бактеріурії для ІСШ:
- 103 КУО/мл уропатогенів у середній порції сечі — для гострого неускладненого циститу у жінок;
- 104 КУО/мл уропатогенів в середній порції сечі — для гострого неускладненого пієлонефриту у жінок та ускладненої ІСШ у чоловіків; і 1–5 • 104 КУО/мл у дітей;
- 105 КУО/мл уропатогенів у середній порції сечі або і 104 КУО/мл сечі, отриманої катетером, — для ускладнення. Упровадження в щоденну клінічну практику сучасних діагностичних методів із залученням новітніх технологій дозволяє покращити якість діагностики та прогнозування відновлення паренхіми нирок на фоні терапевтичних заходів, що проводяться при лікуванні хронічних запальних захворювань нирок.
Консультація гінеколога набуває особливого значення не лише для виключення вагінального дисбіозу, вагініту, запальних захворювань з боку органів малого таза, у тому числі спричинених ІПСШ, а для подальшого лікування таких пацієнток із дотриманням принципів міждисциплінарного підходу, сприйняття проблеми запальних захворювань як геніталій, так і сечовивідних шляхів у єдиному контексті.
У цілому на підставі аналізу клініко-параклінічних орієнтирів встановлення діагнозу й призначення емпіричної терапії повинно проводитись з урахуванням індивідуальних особливостей. За таких умов жінки з нетиповими симптомами або гострим неускладненим пієлонефритом за наявності факторів ризику, а також ті, хто не реагує на призначену антимікробну терапію, повинні обстежуватись більш поглиблено та ретельно в динаміці спостереження із залученням суміжних спеціалістів [36].
До додаткових методів обстеження відносять:
- ультразвукове дослідження нирок, сечоводів, сечового міхура (проводиться з метою виключення обструкції сечовивідних шляхів);
- екскреторну урографію — виконується тільки у випадках затяжного хронічного циститу;
- цистоскопію — проводиться за показаннями, у випадках макрогематурії або рецидивуючого циститу. При гострому неускладеному циститі цистоскопія не показана.
Загальні підходи до лікування циститу
Гострі або хронічні неускладнені цистити не потребують стаціонарного лікування. Лікування призначається лікарем загальної практики, лікарем-гінекологом або урологом.
Золотим стандартом лікування ІСВШ загалом та циститів зокрема є антибактеріальна терапія [28]. Основною вимогою до ефективної антибіотикотерапї є швидка елімінація збудника, що запобігає прогресуванню бактеріальної інвазії та розвитку ускладнень.
Призначення антибактеріального лікування при безсимптомній бактеріурії практично не впливає на санацію сечових шляхів. Але проведення превентивної терапії дає змогу запобігти маніфестації захворювання у вагітних, у хворих з ускладненим преморбідним фоном (цукровий діабет, наявність нейрогенних розладів сечовипускання та рефлюксу, наявність однієї нирки, пре- та посттрансплантаційні стани, наявність струвітних каменів, часте використання уретрального катетера).
Слід зазначити, що групу підвищеного ризику становлять жінки, які мають численні або випадкові статеві стосунки з різними партнерами, особливо не захищені від інфекцій, що передаються статевим шляхом, за умови високої ймовірності інфікування органів статевої та сечової систем збудниками контактних інфекцій. Слід також враховувати, що призначення антибактеріальної терапії з приводу запального захворювання геніталій може сприяти зниженню безсимптомної бактеріурії.
Запальні захворювання органів сечової та репродуктивної систем незалежно від етіологічної природи запального процесу супроводжуються значними ознаками дисбактеріозу, який посилюється на тлі використання антибактеріальної терапії, а в кожної другої хворої (51,3 %) спостерігається алергізація організму, що, у свою чергу, обмежує можливості антибактеріальної терапії.
Цілеспрямована терапія дозволяє вибрати засіб з необхідним спектром антибактеріальної дії і, відповідно, з меншим ризиком ускладнень щодо вибраної тактики ведення хворої (суперінфекція, множинна резистентність тощо). Однак у клінічних умовах лікування нерідко слід розпочинати негайно, не очікуючи результатів бактеріологічних досліджень. Крім того, своєчасне визначення чутливості мікроорганізмів до антибактеріальних препаратів проблематичне через відсутність стандартизованих методів тестування, критеріїв інтерпретації, результатів для сучасних антибіотиків (цефалоспорини, фторхінолони, карбапенеми).
Емпірична антибактеріальна терапія заснована на виборі засобу, що максимально перекриває можливий спектр мікроорганізмів, які найбільш часто є збудниками захворювання. За наявності численного переліку препаратів вибір оптимального лікарського засобу залежить від самого лікаря й ґрунтується:
- на спектрі та сприйнятливості моделі етіологічних уропатогенів;
- ефективності для конкретного показання в клінічних дослідженнях;
- переносимості й можливих побічних реакціях;
- негативних екологічних наслідках;
- вартості;
- наявності.
Згідно з рекомендаціями Європейської асоціації урологів і відповідно до цих принципів у Європі як препарати першої ланки виділяють фосфоміцину трометамол (3 г у разовій дозі), півмецилінам (400 мг три рази на добу впродовж 3 днів) і нітрофурантоїн (100 мг два рази на добу протягом 5 днів) [37–39].
Альтернативною, але не менш ефективною лінією терапії є антибіотики фторхінолонової групи (офлоксацин, ципрофлоксацин, левофлоксацин). Тривалість терапії неускладненого циститу, за даними різних авторів, становить від 5 до 14 днів, що визначається особливостями клінічного розвитку захворювання, передумовами його виникнення та фоном, на якому формується запальний процес [40].
Терапію хронічних циститів проводять з урахуванням трьох факторів: наявності в анамнезі ознак, що вказують на порушення протективної системи сечових шляхів; наявності елементів обструкції та вогнищевого бактеріовиділення; виявлення окремих традиційних збудників — мікроорганізмів анаеробів, C.trachomatis, M.hominis, M.genitalieum, U.urealyticum, найпростіших.
Виділення збудника в монокультурі за наявності преморбідного фону або в разі рецидиву циститу вимагає призначення 7-добового курсу антибіотика або уроантисептика.
За наявності мікробної асоціації доцільне послідовне або одночасне призначення двох препаратів різних груп.
У разі виявлення найпростіших, мікроаерофілів, анаеробів або збудників із невизначеним положенням у таксономічному ряді раціональне лікування слід проводити з певною етапністю: спочатку проводити лікування найпростіших (Trichomonas vaginalis), які можуть бути факультативними господарями для інших збудників; лікування анаеробної інфекції, а також усунення хламідій, молікутів. При асоційованому ураженні й розвитку циститу термін лікування збільшується за рахунок призначення імідазолових та хінолінових похідних.
З огляду на те, що гострі та хронічні неускладнені цистити превалюють у жінок репродуктивного віку за наявності в них поєднання класичної кишкової мікрофлори з протозойними або змішаними інфекціями (Trichomonas vaginalis, Entamoeba histolytica та ін.), лікування в режимі монотерапії є недостатнім і неефективним.
За таких умов при проведенні антибіотикотерапії препаратом вибору є Тифлокс — комбінований препарат: поєднання антибіотика фторхінолонової групи — офлоксацину (200 мг) та нітроімідазолової групи — орнідазолу (500 мг), що діє одночасно на грампозитивну та грамнегативну мікрофлору, анаеробів та протозойну інфекцію. Згідно з результатами клінічних досліджень, препарат Тифлокс не поступається за клінічною ефективністю та безпечністю оригінальному офлоксацину та орнідазолу [31, 42]. Схема прийому — 1 таблетка 2 рази на добу. Тривалість лікування — 7–10 днів та не менше від 3 днів вже після зникнення симптомів захворювання. Препарат дозволяє досягти швидкого терапевтичного ефекту в короткі строки, не має виражених побічних дій та може бути використаний у рутинній практиці не тільки спеціалістами вузького профілю, а й лікарем загальної практики.
Враховуючи існуючий патофізіологічний взаємозв’язок між частотою виникнення хронічних рецидивуючих циститів, пієлонефритів у поєднанні з вульвовагінітами та дисбактеріозом кишечника на тлі атибактеріальної терапії, одночасно призначають пробіотики.
Ми вважаємо за доцільне в комплексі протизапальної терапії використовувати пробіотичний лікарський препарат Лактовіт Форте, що містить спори імуномодулюючих бактерій L.sporogenes, фолієву кислоту й ціанокобаламін (вітаміни В9 і В12). Ця комбінація відновлює слизову кишечника і його власну корисну мікрофлору, проявляючи імуномодулюючу дію шляхом стимуляції певних ланок клітинного й гуморального імунітету.
Лактовіт Форте при кишковому й вагінальному дисбіозі внаслідок прийому антибіотиків та з інших причин, при лікуванні неспецифічних запальних захворюваннях геніталій призначається по 1 таблетці 2 рази на добу впродовж прийому антибактеріальної терапії та 10–14 днів після її закінчення. Така система призначення даного пробіотичного препарату сприяє нормалізації біоценозу кишечника та слизових оболонок, знижує ризик виникнення рецидивів циститів, а також запальних захворювань геніталій, висока ймовірність яких повинна завжди враховуватись при лікуванні інфекцій сечової системи.
За таких умов слід своєчасно діагностувати супутні гінекологічні захворювання (бактеріальний вагініт, специфічні й неспецифічні вагініти, запальні захворювання органів малого таза тощо), проводити лікування та оцінювати його ефективність. Відповідно до сучасних рекомендацій (інформаційний лист МОЗ України № 66, 2016 р.) до отримання результатів аналізів та за наявності клінічних проявів бактеріального вагінозу або вагініту рекомендується призначення препарату Мератин Комбі — вагінальних таблеток з широким спектром антибактеріальної дії щодо бактерій, умовно-патогенної флори, найпростіших і грибів. Це сприяє підвищенню ефективності лікування інфекцій сечових шляхів і профілактиці повторних випадків їх виникнення.
Критерієм одужання при циститі слід вважати відсутність скарг, нормалізацію аналізів сечі й відповідність референтним значенням упродовж року диспансерного спостереження.
Отже, численність шкідливих агентів та факторів, використання несистемного підходу без урахування стану органів малого таза негативно впливають на розвиток запальних захворювань органів сечової системи, вимагають перегляду з обґрунтуванням диференціальних підходів як у діагностиці, так і в лікуванні інфекцій сечовивідних шляхів у жінок репродуктивного віку.
Особливо це важливо за наявності об’єктивних симптомів, які значною мірою пов’язані з інфекційними агентами, що вражають як геніталії, так і органи сечової системи.
Тому при зверненні жінок до спеціалістів, як правило, гінеколога, уролога або нефролога, слід проводити комплексну клініко-мікробіологічну оцінку стану органів сечової системи та геніталій на підставі всіх принципів поєднаного міждисциплінарного підходу щодо вирішення представленої проблеми.
У лікуванні інфекції сечових шляхів у жінок репродуктивного віку необхідно враховувати ймовірність мікст-інфекції та поєднання з гінекологічними захворюваннями (запальні захворювання органів малого таза, вагініти тощо), наявність дисбіозу кишечника та піхви. Комбінований препарат Тифлокс охоплює весь можливий спектр збудників у жінок репродуктивного віку. При вагініті та вагінозі є доцільним одночасне застосування вагінальних таблеток Мератин Комбі впродовж 10 днів.
Призначення пробіотиків з імуномодулюючою дією (Лактовіт Форте) сприяє відновленню власної мікрофлори слизових сечових та статевих шляхів, профілактиці рецидивів ІСВШ.
Отже, першочерговим завданням практикуючого лікаря будь-якої ланки надання медичної допомоги саме жінкам репродуктивного віку є визначення анатомічного рівня враження, тяжкості перебігу запального процесу, наявності факторів ризику, супутніх захворювань та можливих наслідків для пацієнта. Тільки після клінічного аналізу всіх цих факторів у сукупності можливе визначення подальшої тактики лікування жінок репродуктивного віку та призначення їм обґрунтованої й адекватної терапії.
Список литературы
Список літератури знаходиться в редакції

/9_u.jpg)
/11_u.jpg)