Журнал «Медицина неотложных состояний» 3 (74) 2016
Вернуться к номеру
Варіанти періопераційного знеболювання хворих із критичною ішемією нижніх кінцівок, що прооперовані методом ендоваскулярної балонопластики
Авторы: Дзюба Д.О., Недашківський С.М. - ДУ «Національна медична академія післядипломної освіти ім. П.Л. Шупика», м. Київ, Україна; Злочевський О.М. - КЗ КОР «Київська обласна клінічна лікарня», м. Київ, Україна
Рубрики: Медицина неотложных состояний
Разделы: Клинические исследования
Версия для печати
Найбільш сучасним методом лікування критичної ішемії нижніх кінцівок є ендоваскулярна балонопластика. З метою оптимізувати інтраопераційну анестезіологічну тактику для знеболювання було використано епідуральну анальгезію та інфузію розчину лідокаїну. Матеріали та методи. 45 пацієнтів були рандомізовані та розподілені на 3 групи по 15 осіб. Хворим І групи проводили аналгоседацію, ІІ групи — внутрішньовенне введення розчину лідокаїну, ІІІ групи — сакральну анестезію. Результати. Застосування як епідуральної, так і внутрішньовенної анальгезії забезпечувало адекватний рівень як інтра-, так і післяопераційної анальгезії при балонопластиці облітеруючого атеросклерозу нижніх кінцівок.
Самым современным методом лечения критической ишемии нижних конечностей является эндоваскулярная баллонопластика. С целью оптимизировать интраоперационную анестезиологическую тактику для обезболивания использовали эпидуральную анестезию и введение раствора лидокаина. Материалы и методы. 45 пациентов были рандомизированы и распределены на 3 группы по 15 человек. Больным І группы проводили аналгоседацию, ІІ группы — внутривенное введение раствора лидокаина, III группы — сакральную анестезию. Результаты. Использование как эпидуральной, так и внутривенной анальгезии обеспечило адекватный уровень как интра-, так и послеоперационного обезболивания при баллонопластике облитерирующего атеросклероза нижних конечностей.
The most modern methods of treatment of critical limb ischemia is endovascular balloon surgery. In order to optimize the intraoperative tactics of anesthesia we used epidural anesthesia and infusion of lidocaine solution. Materials and methods. Forty five patients were randomized into 3 groups of 15 people. Patients of I group were performed analgosedation, the II group got intravenous infusion of lidocaine, the III one received epidural analgesia. The use of epidural and lidocaine anesthesia provided adequate levels of both intra- and postoperative analgesia during balloon surgery at obliterating atherosclerosis of the lower limbs.
критична ішемія нижніх кінцівок, ендоваскулярна балонопластика, епідуральна анестезія, сакральна анестезія, бупренорфін, лідокаїн.
критическая ишемия нижних конечностей, эндоваскулярная баллонопластика, эпидуральная анальгезия, сакральная анестезия, бупренорфин, лидокаин.
critical ischemia of the lower limbs, endovascular balloon surgery, epidural analgesia, sacral analgesia, buprenorphine, lidocaine.
Статтю опубліковано на с. 72-74
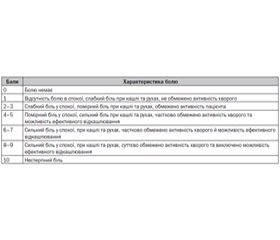
Критична ішемія спокою (КІ) — це термінальна стадія облітеруючого артеріального склерозу (ОАС). Вона виникає внаслідок хронічної нестачі кровотоку в пошкодженій кінцівці, що запускає каскад патофізіологічних реакцій, які призводять до потужного больового синдрому та трофічних змін.
Матеріали та методи
Результати
Висновки
1. Norgren L. et al. Inter-society consensus for the management of peripheral arterial disease (TASC II) // European Journal of Vascular and Endovascular Surgery. — 2007. — Т. 33, № 1. — S1-S75.
2. Савельев В.С. Критическая ишемия нижних конечностей / В.С. Савельев, В.М. Кошкин. — М., 1997. — 123 с.
3. Кузнецов М.Р. и др. Основные принципы диагностики и амбулаторного лечения облитерирующего атеросклероза артерий нижних конечностей // Русский медицинский журнал. — 2012. — Т. 20, № 36. — С. 1733-1737.
4. Лазарева М.А. Мацких А.Ю., Лазарева М.А. Заболевания периферических артерий, артериол и капилляров: Учебное пособие для амбулаторно-поликлинических хирургов. — Екатеринбург: УГМУ, 2014. — 88 с.
5. Varu V.N., Hogg M.E., Kibbe M.R. Critical limb ischemia // Journal of vascular surgery. — 2010. — Т. 51, № 1. — С. 230-240.
6. Coats P., Wadsworth R. Marriage of resistance and conduit arteries breeds critical limb ischemia // American Journal of Physiology-Heart and Circulatory Physiology. — 2005. — Т. 288, № 3. — С. H1044-H1050.
7. Vahidi E. et al. Comparison of intravenous lidocaine versus morphine in alleviating pain in patients with critical limb ischaemia // Emergency medicine journal: EMJ. — 2014.
8. Block B.M., Liu S., Rowlingson A.J., Cowan A.R., Cowan J.A. Efficacy of postoperative epidural analgesia: a meta-analysis // JAMA. — 2003. — Vol. 290. — Р. 55-63.
9. Ростомашвили Е.Т. Использование каудальной анестезии в практике амбулаторной хирургии // Амбулаторная хирургия. — 2005. — № 1(17). — С. 60-65.
10. Szijártó A. et al. Rapidly progressing fatal reperfusion syndrome caused by acute critical ischemia of the lower limb // Cardiovascular. Pathology. — 2013. — Т. 22, № 6. — С. 493-500.
11. Волочков В.А., Игнатов Ю.Д., Страшнов В.И. Болевые синдромы в анестезиологии и реаниматологии. — М.: МЕДпресс-информ, 2006. — 320 с.
12. Kainzwaldner V., Rachinger-Adam B., Mioc-Curic T., Wöhrle T., Hinske L.C., Luchting B., Ewert T., Azad S.C. Quality of postoperative pain therapy: evaluation of an established anesthesiology acute pain service // Anaesthesist. — 2013. — Vol. 62(6). — P. 453-459.

/73.jpg)