Газета «Новости медицины и фармации» 4 (567) 2016
Вернуться к номеру
Сучасний погляд на імуномодулюючу дію пробіотиків
Авторы: Уманець Т.Р. - ДУ «Інститут педіатрії, акушерства і гінекології НАМН України», м. Київ, Україна
Рубрики: Иммунология
Разделы: Справочник специалиста
Версия для печати
Статья опубликована на с. 16-18 (Укр.)
Згідно з визначенням Всесвітньої організації охорони здоров’я, пробіотиками вважаються «живі мікроорганізми, які корисно впливають на здоров’я, покращуючи кишково-мікробний баланс господаря» (FAO/WHO, 2002) [30]. Більшість пробіотиків належать до роду Lactobacillus та Bifidobacterium.
Кисломолочні бактерії — це звичайні мешканці мікрофлори людської кишки, та більшість із них вважається безпечними при введенні як пробіотиків. Вони переважно не патогенні, грампозитивні, каталазанегативні та в своїй більшості не здатні утворювати спори, характеризуються своїм основним метаболітом і включають бактерії, що належать до кількох родів (Lactococcus, Streptococcus, Enterococcus, Leuconostoc та Lactobacillus) [1, 2, 11].
До пробіотиків належить рід Bifidobacterium, а також інші мікроорганізми (деякі Escherichia coli та Saccharomyces cerevisiae) [25].
У наш час досягнуто певного консенсусу щодо позитивного впливу пробіотиків при запальних захворюваннях кишечника та алергічній патології як у дітей, так і в дорослих [3, 12, 27, 37]. Продемонстровано, що пробіотики модулюють проникність епітеліальних бар’єрів, змінюють запальний потенціал епітеліальних клітин, конкурують з патогенами за колонізацію слизових або безпосередньо змінюють активність імунних клітин [25]. Взаємодія між імунною системою слизових і мікробіотою людини відіграє суттєву роль у підтримці гомеостазу слизових. Тому терапевтичні підходи, що націлені на модуляцію імунної системи слизових кишечника за допомогою пробіотиків, можуть вважатися цікавим інструментом для лікування різної імунопатології людини [2, 11, 17].
Механізми дії пробіотиків інтенсивно вивчаються. Дотепер проведено багато досліджень щодо впливу різних пробіотичних штамів на імунологічний профіль людини. Доведено, що пробіотики можуть впливати на імунні функції різними шляхами, але механізм їх дії є штам-специфічним [11, 17, 25].
Пробіотики та уроджений імунітет
Взаємодія між штамами пробіотиків та ентероцитами відіграє важливу роль у контрольованій секреції цитокінів і хемокінів епітеліальними клітинами. Продемонстровано, що деякі пробіотичні організми можуть модулювати експресію про- та протизапальних молекул залежно від штаму. Наприклад, Lactobacillus sakei індукує експресію ІЛ-1β, ІЛ-8 та TNF-α, тоді як L. johnsonii стимулює вироблення TGF-β у Сaco-2 клітинах [17].
Багато штамів пробіотиків можуть впливати на уроджені захисні механізми, такі як фагоцитоз та активність природних кілерних клітин (табл. 1) [17, 31].
Пробіотики та адаптивний імунітет
Ключовою клітиною, яка бере участь у імунній відповіді під впливом пробіотиків, є дендритна клітина (ДК) [11, 31].
ДК кишечника локалізуються в спеціальній лімфоїдній тканині, яку називають лимфоїдною тканиною, асоційованою з кишечником (GALT — gut-associated lymphoid tissue) [25]. Це тип ембріональних клітин, які залучаються як «датчики» мікробних лігандів шляхом активації уроджених імунних рецепторів (рецептори розпізнавання антигенних структур (PRR) — Toll-like рецепторів (TLR), С-тип рецепторів лектинів та ін.). Щодо пробіотичної сигналізації, то одним із найбільш досліджених рецепторів є TLR2, що разом із TLR1 або TLR6 розпізнає пептидоглікан стінки клітини, ліпотейхоєву кислоту та ліпопептиди [16]. Сигнальні шляхи, що активуються за участю бактеріальних молекул, дозволяють змінити фенотипи ДК і секрецію цитокінів, що є основою інтеграції мікробного метаболізму та метаболізму носія з імунними функціями. Так, наприклад, вплив антигенів нитчастих бактерій індукують CD103+ДК кишечника, які відіграють важливу роль у локальній індукції Th17-лімфоцитів [28, 34]. Капсульний полісахарид А із Bacteroides fragilis продемонстрував взаємодію безпосередньо з плазмоцитоїдними ДК через TLR-2 із секрецією молекул, що мають захисну функцію від розвитку коліту та стимулюють CD4+-клітини для секреції IL-10 [29, 33]. Екзополісахарид із Bacillus subtilis запобігає запаленню кишечника, що стимулюється Citrobacter rodentium і залежить від сигналізації TLR-4 та MyD88 [29].
Оскільки ДК є головною у розвитку толерантності, пробіотики можуть модулювати імунну реакцію шляхом впливу на дозрівання та активацію ДК (табл. 2) [36].
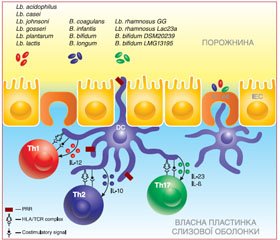
ДК власних пластинок слизової оболонки кишечника захоплюють антигени пробіотичних штамів через PRR-рецептори шляхом надсилання своїх дендритів між кишковими епітеліальними клітинами, відкриваючи щільні сполучення між епітелієм або через трансцитоз М-клітин [17] (рис. 1).
Сигнали, що передаються від PRR-рецепторів ДК до Т-хелперних клітин (із залученням HLA/TCR-комплексу, ко–стимулювальних сигналів, секреції різного профілю цитокінів), визначають у подальшому характер імунної відповіді й індукують ефекторні функції, пов’язані з Th1-, Th2-, Th17-клітинами. Проведені дослідження свідчать, що різні штами пробіотиків можуть впливати на секрецію різних профілів цитокінів із про- та протизапальною дією.
Вважається, що всі кисломолочні бактерії, такі як L. plantarum, L. lactis, L. casei та L. rhamnosus GG, інгібують Тh2 імунну відповідь. Ці бактерії суттєво зменшують продукцію ІL-4 та ІL-5 мононуклеарними клітинами периферійної крові [17].
З другого боку, багато досліджень вказують, що пробіотики сприяють виробленню ІL-10, цитокіну, який продукується багатьма клітинами, у тому числі клітинами Тh2, ДК, моноцитами, В-клітинами, кератиноцитами та регуляторними Т-клітинами. ІL-10 має протизапальну дію та інгібує Тh1 імунні реакції [17].
Хоча ці дослідження демонструють важливу роль пробіотиків у визначенні балансу Тh1/Тh2, виявляється, що деякі пробіотики впливають на обидві субпопуляції (табл. 3).
Пробіотичні бактерії L. rhamnosus Lac23a, GG можуть пригнічувати реакції Th17 через як прямі, так і непрямі механізми. Th17-клітини продукують IL-17, що спричиняє запалення тканини. Пробіотичні штами інгібують активність Th17 та IL-17, індукуючи проліферацію субпопуляції Т-регуляторних клітин та Th1 шляхом індукції вироблення IL-23, IL-27, який пригнічує утворення IL-17 або стимулює TLR9 на Th17-клітинах [16, 25, 36].
Отже, імунологічні ефекти пробіотиків штам-специфічні та пов’язані з модуляцією: уродженої імунної відповіді за рахунок впливу на процеси дозрівання ДК як результат взаємодії певного штаму з ентероцитами кишечника та ДК; Th1/Th2 цитокінового балансу і переважно з посиленням Th1-хелперної імунної відповіді та потенційною можливістю зменшення Th2-хелперної імунної відповіді; проліферації Т-регуляторних клітин та їх функцій.
Серед великої кількості пробіотиків останнім часом увагу науковців привертає одна з найбільш перспективних спороутворюючих лактобактерій Bacillus coagulans (оригінальна назва — Lactobacillus sporogenes), яка має переваги щодо більшості інших бактерій, які застосовуються як пробіотики.
Bacillus coagulans не руйнується під впливом шлункового соку і жовчі. Потрапляючи у дванадцятипалу кишку, спори проростають у вегетуючі бактерії в кишечнику людини і проявляють свої пробіотичні ефекти [9, 14, 15, 19]. Крім того, Bacillus coagulans стійка до дії антибіотиків. Завдяки цьому пробіотик можна застосовувати разом зі стандартною хіміотерапією, без ризику пригнічення його активності [4–6].
Bacillus coagulans належить до полурезидентних бактерій — виконавши в організмі людини функцію пробіотика, повільно залишає організм, не порушуючи індивідуальний склад мікрофлори кишечника.
Даний пробіотик займає проміжне положення між родом Bacillus і Lactobacillus, який продукує молочну кислоту. Молочна кислота має антибактеріальну дію і за рахунок метаболічного ефекту (проходить крізь мембрани бактерій і знижує внутрішньоклітинний рН) впливає на окисне фосфорилювання в клітинах. Бактеріоцини Bacillus coagulans інгібують як грампозитивну, так і грамнегативну флору та деякі гнильні гриби роду Fusarium [8].
У ряді експериментальних і клінічних досліджень було доведено, що Bacillus coagulans має імуномодулюючу дію: підвищує рівень антитіл, стимулює клітинний імунітет та фагоцитоз [6, 18, 26]. При цьому вплив на імунну систему обумовлений дією метаболітів бактерії, клітинної стінки та спор.
Вивчення впливу Bacillus сoagulans на продукцію цитокінів показало пригнічення синтезу IL-2, посилення продукції IL-4, IL-10 і особливо IL-6, незначне збільшення продукції TNF-α, вірогідне збільшення INF-γ (табл. 2) [18]. Вважається, що спори бактерій цього роду можуть бути захоплені М-клітинами слизової кишечника, які здійснюють їх передачу в пейєрові бляшки і далі в лімфатичні вузли. В експерименті пероральне введення спор мишам викликало системну імунну відповідь у вигляді підвищення IgG підкласу IgG2а і місцеву реакцію — секрецію IgA. Аналіз мРНК цитокінів лімфоцитів імунної системи кишечника вказував на ранню індукцію інтерферону-γ та TNF-α [10].
Останніми роками був встановлений імуномодулюючий ефект Bacillus coagulans в умовах антибіотикоасоційованої діареї, пов’язаної з Clostridium difficile [12]. Механізм терапевтичного ефекту Bacillus coagulans при даній патології полягав у пригніченні секреції хемокінів, міграції нейтрофілів і зменшенні експресії ЦОГ-2 у товстому кишечнику [12, 13, 23].
У клінічному дослідженні доведена здатність Bacillus coagulans підвищувати Т-клітинну відповідь при вірусних інфекціях, а саме: вірогідне підвищення CD3-CD69+-клітин, IL-6 и IL-8, γ-интерферону, TNF-α у відповідь на експозицію аденовірусу та вірусу грипу А [7].
Bacillus сoagulans має також антиоксидантну та гіпохолестеринемічну активність, сприяє перетравленню лактози [20, 21, 24].
На основі цієї бактерії на світовому фармацевтичному ринку з’явився ряд препаратів із доведеною клінічною ефективністю [6, 32]. Одним із таких препаратів є Лактовіт Форте, в якому Bacillus сoagulans знаходиться в комбінації з вітамінами В9 (фолієва кислота) та В12 (ціанокобаламін). Доцільність введення вітамінів В9 і В12 до складу препарату Лактовіт Форте полягає, з одного боку, у сприянні росту та розмноженню Bacillus coagulans та з іншого — у посиленні імуномодулюючого ефекту та відновної дії на слизову кишечника.
Вітамін В12 підвищує протиінфекційну резистентність організму за рахунок підвищення бактерицидної та опсонізуючої активності сироватки крові, збільшення продукції антитіл, посилення фагоцитарної активності лейкоцитів, стимулювання утворення інтерферону.
Вітамін В9 також має вплив на імунну систему. При дефіциті цього вітаміну відзначене пригнічення CD8+- і NK-клітин (що асоційоване зі зменшенням резистентності до інфекцій), а також доведено зменшення виживання Т-регуляторних клітин, що призводить до підвищення чутливості кишечника до запальних процесів інфекційного та автоімунного характеру [20, 22, 35]. Вітаміни В9 і В12 необхідні для процесу кровотворення та профілактики розвитку анемії, мають репаративні та імуномодулюючі властивості.
Таким чином, основним фармакологічним ефектом Bacillus coagulans є її імуномодулюючі властивості. Bacillus coagulans стимулює клітинний і гуморальний імунітет. Ефективність пробіотиків, що містять спори Bacillus coagulans, підтверджена даними доказової медицини. Комбінація Bacillus coagulans з вітамінами В9 і В12 у складі Лактовіту Форте розширює клінічні можливості застосування даного препарату, що обґрунтовує його вибір не тільки при порушенні балансу мікрофлори внаслідок антибактеріальної терапії, кишкових інфекцій, але й при супутній соматичній патології — анемії, синдромі мальабсорбції, імунологічних порушеннях у відновлювальний період після перенесених інфекційних захворювань, операцій, опіків і травм, променевої і хіміотерапії, як засобу профілактики інфекційних захворювань. З цією метою препарат Лактовіт Форте призначають залежно від віку: дітям від 6 місяців до 2 років — по 1/2 капсули (разова доза); старше 2 років та у дорослих — по 1 капсулі 2 рази на добу за 40 хвилин або безпосередньо перед прийомом їжі протягом не менше ніж 4–6 тижнів. Для дітей віком до 2 років рекомендовано відкрити капсулу та розчинити її вміст у 10 мл грудного молока або охолодженої до кімнатної температури кип’яченої води.
Список литературы
Список літератури знаходиться в редакції

/16_u.jpg)
/18_u.jpg)
/18.jpg)