Статья опубликована на с. 13-17
Остеоартроз (ОА) — очень распространенное заболевание суставов, которым страдают около 80 % населения в возрасте 50–60 лет, приводящее к ограничению физической активности и, как следствие, к снижению общего качества жизни. По данным Центра контроля заболеваемости в США, ОА представляется более существенным фактором ограничения активности пожилых людей, чем артериальная гипертензия, ишемическая болезнь сердца (ИБС), слепота или сахарный диабет. Это, несомненно, диктует необходимость поиска эффективных препаратов для лечения пациентов с ОА.
22–23 октября 2015 года состоялась научно-практическая конференция Ассоциации ревматологов Украины «Стандартизированные подходы к диагностике и лечению ревматических болезней». В рамках конференции был проведен круглый стол «Новые возможности в лечении остеоартроза».

С докладом
«Современные возможности оценки болезнь-модифицирующего потенциала препаратов для лечения остеоартроза» выступил профессор О.Б. Яременко.
Как известно, на сегодняшний день в различных рекомендациях по терапии ОА пункт о структурно-модифицирующем направлении остается вариабельным, так как среди препаратов, замедляющих процесс дегенерации хряща и имеющих доказанную эффективность, нет однозначно принятых всеми специалистами в этой области. Одна из причин сложившейся ситуации — отсутствие унифицированных методических подходов к оценке препаратов такого действия. А между тем именно замедление процесса прогрессирования остеоартроза является одной из задач лечения этого заболевания. Согласно рекомендациям Ассоциации ревматологов Украины 2004 года критериями качества лечения остеоартроза являются отсутствие или существенное снижение проявлений суставного синдрома, отсутствие рецидивов синовита, улучшение качества жизни пациента; одним из желаемых результатов является также замедление рентгенологического прогрессирования процесса, деструктивных изменений суставного хряща по данным ультразвукового исследования суставов и МРТ.
Рентгенологическое исследование при ОА проводится с использованием ионизирующего излучения и в клинической практике применяется для подтверждения диагноза и установления стадии ОА. В клинических исследованиях проводится полуколичественная оценка по шкале Kellgren — Lawrence или шкале OARSI и количественная оценка сужения суставной щели. Последнее исследование используется наиболее часто и имеет ряд преимуществ. Это воспроизводимый, недорогой, общедоступный, общепризнанный метод, позволяющий визуализировать остеофиты, склероз и наличие кист. Однако этот метод имеет и существенные недостатки. Кроме вредного ионизирующего излучения, он не позволяет визуализировать хрящевую ткань. Проблема также заключается в том, что методика проведения рентгенологического исследования долгие годы не была унифицирована, позиция больного при проведении исследования в динамике не была строго установленной, могла изменяться, что приводило к несопоставимости результатов разных исследований и трудностям оценки динамики сужения суставной щели. Несколько лет назад по рекомендации ЕМА и FDA методика проведения рентгенографии была стандартизирована с целью получения адекватного изображения и измерения ширины суставной щели (ШСЩ). Согласно этой методике рентгенограмма переднезадней проекции коленного сустава производится в зафиксированном положении благодаря фиксирующему устройству. Угол направления луча составляет 10°. Установлено, что ШСЩ необходимо измерять на расстоянии 15 мм от края суставной щели на протяжении 3 см с последующим расчетом средней ШСЩ. Однако, несмотря на унификацию этой методики, важным ее недостатком является невозможность визуализировать мягкие ткани, а состояние и толщина суставного хряща оцениваются опосредованно, по ШСЩ. Этот недостаток не позволяют считать метод рентгенографии эталонным в оценке структурно-модифицирующего действия препаратов. Высокая точность ультразвуковой визуализации изменений бедренного хряща у больных ОА доказана при сравнении данных УЗИ и артроскопии. Результаты изучения корреляции величин толщины суставного хряща, полученных по данным УЗИ и по данным аутопсий, доказали возможность использования данного метода у больных ОА коленного сустава, как с минимальными изменениями, так и при значительном поражении сустава. Однако методика УЗИ при данной патологии также не стандартизирована и потому не рекомендована для проведения рандомизированных исследований эффективности структурно-модифицирующей терапии ОА.
Современным общепризнанным и рекомендованным рабочей группой OARSI FDA исследованием для оценки структурных изменений при ОА считается МРТ. Для оценки морфометрии хряща коленного сустава есть доказательства прогностической валидности этого метода с хорошим уровнем надежности. С помощью МРТ можно точно измерить изменения морфологии хряща в течение 12 месяцев для ОА коленного сустава. МРТ может дополнить результаты исследований в отношении повышения темпов утраты хрящевой ткани, в том числе при ОА более высокого рентген-класса. Также МРТ обладает способностью давать картину других тканей, что с учетом рекомендации рассматривать модификационную терапию в более широком контексте требует дальнейшей работы относительно количественной и предиктивной валидности внехрящевых изменений. В 2015 году было проведено исследование влияния глюкозамина сульфата и хондроитина сульфата на структурные изменения при ОА коленного сустава. По данным количественной МРТ, у больных с этой патологией, принимавших глюкозамина сульфат и хондроитина сульфат, через 24 месяца наблюдалось уменьшение потери объема хряща в отдельных регионах. Это регистрировалось как на фоне приема НПВС (у больных с меньшим сужением ШСЩ), так и без их приема (у больных с большим сужением ШСЩ). Эти данные свидетельствуют о болезнь-модифицирующем эффекте хондропротекторов, который не идентифицируется рентгенографически. Таким образом, количественная МРТ является на сегодняшний день наиболее чувствительным методом оценки эффективности препаратов, ее результаты не всегда коррелируют с рентгенографическими данными. Применение МРТ позволяет на качественно новом уровне доказательности демонстрировать наличие или отсутствие влияния лечения на деградацию хряща. Однако известно о существовании определенной диссоциации между морфологическими изменениями хряща и клиническими проявлениями суставного синдрома. У некоторых больных при наличии структурных изменений хряща отсутствуют клинические проявления, и наоборот, при выраженном клинически суставном синдроме не определяются морфологические изменения хрящевой ткани. В этой связи актуальным остается определение биомаркеров хряща. Основными лимитирующими факторами их использования являются отсутствие линейной зависимости концентрации биомаркеров и изменений структурных параметров, а также взаимосвязь маркеров ОА с не зависящими от ОА возрастными изменениями. Проведено большое количество исследовательских работ, в которых в качестве биомаркеров хрящевой ткани рассматривались различные вещества. По их результатам среди множества биомаркеров наиболее информативным для оценки прогрессирования ОА коленных суставов в клинических условиях признано определение С-телопептида коллагена II типа в моче и олигомерного матриксного протеина хряща в сыворотке крови.
Таким образом, на сегодняшний день необходимо дальнейшее проведение клинических исследований на новом методическом уровне для оценки структурно-модифицирующего действия препаратов для лечения ОА.
В частности, в одном из таких исследований изучался модифицирующий эффект препарата Пиаскледин-300. Он представляет собой комплекс неомыляемых фитостеролов (ASU). Препарат выпускается французской компанией Laboratoires EXPANSCIENCE в капсулах и рекомендован к приему во время еды 1 раз в сутки в течение 3–6 месяцев.
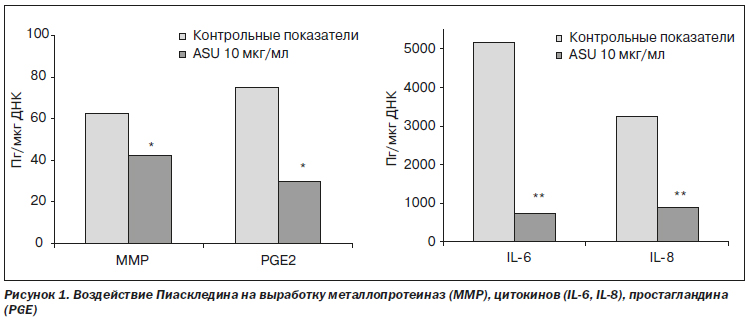
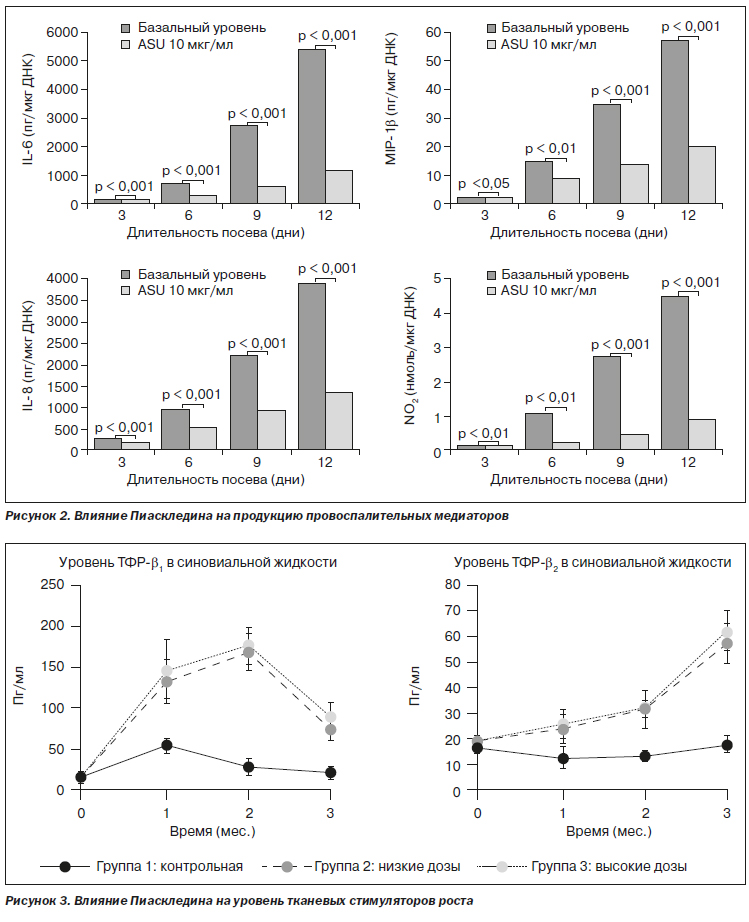
По данным, зафиксированным исследователями, было выявлено влияние ASU на выработку металлопротеиназ (ММР), цитокинов (IL-6, IL-8), простагландина (PGE2) (рис. 1), а также способность Пиаскледина ингибировать продукцию провоспалительных медиаторов (рис. 2). Также было обнаружено, что этот препарат вызывает значительное повышение уровня ТФР-1b в синовиальной жидкости коленных суставов при использовании разных дозировок (рис. 3).

Более детально о клиническом применении Пиаскледина рассказал в своем докладе
«Эффективная и рациональная терапия остеоартроза: что предпочесть?» д.м.н. Д.Г. Рекалов.
На сегодняшний день тактика терапии больных с ОА включает в себя несколько составляющих. Начинать терапию целесообразно все же с нефармакологических методов лечения. Больным рекомендуют физическую активность, коррекцию массы тела, физиотерапию, психосоциальное воздействие, ортопедические пособия. Однако в клинической практике эти рекомендации крайне редко соблюдаются пациентами, что вынуждает обращаться к применению медикаментозных средств. Наиболее часто в терапии ОА используются анальгетики, пероральные НПВС и медленнодействующие болезнь-модифицирующие препараты из группы хондропротекторов. На сегодняшний день есть доказательная база для использования хондроитина сульфата, который обладает эффективностью при лечении начальных и умеренных проявлений ОА. Величина анальгетического эффекта его колеблется в диапазоне от малого до умеренного, по данным длительных наблюдений, он обладает структурно-модифицирующим и симптом-модифицирующим действием. Не так давно на украинском рынке появился препарат неомыляемых соединений сои и авокадо (ASU) — Пиаскледин-300. Первое упоминание об использовании этого соединения относится к 50-м годам прошлого века, когда его применение было признано эффективным при лечении патологии кожи и хряща при склеродермии. В 1970-х годах ASU определены как вещества, активирующие эпидермис, мукозный и коллагеновый слой кожи и кости, а также обнаружен их анальгетический эффект при ОА тазобедренного сустава и способность замедлять прогрессирование заболевания. Действие ASU обусловлено их способностью повышать экспрессию трансформирующего фактора роста 1 и 2 и ингибитора тканевого плазминогена. ASU стимулируют синтез протеогликанов и образование коллагеновых волокон, ингибируют и блокируют продукцию интерлейкина-1β,
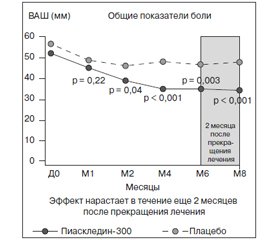
одного из цитокинов, вызывающих быструю деструкцию костной и хрящевой ткани, что приводит к необратимым изменениям у пациентов с ОА. Кроме того, оказывая опосредованный коллагенолитический эффект на хондроциты и синовиоциты, они угнетают синтез ходроцитами коллагеназы, стромелизина, интерлейкина-6 и -8, а также простагландина Е2. Докладчик привел данные основных клинических исследований эффективности и безопасности ASU. Впервые симптом-модифицирующее действие этого вещества было показано в 1998 году, когда был зафиксирован анальгетический эффект у пациентов с ОА, более чем в 2 раза превышающий плацебо, а также снижение ограничения функциональной активности больных. Причем выявлялось потенцирование эффекта к 6-му месяцу терапии с периодом последействия 2 месяца после отмены препарата (рис. 4). Также в исследовании эффективности и безопасности ASU с участием 164 пациентов с ОА коленного и тазобедренного сустава использование Пиаскледина-300 в комбинации с НПВС после 45 дней терапии позволило снизить дозировку последних, необходимую для купирования симптомов заболевания, что уменьшало выраженность побочных явлений от приема НПВС. Среднесуточная доза НПВС в группе, получающей Пиаскледин-300, от начала лечения до 45-го дня составляла в среднем 75 ± 59 мг и 26 ± 38 мг. В группе плацебо эти цифры составили соответственно 78 ± 45 мг и 50 ± 48 мг. Общая доза полученного НПВС в группе Пиаскледина составила 372 ± ± 742 мг, а в группе плацебо — 814 ± 1026 мг.
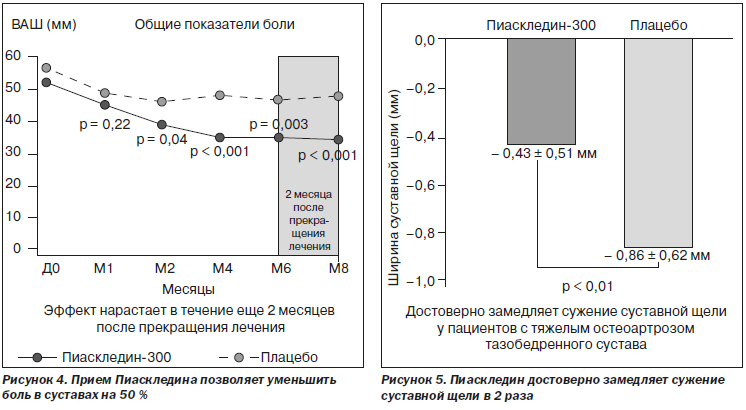
Структурно-модифицирующее действие ASU при коксартрозе, проявляющееся в замедлении деструкции хряща и прогрессирования сужения суставной щели, было доказано в крупномасштабных исследованиях Lequence et al. в 2002 году и E. Maheu et al. в 2009 году. По результатам этих работ после двух лет терапии Пиаскледином у пациентов с выраженным коксартрозом отмечалось в 2 раза меньшее сужение суставной щели, чем в группе плацебо. После трех лет терапии в исследовании ERADIAS уменьшение количества пациентов с сужением суставной щели в группе ASU в сравнении с группой плацебо составило 50 % (рис. 5). Данные исследований, подтверждающих эффективность Пиаскледина, позволили рекомендовать его как структурно-модифицирующий препарат для лечения ОА. Также был проведен метаанализ 4 крупных рандомизированных исследований с участием в общей сложности 600 пациентов, который показал, что частота развития побочных эффектов в группе Пиаскледина и в группе плацебо не имела достоверных различий, что говорит о высоком индексе безопасности применения ASU.
Таким образом, с учетом клинических и экспериментальных данных использование медленнодействующих болезнь-модифицирующих препаратов как стандартного лечения ОА является необходимой и эффективной составляющей терапии. В качестве препаратов первой линии следует использовать оригинальные молекулы, включенные в стандарт лечения и рекомендованные EULAR и OARSI. Клинически подтвержденная данными рандомизированных исследований эффективность и безопасность, наличие структурно- и симптом-модифицирующего действия Пиаскледина-300 позволяет применять его (в сочетании с парацетамолом при необходимости) в качестве терапии первой линии для лечения ОА.

В Украине также было проведено открытое многоцентровое исследование эффективности и безопасности базисной терапии ОА, о результатах которого рассказал в своем докладе
д.м.н., профессор Института кардиологии им. Н.Д. Стражеско О.П. Борткевич. Целью исследования была оценка эффективности и переносимости неомыляемых соединений сои и авокадо, а именно препарата Пиаскледин-300, у пациентов с ОА коленных и тазобедренных суставов. Исследование проходило на базе 8 центров Украины. В него были включены амбулаторные или стационарные больные — мужчины и женщины в возрасте от 40 до 70 лет с первичным гонартрозом или коксартрозом 1–3-й рентгенологической стадии. Также критериями включения пациентов в исследование были наличие клинически значимых проявлений заболевания, индекс интенсивности боли в суставах ≥ 30 мм, индекс Лекена ≥ 5 баллов, необходимость приема НПВС на протяжении последних 5 месяцев и отсутствие использования каких-либо препаратов с хондропротекторной активностью в течение последних 3 месяцев. Из исследования были исключены пациенты, имеющие один из нижеперечисленных факторов: вторичный ОА; клинически латентный период заболевания; наличие язвенной болезни желудка или двенадцатиперстной кишки; тяжелая гепатоцеллюлярная или почечная недостаточность; тяжелое течение других острых или хронических заболеваний; индивидуальная непереносимость препарата, аллергия на препарат; тяжелые соматические заболевания (тяжелые формы ИБС, онкопатология, хроническая легочная недостаточность, ВИЧ). Критериями оценки эффективности были стандартные для подобных видов исследования показатели, а именно интенсивность боли в покое и при движении, длительность и интенсивность утренней скованности, динамика суммарного индекса Лекена, динамика функциональной недостаточности (WOMAC) и суточная потребность в НПВС. Общая оценка эффективности лечения проводилась пациентом и врачом. Переносимость препарата оценивалась по наличию и степени выраженности побочных эффектов. Контроль состояния пациентов осуществлялся через 1, 3 и 5 месяцев терапии.
В исследовании принял участие 141 пациент — 102 женщины и 39 мужчин, средний возраст которых составил 60,20 ± 8,44 года. 114 больных страдали гонартрозом, у 43 пациентов был диагностирован коксартроз. Вторую и третью рентгенологические стадии имели 98 и 43 пациента соответственно. Большинство больных (131 человек) нуждались в постоянном использовании НПВС. Начальные средние значения оцениваемых показателей составляли: индекс боли в покое 37,86 ± 7,60; индекс боли при движении 44,63 ± 8,10; утренняя скованность (мин) 16,41 ± 5,40; утренняя скованность (интенсивность) 32,48 ± 5,90; индекс Лекена 9,7 ± 2,6; индекс WOMAC суммарный 265,0 ± 42,4 мм.
Оценка результатов показала достоверную эффективность Пиаскледина-300. Динамика оцениваемых показателей через 1, 3 и 5 месяцев лечения приведена в табл. 1.
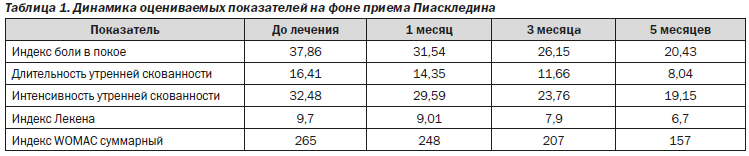
Индекс боли в покое за 5 месяцев терапии уменьшился на 46 %, при этом улучшение отмечалось у 119 пациентов. Уменьшение длительности и интенсивности утренней скованности на 29 и 27 % соответственно наблюдалось более чем у 100 пациентов. Индекс Лекена снизился на 31 % через 5 месяцев лечения, улучшение этого показателя отмечалось у 105 больных. Индекс WOMAC суммарный снизился на 41 %, улучшение зафиксировано у 95 пациентов. Следует отметить, что положительная динамика всех показателей была равномерной от первого к пятому месяцу лечения. Если в начале терапии только 7 % больных могли обходиться без постоянного приема НПВС, то через месяц эта цифра увеличилась до 16,3 %, через 3 месяца — до 26,25, а через 5 месяцев 47,5 % больных не принимали НПВС. Также было отмечено снижение необходимой эффективной дозы этих препаратов на фоне приема Пиаскледина-300. После 5 месяцев лечения дозировка НПВС составляла 28 % от первоначальной дозы. Через 5 месяцев лечения более 120 человек отметили значительное улучшение состояния на фоне приема Пиаскледина-300, 15 человек отметили улучшение и только 3 пациента пришли к выводу, что их состояние осталось без изменений. Оценка врача незначительно отличалась от мнения пациентов.
За время исследования было зафиксировано 3 случая возникновения побочных эффектов: две аллергические реакции по типу крапивницы, которые купировались приемом противоаллергических препаратов в течение 5–7 дней, и один эпизод появления боли в животе, который купировался самостоятельно.
В настоящий момент исследование продолжается, по результатам оценки данных после пятимесячного наблюдения специалистами был сделан вывод, что Пиаскледин-300 обладает симптом-модифицирующим действием, является эффективным для лечения больных ОА коленного и тазобедренного суставов. Механизм действия, высокая эффективность, удобство использования и хорошая переносимость препарата, минимальные противопоказания позволяют рекомендовать и использовать его в качестве базисного средства для лечения остеоартроза.
 С докладом «Современные возможности оценки болезнь-модифицирующего потенциала препаратов для лечения остеоартроза» выступил профессор О.Б. Яременко.
С докладом «Современные возможности оценки болезнь-модифицирующего потенциала препаратов для лечения остеоартроза» выступил профессор О.Б. Яременко. Более детально о клиническом применении Пиаскледина рассказал в своем докладе «Эффективная и рациональная терапия остеоартроза: что предпочесть?» д.м.н. Д.Г. Рекалов.
Более детально о клиническом применении Пиаскледина рассказал в своем докладе «Эффективная и рациональная терапия остеоартроза: что предпочесть?» д.м.н. Д.Г. Рекалов. В Украине также было проведено открытое многоцентровое исследование эффективности и безопасности базисной терапии ОА, о результатах которого рассказал в своем докладе д.м.н., профессор Института кардиологии им. Н.Д. Стражеско О.П. Борткевич. Целью исследования была оценка эффективности и переносимости неомыляемых соединений сои и авокадо, а именно препарата Пиаскледин-300, у пациентов с ОА коленных и тазобедренных суставов. Исследование проходило на базе 8 центров Украины. В него были включены амбулаторные или стационарные больные — мужчины и женщины в возрасте от 40 до 70 лет с первичным гонартрозом или коксартрозом 1–3-й рентгенологической стадии. Также критериями включения пациентов в исследование были наличие клинически значимых проявлений заболевания, индекс интенсивности боли в суставах ≥ 30 мм, индекс Лекена ≥ 5 баллов, необходимость приема НПВС на протяжении последних 5 месяцев и отсутствие использования каких-либо препаратов с хондропротекторной активностью в течение последних 3 месяцев. Из исследования были исключены пациенты, имеющие один из нижеперечисленных факторов: вторичный ОА; клинически латентный период заболевания; наличие язвенной болезни желудка или двенадцатиперстной кишки; тяжелая гепатоцеллюлярная или почечная недостаточность; тяжелое течение других острых или хронических заболеваний; индивидуальная непереносимость препарата, аллергия на препарат; тяжелые соматические заболевания (тяжелые формы ИБС, онкопатология, хроническая легочная недостаточность, ВИЧ). Критериями оценки эффективности были стандартные для подобных видов исследования показатели, а именно интенсивность боли в покое и при движении, длительность и интенсивность утренней скованности, динамика суммарного индекса Лекена, динамика функциональной недостаточности (WOMAC) и суточная потребность в НПВС. Общая оценка эффективности лечения проводилась пациентом и врачом. Переносимость препарата оценивалась по наличию и степени выраженности побочных эффектов. Контроль состояния пациентов осуществлялся через 1, 3 и 5 месяцев терапии.
В Украине также было проведено открытое многоцентровое исследование эффективности и безопасности базисной терапии ОА, о результатах которого рассказал в своем докладе д.м.н., профессор Института кардиологии им. Н.Д. Стражеско О.П. Борткевич. Целью исследования была оценка эффективности и переносимости неомыляемых соединений сои и авокадо, а именно препарата Пиаскледин-300, у пациентов с ОА коленных и тазобедренных суставов. Исследование проходило на базе 8 центров Украины. В него были включены амбулаторные или стационарные больные — мужчины и женщины в возрасте от 40 до 70 лет с первичным гонартрозом или коксартрозом 1–3-й рентгенологической стадии. Также критериями включения пациентов в исследование были наличие клинически значимых проявлений заболевания, индекс интенсивности боли в суставах ≥ 30 мм, индекс Лекена ≥ 5 баллов, необходимость приема НПВС на протяжении последних 5 месяцев и отсутствие использования каких-либо препаратов с хондропротекторной активностью в течение последних 3 месяцев. Из исследования были исключены пациенты, имеющие один из нижеперечисленных факторов: вторичный ОА; клинически латентный период заболевания; наличие язвенной болезни желудка или двенадцатиперстной кишки; тяжелая гепатоцеллюлярная или почечная недостаточность; тяжелое течение других острых или хронических заболеваний; индивидуальная непереносимость препарата, аллергия на препарат; тяжелые соматические заболевания (тяжелые формы ИБС, онкопатология, хроническая легочная недостаточность, ВИЧ). Критериями оценки эффективности были стандартные для подобных видов исследования показатели, а именно интенсивность боли в покое и при движении, длительность и интенсивность утренней скованности, динамика суммарного индекса Лекена, динамика функциональной недостаточности (WOMAC) и суточная потребность в НПВС. Общая оценка эффективности лечения проводилась пациентом и врачом. Переносимость препарата оценивалась по наличию и степени выраженности побочных эффектов. Контроль состояния пациентов осуществлялся через 1, 3 и 5 месяцев терапии.