Газета «Новости медицины и фармации» Акушерство и гинекология (569) 2016 (тематический номер)
Вернуться к номеру
Уніфікований клінічний протокол первинної, вторинної (спеціалізованої) та третинної (високоспеціалізованої) медичної допомоги. Тактика ведення пацієнток з ендометріозом
Рубрики: Акушерство и гинекология
Разделы: Официальная информация
Версия для печати
Статья опубликована на с. 47-59
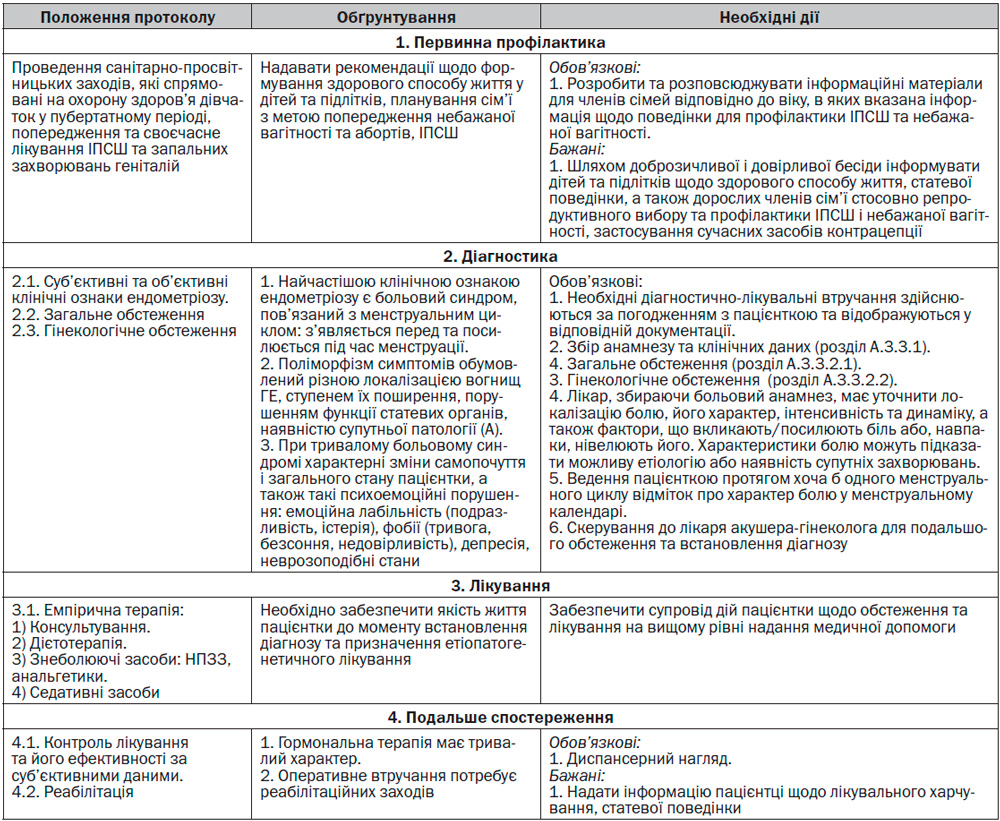
Вступ
Генітальний ендометріоз — доброякісне гормонозалежне захворювання, в основі якого лежить гетеротопія ендометрію на фоні порушення функції гіпоталамо-гіпофізарно-яєчникової системи, імунного дисбалансу за наявності генетичної схильності. Актуальність ендометріозу пов’язана зі зростаючою частотою ендометріозу серед дівчат-підлітків і жінок репродуктивного віку та спричиненим ним безпліддям, а також формуванням стійкого больового синдрому, що негативно впливає на якість життя жінки.
Медичні аспекти генітального ендометріозу визначаються значним поширенням і тенденцією до збільшення частоти цієї патології, прогресуючим перебігом захворювання, його тяжкістю, порушенням функції статевих органів та інших систем організму, що значною мірою впливає на якість життя.
За сучасними уявленнями, ендометріоз вважається ендометріоїдною хворобою, а саме системним захворюванням організму, при якому розвиваються поліорганні порушення, що ускладнюють лікування захворювання та досягнення довготривалих позитивних результатів.
Медикоорганізаційні технології Протоколу базуються на даних доказової медицини, міжнародного та вітчизняного досвіду з метою удосконалення медичної допомоги населенню.
Перелік скорочень
АГнРГ Агоністи гонадотропінрилізинг гормону
ГЕ Генітальний ендометріоз
ДРТ Допоміжні репродуктивні технології
АМК Ациклічні маткові кровотечі
ІПСШ Інфекції, що передаються статевим шляхом
ХТБ Хронічний тазовий біль
МОЗ Міністерство охорони здоров’я
МРТ Магнітно-резонансна томографія
РЗ Репродуктивне здоров’я
ПC Планування сім’ї
РП Репродуктивні права
ГЕ Генітальний ендометріоз
ДРТ Допоміжні репродуктивні технології
АМК Ациклічні маткові кровотечі
ІПСШ Інфекції, що передаються статевим шляхом
ХТБ Хронічний тазовий біль
МОЗ Міністерство охорони здоров’я
МРТ Магнітно-резонансна томографія
РЗ Репродуктивне здоров’я
ПC Планування сім’ї
РП Репродуктивні права
А.1 Паспортна частина
А.1.1 Діагноз
Ендометріоз
А1.2 Шифр за МКХ-10:
N80 Ендометріоз
N 80.0 Ендометріоз матки Аденоміоз
N 80.1 Ендометріоз яєчника
N 80.2 Ендометріоз маткової труби
N 80.3 Ендометріоз тазової очеревини
N 80.4 Ендометріоз прямокишково-піхвової перетинки і піхви
N 80.5 Ендометріоз кишечника
N 80.6 Ендометріоз шкірного рубця
N 80.8 Інший ендометріоз
N 80.9 Ендометріоз, неуточнений
N80 Ендометріоз
N 80.0 Ендометріоз матки Аденоміоз
N 80.1 Ендометріоз яєчника
N 80.2 Ендометріоз маткової труби
N 80.3 Ендометріоз тазової очеревини
N 80.4 Ендометріоз прямокишково-піхвової перетинки і піхви
N 80.5 Ендометріоз кишечника
N 80.6 Ендометріоз шкірного рубця
N 80.8 Інший ендометріоз
N 80.9 Ендометріоз, неуточнений
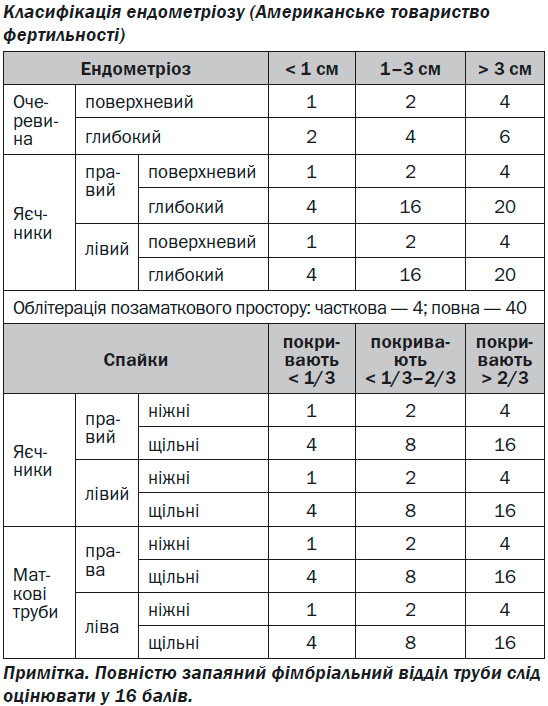
У багатьох країнах світу використовують класифікацію Американського товариства фертильності, згідно з якою при різноманітних локалізаціях ендометріозу враховується ступінь поширеності, глибина ураження і тяжкості захворювання, відповідно до чого формують бальну оцінку зазначених параметрів. Виділяють 4 стадії захворювання: І (1–5 балів), II (6–15 балів), III (до 16–40 балів), IV (40 балів і більше).
A.1.3 Для кого призначений протокол (потенційні користувачі):
Лікарі акушери-гінекологи, анестезіологи-реаніматологи, лікарі загальної практики — сімейні лікарі, медичні сестри, акушерки, сестри медичні — анестезисти, медичні психологи, керівники ЗОЗ різних форм власності та підпорядкування, організатори охорони здоров’я.
A.1.4 Мета Протоколу: надання якісної медичної допомоги для забезпечення у пацієнток покращення природної здатності до зачаття, підвищення ефективності ДРТ, знеболювання як альтернативи хірургічному лікуванню або при очікуванні оперативного лікування, а також як додаткові заходи до оперативного лікування та профілактики рецидивів.
A.1.5 Дата складання Протоколу: 2015 р.
A.1.6 Дата перегляду Протоколу: 2018 р.
А.1.7 Розробники протоколу
A.1.8 Епідеміологічна інформація
Від ендометріозу страждає близько 15–50 % жінок репродуктивного віку, 30–40 % хворих на ендометріоз мають безплідність. Генітальна форма ендометріозу є найбільш поширеною (92–94 %), екстрагенітальна локалізація ендометріозу зустрічається в 6–8 % випадків.
Ендометріоз — поширене гінекологічне захворювання, при якому клітини ендометрію розростаються поза межі цього шару. Розвивається у жінок репродуктивного віку. Оскільки ендометріоїдна тканина має рецептори до статевих гормонів, у ній виникають ті ж зміни, що і в нормальному ендометрії, які проявляються щомісячними кровотечами. Ці невеликі кровотечі призводять до запалення в оточуючих тканинах і викликають основні прояви захворювання: біль, збільшення органа, безпліддя.
Причини виникнення захворювання точно не встановлені. Припускають участь у механізмі захворювання клітинних ферментів, рецепторів до гормонів, а також генних мутацій.
А.2 Загальна частина
А.2.1. Для установ, що надають первинну медичну допомогу
А.2.2.1 Для установ, що надають вторинну (третинну) амбулаторну допомогу
А.2.2.2 Для установ, що надають вторинну (третинну) стаціонарну допомогу
А.3 Етапи діагностики і лікування
Алгоритм організації медичної допомоги пацієнтам з ендометріозом
А.3.1 Правові та етичні засади діагностики та лікування ендометріозу
Дотримання чинного законодавства:
Медична допомога пацієнткам з ендометріозом надається за їх зверненням і вільним вибором лікаря (бажано до свого сімейного лікаря) відповідно до ст. 284 Цивільного кодексу України та ст. 34 Основ законодавства про охорону здоров’я.
Пацієнтка має право на інформацію про стан свого здоров’я (ст. 285. Цивільного кодексу України). Діагностично-лікувальні втручання обговорюються та узгоджуються з пацієнткою (накази МОЗ України від 15.07.2011 № 417 та від 29.12.2003 № 620).
Дотримання конфіденційності/лікарської таємниці: медичні працівники зобов’язані забезпечити збереження інформації, отриманої від пацієнтки, та не допустити її розголосу іншим особам (ст. 286 Цивільного кодексу України). Медичні працівники та інші особи, яким у зв’язку з виконанням професійних або службових обов’язків стало відомо про хворобу, медичне обстеження, огляд та їх результати, інтимну і сімейну сторони життя громадянина, не мають права розголошувати ці відомості, крім передбачених законодавчими актами випадків (ст. 40 Основ законодавства України про охорону здоров’я).
Не підлягають розголошенню відомості, що стосуються лікарської таємниці, крім випадків, передбачених Законом (ст. 46 Закону України «Про інформацію»).
Етичні принципи: медичні працівники повинні поважати гідність клієнтки та пам’ятати про ставлення до пацієнтки з повагою і зуміти допомогти їй зберегти свою гідність.
Прийняття вільного й інформованого рішення: пацієнтка має право висловити свою точку зору та прийняти самостійне рішення після одержання повної, достовірної та чіткої інформації щодо діагностично-лікувальних втручань, профілів безпечності лікувальних препаратів, ризиків та можливих ускладнень.
Необхідно усвідомлювати, що пацієнтка не завжди розуміє надану їй інформацію повною мірою. Важливо приділити жінці достатньо часу для проведення консультування, відповісти на її питання зрозумілою для неї мовою.
А.3.2 Принципи консультування пацієнтки
Принципи спілкування:
Відношення до пацієнтки має бути доброзичливим, уважним, підтримуючим, учасливим незалежно від віку, соціального та матеріального статусу пацієнтки. Розуміння хворого з боку лікаря — це підґрунтя, на якому зростає довіра. Повага передбачає визнання цінності хворого як індивіда і серйозності його тривог. Співчуття — ключ до співпраці лікаря та хворого. Налагоджені стосунки лікаря і хворого не лише цілющі самі по собі, вони посилюють і полегшують вплив інших лікувальних процедур.
Первинне консультування обов’язково проводиться при першому зверненні пацієнтки.
А.3.3
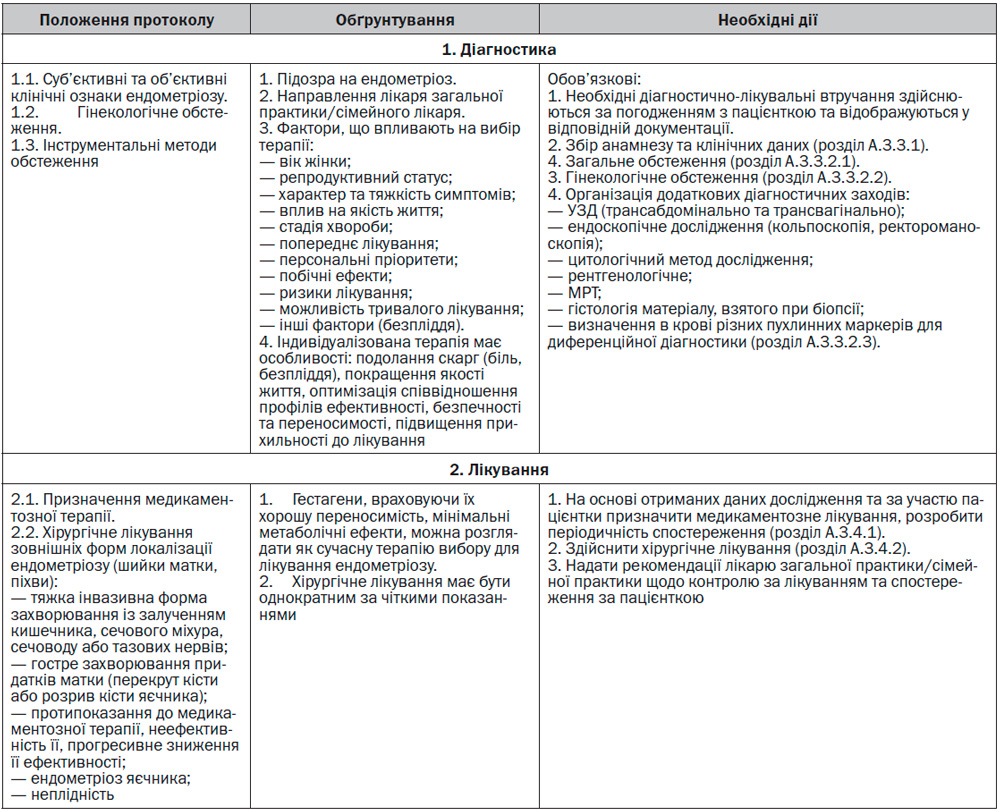
А.3.3.1 Загальний алгоритм діагностики та диференційної діагностики.
Збір анамнезу, суб’єктивних ознак та внесення відповідного запису до медичної документації:
З’ясовується давність захворювання або виникнення симптомів ХТБ, репродуктивний статус (кількість пологів, абортів і про можливі їх ускладнення), можливі оперативні втручання, а також вид попереднього лікування ендометріозу, можливі проблеми безпліддя.
Ендометріоз і безпліддя можуть набувати розвитку паралельно, залежно від однієї або декількох загальних причин. При цьому мають значення захворювання, що супроводжують ендометріоз. Серед них можна виділити:
а) порушення секреції гормонів (естрадіол, прогестерон, лютеїнізуючий гормон, фолікулостимулюючий гормон, пролактин і тестостерон), які призводять до неповноцінної овуляції і/чи функціональної неповноцінності жовтого тіла та ендометрію;
б) порушення локального імунітету;
в) гіперпластичні процеси ендометрію, молочної залози, щитоподібної залози;
г) доброякісні новоутворення: кісти, міоми, кістоми, що часто спостерігаються при ендометріозі.
б) порушення локального імунітету;
в) гіперпластичні процеси ендометрію, молочної залози, щитоподібної залози;
г) доброякісні новоутворення: кісти, міоми, кістоми, що часто спостерігаються при ендометріозі.
Різні чинники розвитку безплідності при ендометріо–зі можна об’єднати в такі групи:
1) механічні;
2) перитонеальні;
3) імунологічні;
4) ендокринні порушення.
1) механічні;
2) перитонеальні;
3) імунологічні;
4) ендокринні порушення.
Необхідно враховувати, що ГЕ характеризується різноманітністю клінічного перебігу від безсимптомного до картини «гострого живота». Найчастішою клінічною ознакою ендометріозу є больовий синдром, пов’язаний з менструальним циклом (з’являється перед та посилюється під час менструації). Поліморфізм симптомів обумовлений різною локалізацією вогнищ ГЕ, ступенем їх поширення, порушенням функції статевих органів, наявністю супутньої патології.
Скарги пацієнтки диференціюють за такими суб’єктивними клінічними ознаками ендометріозу:
1. Типові симптоми: ХТБ, дисменорея, диспареунія, безпліддя.
2. Менш типові симптоми: міжменструальні кров’я–нисті виділення, АМК, дизурія, дисхезія (порушення дефекації).
3. Більш рідкісні симптоми: гематурія, кровотечі з прямої кишки.
4. Симпотоми, які зустрічаються дуже рідко: гемо–птизис (кровохаркання), кишкова непрохідність, водянка нирки та сечоводу, шкірні вузли.
1. Типові симптоми: ХТБ, дисменорея, диспареунія, безпліддя.
2. Менш типові симптоми: міжменструальні кров’я–нисті виділення, АМК, дизурія, дисхезія (порушення дефекації).
3. Більш рідкісні симптоми: гематурія, кровотечі з прямої кишки.
4. Симпотоми, які зустрічаються дуже рідко: гемо–птизис (кровохаркання), кишкова непрохідність, водянка нирки та сечоводу, шкірні вузли.
Клінічними ознаками ендометріозу також є слабкість, швидка втомлюваність, значна втрата працездатності. Вираженість больового синдрому, що регулярно повторюється в дні менструації, та прогресуюча слабкість сприяють появі почуття тривоги, страху.
Необхідно враховувати, що не завжди спостерігається кореляція між розміром вогнища ураження, тривалістю процесу та клінічними проявами захворювання. Ендометріоїдна кіста яєчника навіть великих розмірів може не давати больової симптоматики, проте іноді спричинює болі, особливо напередодні та під час менструації, які можуть супроводжуватися нудотою, блювотою, втратою свідомості. При мікроперфорації ендометріоїдних кіст нерідко виникають явища перитоніту. Для більшості хворих на ГЕ матки характерні рясні тривалі менструації, нерідко метрорагії, почуття тяжкості, розпирання в нижніх відділах живота.
Характер порушень менструальної функції багато в чому залежить від локалізації вогнищ ендометріозу, ступеня ураження геніталій і тазових органів. Найбільш частими з них є:
— прогресуюча дисменорея (при внутрішньоматковому ендометріозі з ураженням перешийка, ендометріозі яєчників, тазової очеревини, крижово-маткових зв’язок, позашийковому ендометріозі з залученням параректальної клітковини та стінки прямої кишки);
— аномальні маткові кровотечі (при аденоміозі в поєднанні з міомою матки);
— кровомазання до і після менструації, контактні кров’янисті виділення (при ендометріозі піхви, шийки матки, шийкового каналу, ендометріозі яєчників і аденоміозі матки).
— прогресуюча дисменорея (при внутрішньоматковому ендометріозі з ураженням перешийка, ендометріозі яєчників, тазової очеревини, крижово-маткових зв’язок, позашийковому ендометріозі з залученням параректальної клітковини та стінки прямої кишки);
— аномальні маткові кровотечі (при аденоміозі в поєднанні з міомою матки);
— кровомазання до і після менструації, контактні кров’янисті виділення (при ендометріозі піхви, шийки матки, шийкового каналу, ендометріозі яєчників і аденоміозі матки).
В окремих випадках ендометріозу, які характеризуються серйозними порушеннями анатомічних структур у ділянці придатків матки, доведено, що безплідність стає прямим наслідком таких пошкоджень, як оклюзія маткових труб, спайкова деформація фімбрій, повна ізоляція яєчників періоваріальними спайками, пряме пошкодження тканини яєчників ендометріоїдними кістами та інше.
Клінічними ознаками ендометріозу можуть також бути психоемоційні порушення, такі як емоційна лабільність (подразливість, істерія), фобії (тривога, безсоння, недовірливість), депресія, неврозоподібні стани.
З урахуванням індивідуальних обставин та ризиків, що асоціюються з проведенням інвазивних діагностичних процедур, вони не є оптимальним підходом. Тому у більшості випадків попередній діагноз встановлюється на підставі наявних клінічних симптомів ендоментріозу й об’єктивних даних неінвазивних методів обстеження і спостереження та розпочинається терапія.
А.3.3. Діагностика/обстеження
А.3.3.2.1 Загальне обстеження.
Зовнішній вигляд (колір шкірного покриву).
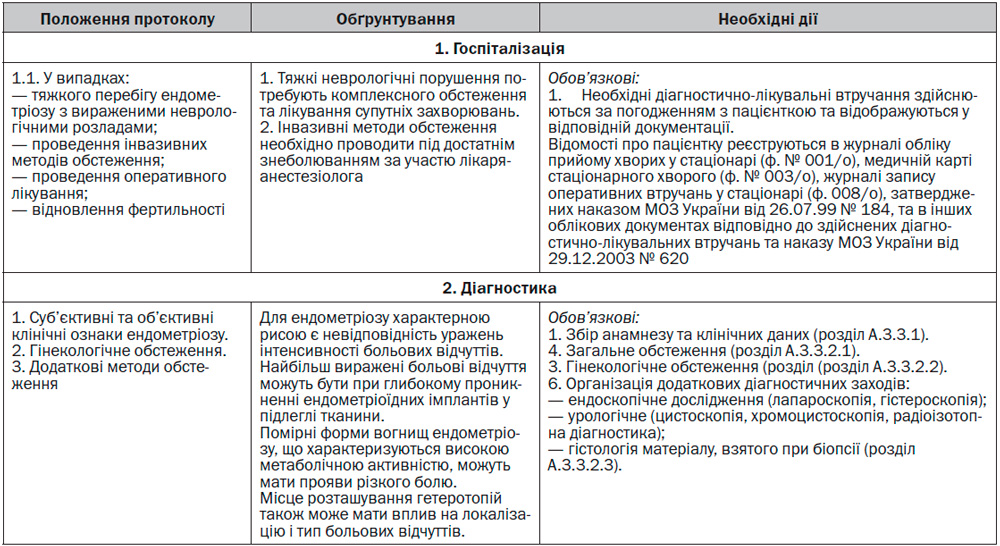
У разі тяжкого перебігу ендометріозу з неврологічними порушеннями або супутніми захворюваннями здійснюють посиндромне обстеження.
А.3.3.2.2 Гінекологічне обстеження.
Обстеження проводять в одноразових стерильних рукавичках.
Зовнішній огляд геніталій. Огляд ділянки проме–жини на наявність ознак ІПСШ (виразок, кондилом, патологічних виділень).
Огляд у дзеркалах стінки піхви та шийки матки на наявність патологічних виділень або деформацій (у разі виявлення ознак ІПСШ чи запального захворювання призначають лікування згідно з діючим клінічним протоколом).
Обстеження перешийка матки:
— ущільнення, розширення, болючість;
— заднього склепіння піхви: інфільтрація, рубцеві зміни;
— придатків матки: величину, рухомість, болючість, консистенцію;
— стану крижово-маткових зв’язок; потовщення, напруження, болючість.
— ущільнення, розширення, болючість;
— заднього склепіння піхви: інфільтрація, рубцеві зміни;
— придатків матки: величину, рухомість, болючість, консистенцію;
— стану крижово-маткових зв’язок; потовщення, напруження, болючість.
А.3.3.2.3 Інструментальні методи обстеження
Інструментальні методи діагностики ГЕ дають змогу оцінити ступінь поширеності захворювання, тяжкість анатомічних порушень:
1) УЗД (трансабдомінально та трансвагінально);
2) ендоскопічне дослідження (кольпоскопія, ректороманоскопія, лапароскопія, гістероскопія);
3) цитологічний метод дослідження;
4) рентгенологічне;
5) МРТ;
6) урологічне (цистоскопія, хромоцистоскопія, радіо–ізотопна діагностика);
7) гістологія матеріалу, взятого при біопсії.
1) УЗД (трансабдомінально та трансвагінально);
2) ендоскопічне дослідження (кольпоскопія, ректороманоскопія, лапароскопія, гістероскопія);
3) цитологічний метод дослідження;
4) рентгенологічне;
5) МРТ;
6) урологічне (цистоскопія, хромоцистоскопія, радіо–ізотопна діагностика);
7) гістологія матеріалу, взятого при біопсії.
УЗД (трансабдомінально та трансвагінально).
Ехографічна діагностика дифузної форми ендометріозу тіла матки ґрунтується на таких критерях:
а) збільшення передньо-заднього розміру матки;
б) округлість її форми;
в) наявність у міометрії (напередодні менструації) аномальних кістозних порожнин діаметром 3–5 мм.
а) збільшення передньо-заднього розміру матки;
б) округлість її форми;
в) наявність у міометрії (напередодні менструації) аномальних кістозних порожнин діаметром 3–5 мм.
Застосування піхвового датчика покращує інформативність УЗД у таких випадках. Ехографічними ознаками вузлової форми ендометріозу тіла матки є:
— поява в стінці матки зони підвищеної ехогенності округлої чи овальної форми;
— наявність в ній невеликих анехогенних включень або кістозних порожнин, які містять дрібнодисперсну масу;
— не завжди чіткі контури утворення, підвищена ехогенність біля переднього контура утворення і понижена — біля віддаленого.
— поява в стінці матки зони підвищеної ехогенності округлої чи овальної форми;
— наявність в ній невеликих анехогенних включень або кістозних порожнин, які містять дрібнодисперсну масу;
— не завжди чіткі контури утворення, підвищена ехогенність біля переднього контура утворення і понижена — біля віддаленого.
При УЗД ендометріоїдних кіст необхідно проводити диференційну діагностику з іншими об’ємними утвореннями в яєчниках, що мають подібну картину, а саме з гематомою яєчника, абсцесом, туберкульозом яєчника та дермоїдними кістами.
Для діагностики ГЕ, оцінки ступеня та характеру судинних порушень використовуються допплерометричні дослідження кровоплину в артеріях органів малого таза.
Гістеросальпінгографію та біконтрастну гінекографію проводять на 2–3-й день після закінчення менструації або після діагностичного вишкрібання. При цьому перевага надається водним розчинам рентген-конт–растних речовин.
Основною ендоскопічною ознакою ГЕ при гістероскопії є наявність вічок ендометріоїдних ходів у вигляді темно-червоних крапкових отворів на фоні блідо-рожевого відтінку слизової порожнини матки, з яких в окремих випадках виливається кров (при множинній локалізації вогнищ ГЕ ендоскопічна картина нагадує будову бджолиних стільників). Разом із тим діагностична цінність цієї ознаки викликає певні сумніви, зважаючи на те, що вона часто зустрічається після попереднього інструментального вилучення функціонального шару ендометрію, при вишкрібанні якого пошкоджується цілісність судинної системи базального прошарку слизової матки, і нерідко за ендометріоїдні гетеротопії приймаються вени, що кровлять.
Високою є інформативність гістероскопії в діагностиці вузлової форми аденоміозу, при цій формі захворювання змінюється рельєф слизової оболонки тіла матки. Так, для вузлової форми аденоміозу характерні збільшення та деформація порожнини матки внаслідок локального вибухання її уражених стінок, на яких локалізуються патологічні утворення з жовтим або блідо-жовтим відтінком без чітких меж, іноді з наявністю поверхневих ендометріоїдних «зіниць». Для всіх форм аденоміозу спільними є яскравість та неоднорідність судинного рисунка.
Лапароскопія дає змогу оглянути всю черевну порожнину від дугласового простору до діафрагми. Ендометріоз може локалізуватися на різних органах і залучити в процес будь-яку перитонеальну структуру. Лапароскопія дає змогу не тільки виявити ендометріоз, його локалізацію, ступінь поширення, стан матки, маткових труб та яєчників, але й надає можливість виконати ендокоагуляцію ендометріоїдних гетеротопій, взяти біопсію і призначити адекватну терапію.
Одними з найновіших підходів у діагностиці ендометріозу вважають застосування технологій протеоміки, тобто вивчення структури та функції окремих білків при ендометріозі. Різні набори, мікро-РНК, що експресуються, які являють собою короткі молекули РНК (у середньому не більше 22 нуклеотидів), виявлені в плазмі (37 мікро-РНК) та еутопічному ендометрії (22 мікро-РНК) пацієнток з ендометріозом на відміну від ендометрію здорових жінок.
Не рекомендується з метою діагностики ендометріо–зу використовувати імунологічні біомаркери, в тому числі СА-125, які містяться в плазмі, сечі або сироватці. Хоча рівень СА-125 у сироватці при помірних і тяжких формах ендометріозу може бути дещо підвищеним, його використання як одного з рутинних методів при цьому захворюванні не є інформативним.
Необхідно проводити диференційну діагностику ендометріозу з лейоміомою матки, хронічним аднекситом, пухлинами геніталій, кишечника, гіпер–пластичними процесами ендометрію, позаматковою вагітністю, нефроптозом, сечокам’яною хворобою, апендицитом, парапроктитом, проктитом, колітом та іншими.
А.3.4 Алгоритм лікування
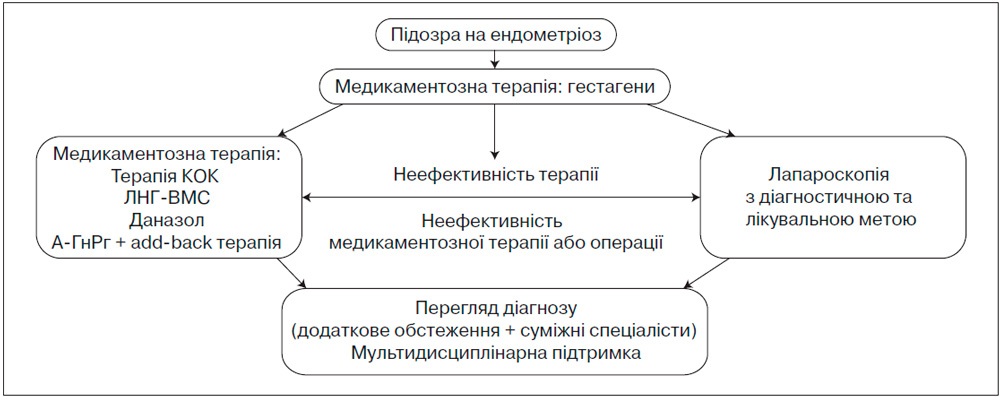
За останні майже десять років доказовою медициною накопичена значна кількість науково доведених даних у вирішенні проблем ГЕ, основні джерела яких надає всесвітня бібліотека-лабораторія Кохрейна. Завдяки даним доказової медицини, що отримані протягом останніх років, у лікуванні ендометріозу відбулися суттєві зміни, а саме застосування методів лікування з доведеною ефективністю та більш низькою частотою побічних ефектів та ймовірністю поновлення фертильності, що є надзвичайно важливим для пацієнтів з ендометріозом. Універсального препарату, який би повністю позбавив пацієнтів від ендометріозу, навіть на сьогодні не існує. Індивідуалізована терапія має особливі пріоритети: подолання скарг (біль, безпліддя), оптимізація співвідношення профілів ефективності, безпечності та переносимості, підвищення прихильності до лікування.
А.3.4.1 Консервативне лікування
Початкові етапи лікування зазвичай передбачають застосування консервативного підходу. При виборі методики терапії ендометріозу слід розглядати як хронічне захворювання, що потребує розробки плану довгострокового ведення пацієнтки з метою максимального використання медикаментозного лікування.
Сучасні підходи до вибору медикаментів для лікування ендометріозу базуються на урахуванні профілю безпечності, клінічної ефективності та побічних ефектів.
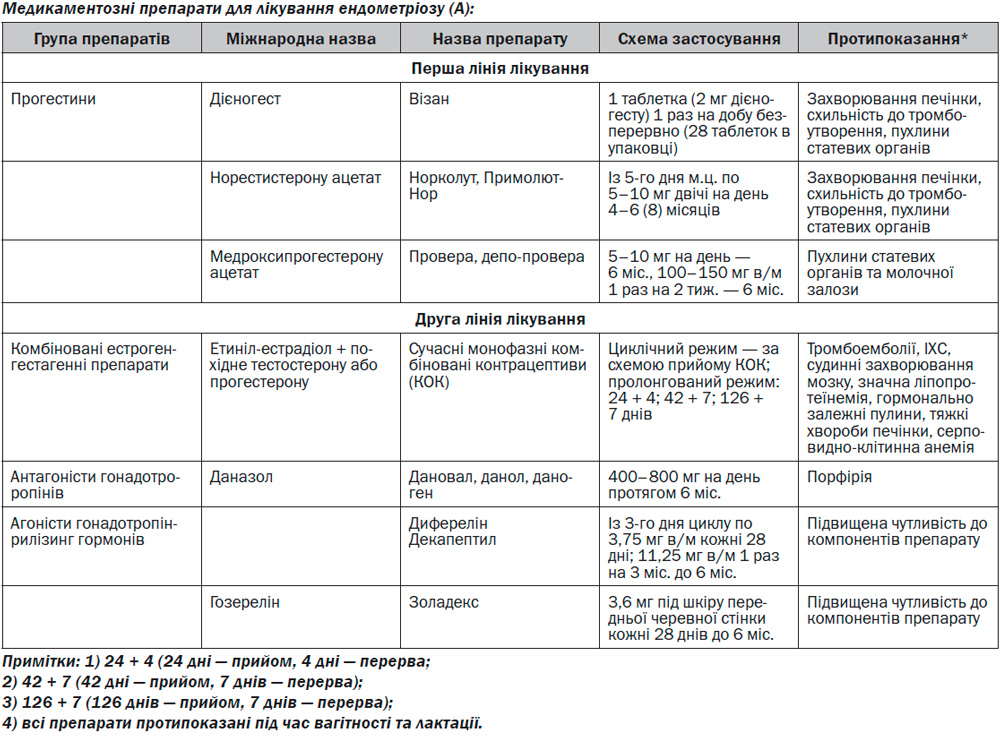
Прогестини
Застосування прогестинів є патогенетично обґрунтованим. Синтетичні гормони з прогестероноподібною активністю пригнічують функціональну активність по осі «гіпофіз — яєчники» та пригнічують проліферативні процеси в ендометрії.
Прогестини, що є похідними нортестостерону (норетистерону ацетату, левоноргестрел, гестоден, дезогестрел, дієногест) мають більш виражений трансформуючий вплив на ендометрій та ендометріоїдну тканину, ніж прогестерон та його похідні (дидрогестерон, медроксипрогестерону ацетат, ципротерону ацетат), що з точки зору патогенетичного підходу є важливим для лікування ендометріозу.
Проте деякі похідні нортестостерону мають парціальні ефекти, включаючи андрогенний вплив та ін., які є небажаними, особливо в разі тривалого застосування.
Сучасні високоселективні прогестини зв’язуються з рецепторами прогестерону, що дозволяє звести до мінімуму і навіть виключити небажані андрогенні, естрогенні та глюкокортикоїдні побічні ефекти. Таким є прогестин дієногест, який поєднує в собі ефективну дію на ендометрій/ендометріоїдну тканину та метаболічну нейтральність, що є характерним для групи прогестерону. Дієногест належить до 19-норпрогестагенів. Його відрізняє від інших похідних 19-нортестостерону наявність ціанометильної групи замість етинільної. З іншими похідними 19-нортестостерону його об’єднують виражений прогестагенний вплив на ендометрій, незначний період напіввиведення з сироватки крові (9–10 годин) та висока біодоступність (при прийомі всередину > 90 %). Дієногест має хорошу переносимість, очевидні антиандрогенні ефекти та помірну інгібуючу дію на секрецію гонадотропінів. Застосування дієногесту дозволяє не лише посимптомно боротися з ознаками захворювання (біль, дисменорея), а й впливати на патогенез ендометріозу, пригнічувати запалення, сприяти регресії ендометріоїдних вогнищ, забезпечувати пацієнтці фертильність та високу якість життя. Дієногест має лише помірний гіпоестрогенний ефект, оскільки дієногест не блокує повністю синтез ендогенних естрогенів, прийом препарату не викликає побічних ефектів, пов’язаних з гіпоестрогенією, — припливів та зниження мінеральної щільності кісткової тканини.
Антипроліферативна дія дієногесту сприяє зникненню або значному зменшенню ендометріоїдних вогнищ. Цей ефект реалізується як на центральному (помірний антигонадотропний вплив), так і на периферичному рівнях (атрофія еутопічного ендометрію та ектопованих ендометріоїдних вогнищ). Дієногест може бути довгостроковим методом лікування (А).
Таким чином, сучасне медикаментозне лікування ендометріозу перешкоджає виникненню так званого запального каскаду під час щомісячної ретроградної менструації, знижує число нервових закінчень в ендометріоїдних вогнищах, є профілактикою формування в структурах ноцицептивної системи ділянок підвищеної збудливості, здатних функціонувати в автономному режимі без додаткової активації ендо-/екзогенними стимулами, рецидивів захворювання та повторного оперативного втручання, покращує робочу продуктивність і якість життя жінки.
КОК
Механізм дії цієї групи препаратів полягає у пригніченні оваріальної функції внаслідок порушення циклічної секреції фолікулостимулюючого та лютеїнізуючого гормонів, що супроводжується ановуляцією та децидуалізацією строми.
Даназол
Даназол є андрогенним стероїдом, похідним 17-етинілтестостерону, має виражену антигонадотропну дію, пригнічує фолікулогенез в яєчниках, внаслідок чого індукує аменорею. Препарат ефективний в лікуванні симптомів ендометріозу, проте використання препарату обмежене типовими (анаболічними та андрогенними) побічними ефектами, такими як збільшення маси тіла, акне, гірсутизм, зменшення розміру молочних залоз, у рідких випадках вірилізація, неспрятливий вплив на ліпідний профіль.
Агоністи ГнРГ
Це синтетичні пептиди, аналоги рилізинг-гормону гіпоталамуса. Механізм їх дії обумовлений конкуруванням з ендогенним ГнРГ за рецептори клітин гіпофізу, що секретують гонадотропіни. Утворення стійкого зв’язку препарату та рецепторів гонадотрофів викликає десенситизацію гіпофіза та блокує стимуляцію секреції гонадотропінів. Пригнічення секреції призводить до гіпоестрогенного ановуляторного стану («псевдоменопауза»), зниженню рівня естрогенів в периферичній крові до рівня, характерного для пост–менопаузи, до атрофії ендометріоїдних ділянок та аменореї.
Використання їх супроводжується симптомами дефіциту естрогенів: приливами жару, сухістю у піхві, зниженням лібідо. Прийом агоністів ГнРГ може призвести до ятрогенного зниження мінеральної щільності кісткової тканини у зв’язку з дефіцитом естрогенів, що підвищує ризик остеопорозу, обме–жує термін застосування ГнРГ до 6 міс., потребує терапії «прикриття» естрогенами та для більшості препаратів виключає можливість проведення повторних курсів лікування. Побічні ефекти АГнРГ не завжди мають мають оборотний розвиток. Тому АГнРГ не повинні використовуватися без зворотної ГТ і призначаються як зворотна терапія ЛНГ-ВМС. В такому випадку АГнРГ можуть призначатися на більш тривалий час (більше 6 міс.).
Неспецифічна медикаментозна терапія, що включає НПЗЗ та КОК, в більшості країн офіційно не схвалена для лікування ендометріозу, однак застосовується в клінічній практиці, оскільки ці препарати можуть ефективно зменшувати больовий синдром при цьому захворюванні (рівень доказовості — 1b). НПЗЗ, у тому числі інгібітори циклооксигенази-2, можливо застосовувати при помірному болі, особливо при дисменореї. З іншого боку, використання НПЗЗ підвищує вірогідність побічних ефектів як у шлунково-кишковій, так і в серцево-судинній системах, а саме підвищення серцево-судинних ризиків при використанні більшості НПЗЗ, через що призначати ці лікарські препарати бажано короткими курсами.
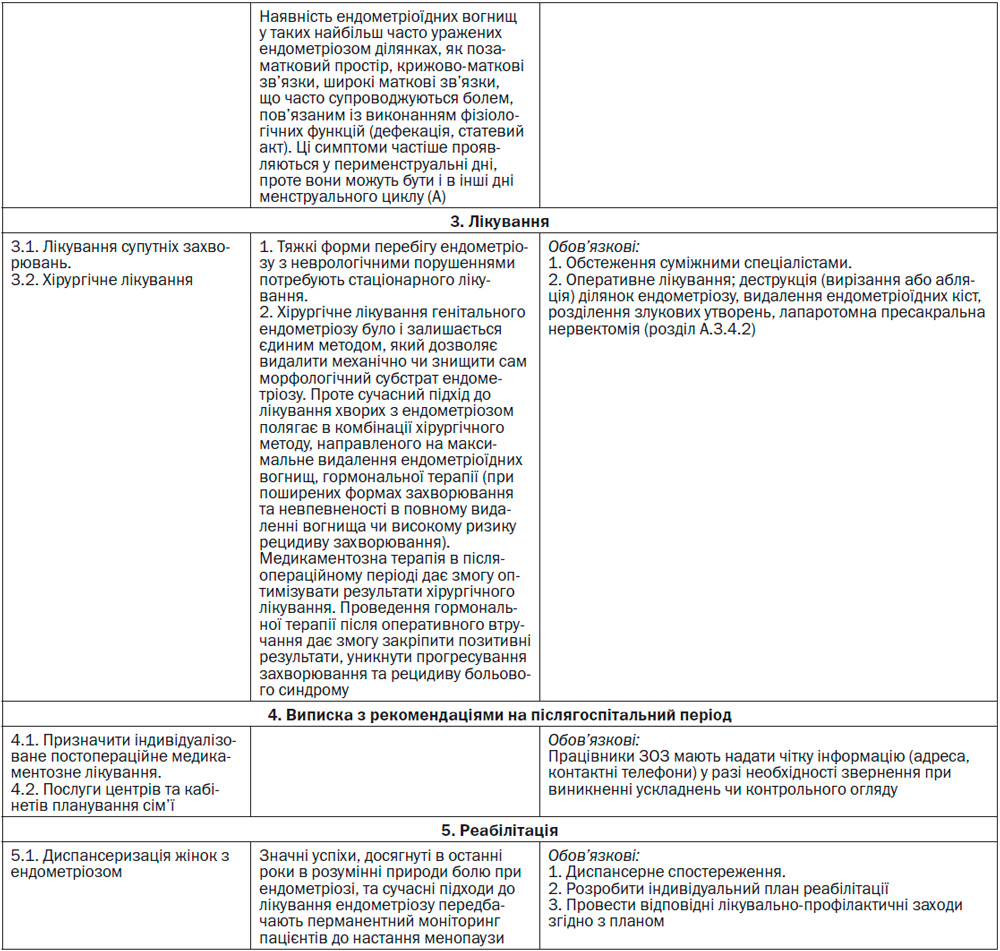
А.3.4.2 Хірургічне лікування
У разі проведення оперативного втручання (при більш тяжкому перебігу захворювання та за відсутності ефекту при проведенні медикаментозної терапії) найчастіше воно комбінується з медикаментозною терапією з метою запобігання рецидивам захворювання та повторним хірургічним процедурам.
Оптимальна тактика хірургічного лікування сьогодні — це ендоскопічне втручання за наявності інформованої згоди пацієнтки на можливе розширення об’єму операції у разі необхідності. При зовнішніх формах поширеного генітального ендометріозу операцію слід виконувати в багатопрофільних стаціонарах, оскільки хірургічний етап лікування може задіяти сечовий міхур, сечовивідники, пряму кишку та інші органи.
При підтвердженні діагнозу діагностичне оперативне втручання розширюють до лікувальної маніпуляції. Процедура, як правило, включає деструкцію (вирізання або абляцію) ділянок ендометріозу, видалення ендометріоїдних кіст, розділення злукових утворень. Лапароскопічне втручання у жінок, які страждають від безпліддя, асоційованого з ендометріозом, дозволяє виконати усі необхідні маніпуляції, пов’язані з іншими причинами безпліддя (міомектомія, поновлення прохідності маткових труб та ін.).
У питанні про вибір об’єму втручання останніми роками вважається, що навіть при поширених формах ендометріозу у жінок, зацікавлених у відновленні генеративної функції, необхідно дотримуватися принципів реконструктивно-пластичної консервативної хірургії і вдаватися до радикальних операцій тільки у тих випадках, коли вичерпані всі інші можливості як хірургічного, так і медикаментозного лікування.
При поширених і поєднаних формах ендометріозу з порушенням функцій чи ураженням ендометріозом сусідніх органів (сечоводи, кишечник, сечовий міхур), при великих розмірах ендометріоїдних кіст, поєднанні ендометріозу з іншими гінекологічними захворюваннями, для адекватного лікування яких необхідно застосовувати хірургічні методи, і в той же час відсутності умов для виконання операції в повному обсязі лапаро–скопічно методом вибору є лапаротомія.
Абсолютні показання (А):
— поєднання ГЕ із захворюваннями внутрішніх органів, що вимагає хірургічного втручання (пухлини яєчників, лейоміома матки, що швидко росте, тяжка дисплазія шийки матки, атипічна гіперплазія ендометрію);
— неефективність медикаментозного лікування;
— ендометріома яєчників понад 3 см у діаметрі.
— поєднання ГЕ із захворюваннями внутрішніх органів, що вимагає хірургічного втручання (пухлини яєчників, лейоміома матки, що швидко росте, тяжка дисплазія шийки матки, атипічна гіперплазія ендометрію);
— неефективність медикаментозного лікування;
— ендометріома яєчників понад 3 см у діаметрі.
Відносні показання: наявність «безсимптомної» лейоміоми матки у поєднанні з атиповою гіперплазією ендометрію у пацієнток віком молодше 40 років, ІІІ ступінь поширеності ГЕ.
Лікування хворих на перитонеальний ГЕ (ураження яєчників, маткових труб, зв’язкового апарату матки, очеревини) має бути комбінованим, тобто включати як хірургічне втручання, так і консервативну терапію.
У лікуванні даного контингенту хворих репродуктивного віку при наявності поодиноких поверхневих вогнищ доцільним є їх видалення з використанням кріо- або лазерної деструкції з подальшим кольпо–скопічним моніторингом та гормональною терапією. З цією метою небажане використання діатермокоагуляції, тому що вона сприяє рецидиву захворювання у кожної третьої пацієнтки.
Лапароскопічна хірургія може проводитися із застосуванням техніки електрокоагуляції, електрокаутеризації, ендокоагуляції, лазерного випромінювання.
Електрокоагуляція окремих ендометріоїдних вогнищ проводиться із застосуванням монополярних і біполярних електродів. Малі (менше 2 см) ендометріо–ми слід розрізати, евакуювати вміст, ретельно вилущувати оболонку пухлиноподібного утворення та/або коагулювати її ложе. Іноді з метою видалення ендометріоми виконують резекцію яєчника. Ендометріоїдні імплантати часто розміщуються поблизу життєво важливих органів, що створює певні труднощі при електрокоагуляції таких імплантатів через небезпеку пошкодження прилеглих органів та анатомічних структур. За показаннями можлива лапароскопічна коагуляція та в деяких випадках пересічення крижово-маткових зв’язок, що дозволяє зменшити больовий синдром. Такий об’єм оперативного втручання розглядають як альтернативу лапаротомній пресакральній нервектомії.
Ідеальною тактикою хірургічного лікування сьогодні є та, що направлена на попередження повторних хірургічних втручань.
А.4 Ресурсне забезпечення виконання протоколу
А.4.1 Вимоги для установ, які надають первинну медичну допомогу
А.4.1.1 Кадрові ресурси:
– Лікар загальної практики — сімейний лікар;
– Фельдшер;
– Акушерка;
– Медична сестра; помічник лікаря загальної практики — сімейного лікаря;
– Санітарка.
– Лікар загальної практики — сімейний лікар;
– Фельдшер;
– Акушерка;
– Медична сестра; помічник лікаря загальної практики — сімейного лікаря;
– Санітарка.
А.4.1.2 Матеріально-технічне забезпечення:
Приміщення:
– окреме приміщення для прийому та огляду пацієнток (де є проточна вода);
– санвузол, що відповідає санітарно-гігієнічним вимогам.
– окреме приміщення для прийому та огляду пацієнток (де є проточна вода);
– санвузол, що відповідає санітарно-гігієнічним вимогам.
Перелік необхідних медикаментів:
– медикаментів для надання ургентної допомоги (укладка ургентна);
– антибіотики широкого спектра дії (пеніцилінового та тетрациклінового ряду), протимікробні та протипротозойні засоби, похідні імідазолу (метронідазол);
– знеболювальні засоби (ібупрофен, парацетамол);
– утеротоніки (окситоцин, ергометрин);
– кровозамінники та перфузійні розчини
– медикаментів для надання ургентної допомоги (укладка ургентна);
– антибіотики широкого спектра дії (пеніцилінового та тетрациклінового ряду), протимікробні та протипротозойні засоби, похідні імідазолу (метронідазол);
– знеболювальні засоби (ібупрофен, парацетамол);
– утеротоніки (окситоцин, ергометрин);
– кровозамінники та перфузійні розчини
А.4.1.3 Інформаційне забезпечення:
Інформаційно-освітні матеріали з питань профілактики ендометріозу.
А.4.2 Вимоги для установ, які надають вторинну (третинну) медичну допомогу
А.4.2.1 Кадрові ресурси:
– лікар-акушер-гінеколог;
– лікар-анестезіолог;
– інші профільні спеціалісти при необхідності;
– медичний психолог;
– акушерка;
– медична сестра;
– сестра медична — анестезист;
– санітарка.
– лікар-акушер-гінеколог;
– лікар-анестезіолог;
– інші профільні спеціалісти при необхідності;
– медичний психолог;
– акушерка;
– медична сестра;
– сестра медична — анестезист;
– санітарка.
А.4.2.2 Матеріально-технічне забезпечення:
Приміщення:
– Засоби санітарного транспорту.
– Матеріально-технічне забезпечення, пропоноване на І рівні та додатково:
– Засоби санітарного транспорту.
– Матеріально-технічне забезпечення, пропоноване на І рівні та додатково:
А.5 Індикатори якості медичної допомоги (для оцінки ефективності етапів лікувально-діагностичного процесу)
1. Відсутність хронічного тазового болю.
2. Відсутність рецидиву після хірургічного лікування.
3. Вилікуване безпліддя.
4. Відсутність побічних явищ.
5. Відсутність ускладнень.
2. Відсутність рецидиву після хірургічного лікування.
3. Вилікуване безпліддя.
4. Відсутність побічних явищ.
5. Відсутність ускладнень.
Б. Бібліографія
1. Nap A.W., Groothuis P.G., Demir A.Y. et al. Pathogenesis of endometriosis // Best Pract. Res. Clin. Obstet. Gynaecol. 2004; 18: 233-244.
2. Garry R. The endometriosis syndromes: a clinical classification in the presence of aetiological confusion and therapeutic anarchy // Hum. Reprod. 2004; 19: 760-768.
3. Sampson J.A. Metastatic or embolic endometriosis due to menstrual dissemination of endometrial tissue into the venous circulation // Am. J. Pathol. 1927; 3: 93-109.
4. Osteen K.G., Sierra-Rivera E. Does disruption of immune and endocrine systems by environmental toxins contribute to development of endometriosis? // Semin. Reprod. Endocrinol. 1997; 15: 301-308.
5. Lucidi R.S., Witz C.A., Chrisco M. et al. A novel in vitro model of the early endometriotic lesion demonstrates that attachment of endometrial cells to mesothelial cells is dependent on the source of endometrial cells // Fertil. Ste–ril. 2005; 84: 16-21.
6. Beliard A., Noel A., Foidart J.M. Reduction of apoptosis and proliferation in endometriosis // Fertil. Steril. 2004; 82: 80-85.
7. Tseng J.F., Ryan I.P., Milam T.D. et al. Interleukin-6 secretion in vitro is up-regulated in ectopic and eutopic endometrial stromal cells from women with endometriosis // J. Clin. Endocrinol. Metab. 1996; 81: 1118-1122.
8. Noble L.S., Takayama K., Zeitoun K.M. et al. Prostaglandin E2 stimulates aromatase expression in endometriosis-derived stromal cells // J. Clin. Endocrinol. Metab. 1997; 82: 600-606; Wu Y., Kajdacsy-Balla A., Strawn E. et al. Transcriptional characterizations of differences between eutopic and ectopic endometrium // Endocrinology. 2006; 147: 232-246.
9. Kao L.C., Germeyer A., Tulac S. et al. Expression profiling of endometrium from women with endometriosis reveals candidate genes for disease-based implantation failure and infertility // Endocrinology. 2003; 144: 2870-2881.
10. Brandenberger A.W., Lebovic D.I., Tee M.K. et al. Oestrogen receptor (ER)-alpha and ER-beta isoforms in normal endometrial and endometriosis-derived stromal cells // Mol. Hum. Reprod. 1999; 5: 651-655.
11. Attia G.R., Zeitoun K., Edwards D. et al. Progesterone receptor isoform A but not B is expressed in endometriosis // J. Clin. Endocrinol. Metab. 2000; 85: 2897-2902.
12. Xue Q., Lin Z., Cheng Y.H. et al. Promoter methylation regulates estrogen receptor 2 in human endometrium and endometriosis // Biol. Reprod. 2007; 77: 681-687.
13. Olive D.L., Pritts E.A. Treatment of endometriosis // N. Engl. J Med. 2001; 345: 266-275.
14. Bulun S.E., Lin Z., Imir G. et al. Regulation of aromatase expression in estrogenresponsive breast and uterine disease: from bench to treatment // Pharmacol. Rev. 2005; 57: 359-383.
15. Bulun S.E., Zeitoun K.M., Takayama K. et al. Molecular basis for treating endometriosis with aromatase inhibitors // Hum. Reprod. Update. 2000; 6: 413-418.
16. Bulun S.E., Gurates B., Fang Z. et al. Mechanisms of excessive estrogen formation in endometriosis // J. Reprod. Immunol. 2002; 55: 21-33.
17. Bukulmez O., Hardy D.B., Carr B.R. et al. Inflammatory status influences aromatase and steroid expression in endometriosis // Endocrinology. 2008; 149: 190-1204.
18. Bulun S.E. Endometriosis // N. Engl. J. Med. 2009; 360: 268-279.
19. Давыдов А.И., Пашков В.М. Генитальный эндометриоз: нерешенные вопросы // Вопр. гинекол., акуш. и перинатол. 2003; 2, 4: 53-60.
20. Адамян Л.В., Яроцкая Е.Л., Чупрынин В.Д. Со–временный взгляд на проблему эндометриоза. — М.: Медицина, 2004; 3, 6: 21-27.
21. Latthe P., Latthe M., Say L., Gulmezoglu M., Khan K.S. WHO systematic review of prevalence of chronic pelvic pain: a neglected reproductive health morbidity // BMC Public Health. 2006; 6: 177-184.
22. Treatment of pelvic pain associated with endometriosis. Practice Committee of the American Society for Reproductive Medicine // Fertil. Steril. 2008; 90: 260-269.
23. Giudice L.N. Endometriosis // Engl. J. Med. 2010; 362: 2389-2398.
24. Giudice L.C., Bulun S.E. Endometriosis // N. Engl. J. Med. 2009; 360: 268-279.
25. Berkley K.J., Rapkin A.J., Papka R.E. The pains of endometriosis // Science. 2005; 308: 1587-1589.
26. Tokushige N., Markham R., Russell P., Fraser I.S. Different types of small nerve fibers in eutopic endometrium and myometrium in women with endometriosis // Fertil. Steril. 2007; 88, 4: 795-803.
27. Al-Jefout M., Dezarnaulds G., Cooper M., Tokushige N. et al. Diagnosis of endometriosis by detection of nerve fibres in an endometrial biopsy: a double blind study // Hum. Reprod. 2009; 24, 12: 3019-3024.
28. Bokor K.C.A., Vercruysse L., Fassbender A., Gevaert O. et al. Density of small diameter sensory nerve fibres in endometrium: a semiinvasive diagnostic test for minimal to mild endometriosis // Human Reproduction. 2009; 24, 12: 3025-3032.
29. Stratton P., Berkley K.J. Chronic pelvic pain and endometriosis: translational evidence of the relationship and implications // Hum. Reprod Update. 2011; 17, 3: 327-324.
30. Latthe P., Latthe M., Say L., Gulmezoglu M., Khan K.S. WHO systematic review of prevalence of chronic pelvic pain: a 33 neglected reproductive health morbidity // BMC Public Health. 2006; 6: 177-184.
31. Flor H., Turk D.C. eds. Chronic pain: An Integrated Biobehavioral Approach. — London: Informa Healthcare Publishing Group, 2011.
32. Latthe P., Latthe M., Say L., Gulmezoglu M., Khan K.S. WHO systematic review of prevalence of chronic pelvic pain: a neglected reproductive health morbidity // BMC Public Health. 2006; 6: 177-184.
33. Treatment of pelvic pain associated with endometriosis. Practice Committee of the American Society for Reproductive Medicine // Fertil Steril 2008; 90: 260-269.
34. American College of Obstetricians and Gynecologists (ACOG). Chronic pelvic pain. Washington (DC): American College of Obstetricians and Gynecologists (ACOG); 2004.
35. ACOG practice bulletin; no. 51; Beutel M.E., Weidner K., Brähler E. Chronic pelvic pain of Women and its Co-Morbidity // Geburtsh. Frauenheilk. 2005; 65: 61-67.
36. Nisenblat V., Print C., Evans S., Ohlsson-Teague M. et al. A unique plasma micro-RNA expression profile is identified in women with endometriosis. 11th World Congress on Endometriosis, 4–7 september, 2011; 2-144: 115.
37. Marwick C. Proponents Gather to Discuss Practi–cing Evidence-Based Medicine // Journal of the American Medical Association. 1997.
38. Geddes J. et al. British Journal of Psychiatry 1997; 171: 220-225; Sitruk-Ware R. New progestogens for contraceptive use // Hum. Reprod. Update. — 2006. — № 12. — Р. 169-178.
39. Sinaii N., Cleary S.D., Younes N. et al. Treatment utilizationfor endometriosis symptoms: a cross-sectional survey study of lifetime experience // Fertil. Steril. — 2007. — № 87. — Р. 1277-1286.
40. Winkel C.A., Scialli A.R. Medical and surgical therapies for pain associated with endometriosis // J. Women’s Health Gender-Based Med. —2001. — № 10. — Р. 137-162.
41. Sitruk-Ware R. New progestogens for contraceptive use // Hum. Reprod. Update. — 2006. — № 12. — Р. 169-178.
42. Krattenmacher R. Drospirenone: pharmacology and pharmacokinetics of a unique progestogen // Contraception — 2000. — № 62. — Р. 29-38.
43. Kohler G., Faustmann T.A., Gerlinger C. et al. A dose-ranging study to determine the efficacy and safety of 1, 2 and 4 mg of dienogest daily for endometriosis // Int. J. Gynaecol. Obstet. — 2010. — № 108. — Р. 21-25.
44. Shimizu Y et al. Dienogest, a synthetic progestin, inhibits the proliferation of immortalized human endometrial epithelial cells with suppression of cyclin D1 gene expression // Mol. Hum. Reprod. — 2009. — № 15, Vol. 10. — Р. 693-701.
45. Vercellini P. et al. Progestogens for endometriosis: forward to the past // Hum. Reprod. Update. — 2003. — № 9, Vol. 4. — Р. 387-396.
46. Katsuki Y. et al. Effects of dienogest, a synthetic steroid, on experimental endometriosis in rats // Eur. J. Endocrinol. — 1998. — № 138, Vol. 2. — Р. 216-226.
47. Katsuki Y. et al. Animal studies on the endocrinological profile of dienogest, a novel synthetic steroid // Drugs. Exp. Clin. Res. — 1997. — № 23, Vol. 2. — Р. 45-62.
48. Nakamura M. et al. Dienogest, a synthetic steroid, suppresses both embryonic and tumor-cell-induced angiogenesis // Eur. J. Pharmacol. — 1999. — № 386, Vol. 1. — Р. 33-40.
49. Okada H. et al. The inhibitory effect of dienogest, a synthetic steroid, on the growth of human endometrial stromal cells in vitro // Mol. Hum. Reprod. — 2001. — № 7, Vol. 4. — Р. 341-347.
50. Oettel M., Carol W., Elger W. A 19-norprogestin without 17α-ethinyl group II: dienogest from a pharmacodynamic point of view // Drugs Today. — 1995. — № 31. — Р. 517-536.
51. Sasagawa S., Shimizu Y., Kami H. et al. Dienogest is a selective progesterone receptor agonist in transactivation analysis with potent oral endometrial activity due to its efficient pharmacokinetic profile // Steroids. — 2008. — № 73. — Р. 222-231.
52. Strowitzki T., Marr J., Gerlinger C., Faustmann T., Seitz C. Dienogest is as effective as leuprolide acetate in treating the painful symptoms of endometriosis: a 24-week, randomized, multicentre, open-label trial // Hum. Reprod. — 2010. — № 25. — Р. 633-641.
53. Gerlinger C., Endrikat J., Kallischnigg G., Wessel J. Evaluation of menstrual bleeding patterns: a new proposal for a universal guideline based on the analysis of more than 4500 bleeding diaries // Eur. J. Contracept. Reprod. Health Care. — 2007. — № 12. — Р. 203-211.
54. Harada T. Apoptosis in human endometrium and endometriosis // Human Reproduction Updat. — 2004. — Vol. 10, № 1. — P. 29-38.
55. Hassa H. Apoptosis patterns in eutopic and ectopic endometrium, adhesions and normal-looking peritoneum from women with or without endometriosis// Arch. Gynecol. Obstet. — 2009. — Vol. 280, № 2. — P. 195-199.
56. Honung D., Chao V.A., Vigne J.L., Wallwiener D., Taylor R.N. Thiazolidinedione inhibition of peritoneal inflammation // Ginecol. Obstet. Invest. — 2003. — Vol. 55. — P. 20-24.
57. Bullimore D.W. Endometriosis is sustained by tumour necrosis factor-alpha // Med. Hipotheses. — 2003. — Vol. 60. — P. 84-88.
58. Garcia-Velasco J.A., Arici A., Zreik T., Noftolin F., Mor G. Macrophage derived factors modulate Fas Ligand expression in cultured endometrial stromal cells: a role in endometriosis // Mol. Hum. Reprod. — 1999. — Vol. 5. — P. 642-650.
Чинні накази МОЗ України станом на 01.04.2014 року
1. Наказ МОЗ № 620 від 29.12.2003 «Про організацію надання стаціонарної акушерсько-гінекологічної та неонатологічної допомоги в Україні».
2. Наказ МОЗ № 302 від 27.12.1999 «Про затвердження форм облікової статистичної документації, що використовується в поліклініках (амбулаторіях)».
3. Наказ МОЗ № 184 від 26.07.1999 «Про затвердження форм облікової статистичної документації, що використовується в стаціонарах лікувально-профілактичних закладів».
4. Наказ МОЗ № 67 від 13.02.2006 «Про затвердження форм первинної облікової документації в закладах, що надають медичну допомогу вагітним, роділлям та породіллям, та інструкцій щодо їх заповнення».
2. Наказ МОЗ № 302 від 27.12.1999 «Про затвердження форм облікової статистичної документації, що використовується в поліклініках (амбулаторіях)».
3. Наказ МОЗ № 184 від 26.07.1999 «Про затвердження форм облікової статистичної документації, що використовується в стаціонарах лікувально-профілактичних закладів».
4. Наказ МОЗ № 67 від 13.02.2006 «Про затвердження форм первинної облікової документації в закладах, що надають медичну допомогу вагітним, роділлям та породіллям, та інструкцій щодо їх заповнення».