Газета «Новости медицины и фармации» 16 (559) 2015
Вернуться к номеру
Рекомендации по урологическим инфекциям (Европейская ассоциация урологов, 2015)
Авторы: проф. Д.Д. Иванов, к.м.н. М.Д. Иванова
Рубрики: Семейная медицина/Терапия, Нефрология, Терапия, Урология
Разделы: Медицинское образование
Версия для печати
Статья опубликована на с. 30-32 (Укр.)
Мета
Наведені настанови мають за мету забезпечення урологів і лікарів інших медичних спеціальностей доказовими вказівками щодо лікування і профілактики інфекцій сечовивідних шляхів (ІСШ). Настанови включають ІСШ у чоловіків і жінок, генітальні інфекції у чоловіків та спеціальні розділи: ІСШ у дитячій урології та за наявності певних факторів ризику, наприклад імуносупресії, ниркової недостатності і цукрового діабету. Велика увага приділяється перед–операційній антибактеріальній профілактиці з метою зменшення надмірного застосування антимікробних агентів при хірургічних втручаннях. У поданих настановах використані дослідження високої якості із залученням міжнародно визнаних положень і класифікацій.
3C.3. Гострий епізод неускладненого циститу (нижня ІСШ) у дорослих
3C.3.1. Діагностика
3C.3.1.1. Клінічний діагноз
Наявність великої ймовірності гострого неускладненого циститу діагностується на підставі анамнестичної наявності симптомів із боку нижніх сечових шляхів (дизурія, збільшення кількості сечовипускань і ургентність) за відсутності вагінальних виділень або подразнення (вульви) у тих жінок, які не мають жодних інших факторів ризику для ускладненої ІСШ [52, 63] (рівень доказовості 2a, GR: В). У жінок літнього віку симптоми сечостатевої системи не обов’язково пов’язані з ІСШ [55].
У пацієнтів із цукровим діабетом зі стабільним глікемічним метаболізмом наявність епізодичного або навіть рецидивного циститу також можна розглядати як неускладнену ІСШ. Проте в довгостроковому спостереженні було помічено, що в пацієнтів із цукровим діабетом може розвинутись нейропатичний міхур із порушенням сечовипускань, що може бути відповідним ускладнюючим фактором [57].
У здорових пацієнтів із незначною та помірною нирковою недостатністю без інших структурних та функціональних порушень сечових шляхів і нирок спорадичний або рецидивуючий цистит також може розглядатися як неускладнений.
3C.3.1.2. Диференціальна діагностика
Симптомну ІСШ слід диференціювати з безсимптомною бактеріурією, що вважається не інфекцією, а синантропною колонізацією і, як правило, не повинна лікуватися, а отже, не підлягає скринінгу, за винятком випадків, якщо це вважається фактором ризику в особливих ситуаціях (див. розд. 3B).
3C.3.1.3. Лабораторна діагностика
Аналіз сечі за тест-смужкою на відміну від мікроскопії сечового осаду є доцільною альтернативою культуральному дослідженню в діагностиці гострого неускладненого циститу [64, 65] (рівень доказовості 2а, GR: В).
Дослідження культури сечі рекомендується в таких випадках:
— підозра на гострий пієлонефрит;
— симптоми, що не усунені або повторюються протягом 2–4 тижнів після завершення лікування;
— жінки з атиповими симптомами [66, 67];
— вагітні жінки і чоловіки з підозрою на ІСШ (рівень доказовості 4, GR: В).
Наявність понад 103 КУО/мл уропатогенів є мікробіологічно діагностично значущою ознакою для жінок із симптомами гострого неускладненого циститу [68] (рівень доказовості 3, GR: В).
Жінки з атиповими симптомами, гострим неускладненим циститом або гострим неускладненим пієлонефритом, а також ті, які не реагують на відповідну антимікробну терапію, повинні розглядатись як кандидати для додаткових діагностичних досліджень (рівень доказовості 4, GR: В).
Урологічне обстеження, включаючи ректальне, завжди повинно проводитися в чоловіків для виключення відповідних ускладнюючих факторів (рівень доказовості 4, GR: А).
3C.3.2. Супровід хвороби
Рекомендується антибактеріальна терапія на підставі, що клінічний успіх значно більший у жінок, які отримували антибіотики, порівняно з прийомом плацебо [69] (рівень доказовості 1a, GR: А). У виборі антибактеріальної терапії слід керуватися [52]:
— спектром і культуральною чутливістю етіологічних уропатогенів;
— ефективністю щодо конкретних показань згідно з клінічними дослідженнями;
— переносимістю та побічними реакціями;
— наявністю можливих несприятливих екологічних наслідків;
— вартістю;
— наявністю.
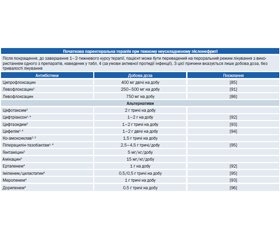
Відповідно до цих принципів і доступних у Європі даних щодо чутливості фосфоміцину трометамол 3 г одноразово, півмецилінам 400 мг три рази на добу протягом 3 днів і нітрофурантоїн макрокристали 100 мг два рази на добу протягом 5 днів вважаються препаратами першого вибору, якщо є доступними [70, 72] (рівень доказовості 1a, GR: A) (табл. 3).
Ці схеми рекомендовані для жінок, але не для чоловіків. Більшість широкого спектра β-лактамазопродукуючих E.coli все ще чутливі до фосфоміцину. Проте в Іспанії спостерігається одночасне збільшення використання фосфоміцину і зростання стійкості до нього β-лактамазопродукуючих E.coli [73].
Альтернативні антибіотики включають триметоприм або його поєднання з сульфонамідом і фторхінолони. Ко-тримоксазол (160/800 мг два рази протягом 3 днів) або триметоприм (200 мг протягом 5 днів) слід розглядати лише як препарати першого вибору в районах із відомим рівнем резистентності для кишкової палички в < 20 % [74, 75] (рівень доказовості 1b, GR: В). Незважаючи на наявний нижчий рівень резистентності в деяких регіонах, фторхінолони не вважаються препаратами першого ряду вибору через несприятливі побічні ефекти, включаючи негативні екологічні наслідки та формування резистентності (табл. 3).
Амінопеніциліни більше не підходять для емпіричної терапії через наявність світових даних про високу резистентність Е.coli до такого лікування. Амінопеніциліни в поєднанні з інгібітором бета-лактамаз, такі як ампіцилін/сульбактам або амоксицилін/клавуланова кислота і пероральні цефалоспорини загалом не такі ефективні, як короткострокова терапія, і не рекомендуються для емпіричної терапії через додаткові екологічні наслідки, але можуть бути використані в окремих випадках [76, 77].
Короткі курси антибактеріальної терапії також можуть розглядатися для лікування циститу у вагітних [78] (рівень доказовості 1a, GR: А), але не всі антибіотики придатні для вагітних. Загалом пеніциліни, цефалоспорини, фосфоміцин, нітрофурантоїн (не у випадку дефіциту Г6ФДГ і у кінці вагітності), триметоприм (не в першому триместрі) і сульфаніламіди (не в останньому триместрі) можуть розглядатись для лікування вагітних.
Чоловікам рекомендується тривалість лікування не менше 7 днів, бажано призначення ТМТ-СМК або фторхінолону з урахуванням результату тесту на чутливість (рівень доказовості 4, GR: В).
У пацієнтів із нирковою недостатністю вибір антимікробних препаратів базується на можливому зниженні рівня ниркової екскреції. Проте більшість антибіотиків мають широкий терапевтичний індекс. Корекція дози не потрібна до моменту досягнення рівня ШКФ < 20 мл/хв за винятком антибіотиків із нефротоксичною дією, наприклад аміноглікозидів. Поєднання діуретиків (наприклад, фуросеміду) і цефалоспоринів є нефротоксичним. Нітрофурантоїн і тетрациклін протипоказані, проте доксициклін може застосовуватись.
3C.3.3. Подальше спостереження
Після лікування проведення рутинних аналізів сечі або культуральних досліджень у безсимптомних пацієнтів не показане [27] (рівень доказовості 2b, GR: В) за винятком вагітних жінок, якщо у них зберігається безсимптомна бактеріурія (див. розд. 3B.5.3). У жінок, у яких симптоми не зникли до кінця лікування, і у випадках, коли симптоми ліквідувались, але повторюються протягом 2 тижнів, культуральне дослідження сечі з визначенням чутливості до антибіотиків повинне бути виконане (рівень доказовості 4, GR: В). В оцінці ефективності терапії в цій ситуації слід врахувати, що причинний мікроорганізм не був чутливий до агента, який спочатку використовувався. Слід розглянути необхідність повторного 7-денного режиму терапії з використанням іншого (протимікробного) агента (рівень доказовості 4, GR: С).
3C.4.1. Діагностика
3C.4.1.1. Клінічний діагноз
Підозра на гострий пієлонефрит виникає за наявності болю в поперековій ділянці, нудоти та блювоти, лихоманки (> 38 °C) або підвищення чутливості в реберно-хребетному куті, що може спостерігатися й за відсутності симптомів циститу [79].
Вагітні жінки з гострим пієлонефритом потребують особливої уваги з причини негативного впливу інфекції на матір із наявною анемією, нирковою або дихальною недостатністю, а також можливого впливу на ненароджену дитину з більшою частотою передчасного розродження і передчасних пологів [80].
Більшість чоловіків із фебрильною ІСШ мають супутню інфекцію простати, що характеризується оборотним збільшенням її розмірів та значень ПСА [81]. Таким чином, урологічна оцінка повинна проводитися на регулярній основі у чоловіків із фебрильною ІСШ, пієлонефритом, рецидивуючою ІСШ або щоразу, коли є підозра на наявність ускладнюючого фактора (рівень доказовості 4, GR: А).
Пацієнти з діабетом і гострим пієлонефритом на тлі метаболічних порушень, наприклад, гіпо- та гіперглікемії, гіперосмолярної дегідратації або кетоацидозу, потребують особливої уваги [57]. У хворих на цукровий діабет може виникнути прогресування інфекції паренхіми нирок, іноді викликане газотвірними організмами, що супроводжується високою смертністю (емфізематозний пієлонефрит) і характеризується гістологічно гострим гнійним інфільтратом з мікроабсцесами та розвитком гострої ниркової недостатності [82].
Походження організмів може бути гематогенним. Інтраренальні абсцеси можуть розриватися, що призводить до перинефриту й поперекового абсцесу, що іноді може бути прихованим. Папілярний некроз притаманний хворим на цукровий діабет, особливо в поєднанні з гострим пієлонефритом, призводить до рубцювання паренхіми нирок. Іноді складно виключити обструкцію з причини відшарування епітелію сосочків, що є причиною нефропатії.
Ризик розвитку хронічної хвороби нирок і ниркової недостатності, викликаної пієлонефритом, є низьким. Наявність міхурово-уретрального рефлюкса, зловживання знеболюючими, сечокам’яна хвороба та обструкція сечовивідних шляхів повинні бути визначені як причинні фактори. Проте гостра бактеріальна інфекція, у тому числі пієлонефрит, може суттєво впливати на прогресування хронічної ниркової недостатності, і, навпаки, хронічна ниркова недостатність може змінити активність інфекції [58].
3C.4.1.2. Диференціальна діагностика
Використовуючи відповідну візуалізацію, вкрай важливо в ранні строки розрізняти гострий неускладнений і ускладнений, в основному обструктивний, пієлонефрит, оскільки останній може дуже швидко призвести до уросепсису.
3C.4.1.3. Лабораторна діагностика
Для рутинної діагностики рекомендується загальний аналіз сечі (наприклад, за допомогою тест-смужок) з оцінкою кількості лейкоцитів, еритроцитів і нітратної реакції [83] (рівень доказовості 4, GR: C). Наявність уропатогенів понад 104 КУО/мл вважається клінічно значущою бактеріурією [84] (рівень доказовості 2b, GR: C).
3C.4.1.4. Візуалізаційна діагностика
Для виключення непрохідності сечових шляхів або сечокам’яної хвороби повинно проводитись ультразвукове дослідження (УЗД) верхніх сечових шляхів (рівень доказовості 4, GR: C). Додаткові дослідження, такі як неконтрастна спіральна комп’ютерна томографія (КТ), екскреторна урографія або сцинтиграфія з димеркаптосукциновою кислотою (DMSA) слід вважати доцільними, якщо у пацієнта зберігається фебрильна температура після 72 годин лікування (рівень доказовості 4, GR: C). Для діагностики ускладнюючих факторів у вагітних жінок повинні переважно використовуватись УЗД або магнітно-резонансна томографія (МРТ) для уникнення радіаційного ризику плода (рівень доказовості 4, GR: В).
3C.4.2. Супровід хвороби
З причини відсутності відповідних досліджень наявність і культуральна чутливість уропатогенів, що викликають неускладнений цистит, можуть бути обґрунтуванням для емпіричної терапії [62] (рівень доказовості 4, GR: В). Разом із тим S.saprophyticus зустрічається рідше при гострому пієлонефриті порівняно з гострим циститом (рівень доказовості 4, GR: В).
3C.4.2.1. Легкі й помірно тяжкі випадки
При легких і середньої тяжкості випадках гострого неускладненого пієлонефриту (табл. 4), тривалість пероральної терапії протягом 10–14 днів зазвичай є достатньою (рівень доказовості 1b, GR: В). 7–10-денний прийом фторхінолонів може бути рекомендований як терапія першої лінії, якщо резистентність кишкової палички становить < 10 % [85] (рівень доказовості 1b, GR: А).
Якщо доза фторхінолонів збільшується, лікування, ймовірно, може бути скорочене до 5 днів [86, 87] (рівень доказовості 1b, GR: B). Однак у суспільстві виявляється все більша кількість фторхінолон-резистентних штамів кишкової палички в деяких частинах світу, що обмежує емпіричне використання фторхінолонів; також фторхінолони протипоказані під час вагітності.
Пероральні цефалоспорини третього покоління, такі як цефподоксиму проксетил або цефтибутен, можуть бути альтернативою [88, 89] (рівень доказовості 1b, GR: В). Однак наявні дослідження показали тільки еквівалент клінічної, але не мікробіологічної ефективності порівняно з ципрофлоксацином.
У результаті збільшення рівня резистентності кишкової палички > 10 % ко-тримоксазол не підходить для емпіричної терапії в більшості випадків, але може бути використаний після підтвердження чутливості за допомогою відповідного тесту [90] (рівень доказовості 1b, GR: В).
Ко-амоксиклав не рекомендується як препарат першого вибору для емпіричної пероральної терапії гострого пієлонефриту (рівень доказовості 4, GR: В). Він рекомендується при встановленні чутливих грампозитивних організмів за результатами тестування (рівень доказовості 4, GR: С).
У популяціях із високим рівнем резистентності E.coli до фторхінолонів і β-лактамів широкого спектра (> 10 %) може розглядатись початкова емпірична терапія аміноглікозидами або карбапенемами, за отриманими результатами тестів на чутливість оцінюється можливість використання також пероральних форм препаратів (рівень доказовості 4, GR: В).
3C.4.2.2. Тяжкі випадки
Пацієнти з тяжким пієлонефритом, які не можуть приймати пероральні препарати у зв’язку з наявністю системних симптомів, таких як нудота і блювота, повинні лікуватися спочатку одним із парентеральних антибіотиків (табл. 5).
Госпіталізація повинна бути розглянута, якщо ускладнюючі фактори не можуть бути виключені шляхом доступних діагностичних процедур та/або пацієнт має клінічні ознаки й симптоми сепсису (рівень доказовості 4, GR: B).
Після поліпшення пацієнт може бути переведений на пероральний прийом одного з антибактеріальних препаратів, зазначених у табл. 4, якщо він проявляє активність щодо збудника, для завершення 1–2-тижневого курсу терапії (рівень доказовості 1b, GR: В).
У вагітних жінок із пієлонефритом може бути розглянуте лікування амбулаторно із застосуванням відповідних антибіотиків за умови, що симптоми слабко виражені і можливо забезпечити їх ретельне спостереження [97, 98] (рівень доказовості 1b, GR: А).
У тяжчих випадках пієлонефриту зазвичай показана госпіталізація і підтримуюча терапія. Після клінічного поліпшення парентеральне лікування може бути змінене на пероральне із загальною тривалістю лікування 7–10 днів (рівень доказовості 4, GR: В).
У чоловіків із фебрильною ІСШ, пієлонефритом, повторною інфекцією або за наявності ускладнюючого фактора пропонується мінімальна тривалість лікування 2 тижні, переважно фторхінолонами, оскільки зазвичай спостерігається залучення передміхурової залози [99] (рівень доказовості 2a, GR: В).
3C.4.3. Подальше спостереження
Рутинні аналізи сечі після лікування за відсутності наявних симптомів у пацієнтів можуть не призначатись (рівень доказовості 4, GR: C) за винятком вагітних жінок, якщо зберігається безсимптомна бактеріурія (див. розділ 3B.5.3).
Пацієнтам, у яких симптоми пієлонефриту не зменшуються протягом 3 днів або рецидивують після ремісії ІСШ протягом 2 тижнів, рекомендовано провести повторний посів сечі з визначенням чутливості до антибіотиків та провести відповідні дослідження, такі як УЗД нирок, КТ або сцинтиграфія нирок (рівень доказовості 4, GR: В).
У пацієнтів без урологічних порушень можливо припустити, що інфекційний агент не був чутливий до раніше призначеного медикаменту й альтернативне лікування повинно бути призначене на підставі результатів культурального посіву (рівень доказовості 4, GR: В).
Для пацієнтів із рецидивом інфекції з тим же збудником діагноз неускладненого пієлонефриту має бути переглянутий. У таких випадках необхідні відповідні діагностичні заходи для виключення будь-яких ускладнюючих факторів (рівень доказовості 4, GR: C).
3C.5. Повторні неускладнені ІСШ у дорослих жінок
3C.5.1. Діагностика
Повторні ІСШ поширені серед молодих здорових жінок, незважаючи на загалом нормально анатомічно і фізіологічно сформовані сечовивідні шляхи[100] (рівень доказовості 2a). Загальні фактори ризику наведені в табл. 2.
Повторні ІСШ повинні бути діагностовані за допомогою посіву сечі (рівень доказовості 4, GR: А). Візуалізація верхніх сечовивідних шляхів і цистоскопія не рекомендується як рутинна оцінка повторних ІСШ у жінок [101] (рівень доказовості 1b, GR: В), але повинні бути виконані без зволікання в атипових випадках. Крім того, слід виключити наявність залишкової сечі (рівень доказовості 4, GR: В).
Повторні ІСШ у чоловіків не включені в наведену настанову, оскільки вони можуть бути ознакою загострення хронічного бактеріального простатиту (див. частину 3I). Крім того, серед можливих інших сюди не включені рецидивуючі ІСШ через ускладнюючі урологічні фактори, такі як наявні сечові катетери, сечокам’яна хвороба та неврологічні порушення спорожнення сечового міхура.
3C.5.2. Супровід хвороби і подальше спостереження
Профілактика ІСШ включає: 1) зміну способу життя та запобігання факторам ризику; 2) неантимікробні заходи; 3) антимікробну профілактику, що повинна бути виконана у відповідному порядку. Урологічні фактори ризику повинні бути розглянуті й усунені, наскільки це можливо. Надмірна залишкова сеча повинна бути оптимально пролікована, що також включає стерильну переривчасту катетеризацію за необхідності.
3C.5.2.1. Фактори ризику та поведінкові зміни
Ряд заходів, таких як споживання рідини та звички особистої гігієни (наприклад, зменшення споживання рідини, звичайне і посткоїтальне відстрочення сечовипускання, витирання після дефекації у напрямку ззаду наперед, спринцювання, тісна білизна) були запропоновані як такі, що збільшують ризик ІСШ. Разом із тим дослідження цих факторів ризику задокументували відсутність зв’язку з рецидивною ІСШ.
У молодих здорових жінок статевий акт є фактором ризику, що найбільше загрожує рецидивами ІСШ. Інші фактори — використання сперміциду, новий сексуальний партнер, наявність ІСШ в анамнезі матері, перенесені ІСШ в дитячому віці.
Найбільш поширені фактори ризику у жінок у постменопаузі наведені в табл. 2. Існує дедалі більше доказів, що ІСШ у дітей і дорослих пов’язані з генетичними мутаціями, що уражають вроджений імунітет [54].
3C.5.2.2. Неантимікробна профілактика
Є багато неантипротимікробних заходів, що рекомендовані для рецидивних ІСШ, але, згідно з результатами належно спланованих досліджень, лише мала їх кількість може бути підґрунтям для формування рекомендацій [102, 103].
Гормональна замісна терапія
У жінок у постменопаузі місцеві вагінальні замінники естрогену (але не пероральні форми) показали можливість запобігання рецидивам ІСШ, але в 6–20 % жінок спостерігалось вагінальне подразнення [103, 104] (рівень доказовості 1b, GR: C).
Імуноактивна профілактика
ОМ-89 (Uro-Vaxom®) досить добре себе зарекомендував і показав більшу ефективність порівняно з плацебо у декількох рандомізованих клінічних випробуваннях із задовільним профілем безпеки. Таким чином, він може бути рекомендований для імунопрофілактики в жінок із рецидивними неускладненими ІСШ [103, 105, 106] (рівень доказовості 1a, GR: B). Ефективність в інших групах пацієнтів і співвідношення ефективності з антибіотикопрофілактикою лишається невстановленою.
Вагінальна вакцина Urovac® дещо знижує ризик рецидиву ІСШ і первинна імунізація з подальшою повторною імунізацією пролонгує час до наступного епізоду інфекції [103] (рівень доказовості 1a, GR: C).
Для парентеральних імунотерапевтичних продуктів на ринку досі бракує великих досліджень третьої фази. У невеликих двофазових дослідженнях StroVac® і Solco-Urovac® показано ефективність при введенні повторної дози того самого препарату (рівень доказовості 1a, GR: C).
Для інших імунотерапевтичних продуктів немає контрольованих досліджень. Таким чином, формування рекомендацій неможливе.
Профілактика пробіотиками (Lactobacillus)
На даний момент не всі пробіотики, клінічна ефективність яких і в профілактиці ІСШ була доведена, стандартизовано доступні. Тільки штами Lactobacillus, що були перевірені дослідженнями, можуть бути розглянуті для профілактики.
За наявності у продажі доцільно розглянути використання інтравагінальних пробіотиків, що містять L.rhamnosus GR-1 і L.reuteri RC-14 для запобігання рецидивним ІСШ [107], ці продукти можуть бути використані один або два рази на тиждень (рівень доказовості 4, GR: С). В одному з досліджень вагінальне застосування Lactobacillus crispatus зменшувало частоту рецидивів ІСШ у пременопаузі, тому препарат також може застосовуватися [108] (рівень доказовості 1b, GR: В).
Щоденне пероральне вживання продукту зі штамами GR-1 і RC-14 потребує перевірки, враховуючи, що препарат відновлює нормальну флору піхви, бореться з патогенами сечостатевої системи та запобігає бактеріальному вагінозу, що збільшує ризик ІСШ [102]. Проте профілактика пероральним прийомом лактобактерій не знижує ризик повторного виникнення ІСШ [103], тому формування рекомендацій неможливе.
Загалом зведені дані з метааналізів наявних рандомізованих клінічних досліджень не показують переконливу перевагу продуктів лактобактерій для профілактики рецидиву ІСШ. Однак відмінності в ефективності між наявними препаратами вказують на необхідність подальших випробувань, доки будь-яка рекомендація щодо використання може бути створена.
Рекомендація: не використовуйте препарати поза дослідженнями.
Профілактика журавлиною
Попередні обмежені дослідження припустили, що журавлина (Vaccinium macrocarpon) корисна у зниженні кількості ІСШ нижніх сечових шляхів у жінок [109, 110]. Останній метааналіз 24 досліджень, що складається загалом із 4473 учасників, показав, однак, що продукти журавлини не зменшили виникнення симптоматики ІСШ значною мірою в цілому або для будь-якої з таких підгруп: діти з рецидивними ІСШ, літні люди, жінки з рецидивними ІСШ, вагітні жінки, хворі на рак, люди з нейропатією сечового міхура чи пошкодженням спинного мозку [111]. У зв’язку з цими суперечливими результатами рекомендації щодо щоденного споживання продуктів журавлини безпідставні.
Профілактика D-манозою
У нещодавньому рандомізованому плацебо-контрольованому несліпому клінічному дослідженні було показано, що добова доза d-манози 2 г значно перевершила плацебо і за ефективністю прирівнюється до 50 мг нітрофурантоїну в запобіганні рецидивуючим ІСШ [112]. Це показово, але недостатньо для формування рекомендацій.
D-маноза на даний час повинна використовуватись тільки в рамках високоякісних клінічних досліджень.
Внутрішньоміхурові інстиляції
Внутрішньоміхурові інстиляції гіалуронової кислоти і хондроїтинсульфату були використані з метою відновлення глікозаміногліканового шару в терапії інтерстиціального циститу, гіперактивного сечового міхура, радіаційного циститу, а також для профілактики рецидивних ІСШ. Недавній огляд 27 клінічних досліджень показав, що масштабні дослідження є терміново необхідними для підтвердження переваг даного виду терапії [113]. Таким чином, загальні рекомендації на даному етапі неможливі.
3C.5.2.3. Антимікробна профілактика
Протимікробна профілактика може застосовуватися безперервно (щодня, щотижня) протягом тривалих періодів (3–6 місяців) або у вигляді однієї посткоїтальної дози. Безперервна або посткоїтальна антибіотикопрофілактика [114] для запобігання рецидивній ІСШ повинна бути розглянута тільки після консультації та змін поведінки і якщо неантимікробні заходи виявилися безуспішними (рівень доказовості 4, GR: В).
У відповідних жінок із рецидивним неускладненим циститом повинна бути розглянута можливість самодіагностики і самолікування за короткою схемою курсу [115] (рівень доказовості 2b, GR: А). Вибір антибіотиків такий же, як для спорадичної гострої неускладненої ІСШ (табл. 3).
Посткоїтальна профілактика повинна стосуватися вагітних жінок з історією частих ІСШ до початку вагітності для зниження ризику ІСШ [116] (рівень доказовості 2b, GR: В).
Безперервні антимікробні схеми профілактики для жінок із рецидивною ІСШ включають, наприклад, нітрофурантоїн (макрокристали) 50 мг або 100 мг один раз на день, фосфоміцину трометамол 3 г кожні 10 днів і під час вагітності, наприклад цефалексин 125 мг, або 250 мг, або цефаклор 250 мг один раз на день [100].
Загалом вибір антибіотиків повинен ґрунтуватися на ідентифікації збудника ІСШ та його чутливості, а також даних анамнезу щодо алергії на препарати та можливих екологічних побічних ефектах, включаючи ряд бактеріальної резистентності обраного препарату. Використовуючи ці принципи, потрібно розглянути кілька питань:
— Екологічні побічні ефекти означають, що пероральні фторхінолони та цефалоспорини більше не рекомендовані для рутинного призначення за винятком особливих клінічних ситуацій.
— Зростання резистентності E.coli до триметоприму у всьому світі ставить під сумнів його призначення з сульфаніламідом або без нього як ефективного профілактичного засобу.
— Є нещодавні попередження державних органів щодо обмеження довгострокового профілактичного застосування нітрофурантоїну з причини рідких, але тяжких легеневих і печінкових побічних ефектів [117].
Загалом це підкреслює необхідність перегляду ролі довгострокової антибіотикопрофілактики у рецидивних ІСШ та необхідність оцінки в кожному конкретному випадку ефективних альтернативних запобіжних заходів.

/30_u.jpg)
/31_u.jpg)
/31_u2.jpg)