Газета «Новости медицины и фармации» Гастроэнтерология (537) 2015 (тематический номер)
Вернуться к номеру
Современные подходы к профилактике НПВП-индуцированных гастро- и энтеропатий
Авторы: Татьяна Чистик
Рубрики: Гастроэнтерология
Разделы: Медицинские форумы
Версия для печати
Статья опубликована на с. 23-30
Нестероидные противовоспалительные препараты (НПВП) обладают уникальным сочетанием свойств: анальгетического, противовоспалительного, жаропонижающего и дезагрегантного, что обусловливает их чрезвычайно широкое применение во всех областях медицины. Более 30 млн человек в мире ежедневно принимают НПВП, причем в 2/3 случаев — без назначения и контроля врача. Это наиболее часто используемая группа лекарственных препаратов, и именно она занимает одно из лидирующих мест по частоте побочных эффектов. Отмечается ежегодный рост числа госпитализаций и смертей, связанных с осложнениями НПВП-терапии, а следовательно, возрастают экономические затраты на их лечение. Так, в Украине прием НПВП обусловливает до 46,5 % всех осложнений фармакотерапии. НПВП обладают большим количеством побочных действий: оказывают нефротоксический, гепатотоксический эффект, снижают агрегацию тромбоцитов, но самое главное — неблагоприятно воздействуют на желудочно-кишечный тракт (ЖКТ), вызывая НПВП-индуцированные гастро- и энтеропатии. Так, по данным западных авторов, язвы желудка или двенадцатиперстной кишки выявляются у 10–15 % пациентов, регулярно принимающих НПВП, а желудочно-кишечные кровотечения или перфорация в течение года может развиться в 1–1,5 % случаев (Bogas M. et al., 2006). Именно поэтому лечение и профилактика НПВП-индуцированных гастро- и энтеропатий является актуальной проблемой современной медицины.
19–20 марта в Киеве состоялась научно-практическая конференция украинского общества терапевтов с международным участием, в рамках которой были рассмотрены актуальные вопросы желудочно-кишечных кровотечений в клинической практике, вызванных приемом НПВП, а также современные подходы к их профилактике.
С докладом «Современные подходы к профилактике кровотечений в тонком кишечнике» выступила доктор медицинских наук, профессор НМУ имени А.А. Богомольца Е.Ю. Губская.
Высокая частота применения нестероидных противовоспалительных препаратов и аспирина в общеклинической практике, при ревматологической патологии, при заболеваниях сердечно-сосудистой системы, у лиц, нуждающихся в анальгезии, стала причиной серьезных медицинских последствий. Известно, что 10–20 % пожилых пациентов в возрасте 65 лет и старше постоянно или периодически принимают НПВП (Guffin M.R., 1998), что нередко приводит к поражению слизистой оболочки тонкого кишечника.
Согласно данным исследования L. Maiden et al. (2005), при приеме НПВП в течение 2 недель у 68 % здоровых добровольцев развились повреждения тонкого кишечника, а повышение уровня фекального кальпротектина выявлялось уже на седьмые сутки, что подтверждалось эндоскопически визуализируемым воспалением. Подобные данные получены и в исследовании Goldstein et al. (2005), в котором тонкокишечные повреждения регистрировались у 55 % здоровых волонтеров, принимавших напроксен в течение 14 дней. По результатам видеокапсульной эндоскопии у больных с артритами, принимавших НПВП на протяжении не менее 3 месяцев, повреждение слизистой оболочки тонкого кишечника обнаружено в 71 % случаев (Graham et al., 2005). Таким образом, НПВП-индуцированные энтеропатии встречаются более чем у 50 % пациентов, принимающих нестероидные противовоспалительные средства, и сопровождаются повреждением нижних отделов ЖКТ (Biarnason et al., 1993).
Не менее часто подобные осложнения возникают и при приеме низких доз аспирина, назначаемого c целью вторичной профилактики сердечно-сосудистых и церебральных заболеваний. Cогласно данным Т.А. Pearson et al. (2002), 70–80 % пациентов с высоким риском атеротромботических осложнений получают низкие дозы аспирина, что в 16,9 и 15,5 % случаев соответственно приводит к повреждению нижних и верхних отделов желудочно-кишечного тракта (Lanas A., 2009). Также в исследовании А. Shiotani et al. (2010) было продемонстрировано, что аспирин-индуцированная энтеропатия может развиться и при краткосрочном приеме аспирина в течение 1–2 недель. При этом такие легкие повреждения, как эрозии, петехии, отмечены в 20–60 % случаев, более серьезные — язвы — до 10 %.
В исследовании W.K. Leung et al. (2007) было установлено, что применение кишечнорастворимых форм аспирина приводит к повреждению дистальных отделов тонкого кишечника, аналогичному НПВП-индуцированной энтеропатии. При этом происходит непосредственное нарушение фосфолипидов клеточной поверхности мембран с одновременным повреждением мембран митохондрий. Снижается межклеточное взаимодействие и повышается проницаемость в тонком кишечнике. Повреждение усиливается агрессивным воздействием желчных кислот, пищи, интестинальных бактерий, протеолитических ферментов, вызывающих вторичное воспаление с активацией нейтрофилов. Значительная роль в этой ситуации отводится действию бактерий. Так, в экспериментальных исследованиях зафиксировано, что прием НПВП сопровождается внедрением грамположительных бактерий в мембрану слизистой оболочки тонкого кишечника и активацией Тл-рецепторов, чувствительных к липополисахаридам этих бактерий. В свою очередь, Тл-рецепторы стимулируют провоспалительный ответ и играют важную роль в интестинальном воспалении (Hagiwara M. et al., 2004; Watanate T. еt al., 2008).
НПВП-энтеропатия является наиболее частой причиной скрытых кишечных кровотечений (Lim Y.J., 2012). Нередко при НПВП-повреждениях тонкого кишечника могут формироваться диафрагмальные стриктуры, явлющиеся патогномоничным признаком данной патологии (Higuchi K. et al., 2009). Они представляют собой диафрагмальные септы толщиной 2–4 мм, чаще выявляемые в середине тонкого кишечника. Диафрагмальные стриктуры приводят к подострой интестинальной обструкции в 17 % случаев у пациентов, принимающих НПВП и имеющих язвы (Kessler et al., 1997). Эти осложнения, как правило, сопряжены с продолжительным приемом ацетилсалициловой кислоты (АСК) и НПВП и сопровождаются диареей, снижением веса, железодефицитной анемией и потерей белка.
Диагностика НПВП-энтеропатий основывается на данных анамнеза: прием аспирина или НПВП, обычно не менее 2 недель; отсутствие приема антибиотиков; исключение болезни Крона. При диагностике учитываются клиническая симптоматика, а также результаты:
— полученные при видеокапсульной эндоскопии (выявление петехий, эрозий, язв, участков оголенной слизистой оболочки, стриктур);
— баллонной энтероскопии; рентгеноскопии (пассаж бария по тонкой кишке);
— лабораторных и биохимических анализов (выявление железодефицитной анемии, гипоальбуминемии);
— фекального кальпротектина; выявление скрытой крови в кале иммунохроматографическим методом с обнаружением специфических антител к Нb человека (строго специфичен к гемоглобину человека, выявляется 0,006 мг Hb на 1 г кала, не требует ограничений в диете);
— водородного теста с глюкозой (синдром избыточного бактериального роста).
При диагностике НПВП-индуцированной энтеропатии, основанной на клинических данных, необходимо учитывать, что побочные эффекты НПВП чаще всего не связаны с абдоминальными жалобами. В 60–70 % случаев НПВП-индуцированная энтеропатия субклиническая. К неспецифическим проявлениям относятся железодефицитная анемия, гастроинтестинальные кровотечения, гипоальбуминемия, мальабсорбция витамина В12 или желчных кислот, диарея, острая абдоминальная боль. В качестве осложнений нередко встречаются массивные кровотечения, обструкции-стриктуры, перфорации — редки, но часто фатальные (Adebayo D. et al., 2006).
Диагностика тонкокишечных кровотечений проводится при помощи традиционной видеогастродуоденоскопии и илеоколоноскопии, однако при этом вероятность выявления источника не превышает 5 % (Kaffes A.J., 2001). Поэтому для большей информативности необходимо проведение видеокапсульной эндоскопии. При выявлении источника тонкокишечного кровотечения рекомендована БЭС для эндоскопического лечения. В случае негативного результата следует провести повторную БЭС, как в случае продолжающегося кровотечения (Svarta S. et al., 2010).
Лечение и профилактика НПВП-энтеропатий включает: отмену АСК/НПВП, назначение селективных ингибиторов циклооксигеназы-2 (ЦОГ-2), ингибиторов протонной помпы (ИПП), простагландинов (мизопростол), цитопротекторов (ребамипид), антибактериальных препаратов (метронидазол, рифаксимин), пробиотиков, сульфасалазина, фосфатидилхолин-ассоциированных НПВП, NO-, H2S и Zn-высвобождающих НПВП.
С учетом частоты и выраженности серьезных побочных эффектов НПВП со стороны слизистой тонкой кишки было предпринято множество попыток для уменьшения или предотвращения подобных осложнений, прежде всего с использованием препаратов, обладающих защитными в отношении кишечного эпителия свойствами. Однако в большинстве случаев результаты исследований не продемонстрировали таких преимуществ. Так, в работах K. Higuchi (2009), Y. Yoda (2010), Y.J. Lim (2012) не была доказана способность лансопразола профилактировать индуцированное повреждение кишечника. В исследованиях S. Zhang (2013) и K. Amagase (2010) было установлено, что омепразол и лафутидин не оказывают протективного действия на слизистую оболочку тонкого кишечника при приеме НПВП. При использовании эндогенного простагландина (Arakawa T., 2012) было достигнуто заживление лишь мелких пролежней.
Обнадеживающие результаты были получены при изучении эффективности ребамипида (Мукоген), который в ряде исследований продемонстрировал не только репаративный, но и цитопротекторный эффект.
Так, в исследовании, проведенном K. Mizukami et al. в 2011 году, было изучено влияние низких доз аспирина на слизистую оболочку тонкого кишечника здоровых лиц и профилактический эффект цитопротектора ребамипида. В нем приняли участие лица, которые в течение месячного периода перед исследованием не принимали лекарственные средства и имели нормальные результаты общеклинических исследований. Критериями исключения были лица после операций на тонком кишечнике, со стенозами, опухолями, эрозиями, язвами, кровотечениями тонкого кишечника, лица с активными гастроэнтерологическими заболеваниями, имеющие в анамнезе язвы, операции и кровотечения, а также лица, которые принимали перед исследованием НПВП или АСК.
Участники были разделены на 2 группы: группа А принимала аспирин 100 мг/день + омепразол + плацебо; группа В — аспирин 100 мг/день + омепразол + ребамипид. Курс лечения составил 4 недели.
Конечные точки: оценить состояние слизистой оболочки тонкого кишечника здоровых лиц до и после 4 недель приема низких доз аспирина; оценить профилактическое действие ребамипида.
Исследование продемонстрировало негативное воздействие аспирина на слизистую оболочку тонкого кишечника как в группе плацебо, так и в группе приема ребамипида. Однако достоверно меньшее количество петехий и эрозий отмечалось в группе ребамипида: 15,5 % в сравнении с 48,4 % в группе плацебо (рис. 1).
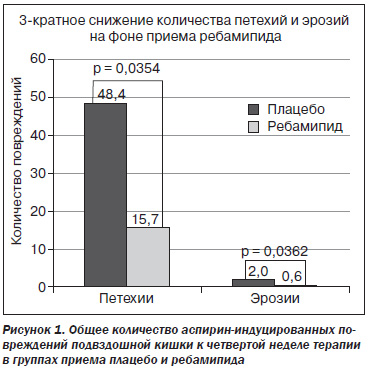
Авторы пришли к выводу, что ребамипид демонстрирует достоверный профилактический эффект, поэтому может рассматриваться как кандидат для лечения аспирин-индуцированных повреждений кишечника.
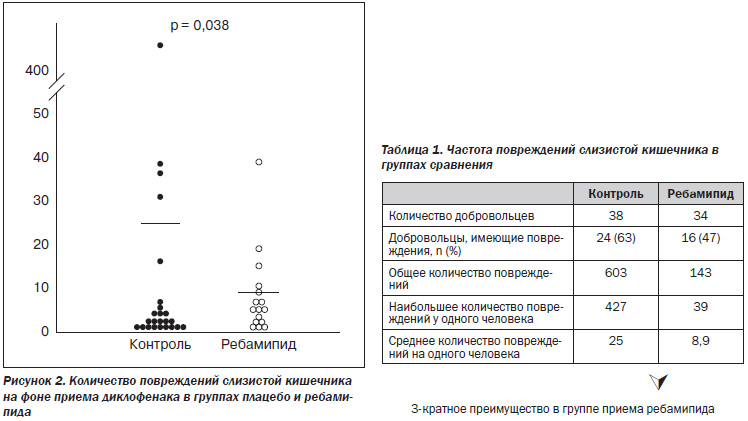
В 2011 году Fujimori et al. было проведено двойное слепое рандомизированное контролируемое исследование с участием 80 здоровых мужчин-добровольцев для изучения профилактической эффективности ребамипида (Мукоген) при одновременном назначении с НПВП. Все пациенты случайным образом были разделены на две равные группы. Контрольная группа (n = 40) принимала диклофенак натрия 75 мг/сут + омепразол 20 мг/сут + плацебо; группа наблюдения — диклофенак натрия 75 мг/сут + омепразол 20 мг/сут + ребамипид. Курс лечения составил 14 дней. Оценка дефектов слизистой оболочки тонкого кишечника проводилась капсульной эндоскопией до и после 2-недельного приема лекарственных средств.
Результаты исследования показали, что в группе плацебо среднее количество повреждений на одного человека составило 25, в группе наблюдения, в которой принимали ребамипид, — 8,9. Таким образом, ребамипид способствовал трехкратному снижению количества повреждений слизистой оболочки тонкого кишечника (рис. 2, табл. 1).
В 2013 году S. Kurokawa провел двойное слепое плацебо-контролируемое многоцентровое исследование для оценки репаративного эффекта ребамипида у пациентов с индуцированным повреждением кишечника, обусловленным приемом низких доз аспирина и/или нестероидных противовоспалительных средств. В него вошли пациенты (n = 61), которые принимали НПВП в течение 3 и более месяцев, с подтвержденным диагнозом НПВП-энтеропатии. Все пациенты были рандомизированы на 2 группы: 1-я группа (n = 30) принимала аспирин/НПВП и плацебо, 2-я (n = 31) — аспирин/НПВП + ребамипид 100 мг 3 раза в день.
Результаты исследования показали, что ребамипид достоверно способствует заживлению повреждений при НПВП-индуцированной энтеропатии и профилактирует появление новых повреждений, что было подтверждено капсульной эндоскопией. Кроме этого, прием ребамипида достоверно улучшал метаболические процессы в сравнении с плацебо и повышал плазменную концентрацию уровня белка.
Таким образом, были сделаны выводы, что среди средств медикаментозного воздействия ребамипид (Мукоген) обеспечивает заживление и предотвращает возникновение новых повреждений вследствие приема НПВП, а также улучшает метаболические процессы.
Доктор медицинских наук, профессор С.М. Ткач (Национальный медицинский университет имени А.А. Богомольца) рассказал о современных подходах к лечению НПВП-индуцированных гастропатий.
Гастроинтестинальная токсичность нестероидных противовоспалительных препаратов является главным фактором, ограничивающим их широчайшее применение при воспалительных состояниях и болевых синдромах. Изъязвления и кровотечения, индуцированные приемом НПВП, по-прежнему остаются одной из главных клинических проблем внутренней медицины. Так, в США побочные эффекты от приема НПВП являются 15-й по частоте причиной смертности, а в среднем у 30 % пациентов, их принимающих, имеются побочные гастроинтестинальные эффекты даже в отсутствие язвообразования. В Великобритании среди более 18 000 госпитализированных больных НПВП были основным классом лекарств, вызывающих побочные эффекты, причем НПВП-индуцированные язвы и кровотечения обусловили 61 % смертей. Такая же ситуация характерна для Украины: нестероидные противовоспалительные препараты обусловливают 46,5 % всех побочных эффектов фармакотерапии.
Установлено, что среди пациентов, принимающих НПВП, риск пептических язв повышается в 3–4 раза, риск развития кровотечений и перфораций составляет 25–35 %, а риск смерти вследствие этих причин — соответственно 3,6 и 7,6 %.
НПВП-гастропатии — это эрозивно-язвенные поражения гастродуоденальной зоны, возникающие при применении нестероидных противовоспалительных препаратов и имеющие характерную клинико-эндоскопическую картину. В качестве регулярного приема рассматривается прием 3 и более доз НПВП в неделю в течение 1 месяца.
К критериям диагноза НПВП-гастропатий (НИИ ревматологии РАМН) относятся:
— хронологическая связь с приемом НПВП;
— высокий риск манифестации кровотечением;
— острые, часто множественные повреждения;
— локализация в антральном отделе желудка;
— отсутствие воспалительного вала вокруг язвы;
— фовеолярная гиперплазия слизистой оболочки;
— достаточно быстрое заживление при отмене НПВП.
Среди факторов риска развития НПВП-гастропатий (Lanas A., 2004) выделяют немодифицируемые: возраст старше 65 лет, наличие язвенных поражений в анамнезе (особенно осложненных), серьезных сопутствующих заболеваний (хроническая сердечная, почечная или печеночная недостаточность, сахарный диабет), генотипы CYP2C19*17 (с усилением функции) и CYP2C9*2, CYP2C9*3. К модифицируемым относятся курение, алкоголь, сочетанный прием пероральных глюкокортикостероидов и антикоагулянтов, длительное использование НПВП в максимальных дозах, применение НПВП с длительным периодом полувыведения и неселективных ингибиторов ЦОГ-2, инфекция H.pylori. Также следует отметить, что нестероидные противовоспалительные препараты и H.pylori-инфекция оказывают синергические повреждающие эффекты на слизистую оболочку, нередко приводящие к изъязвлению желудка, с вовлечением в процесс подслизистой и мышечной оболочки.
Патогенез НПВП-гастропатии включает в себя несколько механизмов. Ключевую роль играет ингибирование фермента циклооксигеназы, имеющего два изомера — ЦОГ-1 и ЦОГ-2. Угнетение активности ЦОГ-1 (структурной) приводит к снижению синтеза простагландинов PgE2 и PgI2, которые выполняют цитопротективную функцию в слизистой оболочке желудка. Спектр основных физиологических эффектов простагландинов включает: стимуляцию секреции защитных гидрокарбонатов и слизи; усиление местного кровотока слизистой оболочки; активацию пролиферации клеток в процессах нормальной регенерации. Угнетение активности ЦОГ-2 (индуцированной) собственно и определяет противовоспалительное действие. Таким образом, снижение синтеза простагландинов, а следовательно, защитных резервов слизистой оболочки желудка и двенадцатиперстной кишки является основной причиной НПВП-гастропатии.
Однако простагландиновый механизм не является единственным объяснением неблагоприятного влияния НПВП на слизистую оболочку. Известно, что эффектами, оказываемыми НПВП, являются: снижение кровотока слизистой оболочки, зависящее не только от простагландинового, но и от секреторного фактора, непосредственное изменение секреции соляной кислоты, образование «белых тромбов» как последствие воспалительной адгезии нейтрофилов на сосудистый эндотелий, изменение молекул эндотелиальной и лейкоцитарной адгезии, а также функции эндотелия сосудов в месте воспаления. Определенный интерес с практической точки зрения представляет и изменение на фоне приема НПВП моторики верхних отделов ЖКТ, которое приводит к усугублению язвенно-геморрагических повреждений слизистой.
Кроме того, известен и топический эффект НПВП на слизистую оболочку, который не связан с простагландиновым механизмом. Прямое «контактное» повреждающее действие НПВП обусловлено их способностью непосредственно проникать в клетки эпителия в кислой среде, где они вызывают обратную диффузию Н+, нарушают качество слизи и снижают концентрацию бикарбонатов. Вследствие этого слизистая оболочка желудка становится более доступной для местного токсического повреждения соляной кислотой, желчными кислотами и кислотными печеночными метаболитами НПВП, панкреатическими ферментами на фоне дуоденогастрального рефлюкса.
Таким образом, патогенетические механизмы, вызывающие развитие НПВП-гастропатии, являются гетерогенными.
Риск НПВП-гастропатий увеличивается у пациентов, принимающих низкие дозы аспирина (менее 325 мг) с целью профилактики кардиоваскулярных заболеваний, так как многие из них также используют и НПВП. Установлено, что даже изолированное использование АСК увеличивает риск развития кровотечения из верхних отделов желудочно-кишечного тракта в дозозависимой форме с более чем четырехкратным возрастанием вероятности при дозе 300 мг в сутки. Риск язвенного кровотечения у пациентов, принимающих совместно неселективный НПВП и АСК, всегда вдвое больше, чем у лиц, принимающих один препарат. При этом применение ИПП у пациентов, принимавших АСК, было связано со значительно более низкой вероятностью таких осложнений.
Для рутинной профилактики НПВП-гастропатий применяют наименее токсичные НПВП (ибупрофен, диклофенак, ингибиторы ЦОГ-2), кишечнорастворимые формы, парентеральное введение НПВП, локальную НПВП-терапию в сочетании с физиотерапией, комбинированное применение НПВП с антисекреторными, антацидными, гастропротекторными средствами, эрадикацию H.pylori. Также существет необходимость персонифицированного назначения НПВП и «препаратов прикрытия» в зависимости от CYP-генотипа (полиморфизм CYP2С19*17 с усилением функции).
При подозрении на НПВП-гастропатию необходимы полное прекращение приема НПВП или ЦОГ-2-ингибитора, приема стероидов, антикоагулянтов, дезагрегантов и других гастротоксических средств, отказ от курения, приема алкоголя, а также соответствующее лечение язв или эрозий ингибиторами протонной помпы (эффективность 90 % и более). Если отмена НПВП невозможна вследствие тяжести основного заболевания, то проводят его замену на селективный ингибитор ЦОГ-2 и одновременно проводят лечение язв и/или эрозий ИПП или синтетическими аналогами простагландинов (мизопростолом, ребамипидом). Необходимо проведение эрадикации H.pylori у всех инфицированных больных и особенно у тех больных, которым планируется длительная терапия НПВП, аспирином или коксибами.
Согласно рекомендациям Американской ревматологической ассоциации, при высоком риске возникновения НПВП-гастропатии (2 и более риск-фактора, наличие осложнений в анамнезе) необходимо назаначать селективные ингибиторы ЦОГ-2 в комбинации с ИПП. При умеренном риске (1 риск-фактор) можно ограничиваться только назначением селективного ингибитора ЦОГ-2. При низком риске (риск-факторов нет) возможно применение классических НПВП.
Доказано, что ингибиторы протонной помпы (омепразол, пантопразол, лансопразол, эзомепразол, рабепразол) являются эффективными и хорошо переносимыми агентами, защищающими желудок и двенадцатиперстную кишку во время приема НПВП. Результаты метаанализа (Rostom A. et al., 2002), объединившего пять рандомизированных клинических исследований, продемонстрировали, что использование ИПП у больных с НПВП-индуцированными гастропатиями было связано с более низким риском эндоскопического выявления язв желудка (ОР 0,40; 95% ДИ 0,32–0,51) и двенадцатиперстной кишки (ОР 0,19; 95% ДИ 0,09–0,37) по сравнению с плацебо. При этом общее количество эндоскопически выявленных язв составило 14,5 % при применении ИПП против 35,6 % в группе плацебо.
Однако необходимо учитывать тот факт, что многие НПВП и ИПП проходят биотрансформацию в печеночной системе цитохрома Р450. Поэтому их совместное применение может ингибировать метаболизм, сопровождаться ослаблением выведения препарата и повышением его концентрации до нежелательного уровня, в связи с чем могут проявляться его побочные эффекты. Поэтому становится понятным, что в таких случаях для уменьшения риска возможных межлекарственных взаимодействий и побочных эффектов должны применяться наиболее безопасные ИПП, слабо реагирующие с цитохромной системой, например пантопразол или рабепразол.
Ребамипид (Мукоген) является мощным цитопротектором, оказывающим плейотропное действие на миграцию и пролиферацию гастроцитов, выработку гликопротеинов слизи и восстановление эпителия.
Репаративное действие ребамипида (Мукоген) реализуется за счет индукции синтеза простагландинов посредством экспрессии ЦОГ-2 (Kleine A. et al., 1993; Sun W.H. et al., 2000) и блокады соответствующих рецепторов (Suetsugu H. et al., 2000). Также ребамипид (Мукоген) активирует такие факторы роста, как EGF (Tarnawski A. et al., 1998), VEGF (Tarnawski A. et al., 2004), HGF (Udogava A. et al., 2003). Цитопротекторный эффект ребамипида связан с индукцией секреции слизи (Ishihara R. et al., 1992). За счет утилизации свободных радикалов (Yashikawa T. еt al., 2003), ингибирования активации нейтрофилов и их миграции (Yashida N. еt al., 1996), а также ингибирования продукции цитокинов лейкоцитами и эпителиальными клетками желудка (Masamune A. et al., 2001) осуществляется противовоспалительное действие препарата. Антихеликобактерный эффект обеспечивается снижением уровня колонизации слизистой (Suzuki H. et al., 1998) и игибированием адгезии H.pylori к эпителию желудка (Hayashi S. et al., 1998).
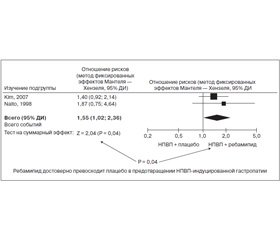
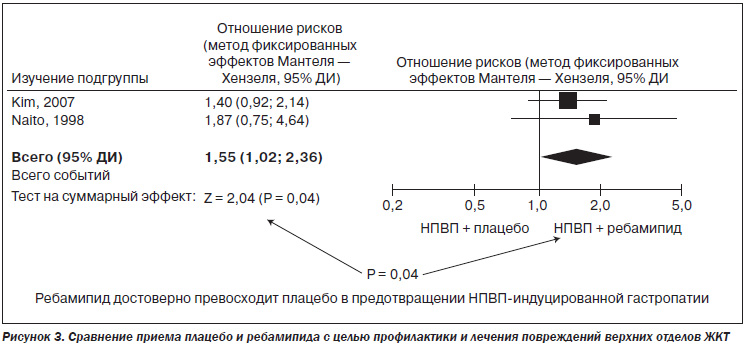
Суммируя эффекты ребамипида (Мукоген), можно сказать, что данный препарат эффективно профилактирует НПВП-индуцированные гастро- и энтеропатии, что подтверждено систематическим обзором и метаанализом, проведенным Shaoheng Zhang et al. в 2013 году. Было установлено, что ребамипид достоверно превосходит плацебо в предотвращении НПВП-индуцированной краткосрочной гастропатии (рис. 3) и энтеропатии.
Доказано, что применение ребамипида по своей эффективности сопоставимо с традиционными методами профилактики, такими как назначение ИПП, Н2-гистаминоблокаторов, мизопростола, в предотвращении повреждений слизистой желудка при приеме НПВП. Препарат хорошо переносится, возникающие побочные эффекты, как правило, легкой степени тяжести, что не требует его отмены.
Таким образом, на основании всего вышеперечисленного можно сделать следующие выводы.
— Гастродуоденальные повреждения, связанные с приемом НПВП или аспирина, являются серьезной и крайне актуальной проблемой, особенно принимая во внимание объемы использования этих препаратов.
— По причине того, что популяция старшего возраста находится в группе высокого риска и именно этой популяцией преимущественно используются НПВП и аспирин, очень вероятно, что клиницисты все чаще будут сталкиваться с такими пациентами и повышенным сопутствующим риском язвенных кровотечений и других осложнений.
— Среди различных фармакологических стратегий, использующихся для первичной и вторичной профилактики НПВП-индуцированных гастродуоденальных повреждений у пациентов, которым показана постоянная терапия НПВП, эрадикация Н.pylori-инфекции и сопутствующая терапия ИПП являются наиболее клинически и экономически эффективными.
— Использование ИПП является эффективным методом вторичной профилактики язвенных осложнений у пациентов, которым необходима антитромботическая терапия аспирином или клопидогрелем.
— В качестве альтернативы ИПП для профилактики НПВП-гастропатий и желудочно-кишечных кровотечений рекомендуется применение ребамипида (Мукоген).
С докладом «НПВП-энтероколопатии: механизмы поражения и пути предотвращения» выступил доктор медицинских наук, профессор А.Э. Дорофеев (Национальный медицинский университет имени А.А. Богомольца).
В настоящее время НПВП являются одной из самых широко применяемых групп лекарственных препаратов, причем многие из них доступны без рецепта. Ежедневно в мире более 30 миллионов человек принимают препараты этой группы. Благодаря такой популярности НПВП занимают одно из ведущих мест в мире и по числу нежелательных побочных эффектов (Sostres C. et al., 2013). На сегодняшний день лучше всего изучены механизмы повреждающего действия НПВП на верхние отделы желудочно-кишечного тракта, и в связи с этим разработаны достаточно эффективные пути предупреждения таких нежелательных последствий. Вначале основное внимание уделялось подавлению кислотообразования в желудке. Поэтому были синтезированы блокаторы 2-го типа гистаминовых рецепторов, снижающих синтез соляной кислоты на 60 %, а затем ИПП, дающие 90% супрессию. Также были открыты и внедрены в клиническую практику селективные ингибиторы циклооксигеназы 2-го типа, обладающие меньшим числом побочных эффектов со стороны верхних отделов ЖКТ. К тому же была показана неблагоприятная роль Helicobacter pylori в развитии НПВП-гастропатии и приняты меры по устранению этой инфекции. Благодаря внедрению таких профилактических подходов за последнее десятилетие в развитых странах уменьшилось количество угрожающих жизни проявлений НПВП-гастропатии — кровотечений и перфораций верхних отделов ЖКТ (Lanas A., et al., 2011).
Еще одним частым нежелательным действием НПВП является повреждение нижних отделов ЖКТ. Достаточно долго истинная частота таких повреждений была неизвестна, потому что, помимо отсутствия ярких клинических проявлений, не было доступных методов прижизненной визуализации, и лишь после внедрения капсульной и двухбаллонной энтероскопии открылись реальные цифры. Так, согласно современным данным, изъязвление кишечника обнаруживается у 30–40 % людей, принимающих НПВП, кровотечение и анемия — у трети, а воспалительное повреждение слизистой оболочки кишечника — более чем у 2/3 больных. Также на фоне применения этих препаратов у большинства пациентов (до 70 %) находят повышение кишечной проницаемости и синдром мальабсорбции (Sostres C. et al., 2013). Причем если число кровотечений из верхних отделов ЖКТ за десятилетие сократилось вдвое, то количество кишечных кровотечений возросло примерно в такой же пропорции. В настоящее время около 40 % желудочно-кишечных побочных эффектов НПВП приходится на кишечник (Laine L. et al., 2008). Отмечается, что даже короткие курсы приема НПВП и применение низких кардиологических доз аспирина сопровождаются повреждением слизистой оболочки кишечника (Wallace J.L., 2013).
Патогенез НПВП-энтероколопатий до конца не установлен. В настоящее время предложена теория множественного повреждения (multiple hit). Первым повреждающим фактором (first hit) являются сами препараты и их метаболиты, непосредственно воздействующие на энтероциты. Предполагается, что они активируют свободнорадикальные процессы, разрушая митохондрии и саркоплазматический ретикулум (Boelsterli U.A. et al., 2013). Такое повреждение способствует снижению барьерной функции кишечника и повышению проницаемости слизистой оболочки для бактериальных токсинов. Стимуляция токсинами TLR4-рецепторов макрофагов способствует выделению провоспалительных интерлейкинов и активации местного воспалительного процесса (второе повреждение — second hit). Показано, что воспалительная инфильтрация слизистой кишечника развивается уже через 6 часов после приема индометацина (Boelsterli U.A. et al., 2013). Препараты, обладающие способностью включаться в энтеропеченочную циркуляцию, оказывают более выраженный повреждающий эффект на слизистую кишечника из-за увеличения времени контакта препарата и/или его метаболитов с энтероцитами.
Важную роль в таком повреждении играет изменение кишечной микробиоты. Показано, что грамотрицательные микроорганизмы потенцируют неблагоприятное воздействие НПВП, а некоторые пробиотики на основе грамположительных бактерий (семейства Lactobacillus и Bifidobacterium) защищают от него. В эксперименте показано протективное воздействие некоторых невсасывающихся кишечных антибиотиков при применении НПВП (Marlicz W. et al., 2014). Объясняется это тем, что липополисахариды, выделяющиеся грамотрицательными микроорганизмами, активируют уже упоминавшиеся TLR4-рецепторы с развитием местного воспалительного ответа. Локальное воспаление вносит свой неблагоприятный вклад в ЦОГ-независимый механизм повышения кишечной проницаемости. Повышенная проницаемость способствует всасыванию желчных кислот и метаболитов НПВП с последующим повреждением митохондрий энтеро- и колоноцитов. Помимо того, некоторые микроорганизмы в процессе своей жизнедеятельности выделяют глюкуронидазу. Под ее воздействием разрушаются глюкуронизированные метаболиты НПВП, которые легче реабсорбируются и включаются в энтеропеченочную рециркуляцию, тем самым увеличивая продолжительность неблагоприятного воздействия на слизистую кишки (Boelsterli U.A. et al., 2013). В связи с этим становится понятно потенцирование неблагоприятного влияния НПВП на слизистую кишечника при использовании ИПП. Как известно, ИПП, подавляя желудочную секрецию, способствуют избыточному росту микроорганизмов в просвете кишечника. Подтверждается этот механизм и усилением неблагоприятного воздействия НПВП на слизистую кишечника при использовании другой группы кислотосупрессивных препаратов — Н2-гистаминоблокаторов (Marlicz W. et al., 2014).Благодаря достаточно ясному пониманию механизмов поражения верхних отделов ЖКТ были разработаны эффективные методы их профилактики. Нейтрализация соляной кислоты ингибиторами протонной помпы позволяет на 60 % уменьшить частоту изъязвлений слизистой и количество кровотечений из верхних отделов ЖКТ. Вторым направлением профилактики этих поражений является эрадикация хеликобактерной инфекции перед назначением НПВП, что дает еще 60% снижение риска повреждения слизистой оболочки (Lanas A. et al., 2013). К сожалению, эти мероприятия не только не предотвращают поражение нижних отделов ЖКТ, но и потенцируют неблагоприятное воздействие НПВП на кишечник. Показано, что двойная антитромбоцитарная терапия у кардиологических больных при приеме ИПП втрое чаще сопровождается кишечными кровотечениями, чем желудочными (Casado Arroyo R. et al., 2012). Попытки использовать НПВП в виде кишечнорастворимых форм или свечей также усугубляют повреждение кишечника. В настоящее время отсутствуют однозначные рекомендации по профилактике НПВП-энтероколопатий (Wallace J.L., 2013).
С учетом возможности циклооксигеназного пути поражения кишечника исследовался синтетический простагландин PGE1. В нескольких небольших открытых исследованиях он уменьшал выраженность кишечной проницаемости и анемии на фоне приема НПВП (Wallace J.L., 2013). Однако этот препарат отличается достаточно большим количеством побочных эффектов и высокой стоимостью. Вторым препаратом с возможным протективным действием оказался метронидазол. Вероятно, его действие обусловлено уменьшением содержания грамотрицательной флоры в просвете кишечника. К сожалению, рандомизированных исследований его эффективности не проводилось, поэтому отсутствует регистрация по данным показаниям. Также отсутствуют достоверные данные о протективных возможностях при НПВП-энтероколопатии препаратов 5-аминосалициловой кислоты (Wallace J.L., 2013).
Новым перспективным направлением представляется предупреждение повреждения митохондрий за счет блокады митохондриального циклофилина D (CypD) новым противовирусным препаратом алиспоривиром (alisporivir) (Boelsterli U.A., et al. 2013). Однако этот препарат пока только проходит клинические исследования для лечения вирусного гепатита С (Buti M. et al., 2014). Его энтеропротективное воздействие изучается параллельно. В эксперименте исследуются блокаторы бактериальной глюкуронидазы, которые должны уменьшать бактериальную деградацию метаболитов НПВП. Пока рано говорить об эффективности такого рода профилактики НПВП-энтероколопатии (Boelsterli U.A. et al., 2013). В клинике изучались некоторые пробиотики, которые в небольших рандомизированных исследованиях продемонстрировали предупреждающее действие на развитие кишечного повреждения при приеме НПВП (Syer S.D. et al., 2015). Правда, в настоящее время в нашей стране ни один из пробиотиков не зарегистрирован по данным показаниям. Многообещающи разработки новых НПВП, имеющих в своем составе NO- и SH-группы. Эти препараты в эксперименте показали большую желудочно-кишечную безопасность по сравнению со своими предшественниками, однако результаты дальнейших клинических исследований оказались не столь оптимистичны (Wallace J.L., 2013; Marlicz W. et al., 2014).
Одним из немногих препаратов, доказавших свою клиническую эффективность в предупреждении НПВП-опосредованного поражения как верхних, так и нижних отделов ЖКТ, является ребамипид. Он был синтезирован в 80-е годы прошлого столетия японскими учеными. Являясь хинолоновым производным, ребамипид повышает синтез простагландинов в слизистой ЖКТ, что сопровождается стимуляцией кровотока и синтеза защитной слизи. Его применение позволяет подавить свободнорадикальные процессы и активацию нейтрофилов в слизистой оболочке (Sugimoto M. et al., 2014). В эксперименте была показана способность ребамипида восстанавливать секрецию энтеропротективного пептида дефензина-5, угнетаемую при приеме НПВП. Также под воздействием ребамипида отмечалось увеличение внутрикишечного числа грамположительных лактобацилл и уменьшение грамотрицательных бактероидов и клостридий (Tanigawa T. et al., 2013). Показана способность ребамипида нормализовать активированную НПВП экспрессию генов матриксных металлопротеиназ и тем самым уменьшать выраженность воспалительного повреждения слизистой кишечника (Yamada S. et al., 2012). В нескольких рандомизированных клинических исследованиях ребамипид доказал свою эффективность в предупреждении эрозивно-язвенных поражений верхних отделов ЖКТ при применении НПВП, коксибов и малых доз аспирина (Hasegawa M. et al., 2013; Kim J.H. et al., 2014; Tozawa K. et al., 2014). Однако верхними отделами ЖКТ протективный эффект ребамипида не ограничивается.
Вначале в нескольких рандомизированных клинических исследованиях при помощи капсульной эндоскопии была доказана способность ребамипида снижать в 4 раза риск развития тонкокишечных повреждений у здоровых добровольцев, принимавших диклофенак и ИПП (Niwa Y. et al., 2008; Fujimori S. et al., 2011). Затем в рандомизированном исследовании на здоровых добровольцах было показано предупреждение ребамипидом изъязвления слизистой кишечника при приеме низких доз аспирина и ИПП (Mizukami K. et al., 2011). Наконец, в недавно опубликованном мультицентровом рандомизированном плацебо-контролируемом исследовании участвовали реальные больные. Они не менее 3 месяцев до начала исследования принимали НПВП или низкие дозы аспирина. Применение на протяжении 4 недель 300 мг в сутки ребамипида привело к достоверному уменьшению (по данным капсульной эндоскопии) количества эрозивно-язвенных повреждений слизистой кишечника, в то время как в группе плацебо число таких повреждений даже увеличилось. В группе ребамипида также отмечалось повышение содержания протеинов в крови (в группе плацебо протеин снижался). Это отражает положительное влияние ребамипида также и на состояние кишечной проницаемости (Kurokawa S. et al., 2014). В метаанализе 4 рандомизированных клинических исследований показано почти трехкратное превосходство ребамипида над плацебо в предупреждении НПВП-индуцированной энтеропатии. При этом подчеркиваются безопасность ребамипида и редкое развитие побочных эффектов, которые у подавляющего большинства пациентов не потребовали прекращения лечения (Zhang S. et al., 2013).
В эксперименте подтверждена способность ребамипида предупреждать повреждение кишечника не только при монотерапии НПВП, но и при обычном в клинической практике крайне неблагоприятном сочетании ИПП + НПВП (Satoh H. et al., 2014). Еще раз следует подчеркнуть, что и в клинических исследованиях ребамипид предупреждал побочные эффекты такой неблагоприятной комбинации, как НПВП/аспирин и ингибитор протонной помпы.
Единственный доступный в нашей стране ребамипид под названием Мукоген изготавливается фирмой «Маклеодс Фармасьютикалс» (Macleods Pharmaceuticals Ltd) по японской лицензии.
Таким образом, любые НПВП и низкие дозы аспирина у большинства больных вызывают повреждение кишечника. Назначение антисекреторных препаратов не только не защищает, но и усиливает повреждение кишечника, в отличие от верхних отделов ЖКТ. Единственным доступным препаратом, способным не только предотвратить повреждение, но и лечить НПВП-энтероколопатию, является ребамипид (Мукоген).