Журнал «Медицина неотложных состояний» 5 (60) 2014
Вернуться к номеру
Періопераційна антиноцицептивна протекція в комплексі лікування хворих з операціями на артеріях нижніх кінцівок
Авторы: Гомон М.Л., Мітюк О.І. - Вінницький національний медичний університет ім. М.І. Пирогова
Рубрики: Медицина неотложных состояний
Разделы: Клинические исследования
Версия для печати
Проведено аналіз перебігу післяопераційного періоду в 47 хворих із 3-м ступенем операційного ризику за шкалою АSA при реконструктивних операціях на артеріях нижніх кінцівок, серед яких у 24 випадках використовувалась спінальна анестезія з традиційним післяопераційним знеболюванням наркотичними та ненаркотичними анальгетиками, у 23 випадках — редукована спіно-перидуральна анестезія/анальгезія із знеболюванням у післяопераційному періоді 0,25% бупівакаїном у комбінації з терапевтичною дозою ненаркотичних анальгетиків. Установлено, що використання спіно-перидуральної анестезії з редукцією дози спінального компонента та застосуванням анальгезії в післяопераційному періоді забезпечує менші коливання гемодинамічних показників, кращу протекцію больового синдрому, менше фармакологічне навантаження наркотичними та ненаркотичними анальгетиками. Рекомендовано широко використовувати методику редукованої спіно-перидуральної анестезії/анальгезії із застосуванням у післяопераційному періоді комбінації перидуральної анальгезії з фоновими терапевтичними дозами ненаркотичних анальгетиків для адекватної антиноцицептивної протекції після складних і довготривалих реконструктивних оперативних втручань на артеріях нижніх кінцівок.
Проведен анализ течения послеоперационного периода у 47 больных при реконструктивных операциях на артериях нижних конечностей с 3-й степенью операционного риска по шкале АSA, среди которых в 24 случаях использовалась спинальная анестезия с традиционным послеоперационным обезболиванием наркотическими и ненаркотическими анальгетиками, в 23 случаях — редуцированная спино-перидуральная анестезия/анальгезия с обезболиванием в послеоперационном периоде 0,25% бупивакаином в комбинации с терапевтической дозой ненаркотических анальгетиков. Установлено, что использование спино-перидуральной анестезии с редукцией дозы спинального компонента и применением анальгезии в послеоперационном периоде обеспечивает меньшие колебания гемодинамических показателей, лучшую протекцию болевого синдрома, меньшую фармакологическую нагрузку наркотическими и ненаркотическими анальгетиками. Рекомендуется широко использовать методику редуцированной спино-перидуральной анестезии/анальгезии с применением в послеоперационном периоде комбинации перидуральной анальгезии с фоновыми терапевтическими дозами ненаркотических анальгетиков для адекватной антиноцицептивной протекции после сложных и длительных реконструктивных оперативных вмешательств на артериях нижних конечностей.
The analysis of the postoperative period has been carried out in 47 patients with the 3rd degree of operational risk by ASA scale during reconstructive surgeries on the arteries of the lower limbs, among which in 24 cases we have used spinal anesthesia with traditional postoperative analgesia with narcotic and non-narcotic analgesics, in 23 cases — reduced spinal and peridural anesthesia/analgesia with analgesia in the postoperative period using 0.25% bupivacaine in combination with a therapeutic dose of non-narcotic analgesics. It has been established that the use of spinal and peridural anesthesia with a reduction of a dose for the spinal component and the use of analgesia in the postoperative period provides smaller fluctuations of hemodynamic parameters, better protection of pain syndrome, lesser pharmacological load with narcotic and non-narcotic analgesics. It is recommended to use widely a technique of reduced spinal and peridural anesthesia/analgesia with the use in postoperative period of combination of peridural analgesia with background therapeutic doses of non-narcotic analgesics for adequate antinociceptive protection after the complex and continuos reconstructive surgeries on the arteries of the lower limbs.
хірургія судин, післяопераційна антиноцицептивна протекція.
хирургия сосудов, послеоперационная антиноцицептивная протекция.
vascular surgery, postoperative antinociceptive protection.
Статья опубликована на с. 71-75
Вступ
Оклюзійна хвороба артерій нижніх кінцівок найчастіше є проявом атеросклерозу з ураженням різних сегментів артеріальної системи. За даними статистики, оклюзійну хворобу кінцівок виявляють у 2–3 % осіб від загальної чисельності населення, що становить понад 20 % у структурі всіх видів захворювань серцево-судинної системи. У США оклюзійну хворобу артерій нижніх кінцівок діагностовано в 8,5 мільйона пацієнтів віком понад 60 років. Майже в 50 % спостережень перебіг захворювання асимптомний, у 40 % — виявлено кульгавість різного ступеня, у 10 % — критичну ішемію, що супроводжувалась болем у спокої або розвитком виразок чи гангрени [1, 2]. Якщо обструкція зменшує діаметр артерії більше ніж на 50 %, стеноз такої величини є гемодинамічно значимим, що потребує активного лікування. Найбільш радикальним методом лікування є хірургічна корекція кровотоку, що виконується в об’ємі ендартеректомії, аутопластики та протезування. Оперативне втручання є потужною травмою у хворого з хронічним захворюванням, тому перебіг його більшою мірою залежить від періопераційного менеджменту хворого. Важливою проблемою захисту хворих від операційної травми є адекватна протекція післяопераційної болі. Відомо, що надмірна стресорна реакція, що виникає вже в післяопераційному періоді під впливом основного й супутніх захворювань, інтоксикації, гіповолемії та психоемоційного напруження, може наростати ще більше й призвести до високого рівня нейроендокринної напруженості. Це, в свою чергу, веде до значної інтенсифікації метаболізму, виражених зрушень гемодинаміки й інших несприятливих змін, що викликають не тільки місцеві порушення, але й системні розлади [3, 6, 8].
Перебіг післяопераційного періоду в першу-другу добу після реконструктивних втручань на артеріях нижніх кінцівок характеризується больовим синдромом, ризиком тромботичних ускладнень та необхідністю обмеження фізичного навантаження на оперовану кінцівку. Гемодинамічна стабільність післяопераційного періоду є основним фактором заживлення операційної рани. Слід відмітити, що обмеження рухової активності, з однієї сторони, є фактором зменшення ризику кровотеч, з іншої — фактором гіподинамії та ризику тромбоемболічних ускладнень. Саме адекватне післяопераційне знеболювання, що може забезпечити місцеве знеболювання кінцівки при збереженні її м’язового тонусу та загальної фізичної активності пацієнта, є концептуально найкращим [4, 5, 7]. Тому для післяопераційного знеболювання в перші 2–3 доби післяопераційного періоду ми використали комбінацію перидуральної анальгезії (низькими концентраціями 0,25% бупівакаїну зі збереженням моторної функції кінцівок) з ненаркотичними анальгетиками. У групі порівняння застосовували традиційне післяопераційне знеболювання з використанням наркотичних і ненаркотичних анальгетиків.
Метою нашого дослідження був порівняльний аналіз анестезіологічного забезпечення післяопераційного періоду після реконструктивних операцій на артеріях нижніх кінцівок на тлі облітеруючого атеросклерозу з використанням перидуральної анальгезії та без неї для визначення оптимальної методики лікування.
Матеріали та методи
Проведено порівняльний аналіз перебігу післяопераційного періоду в 47 хворих із 3-м ступенем операційного ризику за шкалою ASA, які перенесли реконструктивні операції на артеріях нижніх кінцівок. Хворі рандомізовані за віком, характером, об’ємом, тривалістю оперативних втручань на 2 групи залежно від методики анестезіологічного забезпечення та ведення післяопераційного періоду. У 1-й, контрольній групі з 24 осіб використано спінальну анестезію (3,9 ± 0,1 мл 0,5% бупівакаїну), в 2-й, дослідній групі з 23 осіб — редуковану (3,5 ± 0,1 мл 0,5% бупівакаїну) спіно-перидуральну анестезію/анальгезію (0,25% бупівакаїн). У першій групі для післяопераційного знеболювання використовували традиційну фармакотерапію комбінацією ненаркотичних і наркотичних анальгетиків, у другій — комбінацію перидуральної анальгезії 0,25% бупівакаїном із терапевтичною дозою ненаркотичних анальгетиків (нестероїдні протизапальні препарати — НПЗП). Вибір післяопераційного знеболювання в другій групі базувався на концепції забезпечення тривалої антиноцицептивної післяопераційної протекції за рахунок перидуральної анальгезії при збереженні моторної функції кінцівки та активності пацієнта. Використовували постійне і болюсне введення місцевого анестетика в перидуральний простір.
Для статистичного аналізу перебігу післяопераційного періоду оцінювались вираженість больового синдрому за візуальною аналоговою шкалою (ВАШ) болю, показники гемодинаміки (середнього артеріального тиску (САТ), частоти серцевих скорочень (ЧСС)); як критерій адекватності корекції магістрального кровотоку та мікроциркуляції проводили безконтактну інфрачервону пірометрію апаратом DT-806; вираженість больового синдрому оцінювали також за кількістю використаних анальгетиків.
Статистичну обробку результатів проводили з використанням методів параметричного аналізу. Для судження про вірогідність відмінностей між групами за аналізованим показником використовували t-критерій Стьюдента. Рівень вірогідності коефіцієнта оцінювали стандартним способом і вважали прийнятним при р < 0,05.
Результати та їх обговорення
Аналізуючи гемодинамічні показники першої доби післяопераційного періоду, встановили, що вихідний САТ в першій та другій групах вірогідно не відрізнявся і становив 98,2 ± 2,6 та 99,5 ± 2,7 мм рт.ст. відповідно (табл. 1). Установлено вірогідне підвищення максимального САТ в першій групі хворих у першу добу після оперативного втручання до 115,7 ± 4,8 мм рт.ст., що свідчить про гіперкінетичний тип гемодинаміки, часткове збереження больового синдрому та вірогідну відмінність від максимального САТ (95,7 ± 3,8 мм рт.ст.) у другій групі. Слід відмітити, що в останній групі не було тенденції до підвищення максимального САТ, що свідчить про гладкий перебіг післяопераційного періоду. В обох групах установлено вірогідне коливання мінімального САТ до 87,6 ± 2,9 та 86,8 ± 3,2 мм рт.ст. відповідно за відсутності вірогідної різниці між ними. Однак при порівнянні кожного показника з рівнем максимального САТ вірогідні коливання виявлено лише при використанні знеболення НПЗП та опіоїдами після спінальної анестезії в першій групі. Таким чином, показники САТ в ранньому післяопераційному періоді в першій групі характеризуються вірогідним коливанням як до високих, так і до низьких цифр.
При аналізі динаміки ЧСС у першій групі відмічено вірогідне підвищення максимальної ЧСС до 108,4 ± 3,6 та вірогідну відмінність від мінімальної (87,9 ± 4,9) та максимальної ЧСС (97,3 ± 4,1) другої групи. У другій групі не виявлено вірогідного коливання ЧСС, що свідчить про гладку та стабільну антиноцицептивну протекцію.
Отже, використання комбінації опіоїдів із НПЗП для післяопераційного знеболювання після спінальної анестезії не забезпечує стабільної гемодинаміки та має тенденцію як до надлишкового підвищення, так і до надлишкового зниження САТ та ЧСС. Разом із тим коливання САТ і ЧСС у другій групі свідчать про стабільність гемодинаміки, коли максимальні та мінімальні показники САТ і ЧСС упродовж першого дня післяопераційного періоду вірогідно менше відрізнялись від вихідних показників, що свідчить про адекватну антиноцицептивну протекцію перидуральної анальгезії.
Аналіз динаміки САТ у наступні дні післяопераційного періоду показав вірогідне підвищення його рівня в першій групі на другу та третю добу до 109,2 ± 4,1 і 108,9 ± 3,4 мм рт.ст. відповідно та відсутність вірогідного коливання в другій групі — відповідно 95,3 ± 3,4 та 94,3 ± 3,2 мм рт.ст.; відмінності в обох групах були вірогідні (табл. 2). Починаючи з четвертої доби вірогідних коливань показників САТ між групами та вихідними показниками не спостерігалось. При виписці в другій групі виявлено вірогідне зниження САТ до 90,3 ± 2,8 мм рт.ст., що розцінено як нормалізація тиску в результаті ефективного лікування. В першій групі при виписці показники САТ не відрізнялися від вихідних показників, проте вірогідно відрізнялися від показників другої групи. Таким чином, перебіг післяопераційного періоду за показником САТ був більш гладким у хворих другої групи.
Аналіз динаміки ЧСС в порівнювальних групах із другої доби післяопераційного періоду показав велику варіабельність похибки та тенденцію до нормалізації пульсу в другій групі (табл. 2). Так, в обох групах виявлена тенденція до нормалізації ЧСС із другого післяопераційного дня і до виписки зі стаціонару, однак вірогідні відмінності отримано лише в другій групі з четвертої доби та при виписці.
Узагальнюючи отримані зміни гемодинаміки в порівнювальних першій і другій групах, слід зробити такі висновки:
1. Використання комбінації перидуральної анальгезії 0,25% бупівакаїном із НПЗП для післяопераційного знеболювання в другій групі забезпечило еукінетичний тип гемодинаміки та більш гемодинамічно гладкий перебіг післяопераційного періоду.
2. Післяопераційне знеболювання з використанням комбінації опіоїдів із НПЗП у перші дві доби післяопераційного періоду характеризується вірогідним коливанням САТ до підвищення, що свідчить про недостатню антиноцицептивну протекцію даної методики в першій групі.
3. Використання комбінації перидуральної анальгезії 0,25% концентрацією бупівакаїна з НПЗП у другій групі не супроводжується появою гіпотензій, що характерно для використання самостійної перидуральної анестезії для післяопераційного знеболювання хворих.
Найчастіше основною причиною збереження гіпертензії в післяопераційному періоді є збереження ішемії в термінальних відділах ноги та недостатнє знеболювання, що може стати причиною хронізації больового синдрому. Тому наступним компонентом дослідження є визначення вираженості больового синдрому та аналіз мікроциркуляції в стопі нижньої кінцівки.
Вираженість больового синдрому в післяопераційному періоді оцінювали за допомогою ВАШ (табл. 4).
Слід відмітити, що хворі під час опитування за ВАШ болю відзначають не вираженість больового синдрому в даний момент, а максимальні його прояви протягом останньої доби, що є важливим фактором сумарної оцінки больового синдрому і чого неможливо зробити об’єктивними методами, оскільки альтернативою є лише математичний аналіз моніторингу. Аналіз динаміки больового синдрому показав, що хворі першої групи відчували біль середньої інтенсивності вже на першу добу (ВАШ = 42,1 ± 5,3 мм) післяопераційного періоду, що був вірогідно більшим порівняно з другою групою (21,9 ± 4,1 мм), де він був низької інтенсивності. На наступну добу у хворих обох груп зберігався біль низької інтенсивності, однак у другій групі він вірогідно менший, ніж в першій, — відповідно 18,7 ± 2,3 та 26,9 ± 3,1 мм. Починаючи з третьої доби в обох групах зберігається біль низької інтенсивності, який не відрізняється між групами. Проте на момент виписки больовий синдром у другій групі вірогідно нижчий, ніж в першій, хоча в обох групах він низької інтенсивності.
Для оцінки вираженості больового синдрому аналізували кількість використаних ненаркотичних анальгетиків (табл. 5). Так, у перші три доби післяопераційного періоду добові дози в першій групі вірогідно перевищували такі в другій. Однак з третьої доби кількість використовуваних ненаркотичних анальгетиків не відрізнялась в обох групах. Таким чином, застосування післяопераційної перидуральної анальгезії забезпечує більш оптимальне післяопераційне знеболювання та ефективно знижує дозу знеболюючих засобів у ранньому післяопераційному періоді.
Отже, додаткове використання перидуральної анальгезії забезпечує краще післяопераційне знеболювання порівняно з фармакотерапією.
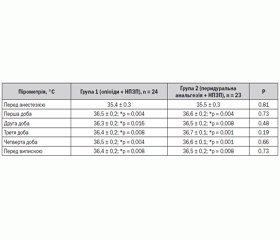
Динаміку мікроциркуляції в стопі нижньої кінцівки оцінювали за зміною місцевої температури на основі інфрачервоної дистанційної пірометрії (табл. 6). Температуру визначали на поверхні підошви хворої ноги. У процесі дослідження виявляли, що після реваскуляризації відбувається активне вирівнювання температури кінцівки в обох групах. Показники пірометрії протягом післяопераційного періоду в обох групах залишалися вірогідно вищими від доопераційних і знижувались лише при реоклюзії, що підтверджувалося як інструментально, так і клінічно. Таким чином, пірометрія в даній ситуації є критерієм успіху реконструктивної операції та малочутливим критерієм зміни циркуляції залежно від виду післяопераційного знеболювання, оскільки відмінності між показниками в першій та другій групах невірогідні.
Висновки
1. Фоновим базовим компонентом антиноцицептивної протекції в післяопераційному періоді є знеболюючий (наркотичний чи ненаркотичний) препарат, доза якого розділена пропорційно протягом доби згідно з рекомендаціями Фармакологічого комітету.
2. Коригуючим керованим компонентом недостатньої антиноцицептивної протекції в післяопераційному періоді є використання подовженої перидуральної анальгезії, що забезпечує покращання мікроциркуляції та адекватну корекцію больового синдрому.
3. Концентрація та загальна доза місцевого анестетика, що використовуються для введення в перидуральний простір, повинні забезпечувати лише селективний сенсорний (протибольовий) блок при збереженні моторної функції м’язів, що в даному дослідженні досягнуто за рахунок 0,25% бупівакаїну.
1. Кабаков Б.О. Динаміка показників ультразвукового дослідження за різних видів знеболювання у пацієнтів при оклюзуючій хворобі артерій нижніх кінцівок / Б.О. Кабаков // Клінічна хірургія. — 2012. — № 8. — С. 37-40.
2. Никульников П.И. Консервативное лечение пациентов по поводу критической ишемии нижних конечностей / П.И. Никульников, А.В. Ратушнюк, А.В. Ликсунов // Клінічна хірургія. — 2013. — № 7. — С.76-77.
3. Потапов А.Л. Сравнительная оценка индивидуальной реакции пациентов на применение различных методов послеоперационной аналгезии / А.Л.Потапов // Медицина невідкладних станів. — 2013. — № 6. — С. 171-173.
4. Смирнова Л.М. Органопротективность регионарной анестезии и антиноцицептивного внутривенного наркоза / Л.М. Смирнова // Біль, знеболювання і інтенсивна терапія. — 2012. — № 1. — С. 53-58.
5. Солярик С.О. Вплив контрольованої пацієнтом епідуральної аналгезії на запальну реакцію в післяопераційному періоді / С.О. Солярик, Ф.С. Глумчер, Ю.Л. Кучин // Біль, знеболювання і інтенсивна терапія. — 2012. — № 2. — С. 76-79.
6. Фесенко У.А. Опиоиды в лечении боли, что мы знаем о них сегодня? / У.А. Фесенко // Біль, знеболювання і інтенсивна терапія. — 2013. — № 1. — С. 34-46.
7. Черний В.И. Полимодальная послеоперационная аналгезия акупаном, дексалгином и налбуфином при резекции легкого / В.И. Черний, Н.Н. Смирнова, А.Н. Егоров // Острые и неотложные состояния в практике врача. — 2013. — № 1. — С. 9-10.
8. Шлапак І.П. Досвід використання гідроксіетилкрохмалю другої генерації в комплексній терапії під час оперативних втручань на черевній порожнині з використанням нейроаксіальної анестезії / І.П. Шлапак, С.М. Недашківський, А.П. Сидоренко // Медицина неотложных состояний. — 2013. — № 2(49). — С. 30-34.

/73/73.jpg)
/74/74.jpg)