Газета «Новости медицины и фармации» 14 (465) 2013
Вернуться к номеру
Современные подходы к лабораторной диагностике аллергических заболеваний
Авторы: Зайков С.В., д.м.н., профессор, Богомолов А.Е., к.м.н. - Винницкий национальный медицинский университет им. Н.И. Пирогова
Рубрики: Семейная медицина/Терапия, Аллергология
Разделы: Справочник специалиста
Версия для печати
 Традиционно диагностика аллергических заболеваний (АЗ) основана на последовательном (этапном) применении ряда методов исследования, к которым относят: 1) клинико-анамнестический (сбор жалоб и анамнеза); 2) физикальный; 3) кожные тесты с аллергенами; 4) провокационные (бронхиальные, назальные, конъюнктивальные, сублингвальные, гастроинтестинальные и пр.) тесты с ними; 5) лабораторно-инструментальный (общелабораторные методы и специфические лабораторные тесты с аллергенами); 6) функциональный и инструментальный (ринопневмометрия, спирография, пикфлоуметрия, эндоскопия полости носа и трахеобронхиального дерева, рентгенография и томография придаточных пазух носа и органов грудной клетки); 7) консультирование пациентов у других специалистов. В рамках данной статьи мы остановимся на современных подходах к лабораторной диагностике АЗ, рациональный выбор методов которой позволяет врачу не только диагностировать аллергопатологию, но и выявить гиперчувствительность (ГЧ) к «виновным» для пациента аллергенам (Ал).
Традиционно диагностика аллергических заболеваний (АЗ) основана на последовательном (этапном) применении ряда методов исследования, к которым относят: 1) клинико-анамнестический (сбор жалоб и анамнеза); 2) физикальный; 3) кожные тесты с аллергенами; 4) провокационные (бронхиальные, назальные, конъюнктивальные, сублингвальные, гастроинтестинальные и пр.) тесты с ними; 5) лабораторно-инструментальный (общелабораторные методы и специфические лабораторные тесты с аллергенами); 6) функциональный и инструментальный (ринопневмометрия, спирография, пикфлоуметрия, эндоскопия полости носа и трахеобронхиального дерева, рентгенография и томография придаточных пазух носа и органов грудной клетки); 7) консультирование пациентов у других специалистов. В рамках данной статьи мы остановимся на современных подходах к лабораторной диагностике АЗ, рациональный выбор методов которой позволяет врачу не только диагностировать аллергопатологию, но и выявить гиперчувствительность (ГЧ) к «виновным» для пациента аллергенам (Ал).
В основе современной лабораторной диагностики АЗ должны лежать современные стандартизованные и хорошо апробированные методы, имеющие доказательную базу. Это особенно важно в таких ситуациях:
- когда невозможно отменить противоаллергические препараты в периоде тестирования;
- имеется выраженная ГЧ к Ал и анафилактические реакции в анамнезе;
- обследование пациента проводится в периоде обострения АЗ;
- необходимо установить диагноз АЗ в раннем детском возрасте;
- имеется множественная ГЧ к Ал, а сроки обследования пациента ограничены;
- изменена реактивность кожи, что приводит к ложноотрицательным и ложноположительным результатам кожного тестирования;
- необходимо одновременное обследование пациента с использованием большого количества лекарственных препаратов и других химических веществ;
- имеет место сложный дифференциально-диагностический случай;
- обследование необходимо в период проведения аллергенспецифической иммунотерапии (АСИТ);
- возникает необходимость в дистанционном обследовании пациента.
Основными задачами лабораторной диагностики АЗ при этом являются:
- определение типов аллергической реакции (АР), установление ГЧ к Ал (специфическая аллергодиагностика);
- выявление характера и степени иммунных нарушений (иммунодиагностика);
- характеристика патогенетиче-ских звеньев, типичных для конкретного АЗ (клиническая лабораторная диагностика).
Прежде чем выбрать тот или иной лабораторный метод специфической аллергологической диагностики для конкретного пациента, врач-аллерголог анализирует анамнез, клинические проявления заболевания в прошлом и настоящем с целью определения круга предполагаемых Ал и типа АР. Следует учитывать, что существующие лабораторные методы выявляют только состояние сенсибилизации к определенным Ал, поэтому результаты лабораторной диагностики не могут служить единственным доказательством того, что именно данный Ал является этиологическим фактором АЗ. Поэтому в тандеме клиницист — лаборант именно клиницист должен опеределять стратегию и тактику диагностики АЗ.
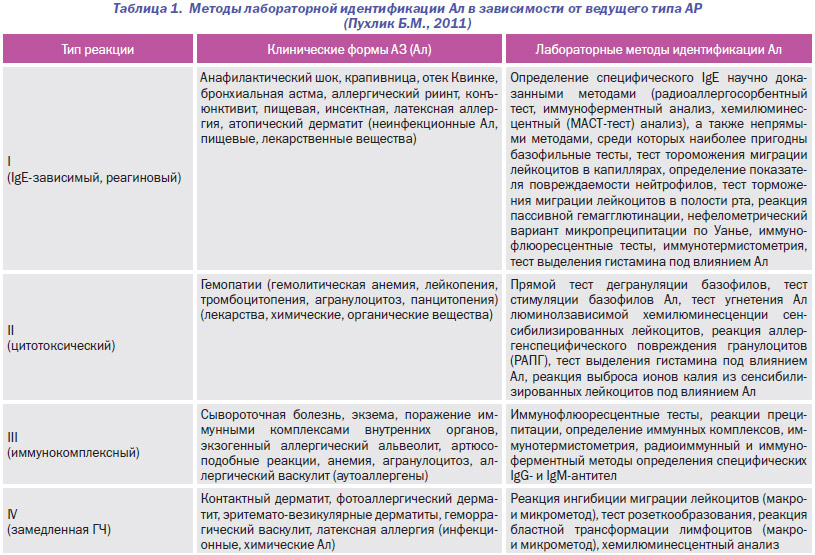
При планировании лабораторной диагностики и необходимости применения специфических методов исследования следует учитывать существующие различия в иммунологических механизмах различных типов АР, так как большинство лабораторных методов дает информацию лишь относительно конкретных участников иммунного реагирования (например, выявлять специфические антитела классов IgE при АР анафилактического типа, IgG или IgM при АР цитотоксического или иммунокомплексного типа, сенсибилизированные лимфоциты при АР замедленного типа). Таким образом, именно предположение клинициста о ведущих патогенетических механизмах АЗ у конкретного пациента обусловливает выбор адекватных методов его последующего лабораторного обследования, что нашло свое отражение в данных, приведенных в табл. 1.
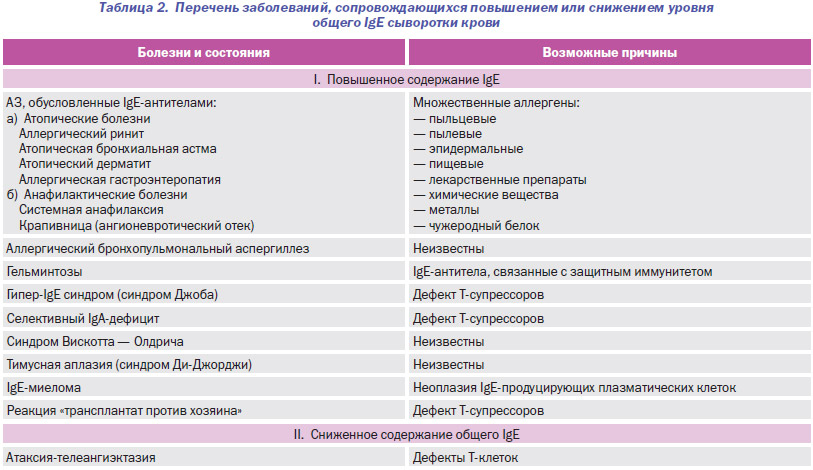
В практике клинико-диагностических лабораторий до сих пор проводится определение уровня общего IgE, хотя изолированная диагностическая ценность этого показателя в аллергологии невысока, поскольку повышение его уровня характерно не только для АЗ, а нормальные показатели общего IgE совершенно не исключают наличие аллергопатологии. В табл. 2 приведены основные причины изменения уровня общего IgE в сыворотке крови. В данной ситуации определение уровней общего IgE может играть лишь ориентировочную роль при обследовании пациентов с АЗ, в первую очередь из-за возможности наличия атопии без клинических проявлений. В связи с этим в настоящее время в странах ЕС и США его измерение практически не используется для скрининга и диагностики АЗ. Определение уровня общего IgE можно использовать при аллергическом бронхолегочном аспергиллезе для оценки эффективности фармакотерапии, для определения показаний к проведению терапии омализумабом и подбора начальных доз препарата.
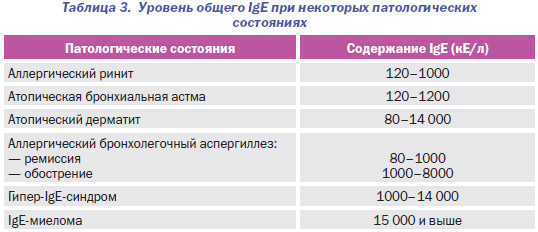
Кроме того, при АЗ уровень сывороточного общего IgE может варьировать в зависимости и от типа заболевания, что также снижает диагностическую ценность данного показателя (табл. 3).
В связи с этим при интерпретации показателей общего IgE следует учитывать ряд факторов.
1. Около 30 % больных АЗ имеют уровень общего IgE в пределах нормативных значений.
2. Часть больных бронхиальной астмой могут иметь ГЧ только к одному Ал, в результате чего уровень общего IgE может быть в пределах нормы, а результаты кожных проб и специфического IgE будут положительными.
3. Концентрация общего IgE в сыворотке крови также повышается при неатопических состояниях (глистная инвазия, иммунодефицитные состояния, бронхопульмональный аспергиллез) с по-следующей нормализацией ее после соответствующего лечения.
4. Хроническая рецидивирующая кра-пивница и ангионевротический отек не являются обязательными показаниями для определения общего IgE, так как чаще имеют неаллергическую природу.
5. Границы нормы, определенные для европейцев, не могут быть применены для представителей зон, эндемичных по гельминтозам.
В связи с вышесказанным значительно большую диагностическую ценность в аллергологии приобретает определение у пациента уровня специфических IgE. Основные показания и противо-показания для этого метода указаны ниже.
Показания и противопоказания к определению специфического IgE
Показания к исследованию
1. Дифференциальная диагностика между IgE-зависимым и не-IgE-зависимым механизмами АР.
Противопоказания к постановке кожных тестов.
2. Невозможность выявления Ал при помощи анамнеза, пищевого дневника и пр.
Противоречие между результатами прик-тестов и данными анамнеза.
3. Недостаточный эффект АСИТ, назначенной по результатам кожных проб.
4. Дермографизм и распространенный дерматит.
5. Ранний детский и пожилой возраст.
6. Гипо- или гиперреактивность кожи.
7. Невозможность отмены противоаллергической терапии препаратами, влияющими на результаты кожных проб.
8. Отрицательное отношение больного к кожным пробам.
9. Наличие в анамнезе системных АР на кожные пробы.
10. Несоответствие результатов кожных проб данным анамнеза и клинической картины АЗ.
11. IgE-зависимая пищевая аллергия.
12. Необходимость количественной оценки чувствительности и специфичности Ал.
13. Уровень общего IgE сыворотки крови более 100 кЕ/л.
Нецелесообразность исследования
1. АЗ с удовлетворительными результатами АСИТ по данным кожных проб.
2. Не-IgE-зависимый механизм АР.
К преимуществам методов определения специфических IgE (sIgE) для диагностики АЗ относятся: безопасность, отсутствие влияния на состояние кожи фармакопрепаратов, независимость от кооперации с пациентом (особенно с детьми), хорошая воспроизводимость, исключение ложноположительных и ложноотрицательных результатов кожных тестов, однократная инвазивность при заборе крови, возможность дистанционного обследования пациента. Однако данные методы имеют и недостатки: большая стоимость обследования и меньшая чувствительность по сравнению с кожными тестами, отсутствие в ряде лабораторий условий для их проведения, достаточно длительное время для получения результатов, возможность фиксации только циркулирующего IgE, наличие перекрестных реакций между ингаляционными и пищевыми Ал, невозможность распознавания небелковых Ал. Кроме того, определение уровня специфических IgE обычно менее чувствительно, чем проведение кожных прик-тестов с Ал, титр sIgE далеко не всегда связан с тяжестью симптомов АЗ, оценка значимости повышения концентрации сывороточного IgE зависит от метода исследования, вида Ал, возраста пациента и характера заболевания. В ряде случаев у пациентов регистрируются ложноположительные (вследствие повышенного уровня общего IgE, формирования иммунных комплексов IgG-IgE и генерации ложного связывания IgE) или ложноотрицательные (вследствие выработки специфических анти-IgE-антител класса IgG, возможности связывания части общего уровня IgE перекрестными Ал, связывания sIgE с тучными клетками до их обнаружения в сыворотке). В связи со всем этим данный вид лабораторного тестирования не рекомендуется проводить изолированно без сбора анамнеза и кожных проб с Ал.
В настоящее время существует не просто несколько методов, а несколько принципиально различающихся подходов к определению sIgE, рациональный выбор которых определяется как клинической задачей и декларированными преимуществами того или иного метода, так и некоторыми специфическими ограничениями, существующими для большинства из них. Так, методы определения sIgE в первую очередь делятся на выполняемые in vivo и in vitro. Тесты in vivo используются для определения ГЧ к индивидуальным Ал, но, к сожалению, имеют целый ряд не только аналитических, но и серьезных клинических ограничений. Тесты для определения специфических IgE in vitro разрабатываются с 1960-х годов, а подход к in vitro диагностике sIgE несколько раз подвергался ключевым изменениям, что отразилось в понятии «новое поколение» in vitro тестов для sIgE. Все без исключения методы in vitro определения абсолютно безопасны для пациента, поскольку не требуют внесения в организм больного дополнительных количеств Ал. Кроме того, при определении аллергенспецифических антител in vitro возможно определение не только отдельных Ал, но и их «панелей» — групп из нескольких родственных Ал, иммобилизованных на твердофазном носителе. Подобный подход очень удобен при обследовании больных с множественной сенсибилизацией к различным АЛ. Он в значительной мере позволяет снизить количество шагов на пути от первоначального направления на анализ до получения его результатов. С одной стороны, это экономически выгодно, поскольку означает снижение общей стоимости исследования и его продолжительности. С другой стороны, «панельное» исследование дает возможность прогнозировать риск развития АР при контакте с новыми Ал, гомологичными к уже имеющимся в списке пациента.
Однако существенным ограничением применения in vitro методов до последнего времени служил тот факт, что они направлены на регистрацию аллергенспецифических IgE-антител, циркулирующих в крови. Поскольку продолжительность жизни свободных IgE не превышает нескольких дней, то наибольшая достоверность результатов in vitro исследований достигается при анализе проб, отобранных в острой фазе AЗ. В настоящее время существуют методы, направленные на регистрацию аллергенспецифических IgG, G4, A-антител, что существенно повышает шанс обнаружения причинно-значимых Ал вне зависимости от времени обострения АЗ.
Иммуноферментный анализ (ИФА, enzyme-linked immunosorbent assay, ELISA), с помощью которого проводится количественное определение аллергенспецифических IgE в крови больного, основывается на том, что на первом этапе исследования испытуемый Ал ковалентно связывается с твердой фазой (бумажный диск, активированный полимер и др.). При добавлении сыворотки больного происходит связывание Ал, фиксированного на твердой фазе, с антителом, если в сыворотке присутствуют соответствующие данному Ал антитела. После отмывания несвязавшихся IgE добавляются антитела против IgE, меченные флуорохромом (пероксидазой хрена, бета-галактозидазой и др.). В дальнейшем происходит образование комплекса: Ал на твердой фазе + специфический IgE + антитела анти-IgE (антитела против IgE). Несвязавшиеся антитела удаляются. Уровни специфического IgE-связывания определяются по интенсивности свечения (реакция оценивается в интервале 1–4-го класса). Чем выше показатель свечения по отношению к негативному контролю (сыворотка, в которой отсутствуют специфические IgE-антитела), тем больше специфических IgE в сыворотке пациента. Специфический характер реакции учитывается на основе позитивного контроля (IgE-связывание интенсивностью 4-го класса). Ценность этого метода состоит в том, что для его проведения сразу с большим количеством Ал требуется небольшое количество сыворотки крови.
Иммуноблоттинг (иммуноблот) является высокоспецифичным и высокочувствительным референтным методом, подтверждающим диагноз для пациентов с положительными или неопределенными результатами анализов, полученных в том числе при помощи реакции пассивной гемагглютинации или ИФА. Этот метод выявления антител к отдельным Ал основан на постановке ИФА на нитроцеллюлозных мембранах, на которые в виде отдельных полос нанесены специфические белки, разделенные гель-электрофорезом. В том случае, если имеются антитела против определенных антигенов, появляется видимая темная линия в соответствующем локусе стрипа. Уникальность иммуноблота заключается в его высокой информативности и достоверности получаемых результатов. При проведении исследования используют наборы двух типов — вестерн-блот и лайн-блот.
Наборы вестерн-блот содержат тестовые стрип-мембраны с электрофоретически разделенными нативными антигенами соответствующих Ал в порядке их молекулярной массы. На мембраны могут быть также нанесены 1–2 дополнительные линии с клинически значимыми антигенами (вестерн-, лайн блот). Это надежный подтверждающий метод, исключающий ложноположительные ответы и перекрестные реакции;
В наборах лайн-блот на тестовые стрип-мембраны нанесены только клинически значимые антигены (нативные, синтетические или рекомбинантные) в определенном порядке. Такой подход используется при дифференциальной диагностике нескольких Ал на одном стрипе.
Иммунохроматографический анализ (ИХА) основан на разделении частиц методом парной связки и реакции между антигеном/Ал и соответствующим ему антителом в биологических материалах (цельная кровь, сыворотка или плазма крови и пр.). Данный вид анализа проводится с помощью специальных экспресс-тестов, тест-полосок или тест-кассет. Взаимодействие (и окрашенная полоса) в контрольной зоне должны проявляться всегда, если анализ проведен правильно, независимо. В экспресс-тестах используются три типа антител:
- подвижные моноклональные антитела к исследуемому антигену или антителу, конъюгированные (сшитые) с коллоидным золотом — красителем, который можно легко идентифицировать даже в самых малых концентрациях. Эти антитела нанесены вблизи участка погружения тест-полоски в физиологическую жидкость;
- поликлональные антитела к исследуемому антигену или антителу, жестко иммобилизованные в тест-зоне полоски;
- вторичные антитела к моноклональным антителам, жестко иммобилизованные в контрольной зоне тест-полоски.
Технология ImmunoCAP определения аллергенспецифических IgE, в основе которой лежит полностью автоматизированное иммуноферментное определение аллергенспецифических IgE с хемилюминесцентным способом регистрации результатов. Идея данной технологии заключается в возможности обнаружения сверхнизких концентраций IgE-антител и других показателей в сверхмалом количестве крови пациента, что технически реализуется путем использования специального вспененного материала, производного бромцианактивированной целлюлозы. Благодаря своей пористой структуре материал имеет большую поверхность взаимодействия и обеспечивает высокую связывающую способность с нанесенным на него антигеном или антителом. Поверхность взаимодействия такого материала в 150 раз больше внутренней поверхности обычной пробирки. Для использования в автоматических установках, хранения и маркирования этот материал помещают в миниатюрный открытый специальный пластмассовый колпачок — CAP, специальная система промывки которого позволяет всего за несколько секунд получить полное отделение несвязанного вещества от пористого материала. Все это обеспечивает высокую точность исследований, их воспроизводимость и быстроту выполнения.
В настоящее время сформулированы особенности интерпретации исследований уровня sIgE, к которым традиционно относят: 1) доступность определения sIgE не должна преувеличивать его диагностическую роль в обследовании больных с АЗ; 2) обнаружение аллергенспецифического IgE (к какому-либо Ал или антигену) не доказывает, что именно этот Ал ответственен за клиническую симптоматику АЗ, в связи с чем окончательное заключение и интерпретация лабораторных данных должны быть сделаны только после их сопоставления с клинической картиной и данными анамнеза; 3) отсутствие sIgE в сыворотке крови не исключает возможности участия IgE-зависимого механизма, так как местный синтез IgE и сенсибилизация тучных клеток может происходить и в отсутствие sIgE в кровотоке (например, аллергический ринит); 4) антитела других классов, специфичные для данного Ал, особенно класса IgG (IgG4), могут быть причиной ложноотрицательных результатов; 5) исключительно высокие концентрации общего IgE могут за счет неспецифического связывания с Ал давать ложноположительные результаты; 6) идентичные результаты для разных Ал не означают их одинакового клинического значения, так как способность к связыванию с IgE у разных Ал может быть различной.
В последние годы в аллергологии все большее значение приобретают иммунологические лабораторные тесты, которые условно можно разделить на 2 большие группы:
- неспецифические (направленные на выявление общих изменений иммунной системы при АЗ);
- специфические (выявление участвующих в иммунологической фазе АР антител и клеток).
В качестве неспецифических используют общий анализ крови, уровень скорости оседания эритроцитов (СОЭ), С-реактивного белка, тесты для определения субпопуляций Т- и В-лимфоцитов, уровня Ig различных классов, комплемента, циркулирующих иммунных комплексов (ЦИК), различных аутоантител (например, при крапивнице), медиаторов аллергического воспаления и цитокинов, в большей степени участвующих в иммунном ответе на Ал: интерлейкин-4 (IL-4) — активация продукции IgE, IL-10, IL-5, гамма-интерферона и других. При этом определение абсолютного числа лимфоцитов, абсолютного количества Т-клеток CD4+ и соотношения CD4+CD8+ относят к простым и экономичным лабораторным тестам для диагностики Т-связанных реакций ГЧ замедленного типа. Через 6–18 часов после реакции с Ал на сенсибилизированных лимфоцитах усиливается экспрессия рецепторов к IL-2, уровень которой можно оценить с помощью моноклональных антител к CD25-антигену. С этой же целью можно определять наличие на лимфоцитах других молекул активации — CD69, CD71. Известно, что при стимуляции лимфоцитов Ал усиливается выделение IL-5, IL-4, гамма-интерферона, но не IL-2 и фактора некроза опухоли альфа. АЗ могут сопровождаться изменениями картины периферической крови и уровня ее белковых фракций. При этом часто наблюдаются лимфоцитоз, возрастание содержания белковых фракций, снижение уровня тромбоцитов и альбуминов, повышение СОЭ, содержания лейкоцитов и эозинофилов. Оценка активации комплемента и выявление снижения его С3- и С4-компонентов, увеличения уровня ЦИК может свидетельствовать в пользу ГЧ к лекарственным препаратам, протекающей по иммунокомплексному типу.
Специфические IgG- и IgG4-тесты позволяют определить наличие аллергенспецифических IgG и IgG4 в сыворотке/плазме крови человека. Измерения уровня специфических IgG/IgG4 антител при помощи ИФА и иммунохроматографии используют в клинических исследованиях не только при АЗ, но и при пневмомикозах. Так, в процессе контроля эффективности АСИТ при инсектной аллергии у части больных наблюдается повышение уровня IgG и/или IgG4, которые считаются биомаркерами ГЧ к соответствующим Ал. Однако эти данные единичны и не нашли пока достаточного подтверждения. Определение IgG и их субклассов при пищевой аллергии не имеет клинического значения, так как регистрируется и у лиц без признаков аллергопатологии.
Специфический IgA-тест позволяет определить аллергенспецифические IgА, являющиеся частью естественной иммунной системы защиты организма, в сыворотке/плазме крови человека при помощи ИФА. Данные антитела присутствуют в слюне, на слизистой оболочке, а также в крови. Уровни специфического IgA могут возрастать при ответе иммунной системы на пищевые Ал.
Определение уровня высвобождения гистамина и лейкотриенов из базофилов после инкубации их с Ал относится к ценным методам лабораторной диагностики АЗ, хотя его проведение возможно только в хорошо оснащенных лабораториях. Так, возможно измерение уровня гистамина и его метаболита (N-метилгистамина) в моче через 24 часа после развития анафилаксии. К лейкотриеновым тестам относится тест антигенной стимуляции базофилов (CAST® — Cellular Antigen Stimulation Test), технология которого основана на определении сульфидолейкотриенов (LTC4, LTD4, LTE4), секретируемых примированными IL-3 базофилами под действием Ал in vitro. Его также называют провокационным тестом in vitro. Благодаря синтезу сульфидолейкотриенов (sLT) de novo анализ CAST® обладает высочайшей специфичностью по сравнению с классическим тестом высвобождения гистамина. Протокол исследования включает три этапа: выделение популяции лимфоцитов из стабилизированной ЭДТА крови, стимуляцию лимфоцитарной суспензии специфическими Ал и ИФА синтезированных базофилами во время стимуляции лейкотриенов.
Компанией Buhlmann laboratories также был разработан цитометрический вариант теста стимуляции базофилов — FLOW-CAST® (FAST). Этапы выделения лимфоцитов и стимуляции их антигенов для обоих вариантов (иммуноферментного и цитометрического) идентичны. Но вместо sLT на третьем этапе определяется количество активированных базофилов, экспрессирующих на поверхности антиген CD63 (gp53) в ответ на стимуляцию Ал. Тест обладает высокой чувствительностью и специфичностью при реакциях анафилактического типа, особенно при лекарственной ГЧ.
Триптаза высвобождается из тучных клеток в процессе реакций анафилактического типа, что позволяет судить об их активности. Она более стабильна, чем гистамин, и легче идентифицируется. В связи с этим одним из методов оценки риска развития анафилаксии у пациентов с инсектной, лекарственной аллергией или при проведении АСИТ может быть определение альфа- и особенно бета-триптазы в сыворотке/плазме крови или назальном секрете. Так, триптаза, особенно бета-форма, может быть обнаружена в крови через 4 часа после анафилактической реакции и в этой ситуации служит клиническим маркером анафилаксии. Так, при уровне триптазы крови > 10 мкг/л существует высокая вероятность развития анафилаксии при проведении АСИТ. Однако следует помнить, что уровень обоих форм триптазы увеличивается у пациентов с системным мастоцитозом. Кроме того, данный тест пока еще не входит в число популярных в Украине.
Обнаружение эозинофилов в различных биологических жидкостях с высокой степенью достоверности коррелирует с диагнозом аллергического ринита, бронхиальной астмы и эозинофильного бронхита. Однако обнаружение эозинофилии в крови может свидетельствовать не только в пользу АЗ, но и ряда иммунодефицитных состояний (хроническая гранулематозная болезнь, реакция отторжения трансплантата, гипер-IgE-синдром, селективный IgА-дефицит, синдром Вискотта — Олдрича), паразитарных инвазий, заболеваний кожи (буллезный пемфигоид, кожно-слизистый кандидоз, ангиолимфоидная гиперплазия, ихтиоз, псориаз, герпетиформный дерматит Дюринга, герпетическая инфекция и пр.), желудочно-кишечного тракта (болезнь Крона, эозинофильный гастроэнтерит, язвенный колит и пр.), инфекционных (туберкулез, бруцеллез, хламидийная инфекция, мононуклеоз и пр.), аутоиммунных (дерматомиозит, синдром Фелти, системная красная волчанка, реавматоидный артрит, системная склеродермия), неопластических и миелопролиферативных (острая лимфоцитарная лейкемия, ангиоиммунобластическая лимфаденопатия, карциноматоз, эозинофильная гранулема, гистицитоз, системный мастоцитоз и пр.), гематологических (полицитемия, постспленэктомический синдром, перцинозная анемия и пр.) заболеваний, а также гормонального дисбаланса (микседема, тиреотоксикоз и пр.) и других заболеваний (склеродермоподобный синдром, синдром Гудпасчера, наследственная эозинофилия, гипоксия, перитонеальный диализ, саркоидоз и пр.).
Повышение уровня эозинофильного катионного протеина (ЕСР) (маркер активации эозинофилов) и хемоаттрактантов в биологических жидкостях могут являются индикаторами аллергического воспаления. Так, ECP-тест дает возможность определить уровень ЕСР в сыворотке крови, хотя его уровень — очень вариабельный показатель и не всегда повышен при АЗ (например, при аллергическом рините), но может отмечаться его повышение при паразитарных инфекциях, неаллергическом рините с эозинофильным синдромом, назальных полипах. Поскольку ECP освобождается из активированных эозинофилов в ходе воспалительного процесса при бронхиальной астме и аллергическом рините, то определение его уровня методами ИФА и иммунофлюоресценции позволяет судить об активности воспаления, эффективности лечения и уровне контроля этих заболеваний.
Иммунодиффузия (метод Ухтерлони) используется для диагностики ГЧ иммунокомплексного типа, в частности, при выявлении антител против сыворотки голубя (легкие любителя птиц) и антител против аспергилл (легочный аспергиллез). Тестируемая сыворотка наносится в лунку в центр чашки с агаром, а антигены в различных концентрациях помещают в лунки вокруг. Антигены и антитела начинают диффундировать через гель по направлению друг к другу. В случае присутствия в тестируемой сыворотке специфических антител начинают формироваться комплексы антиген-антитело, создавая линию преципитации.
Согласно результатам всех вышеуказанных исследований можно выделить достаточно типичные изменения состояния иммунной системы, которые возникают при АЗ:
- изменение количества Т-хелперов (фенотип CD3+, CD4+);
- повышение уровней IgG, IgM, общего IgE;
- повышение уровня ЦИК, особенно мелких размеров;
- повышение уровня активированных Т-лимфоцитов (HLA-DR+, CD25+);
- снижение абсолютного и относительного уровня Т-клеток (фенотип CD3+, CD8+);
- изменение уровня цитокинов — повышение концентрации IL-4 и IL-5, снижение содержания гамма-интерферона;
- снижение фагоцитарной активности нейтрофильных гранулоцитов;
- повышение уровня катионного белка эозинофилов (измерение уровня эозинофильного катионного белка является эффективной оценкой степени эозинофильного воспаления).
Следует также подчеркнуть, что вследствие отсутствия доказательств эффективности не рекомендуется применение цитотоксических тестов, реакций провокации-нейтрализации, электрокожного тестирования, кинезиологии, иридологии, анализа по волосам или определение пищеспецифических IgG и их субклассов. Некорректным в связи с этим является также использование в аллергологии тестов, достоверность которых невозможно объяснить с позиций современной науки (метод Фоля, различные варианты резонансной диагностики и пр.), а также малоинформативные тесты, дающие большое количество ложноположительных и ложноотрицательных результатов (лейколизиса, лейкергии и пр.). Применение подобных тестов вводит в обман пациентов, дезориентирует врачей, препятствует эффективному процессу диагностики и лечения АЗ. Таким образом, для успешной диагностики АЗ важнейшее значение имеет правильный анализ и адекватная оценка данных аллергологического, фармакологического и пищевого анамнеза, клинической картины заболевания, результатов кожных и других провокационных тестов с аллергенами, специфических лабораторных, а также общелабораторных и инструментальных методов исследования. Только комплексное обследование пациента способно помочь врачу в постановке диагноза аллергопатологии и определении виновных в его развитии аллергенов.