Газета «Новости медицины и фармации» 4 (445) 2013
Вернуться к номеру
Эторикоксиб в лечении боли и воспаления
Рубрики: Ревматология, Травматология и ортопедия
Разделы: Справочник специалиста
Версия для печати
Нестероидные противовоспалительные препараты (НПВП) применяются в лечении самых различных состояний и заболеваний, сопровождающихся воспалением и болью. Применение этих препаратов растет, в частности, в связи с повышением продолжительности жизни людей и связанным с ним увеличением распространенности ряда заболеваний. В особенности это касается хронических заболеваний опорнодвигательного аппарата. Несмотря на существование большого количества различных представителей класса нестероидных противовоспалительных препаратов, поиск новых веществ продолжается. В значительной степени это связано с необходимостью улучшения профиля безопасности при оптимальном соотношении обезболивающих и противовоспалительных эффектов.
Чаще всего НПВП применяют в рамках комплексного лечения боли и воспаления, связанных с остеоартритом (ОА) и ревматоидным артритом (РА). Заболевания опорнодвигательного аппарата встречаются часто и обычно характеризуются прогрессирующим течением и выраженной инвалидизацией. Эти состояния связаны со значительным социальным, экономическим бременем и снижением продуктивности. Ревматоидный артрит, остеоартрит и боль в спине — состояния, которые имеют наибольшие социальные последствия. В Соединенных Штатах заболевания опорнодвигательного аппарата, которые включают боль в спине, артрит, травмы и остеопороз, встречаются чаще, чем любые другие заболевания (The Burden of Musculoskeletal Diseases in the United States, 2008). Среди этих заболеваний ОА является наиболее часто встречающейся патологией суставов, частота которой у лиц в возрасте 60 лет и старше достигает 10 % среди мужчин и 13 % — среди женщин (Zhang и Jordan, 2010). Более того, показатель распространенности будет расти в связи со старением населения и эпидемией ожирения.
Современные подходы к лечению этих заболеваний разнообразны, но на той или иной стадии становится необходимым применение медикаментозной терапии, направленной на угнетение воспаления и боли. При ОА и РА обычно назначают НПВП, однако последние также имеют весомое значение и в лечении других болевых синдромов — боли в спине, боли при анкилозирующем спондилоартрите и других видов боли (зубная боль, головная боль) (Argoff, 2002).
Действие НПВП осуществляется за счет ингибирования фермента циклооксигеназы (ЦОГ). Последний имеет две изоформы — ЦОГ1 и ЦОГ2. Неселективные препараты ингибируют ЦОГ1, с чем связывают их побочные эффекты на желудочнокишечный тракт (ЖКТ): диспепсию, кровотечение, формирование язв и прочие. В связи с попытками создать НПВП, которые не влияли бы на активность ЦОГ1 и таким образом реже вызывали бы побочные эффекты со стороны желудочнокишечного тракта, были синтезированы селективные ингибиторы ЦОГ2, представителем которых является эторикоксиб. Эторикоксиб — инновационный препарат, высокоселективный ингибитор ЦОГ2 с уникальными свойствами, основанными на новой химической формуле. Результаты ряда рандомизированных клинических исследований (РКИ), в которых сравнивали селективные ингибиторы ЦОГ2 и традиционные НПВП, подтвердили правильность этих соображений (Bombardier и соавторы, 2000; Hunt и соавторы, 2003; Farkouh и соавторы, 2004; Ramey и соавторы, 2005; Combe и соавторы, 2009).
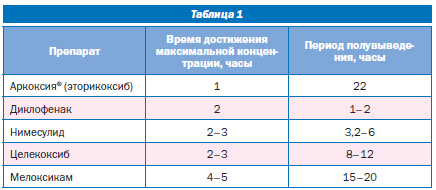
Результаты клинических исследований демонстрируют, что действие эторикоксиба развивается быстро, в течение примерно получаса после приема, и длится в течение суток. Фармакокинетику эторикоксиба в дозах от 5 до 120 мг изучали в рандомизированном открытом исследовании однократного приема увеличивающихся доз с участием 12 здоровых добровольцев в возрасте от 25 до 60 лет (средний возраст 36 лет). Биодоступность эторикоксиба при пероральном приеме приближалась к 100 %. Максимальная концентрация в плазме (Сmax) и площадь под кривой «концентрация в плазме — время» были пропорциональны дозе препарата в диапазоне до 120 мг. Пиковые концентрации в плазме наблюдались примерно через 1 час после приема препарата, а период полувыведения (t1/2) был равен приблизительно 22 часам (Friesen R., Dube D., Fortin R. еt al., 1998).
Фармакокинетика препарата линейна и пропорциональна дозе. Примечательно, что время достижения максимальной концентрации в плазме очень короткое (1 час), а период полувыведения длительный (22 часа); для сравнения: аналогичные показатели для диклофенака натрия составляют 2 и 1–2 часа, нимесулида — 2–3 и 3,2–6 часов, целекоксиба — 2–3 и 8–12 часов, мелоксикама — 4–5 и 15–20 часов (табл. 1).
Фармакологические особенности данного препарата и быстрое развитие обезболивающего эффекта стали предпосылкой для применения его в хирургической практике. Эторикоксиб накапливается в больших концентрациях в тканях и синовиальной жидкости, где эффективно блокирует синтез простагландинов, обеспечивая таким образом выраженный противовоспалительный и обезболивающий эффекты. Значимая концентрация препарата, приводящая к ингибированию ЦОГ2, достигается в экссудате послеоперационной раны при протезировании тазобедренного сустава в течение 2 часов. Быстрое и длительное блокирование образования простагландинов в зоне оперативного вмешательства позволяет рассматривать этот препарат как потенциальный ингибитор гетеротопной оссификации — одного из осложнений эндопротезирования.
Кроме упомянутых выше работ интересно остановиться на исследовании Lin и соавторов (2010), которые изучали эффективность эторикоксиба в реальной клинической практике в рамках мультицентрового проспективого открытого исследования.
Многоцентровое проспективное открытое исследование проводилось на одной группе пациентов с диагнозом «остеоартрит» (n = 500), принимавших нестероидные противовоспалительные препараты или другие анальгетики, включая опиоиды (целекоксиб — 20,6 % пациентов, мелоксикам — 16,4 %, ацетаминофен — 12,6 %, диклофенак — 11,6 %, этодолак — 7,2 %, ультрацет — 5,8 %, тиапрофеновая кислота — 2,8 %, напроксен — 1,4 %), и имевших, по мнению лечащего врача, неадекватный ответ на принимаемую терапию (≥ 40 мм по 100мм визуальной аналоговой шкале оценки боли (ВАШ)). Оценка эффективности проводилась спустя 4 недели применения вышеуказанных препаратов. После подтверждения недостаточной эффективности принимаемой терапии (≥ 40 мм по 100мм ВАШ) пациенты были переведены на прием эторикоксиба в режиме 60 мг 1 раз в день сроком на 4 недели, без предварительного отмывочного периода после принимаемой ранее терапии. Первичной конечной точкой был процент пациентов с улучшением на ≥ 30 % по шкале индекса выраженности боли при остеоартрите университетов Западного Онтарио и Макмастера (WOMAC) — оценивалась боль, возникающая при ходьбе по ровной поверхности после 4 недель лечения. Вторичная конечная точка включала оценку по подшкале боли WOMAC, подшкале скованности и функциональной активности, краткому опроснику по боли (Brief Pain Inventory — BPI), шкале общей оценки исследователем ответа пациента на терапию (Investigator Global Assessment of Response to Therapy — IGART), показатели по которой тесно связаны со степенью воспаления, боли и отечности сустава, опроснику для пациента об удовлетворенности от получаемой терапии (Treatment Satisfaction Questionnaire for Medication — TSQM), краткой форме опросника общего состояния здоровья (SF36). Оценка безопасности и переносимости производилась в процессе анализа неблагоприятных явлений.
После 4 недель терапии эторикоксибом авторы наблюдали существенное улучшение состояния пациентов, что подтверждалось изменениями оценок по шкале WOMAC (индекс боли, скованность и функциональная активность) и BPI — у 66,4 % пациентов отмечалось значительное (³ 30 %) снижение выраженности болевого синдрома после переключения на терапию эторикоксибом. Кроме того, эторикоксиб способствовал улучшению качества жизни пациентов благодаря купированию боли и воспаления: в исследовании Lin и соавторов (2010) после перевода на терапию эторикоксибом с других НПВП ученые отмечали достоверное улучшение настроения, улучшение общей и двигательной активности, а также способности выполнять повседневную работу, восстановление сна (р < 0,0001). Об улучшении качества жизни пациентов свидетельствовали результаты заполненного ими опросника SF36.
Таким образом, авторы пришли к выводу, что в связи с недостаточной эффективностью НПВП и других анальгетиков, принимаемых пациентами с ОА, перевод на терапию эторикоксибом позволил добиться клинически значимого улучшения состояния пациентов — снижения индекса боли, уменьшения скованности и повышения функциональной активности (р < 0,0001).
Однако в некоторых работах — РКИ и обсервационных исследованиях высказывалось предположение о том, что длительное применение селективных ингибиторов ЦОГ2 и традиционных НПВП может быть связано с повышенным риском сердечнососудистых тромботических событий по сравнению с плацебо. В свете этих данных крайне интересными представляются результаты программы MEDAL (Multinational Etoricoxib and Diclofenac Arthritis Longterm programme), которая была проведена с целью проспективной оценки кардиоваскулярных и желудочнокишечных рисков, связанных с приемом селективного ингибитора ЦОГ2 эторикоксиба и традиционного НПВП диклофенака.
MEDAL представляет собой программу, состоящую из трех исследований — EDGE, EDGE II и MEDAL. В программу был включен 34 701 пациент на базе 1380 центров клинических исследований из 46 стран с июня 2002 по май 2006 года. Целью исследования MEDAL было сравнение числа подтвержденных тромботических сердечнососудистых (СС) событий в группе пациентов, принимавших эторикоксиб (60 или 90 мг 1 раз в сутки при ОА и 90 мг при РА), и в группе пациентов, принимавших диклофенак (150 мг в сутки).
В исследованиях EDGE и EDGE II сравнивалась переносимость эторикоксиба и диклофенака со стороны ЖКТ у пациентов с ОА и РА.
В программе МЕDAL 3661 (10,6 %) пациент был с диагнозом «сахарный диабет», 16 319 (47 %) — с диагнозом «артериальная гипертензия»; 4071 (11,7 %) являлись курильщиками и 3874 (11,2 %) имели в анамнезе клинические проявления атеросклероза.
Пациенты были случайным образом распределены на группы для получения эторикоксиба в дозе 60 или 90 мг или диклофенака 150 мг. Средняя продолжительность лечения составляла 18 месяцев. По результатам программы MEDAL общее число зарегистрированных тромботических СС событий в группе эторикоксиба составило 320 случаев, в группе диклофенака — 323 случая, но профиль желудочнокишечной безопасности был лучше у эторикоксиба, и количество неблагоприятных явлений со стороны печени, которые были причиной преждевременного прекращения участия пациентов в исследовании, также было меньше в группе эторикоксиба. Эффективность эторикоксиба в лечении основного заболевания (ОА или РА) в дозах 60 и 90 мг была сопоставима с таковой диклофенака натрия, применяемого в максимальной суточной дозе 150 мг. Частота прекращения лечения в связи с неблагоприятными явлениями и частота серьезных неблагоприятных явлений не различались во всех группах.
Стоит отметить, что эторикоксиб чаще отменяли в связи с артериальной гипертензией. Среднее изменение артериального давления на фоне терапии эторикоксибом было невелико и составляло около 1 мм рт.ст. по сравнению с исходным систолическим АД на визите рандомизации. Однако подъем артериального давления — известный классовый эффект, свойственный как традиционным НПВП, так и селективным ингибиторам ЦОГ2 (метаанализ Aw T.J., 2005).
Krum и соавторы (2011) также изучали данные, представленные в программе MEDAL. Последняя, как уже было отмечено, является не просто крупнейшим исследованием по изучению эффективности и переносимости НПВП при ОА и РА, но и первой работой подобного рода, в которой сердечнососудистые исходы рассматривали как первичные конечные точки. Несмотря на разницу систолического артериального давления на 2 мм рт.ст. по сравнению с исходным (на момент включения в исследование) среди лиц, получавших эторикоксиб (по сравнению с диклофенаком), которая в кардиологических исследованиях считается значимой, не наблюдали существенной разницы в сердечнососудистых исходах между группами диклофенака и эторикоксиба в течение 18месячного периода наблюдения. Исходя из этих соображений, авторы проанализировали взаимосвязь между изменением АД, вызванным НПВП и ингибиторами ЦОГ2, и сердечнососудистыми исходами, оценив влияние исходного артериального давления и его изменения во время лечения на развитие сердечнососудистых событий в рамках программы MEDAL.
Ключевыми результатами упомянутого анализа было то, что исходное АД было тесно связано с последующими исходами, в частности со смертностью от всех причин и прогрессированием сердечной недостаточности. Эти данные в полной мере сопоставимы с данными Framingham когорты, согласно которым большее систолическое АД и исходное пульсовое давление — основные предикторы будущих сердечнососудистых событий. Особо интересным в плане связи терапии селективными ингибиторами ЦОГ2 с большими сердечнососудистыми событиями представляется отсутствие связи между изменениями АД после рандомизации и последующими сердечнососудистыми событиями.
Таким образом, авторы выявили связь между исходными показателями АД и последующими сердечнососудистыми событиями, но изменение АД во время лечения традиционными НПВП или ингибитором ЦОГ2 не было связано с этими событиями. Однако стоит отметить, что более низкий риск сердечнососудистых событий имели пациенты, которые контролировали АД; в связи с этим очень важной представляется значимость контроля АД во время терапии традиционными НПВП и ингибиторами ЦОГ2. Так, данные анализа свидетельствуют о том, что повышение сердечнососудистого риска на фоне терапии традиционными НПВП и ингибиторами ЦОГ2 не связано с их гипертензивными эффектами.
Ингибирование селективными ингибиторами ЦОГ2 простагландина I2 и E2 в сосудистой стенке без сопутствующего торможения TxA2 может способствовать развитию артериальной гипертензии и тромбоза, тем самым повышая сердечнососудистый риск. Кроме того, удаление гена ЦОГ2 в эндотелиальных и гладкомышечных клетках приводит к снижению синтеза и высвобождения оксида азота — мощного вазодилататора, в связи с чем уменьшается релаксация сосудов.
В работе Yu и соавторов (Source Vascular COX2 modulates blood pressure and thrombosis in mice, 2012) сообщается о том, что повышение кардиоваскулярного риска не является побочным эффектом отдельного препарата, но скорее представляется прямым следствием фармакологического ингибирования ЦОГ2. Более того, эти риски характерны для всех НПВП, как селективных, так и неселективных.
Наконец, эторикоксиб применяли в качестве альтернативы другим НПВП у лиц с аллергическими реакциями на эти препараты. Известно, что НПВП являются частой причиной реакций гиперчувствительности. Pagani и соавторы (2010) изучали в рамках простого слепого исследования переносимость эторикоксиба у 139 пациентов с аллергией к НПВП (у 83 пациентов зафиксированы реакции на один препарат, а у 56 — на несколько). Непереносимость эторикоксиба отмечалась только у 4 пациентов (2,8 %). Полученные результаты свидетельствуют о хорошей долгосрочной переносимости эторикоксиба у пациентов с гиперчувствительностью к другим НПВП без различий между лицами с непереносимостью одного или нескольких препаратов.
В завершение стоит отметить, что эторикоксиб обладает выраженным обезболивающим и противовоспалительным эффектом, проникает в ЦНС в эффективной концентрации (B. Renner, J. Zacher, A. Buvanendran et al., 2009) и имеет хороший профиль безопасности. Кроме благоприятного гастроинтестинального профиля, терапия эторикоксибом не сопряжена с дополнительными по сравнению с другими НПВП кардиоваскулярными рисками, которые, как сообщается в работах некоторых авторов, скорее связаны с исходными показателями функционирования сердечнососудистой системы, чем с терапией НПВП.
Подготовил Константин Кремец
Данный материал предоставлен компанией MSD в качестве профессиональной поддержки для специалистов в области медицины. Информация, относящаяся к любому продукту, может быть не согласована с информацией по медицинскому применению данного продукта. Просим ознакомиться с полной информацией по медицинскому применению продукта для получения официально утвержденной информации по любым продуктам, обсуждаемым в данной публикации, до их назначения пациентам.
Список литературы находится в редакции

