Газета «Новости медицины и фармации» Антимикробная терапия и пульмонология (408) 2012 (тематический номер)
Вернуться к номеру
Клиническая фармакология макролидов
Авторы: В.В. Косарев, д.м.н., профессор, С.А. Бабанов, д.м.н., профессор Кафедра профессиональных болезней и клинической фармакологии ГОУ ВПО «Самарский государственный медицинский университет», Россия
Версия для печати
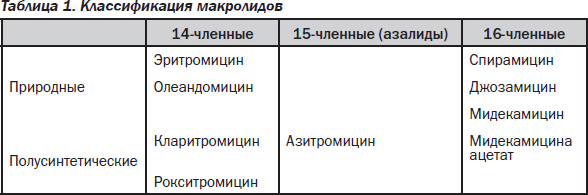
В настоящее время наблюдается возросший интерес к применению макролидов в клинической и амбулаторной практике при терапии инфекций в пульмонологической и оториноларингологической практике. Макролиды входят в отечественные рекомендации по ведению пациентов с широко распространенными внебольничными инфекциями, в частности с синуситом, отитом, внебольничной пневмонией; при этом они не только формально являются средствами эмпирической терапии этих заболеваний, но и фактически занимают ведущее место как в предпочтениях врачей, так и в реальных повседневных назначениях. На состоявшемся в июне 2006 г. в Лиссабоне XII Международном конгрессе по инфекционным заболеваниям и антимикробной химиотерапии (12th ICID congress) на обсуждение была выдвинута привлекательная своей практической направленностью клинико-фармакологическая классификация макролидов. Предлагается разделить антибиотики этого класса на 2 группы согласно их внутриклеточной фармакодинамике. Препараты первой группы проникают внутрь лейкоцитов быстрее, медленнее высвобождаются в очаге инфекции, но, что принципиально важно, они задействуют только фагоцитирующие клетки в отличие от антибиотиков второй группы. Макролидные антибиотики в высоких концентрациях накапливаются в воспаленных клетках, включая фагоциты, которые, как известно, быстро доставляют эти антибиотики в очаг инфекции. В частности, азитромицин обнаруживается в воспаленных тканях уже через несколько часов после приема и сохраняется в высоких эрадикационных концентрациях в течение нескольких дней. Основу химической структуры макролидов составляет макроциклическое лактонное кольцо; в зависимости от числа содержащихся в нем атомов углерода различают 14-членные (эритромицин, кларитромицин, рокситромицин), 15-членные (азитромицин) и 16-членные (спирамицин, джозамицин, мидекамицин) макролиды.
Общие свойства:
— преимущественно бактериостатическое действие;
— активность против грамположительных кокков (стрептококки, стафилококки) и внутриклеточных возбудителей (микоплазмы, хламидии, легионеллы);
— низкая активность против H.influenzae;
— высокие концентрации внутри клеток;
— низкая токсичность;
— отсутствие перекрестной аллергии с b-лактамами.
Спектр антимикробной активности макролидов охватывает практически все респираторные бактериальные патогены, включая атипичные микроорганизмы, природно устойчивые к бета-лактамным антибиотикам. Для всех макролидов характерны преимущественно бактериостатическое действие, активность против грамположительных кокков (стрептококки, стафилококки) и внутриклеточных возбудителей (микоплазмы, хламидии, легионеллы), высокие концентрации в тканях (в 5–10–100 раз выше плазменных), низкая токсичность, отсутствие перекрестной аллергии с b-лактамами. Макролиды в субъингибирующих концентрациях способны снижать продукцию альгината (он обеспечивает адгезию бактерий на биологических поверхностях) и подвижность P.aeruginosa и Proteus mirabilis, тем самым уменьшая степень колонизации и формирования биопленок. Макролиды относятся к «тканевым» антибиотикам и наиболее интенсивно накапливаются в миндалинах, лимфатических узлах, среднем ухе, придаточных пазухах носа, легких, бронхиальном секрете, плевральной жидкости, органах малого таза. Препараты группы макролидов проникают в гранулоциты, моноциты, альвеолярные макрофаги, фибробласты и доставляются ими к очагу инфекции, где создают концентрации, во много раз превышающие минимально подавляющие концентрации для чувствительных микроорганизмов.
Современные макролиды в отличие от других антимикробных препаратов обладают противовоспалительными, иммуномодулирующими и мукорегулирующими свойствами. Они благотворно влияют на фагоцитоз, хемотаксис, киллинг и апоптоз нейтрофилов, ингибируют окислительный «взрыв» — образование высокоактивных окисляющих соединений, в первую очередь NO, способных повреждать собственные ткани [1]. Взаимодействуя с полиморфно-ядерными нейтрофилами, лимфоцитами, эозинофилами, моноцитами, макролиды подавляют синтез и секрецию провоспалительных цитокинов — интерлейкинов (ИЛ) — ИЛ-1, ИЛ-6, ИЛ-8, фактора некроза опухоли a и усиливают секрецию противовоспалительных цитокинов — ИЛ-2, ИЛ-4, ИЛ-10. Они снижают вязкость и эластичность бронхиального и назального секрета и способны уменьшать продукцию мокроты у пациентов с избыточной ее секрецией [2, 3]. Азитромицин имеет наибольшую степень проникновения в полиморфноядерные нейтрофилы и значительно дольше задерживается в них в сравнении с кларитромицином и эритромицином, что в большей степени повышает способность к фагоцитозу и антиинфекционной защите. Азитромицин вызывает дегрануляцию нейтрофилов и стимулирует оксидативный взрыв (потребление кислорода, необходимое для осуществления функций макрофагов). Доказательствами дегрануляции нейтрофилов являются повышение уровня лизосомальных ферментов в плазме крови и снижение в макрофагах после приема первой дозы азитромицина.
Резистентные респираторные патогены
У большинства бактерий устойчивость возникает в результате ферментативной модификации локуса связывания макролидов и снижения сродства к антибиотику. Это происходит вследствие мутации генов в 23S-субъединице рибосомальной РНК, ответственных за синтез фермента метилазы. В итоге все макролиды, линкозамиды и стрептограмин В теряют способность к связыванию с рибосомами (MLSВ-фенотип резистентности), а микроорганизм приобретает высокий уровень устойчивости (МПК > 32–64 мг/л). Способностью к развитию MLSВ-фенотипа резистентности обладают S.pneumoniae, M.pneumoniae, S.aureus. У S.pneumoniae, H.influenzae, Mycobacterium spp., а также у Helicobacter pylori, Propionobacterium spp., Bordetella pertusis выявлен механизм устойчивости вследствие точечных мутаций в V домене 23S рРНК и генах, кодирующих синтез рибосомальных белков. По данным крупномасштабного исследования Alexander Project, резистентные к эритромицину пневмококки (РЭП) широко распространены во Франции и Италии (более 40 %), Бельгии и Испании (более 30 %); средний уровень (ниже 20 %) зарегистрирован в Швейцарии, Англии, Греции; с низкой частотой (менее 5 %) встречаются в Германии, Нидерландах и Чехии [3, 4], странах Юго-Восточной Азии и Японии (50–80 %) [5]. Согласно результатам многоцентрового исследования ПеГАС-1, распространенность устойчивых штаммов S.pneumoniae в разных регионах России составляет 5–6 % и доминирует М-фенотип резистентности [6], при котором МПК для пневмококков находятся в тех пределах, когда можно рассчитывать на эффективность макролидов, создающих высокие локальные концентрации. Данные о частоте выделения устойчивых к эритромицину S.pyogenes получены в Международном исследовании PROTEKT [7] и в национальных исследованиях. Одинаково высокий уровень отмечен в Италии (24,5–40 %) и Португалии (23,8–35,8 %), где превалировал erm-фенотип резистентности, а также в Испании (21,2–27 %) с преобладанием mefA-фенотипа, однако во Франции уровень уже был ниже (6,2–12,9 %), а в Бельгии и Нидерландах не выявлены резистентные к макролидам стрептококки [8–11]. В Центральной и Восточной Европе частота варьировала от 18 % в Венгрии, 13 % в Чехии, Польше и России, менее 10 % в Словакии до полного отсутствия в Болгарии [7]. В Канаде и США частота не превышала 3 % [12, 13]. В России резистентность S.pyogenes к эритромицину, азитромицину и кларитромицину составила 11,7 %, причем у 90 % штаммов — за счет метилирования рибосом, а у 10 % — путем эффлюкса [14]. В Москве частота устойчивости к макролидам среди S.pyogenes достигает 18,2 %; все устойчивые штаммы демонстрировали М-фенотип, сохраняя чувствительность к клиндамицину [15]. Резистентность H.influenzae к макролидам в России не превышает 5 % [16]. Низкий уровень резистентности отмечается среди клинических изолятов M.catarrhalis [17]. Сохраняют высокую чувствительность in vitro атипичные возбудители, при этом терапевтическая эффективность макролида определяется не только прямым антибактериальным действием, но и влиянием на систему неспецифической антиинфекционной защиты [18].
До сих пор широко применяется эритромицин — первый природный макролид, действующий на гeмолитические стрептококки группы А, пневмококки (кроме пенициллин-резистентных), стафилококки (включая PRSA), внутриклеточные микроорганизмы (хламидии, микоплазмы, легионеллы, кампилобактеры), возбудителей коклюша, дифтерии. Малоактивен в отношении Haemophilus influenzae. При приеме внутрь препарат частично инактивируется в кислой среде желудка, поэтому биодоступность может варьировать от 30 до 60 % и значительно снижается в присутствии пищи. Плохо проникает через ГЭБ, метаболизируется в печени, выводится преимущественно через ЖКТ. Период полувыведения составляет от 1,5 до 2,5 ч. Применяется при стрептококковых инфекциях у пациентов с аллергией на пенициллины (тонзиллофарингит, скарлатина, профилактика ревматической лихорадки). Эритромицин можно применять при кампилобактериозе, для плановой «стерилизации» кишечника перед оперативными вмешательствами (в сочетании с неомицином или канамицином), внебольничной пневмонии, дифтерии, коклюше, периодонтите, инфекциях кожи и мягких тканей, хламидийной инфекции, микоплазменной инфекции, легионеллезе. Эритромицин применяется внутрь — по 0,25–0,5 г каждые 6 ч за 1 ч до приема пищи; при стрептококковом тонзиллофарингите — по 0,25 г каждые 8–12 ч в течение 10 дней; для профилактики ревматической лихорадки — по 0,25 г каждые 12 ч. Внутривенно капельно по 0,5–1,0 г каждые 6 ч. Антимикробная активность олеандомицина меньше, чем у эритромицина, к тому же он хуже переносится больными, поэтому препарат назначают очень редко.
Кларитромицин (клацид, фромилид) — полусинтетический 14-членный макролид. По спектру активности близок к эритромицину. В отличие от эритромицина он:
— имеет активный метаболит — 14-гидрокси-кларитромицин, за счет которого повышена активность против Н.influenzae;
— наиболее активный макролид против B.pylori;
— действует на атипичные микобактерии (M.avium и др.), вызывающие оппортунистические инфекции при СПИДе;
— лучшая биодоступность — 50–55 %;
— более длительный период полувыведения (3–7 ч);
— лучше переносится;
— не назначается детям до 6 мес., беременным и кормящим грудью.
Также современным препаратом группы макролидов является азитромицин. В отличие от эритромицина азитромицин активен в отношении H.influenzae (включая продуцирующие бета-лактамазы).
Азитромицин активен в отношении аэробных грамположительных бактерий: Streptococcus pneumoniae, Streptococcus pyogenes, Streptococcus agalactiae, Streptococcus spp. групп C, F и G, Streptococcus viridans, Staphylococcus aureus; аэробных грамотрицательных бактерий: Haemophilus influenzae, Moraxella catarrhalis, Bordetella pertussis, Bordetella parapertussis, Legionella pneumophila, Haemophilus ducrei, Helicobacter pylori, Campylobacter jejuni, Neisseria gonorrhoeae и Gardnerella vaginalis; анаэробных бактерий: Bacteroides bivius, Clostridium perfringens, Peptostreptococcus spp. Препарат активен в отношении внутриклеточных микроорганизмов: Chlamydia trachomatis, Mycoplasma pneumoniae, Ureaplasma urealyticum, Borrelia burgdorferi, а также в отношении Treponema pallidum. Азитромицин превосходит другие макролиды по активности против H.influenzae и M.catarrhalis. Макролиды не действуют на оксациллинрезистентные стафилококки и энтерококки, грамотрицательные бактерии семейства Enterobacteriaceae, P.aeruginosa, Acinetobacter spp. и другие неферментирующие бактерии. После приема внутрь азитромицина в дозе 500 мг Cmax в плазме крови достигается через 2,5–2,96 ч и составляет 0,4 мг/л. Основные места создания высоких и стабильных концентраций азитромицина — это ткань легкого, бронхиальный секрет, пазухи носа, миндалины, среднее ухо, простата, почки и моча. При приеме той же дозы в слизистой бронхов концентрация азитромицина в 200 раз, а в бронхоальвеолярном секрете — в 80 раз превышает сывороточную. Таким образом, азитромицин выгодно отличается от других макролидов по созданию высоких концентраций в очагах инфекций — в 30–50, а по некоторым данным — в 100 раз больше, чем в сыворотке. У пациентов с почечной и печеночной недостаточностью и у пожилых фармакокинетика значительно не меняется, что делает возможным использовать его без видимых опасений. По способности проникать через гистогематические барьеры (кроме гематоэнцефалического) азитромицин превосходит бета-лактамы и аминогликозиды. На моделях in vitro и in vivo показано, что азитромицин захватывается и доставляется в очаг инфекции полиморфноядерными лейкоцитами и макрофагами. Строение молекулы антибиотика (наличие атома азота, отсутствующего в 14- и 16-членных макролидах) обеспечивает прочную связь с кислыми органеллами клетки и наибольший период полувыведения препарата (48–60 часов в зависимости от дозы азитромицина), что позволяет принимать его один раз в сутки. При этом постантибиотический эффект сохраняется в течение 7–10 и более суток после завершения 3–5-дневных курсов приема внутрь в стандартной дозе. Несомненным преимуществом азитромицина по сравнению с другими макролидами является существенно большая устойчивость к действию соляной кислоты желудочного сока, а отсутствие ингибирующего влияния на микросомальную систему цитохрома Р450 (что характерно для 14-членных макролидов) обеспечивает низкую вероятность лекарственных взаимодействий.
Распределение
Азитромицин хорошо проникает в дыхательные пути, органы и ткани урогенитального тракта, в предстательную железу, в кожу и мягкие ткани. Высокая концентрация в тканях (в 10–50 раз выше, чем в плазме крови) и длительный T1/2 обусловлены низким связыванием азитромицина с белками плазмы крови, а также его способностью проникать в эукариотические клетки и концентрироваться в среде с низким рН, окружающей лизосомы. Это, в свою очередь, определяет большой кажущийся Vd (31,1 л/кг) и высокий плазменный клиренс. Способность азитромицина накапливаться преимущественно в лизосомах особенно важна для элиминации внутриклеточных возбудителей. Доказано, что фагоциты доставляют азитромицин в места локализации инфекции, где он высвобождается в процессе фагоцитоза. Концентрация азитромицина в очагах инфекции достоверно выше, чем в здоровых тканях (в среднем на 24–34 %) и коррелирует со степенью воспалительного отека. Несмотря на высокую концентрацию в фагоцитах, азитромицин не оказывает существенного влияния на их функцию. Азитромицин сохраняется в бактерицидных концентрациях в очаге воспаления в течение 5–7 дней после приема последней дозы, что позволило разработать короткие (трехдневные и пятидневные) курсы лечения. Выведение азитромицина из плазмы крови проходит в 2 этапа: T1/2 составляет 14–20 ч в интервале от 8 до 24 ч после приема препарата и 41 ч в интервале от 24 до 72 ч, что позволяет применять препарат 1 раз/сут.
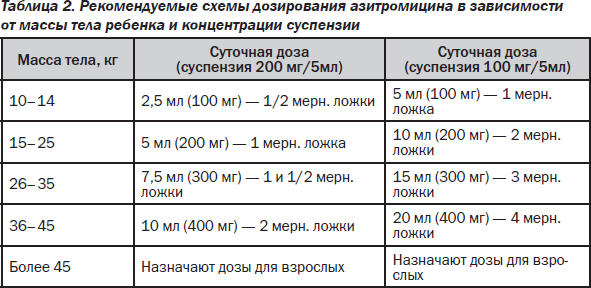
Показаниями к применению азитромицина являются инфекции ВДП при аллергии на пенициллины (стрептококковый тонзиллофарингит, острый синусит), инфекции НДП (обострение ХОБЛ, внебольничная пневмония), ородентальные инфекции, инфекции кожи и мягких тканей, хламидийная инфекция, микоплазменная инфекция, профилактика атипичных микобактериозов при СПИДе, скарлатина. Взрослым при инфекциях верхних и нижних отделов дыхательных путей азитромицин назначают по 500 мг (2 капс.) в сут. в течение 3 дней; курсовая доза — 1,5 г. При инфекциях кожи и мягких тканей назначают 1 г (4 капс.) в 1-й день, далее — по 500 мг (2 капс.) ежедневно со 2-го по 5-й день; курсовая доза — 3 г. При остром неосложненном уретрите или цервиците назначают однократно 1 г (4 капс.). При болезни Лайма (боррелиозе) для лечения начальной стадии (erythema migrans) назначают по 1 г (4 капс.) в 1-й день и по 500 мг (2 капс.) ежедневно со 2-го по 5-й день (курсовая доза — 3 г). При заболеваниях желудка и двенадцатиперстной кишки, ассоциированных с Helicobacter pylori, назначают по 1 г (4 капс.) в сут. в течение 3 дней в составе комбинированной антихеликобактерной терапии. Детям старше 12 лет при инфекциях верхних и нижних отделов дыхательных путей, кожи и мягких тканей препарат назначают из расчета 10 мг/кг 1 раз/сут в течение 3 дней (курсовая доза — 30 мг/кг) или в первый день — 10 мг/кг, затем 4 дня — по 5–10 мг/кг/сут. Детям при инфекциях верхних и нижних отделов дыхательных путей, инфекциях кожи и мягких тканей (за исключением хронической мигрирующей эритемы) азитромицин в форме суспензии назначают из расчета 10 мг/кг массы тела в течение 3 дней. Рекомендуемые схемы дозирования азитромицина в зависимости от массы тела ребенка и концентрации суспензии представлены в табл. 2. Взрослым при инфекциях верхних и нижних отделов дыхательных путей назначают по 500 мг/сут в течение 3 дней; курсовая доза — 1,5 г.
Рокситромицин по спектру антимикробной активности близок к эритромицину, но отличается стабильной биодоступностью (50 %), не зависящей от приема пищи, более высокими концентрациями в крови и тканях, большим Т1/2 (10–12 ч), лучшей переносимостью и меньшей вероятностью лекарственных взаимодействий. Применяется при стрептококковом тонзиллофарингите, остром синусите, обострении хронической обструктивной болезни легких, внебольничной пневмонии, ородентальных инфекциях, инфицировании кожи и мягких тканей, хламидийной и микоплазменной инфекциях.
Спирамицин — один из первых природных 16-членных макролидов. Особенности: активен против некоторых пневмококков и Streptococcus pyogenes, устойчивых к 14- и 15-членным макролидам, действует на токсоплазмы и криптоспоридии, биодоступность (30–40 %) не зависит от приема пищи, создает более высокие и стабильные тканевые концентрации, чем эритромицин, Т равен 8–14 ч. Препарат не влияет на активность изоферментов цитохрома Р450, поэтому не изменяет метаболизм других ЛС. Показания к применению: инфекции ВДП при аллергии на пенициллины (стрептококковый тонзиллофарингит), инфекции НДП (обострение ХОБЛ, внебольничная пневмония), ородентальные инфекции, инфекции кожи и мягких тканей, хламидийная инфекция, микоплазменная инфекция, токсоплазмоз, криптоспоридиоз.
Мидекамицин — природный 16-членный макролид. По спектру активности и другим свойствам сходен со спирамицином (но не действует на простейшие). Показаниями к его применению являются инфекции ВДП при аллергии на пенициллины (стрептококковый тонзиллофарингит), инфекции НДП (обострение ХОБЛ, внебольничная пневмония), инфекции кожи и мягких тканей, урогенитальные инфекции, микоплазменная инфекция.
Джозамицин по основным характеристикам близок к другим 16-членным макролидам, незначительно ингибирует цитохром Р450. Клинически значимые взаимодействия зарегистрированы лишь при сочетании с карбамазепином и циклоспорином (замедление их элиминации). Показаниями к его применению являются инфекции ВДП при аллергии на пенициллины (стрептококковый тонзиллофарингит), инфекции НДП, кожи и мягких тканей, урогенитальные инфекции.
Лекарственное взаимодействие
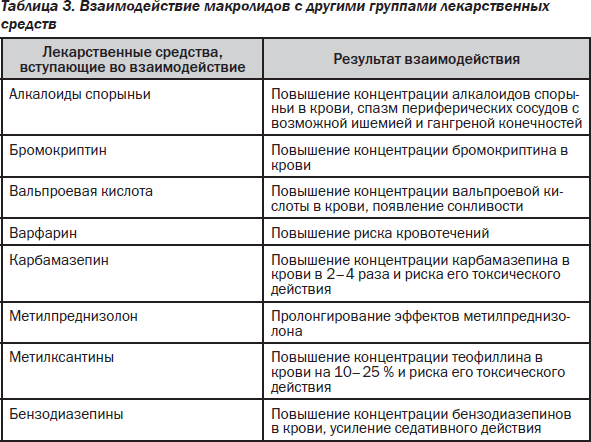
14-членные макролиды снижают активность изофермента цитохрома Р450 ЗА4, поэтому замедляют печеночный метаболизм многих ЛС. 15- и 16-членные макролиды слабо или практически не влияют на активность микросомальных ферментов. При одновременном применении азитромицина и антацидов (алюминий- и магнийсодержащих) замедляется всасывание азитромицина. Этанол и пища замедляют и снижают абсорбцию азитромицина. При совместном назначении варфарина и азитромицина (в обычных дозах) изменения протромбинового времени не выявлено, однако учитывая, что при взаимодействии макролидов и варфарина возможно усиление антикоагулянтного эффекта, пациентам необходим тщательный контроль протромбинового времени. Сочетанное применение азитромицина и дигоксина повышает концентрацию последнего. При одновременном назначении с теофиллином, карбамазепином, циклоспорином, бромкриптином, дизопирамидом эритромицин повышает их концентрацию в крови за счет торможения метаболизма в печени. При сочетании эритромицина с ловастатином возможно развитие тяжелой миопатии и рабдомиолиза. Биодоступность дигоксина на фоне приема эритромицина может возрастать в связи с уменьшением инактивации дигоксина кишечной микрофлорой. Среди нежелательных реакций на эритромицин можно выделить диспептические и диспепсические явления (у 20–30 % пациентов), обусловленные стимуляцией моторики ЖКТ (прокинетическое, мотилиноподобное действие), пилоростеноз у новорожденных детей (поэтому им предпочтительнее назначать 16-членные макролиды — спирамицин, мидекамицин). Аллергические реакции при применении макролидов развиваются очень редко. При внутривенном введении препаратов возможно развитие тромбофлебитов (поэтому их следует вводить в максимально возможных разведениях и в виде медленной инфузии).
При одновременном применении азитромицина с эрготамином и дигидроэрготамином отмечается усиление токсического действия последних (вазоспазм, дизестезия). Совместное назначение триазолама и азитромицина снижает клиренс и усиливает фармакологическое действие триазолама. Азитромицин замедляет выведение и повышает концентрацию в плазме и токсичность циклосерина, непрямых антикоагулянтов, метилпреднизолона, фелодипина, а также лекарственных средств, подвергающихся микросомальному окислению (карбамазепин, терфенадин, циклоспорин, гексобарбитал, алкалоиды спорыньи, вальпроевая кислота, дизопирамид, бромокриптин, фенитоин, пероральные гипогликемические средства, теофиллин и другие ксантиновые производные) за счет ингибирования азитромицином микросомального окисления в гепатоцитах. Линкозамины ослабляют эффективность азитромицина, а тетрациклин и хлорамфеникол — усиливают. Фармацевтически азитромицин несовместим с гепарином.
Применение макролидов в лечении острых респираторных инфекций
Макролиды сохраняют активность в отношении практически всех возбудителей респираторных инфекций, что выдвинуло их на первый план при лечении инфекций верхних и нижних дыхательных путей. Препараты макролидов широко применяются при лечении внебольничной пневмонии, инфекционно-зависимых обострений хронической обструктивной болезни легких, инфекциях в оториноларингологической практике (антибактериальной терапии острого и хронического тонзиллита, острого бактериального синусита, отита, фронтита). Многие авторы отмечают предпочтительное использование азитромицина в терапии данной патологии.
У госпитализированных больных рекомендовано проводить комбинированную антибактериальную терапию, особенно при тяжелом течении, что подтверждено многими клиническими наблюдениями. Так, когортное исследование на 1391 пациенте с внебольничной пневмонией различной этиологии показало, что смертность при лечении комбинацией цефалоспорина III поколения с макролидом в 2 раза ниже, чем при монотерапии бета-лактамом (ОР 2; 95%ДИ 1,24–3,23) [19]. В другом исследовании установлено, что комбинация «бета-лактам + макролид» эффективнее, чем «бета-лактам + хинолон» (смертность 4,9 и 15,0 % соответственно) [20].
Многоцентровое рандомизированное исследование лечения внебольничной вневмонии показало одинаковую клиническую эффективность ступенчатой монотерапии азитромицином (внутривенные инфузии антибиотика с переходом на прием внутрь; n = 202) и ступенчатой монотерапии цефуроксимом (n = 105) и в комбинации с эритромицином (n = 96). Выздоровление и улучшение состояния пациентов в первой группе составили 77 %, во второй группе — 74 %. Преимущества азитромицина заключались в сокращении средней продолжительности лечения (8,6 и 10,3 дня соответственно), и меньше отмечалось побочных эффектов [21].
Поскольку азитромицин обладает клинически значимой активностью против H.influenzae, он имеет приоритет при лечении острого бронхита, обострения хронической обструктивной болезни легких у пациентов молодого возраста без серьезных сопутствующих заболеваний и выраженного нарушения бронхиальной проходимости [22]. Но у пациентов старше 60 лет и/или страдающих сахарным диабетом, застойной сердечной недостаточностью, хронической обструктивной болезнью легких возрастает роль грамотрицательных микроорганизмов, поэтому требуется комбинированная терапия, вариантом которой является сочетание современных макролидов (например, азитромицина) с цефалоспоринами III поколения или ингибиторозащищенными пенициллинами.
У пациентов моложе 60 лет без сопутствующей патологии при монотерапии нетяжелой внебольничной пневмонии таблетированным азитромицином сроки лечения могут быть сокращены до трех дней, если ежесуточная доза составляет 500 мг. При остром среднем отите общепринятая продолжительность антибактериальной терапии, которая показана при отсутствии положительной динамики в течение 24–72 ч наблюдения, составляет 10 дней. При остром стрептококковом тонзиллите, отите пятидневный курс азитромицина обеспечивает эрадикацию S.pyogenes и H.influenzae при сокращении стандартных сроков лечения в 2 раза.
Применение азитромицина при остром бактериальном синусите и терапии острого трахеобронхита и инфекционно-зависимом обострении хронической обструктивной болезни легких в течение 3 дней (по 500 мг в сутки) позволяет достигнуть такой же клинической эффективности, как при лечении амоксициллином/клавуланатом в течение 10 и 5–10 дней (по 650 мг 3 раза в сутки); при этом сокращается число побочных эффектов.
Заключение
Современные макролиды, в первую очередь азитромицин, занимают ведущие позиции в лечении респираторных бактериальных инфекций благодаря уникальным фармакокинетическим и фармакодинамическим свойствам, адекватному антимикробному спектру, наличию иммуномодулирующей и противовоспалительной активности, безопасности и экономической выгоде при применении. Отличительной особенностью азитромицина является пролонгированная фармакокинетика (Т1/2 в зависимости от дозы составляет 48–60 часов) и способность накапливаться и длительно задерживаться в иммунокомпетентных клетках в течение 8–12 суток после завершения 3–5-дневных курсов приема внутрь в стандартной дозе, что согласуется с общей тенденцией сокращения сроков антимикробной терапии не в ущерб качеству лечения. Препараты этой группы имеют небольшое количество нежелательных реакций в сравнении со многими другими антибиотиками, а также позитивными неантибиотическими эффектами, что важно при использовании их в пульмонологической, оториноларингологической, геронтологической практике [1, 2, 21]. Некоторые макролиды (эритромицин, азитромицин и др.) могут быть использованы для лечения различных инфекций в период беременности и лактации. Кроме того, антибиотики этой группы демонстрируют хорошие клинико-экономические результаты при наиболее распространенных инфекциях [1].
1. Красильникова А.В. Сравнительная эффективность генериков азитромицина при внебольничной пневмонии у взрослых (клинические и фармакоэкономические аспекты): Автореф. дисс… на соискание ученой степени кандидата медицинских наук. — Волгоград, 2004. — 24 с.
2. Косарев В.В., Лотков В.С., Бабанов С.А. Клиническая фармакология. — Ростов-на-Дону: Феникс, 2008.— 348 с.
3. Schito G.C., Debbia E.A., Marchese A. The evolving threat of antibiotic resistance in Europe: new data from the Alexander Project // J. Antimicrob. Chemother. — 2000. — 46 (suppl. T1). — 3-9.
4. Huff J., White A., Power E. et al. 10-year trends in penicillin- and erythromycin-resistant S.pneumoniae for 5 European countries and the USA. The Alexander Project [abstract C2-1624] // Abstracts from the 42nd Interscience Conference on Antimicrobial Agents and Chemotherapy. — San Diego, USA: American Society of Microbiology, 2002. — 108.
5. Schito G.C. Is antimicrobial resistance also subject to globalization? // Clin. Microbial. Infect. — 2002. — 8 (suppl. 3). — 1-8.
6. Козлов Р.С., Кречикова О.И., Сивая О.В. и др. Антибиотикорезистентность Streptococcus pneumoniae в России: результаты проспективного многоцентрового исследования (фаза А проекта ПеГАС-1) // Клиническая микробиология и антимикробная химиотерапия. — 2002. — № 3. — 267-77.
7. PROTEKT Study Database. — Feb. 2001 (http:http://w.w.w.protekt.org).
8. Cornaglia G., Fontana R. Epidemiological survey of bacterial rasistance in upper respiratory tract infections in Italy // Int. J. Antimicrob. Agents. — 2000. — 16. — 259-62.
9. Melo-Cristino J., Fernandes M.L. Streptococcus pyogenes isolated in Portugal: macrolide resistance phenotypes and correlation with T types. Portuguese Surveillance Group for Study of Respiratory Pathogenes // Microb. Drug Resist. — 1999. — 5. — 219-25.
10. Alos J.I., Aracil B., Torres C. et al. High prevalence of erythromycin-resistant, clindamycin/miocamycin-susceptible (M phenotype) Streptococcus pyogenes : results of a Spanish multicentre study in 1998, Spanish group for the study of Infection in the Primary Health Care Setting // J. Antimicrob. Chemother. — 2000. — 45. — 605-9.
11. Baquero F., Garcia-Rodriguez J.A., de Lomas J.C., Aguilar L. Antimicrobial resistance of 914 beta-hemolytic streptococci isolated from pharyngeal swabs in Spain: results of 1-year (1996–1997) multicenter surveillance study. The Spanish Surveillance Group for Respiratory Pathogenes // Antimicrob. Agents Chemother. — 1999. — 43. — 178-80.
12. Kaplan E.L., Johnson D.R., Del Rosario M.C., Horn D.L. Susceptibility of group A beta-hemolytic streptococci to thirteen antibiotics: examination of 301 strains isolated in the United States between 1994 and 1997 // Pediatr. Infect. Dis. — 1999. — 18. — 1069-72.
13. de Azavedo J.C., Yeung R.H., Bast D.J. et al. Prevalence and mechanisms of macrolide resistance in clinical isolates of group A streptococci from Ontario, Canada // Antimicrob. Agents Chemother. — 1999. — 43. — 2144-7.
14. Козлов Р.С., Сивая О.В., Шпынев Л.В. и др. Антибиотикорезистентность Streptococcus pyogenes в России: результаты многоцентрового проспективного исследования ПеГАС-1 // Клиническая микробиология и антимикробная химиотерапия. — 2005. — № 2. — 154-66.
15. Сидоренко С.В. Проблемы этиотропной терапии внебольничных инфекций дыхательных путей // Consilium medicum. — 2002. — № 1. — 4-10.
16. Чучалин А.Г., Синопальников А.И., Яковлев С.В. и др. Внебольничная пневмония у взрослых: практические рекомендации по диагностике, лечению и профилактике (пособие для врачей) // Клиническая микробиология и антимикробная химиотерапия. — 2003. — № 3. — 198-224.
17. Jones M.E., Blosser-Middleton R.S., Critchley I.A. et al. In vitro susceptibility of Streptococcus pneumoniae, Haemophilus influenzae and Moraxella catarrhalis: a European multicenter study during 2000-2001 // Clin. Microbiol. Infect. — 2003. — 9. — 590-599.
18. Watere G.W., Somes G.W., Wunderink R.G. Monotherapy may be suboptimal for severe bacteremic pneumococcal pneumonia // Arch. Intern. Med. — 2001. — 161. — 1837-42.
19. Plouffe J., Schwartz D.B., Kolokathis A. et al. Clinical efficacy of intravenous followed by oral azithromycin monotherapy in hospitalized patients with community-acquired pneumoniae // Antimicrobial. Agents Chemother. — 2000. — 44. — 1796-802.
20. Kozyrskkyj A.L., Hildes-Ripstein G.E., Longstaffe S.E. et al. Treatment of acute otitis media with a shortened course of antibiotics: A meta-analysis // JAMA. — 1998. — 279 (21). — 1736-42.
21. Оськина Е.А. Оптимизация антимикробной химиотерапии у больных старших возрастных групп в гериатрическом стационаре // Автореф. дис... канд. мед. наук. — Самара, 2006. — 24 с.
