Газета «Новости медицины и фармации» Антимикробная терапия и пульмонология (408) 2012 (тематический номер)
Вернуться к номеру
Основні принципи призначення імунотропної терапії. Імунопрофілактика. Імунореабілітація
Авторы: О.В. Ломакіна, Н.Г. Риндіна, О.І. Шушляпін, Д.В. Ольховський Харківський національний медичний університет
Версия для печати
Імунотропні дії чинників зовнішнього середовища, бактерій, вірусів приводять до тимчасових змін в імунограмі у здорових людей і викликають стійкі імуномодуляції у хворих, що реалізовуються як імунодефіцити, алергія, автоімунні захворювання. Тому розробка методів корекції функцій імунної системи за допомогою імунотропних лікарських препаратів є основним напрямом клінічної імунології. Імунізація населення з метою створення імунітету проти інфекцій дозволила попередити їх розвиток у багатьох людей. Відтак вивчення методів вакцинації і застосування антисироваток є важливим завданням клінічного імунолога.
Разом з тим широке застосування імунотропних препаратів призвело до появи побічних реакцій і ускладнень при проведенні імунотерапії, що збільшило необхідність імунологічного обстеження і моніторингу контингенту, який піддається вакцинації. У зв’язку з цим значно зросла роль лікаря-імунолога у визначенні видів вакцин та індивідуальних термінів проведення щеплень при відхиленнях у функціонуванні імунної системи. У місцях мешкання міського і сільського населення проведено розробку методів імунореабілітації населення.
Принципи імунотерапії, імунокорекції й імуномодуляції
Порушення імунних механізмів відіграють вирішальну роль у патогенезі первинних і вторинних імунодефіцитів, атопічних захворювань, хвороб, пов’язаних з утворенням імунних комплексів, автоімунних захворювань, лімфопроліферативних процесів. Існують способи виборчої дії на клітини імунної системи, пригнічення і стимуляції імунних реакцій, які можна використовувати для імунотерапії, імунокорекції й імуномодуляції.
— Імунотерапія (ІТ) — лікувальна дія на імунну систему з метою припинення патологічного процесу.
— Імунокорекція — способи терапії, що припиняють або виправляють дефекти в імунній системі, тобто корекція дефектних ланок імунітету.
— Імуномодуляція — це тимчасове підвищення або зниження тих або інших показників імунітету. Імунотерапія може бути місцевою і загальною, комбінованою та монотерапією.
Завдання імунотерапії — стимулювання зниженої імунореактивності; ослаблення підвищеної імунореактивності (при алергії, автоімунних захворюваннях); заміщення бракуючих чинників імунореактивності.
З огляду на особливості імунотерапії різних захворювань необхідно виділити такі її групи:
— Імунотерапія захворювань з підвищеною імунореактивністью.
— Імунокорекція первинних і вторинних імунодефіцитів.
— Імунотерапія пухлин і лімфопроліферативних захворювань.
— Імунотерапія посттрансплантаційних реакцій.
— Імунокорекція порушень репродукції.
За характером дії на імунітет розрізняють такі види ІТ:
— стимулююча — використовується для активації реакцій імунітету в здоровому організмі з метою попередження інфекційних захворювань і при імунодефіцитах;
— пригнічуюча — застосовується для пригнічення імунних реакцій при алергії і автоалергічних (автоімунних) захворюваннях;
— специфічна — використовуються препарати антигенів або антитіл, специфічні щодо збудника або антигену;
— неспецифічна — включає дії на систему імунітету хімічних речовин, фізичних чинників і антигенів, неспецифічних щодо патологічного процесу, який виник.
При загальній терапії препарат, що вводиться в організм, рівномірно діє на всю лімфоїдну тканину.
Місцева терапія (регіонарна) — електрофорез, інгаляції, промивання — впливає саме на осередок ураження. Це дозволяє знизити загальні побічні ефекти і досягти найбільшого впливу на місцеві чинники імунітету, які нерідко відіграють провідну роль у патологічному процесі.
Комбінована терапія — застосування декількох препаратів, що діють на різні ланки імунітету і поєднання різних способів загальної і місцевої дії.
Успішна імунотерапія неможлива без застосування імунодіагностики. Той або інший терапевтичний засіб призначають тільки після вивчення характеру порушень імунореактивності. Для імуностимуляції або імуносупресії необхідно заздалегідь випробувати засоби, що призначаються, шляхом шкірних проб або в тестах in vitro на ефективність для даного хворого. Це дозволяє прогнозувати ефективність препарату і уникнути ускладнень. Імунодіагностика також дозволяє коригувати лікування, якщо воно є недостатньо ефективним.
Клінічні критерії призначення імуностимулюючої терапії: хронічна гнійна інфекція, низька ефективність лікування основного захворювання (запального процесу) загальноприйнятими засобами; лікування високими дозами імунодепресантів, тривала глюкокортикостероїдна, антибактеріальна, променева терапія.
Імунологічні критерії призначення імуностимулюючої терапії (за наявності клінічних ознак імунодефіциту): зниження кількості та порушення функціональної активності лімфоцитів, зниження рівня сироваткових імуноглобулінів, комплементу, активності фагоцитозу (незавершений фагоцитоз) не менше ніж на 30–50 %.
Клінічними критеріями призначення імуносупресуючої терапії є: тяжкі форми алергії з ураженням нирок, трансплантація органів і тканин, системні захворювання сполучної тканини.
Імунологічні критерії призначення імуносупресуючої терапії: поява високих титрів автоантитіл у крові.
При призначенні імунотерапії слід її обґрунтувати і скласти план лікування.
Специфічна імунотерапія
Специфічна активна стимулююча імунотерапія пов’язана з імунопрофілактикою інфекційних захворювань. Для неї застосовують вакцини, анатоксини, антигени. Прикладом може бути застосування стафілококового анатоксину і вакцини для лікування і профілактики стафілококових інфекцій. Стафілококову вакцину (анатоксин) застосовують для збільшення рівня антистафілококових антитіл. Вона активує фагоцитоз, стимулює антитілоутворения. Показання до застосування: хронічна рецидивуюча стафілококова інфекція. Протипоказання: тяжкі алергічні захворювання, первинні імунодефіцити. Ефективність застосування стафілококового анатоксину і вакцини контролюється початковим і подальшим визначенням титру антитіл.
Специфічна активна переважна імунотерапія заснована на індукції толерантності до антигену, десенсибілізації або гіпосенсибілізації. Цей варіант найчастіше використовується при полінозах. Суть його полягає у введенні в організм хворого в період ремісії зростаючих доз алергену, починаючи з мінімальної кількості, що не викликає алергічної реакції. Алерген вводиться внутрішньошкірно, інтраназально або перорально. Відбувається утворення IgG4, що запобігає при повторному введенні (попаданні) алергену його зв’язуванню з IgE і дегрануляції тучних клітин (анафілаксії). При інфекційно-алергічних процесах гіпосенсибілізацію проводять алергенами мікроорганізмів, роль яких у запаленні доведена. Для цього використовують автовакцини, гомовакцини або різні препарати мікроорганізмів. Основним механізмом дії специфічної гіпосенсибілізуючої терапії є вироблення у хворих «блокуючих» антитіл класу IGG, стимуляція Т-супресорів, активність яких при алергії знижена. Показання: алергоанамнез. Протипоказання: супутні тяжкі захворювання (туберкульоз, ревматизм, онкологія, психічні, вагітність та ін.).
Специфічна адаптивна імунотерапія. При ній імунокомпетентні клітини отримують готову антигенспецифічну інформацію — чинник перенесення (ЧП) та імунну І-РНК. ЧП — екстракт лейкоцитів сенсибілізованого донора, здатний переносити гіперчутливість сповільненого типу несенсибілізованим реципієнтам. Стимулює імунореактивність, підсилює антитілозалежну цитотоксичність, збільшує число Т-лімфоцитів. І-РНК — виділена з лімфоїдних тканин імунізованих тварин. Здатна індукувати імунну відповідь у інтактних тварин. Функціонує як Т-хелперний чинник, стимулюючий клітинний, трансплантаційний і протипухлинний імунітет.
Специфічна пасивна замісна імунотерапія. Під такою терапією мають на увазі введення готових специфічних захисних чинників системи імунітету. Це специфічні антитіла у вигляді імунних сироваток або очищені препарати імуноглобулінів. Особливо ефективною є при інфекційних захворюваннях (правець, газова гангрена, дифтерія, ботулізм та ін.), при укусах змій, гнійно-септичних інфекціях.
Специфічна пасивна переважна імунотерапія. Відрізняється від замісної тим, що імунні чинники (антитіла) вводяться в організм з метою пригнічення імунологічних реакцій. Приклад: профілактика резус-конфликту при вагітності, що полягає в уведенні впершенароджуючим Rh(–)-жінкам у перші 48–72 години після народження Rh(+)-дитини антирезусних антитіл, що пригнічують синтез антитіл у матері в результаті скріплення Rh-антигену. Іншим прикладом може бути введення ритуксимабу (антитіл до CD19+) хворим на ревматоїдний артрит для зменшення клону В-лімфоцитів, що продукують антитіла до хряща.
Неспецифічна імунотерапія
Неспецифічна активна стимулююча імунотерапія активує імунну відповідь. Використовуються дії трьох видів: біологічні, хімічні, фізичні.
1. Біологічні дії
Ад’юванти — неспецифічні підсилювачі імунологічних реакцій. Вони підсилюють імунну відповідь на відповідний антиген, створюють депо антигену, сприяють його повільному надходженню в кров і формуванню найбільш ефективної стимуляції імунної відповіді. Це ліпополісахариди деяких бактерій. Вони стимулюють В-лімфоцити, фагоцитоз, утворення інтерлейкіну-1 і лімфокінів. До них належать ад’ювант Фрейнда, вакцина БЦЖ для стимуляції антитілоутворення в людини, бактерійні продукти — продигіозан, пірогенал. Застосування їх показано при нестачі імуноглобулінів і функціональної активності В-лімфоцитів. Доцільне їх призначення поєднано з макролідами при запальних процесах. Протипоказане поєднане застосування їх з цефалоспоринами і бета-лактамами, з якими вони є антагоністами.
Нуклеїнові кислоти або їх солі, полінуклеотиди, активують різні ланки імунної відповіді. Краще їх уводити поєднано з антигеном в ранні стадії імуногенезу, в низьких дозах — стимулюючи його, у високих — пригнічуючи. Нуклеїнат натрію — натрієва сіль дріжджової РНК — стимулює міграцію стовбурових клітин, кооперацію Т-, В-лімфоцитів, функціональну активність їх популяцій, антитілогенез. Ефективний при вторинних імунодефіцитах.
Вітаміни — регулятори біохімічних процесів у клітинах і тканинах, зокрема імунної системи. Вітамін С має антиоксидантну активність, стимулює фагоцитоз, міграцію і диференціювання Т- і В-лімфоцитів. У великих дозах (1–3 г/добу) чинить протиалергічну і протизапальну дії. Вітамін Е підсилює активність Т-хелперів і синтез антитіл. Вітамін А має ад’ювантні властивості, стимулює активність комплементу, пропердину, підсилює антитілогенез і протипухлинний імунітет, зменшує імунодепресивну дію глюкокортикостероїдів і антибіотиків.
2. Хімічні дії
Штучні поліелектроліти (пентоксил, метилурацил, дибазол, тафцин, діуцифон) активують В-лімфоцити і антитілогенез на присутній в організмі антиген.
3. Фізичні дії — залежно від виду енергії і дози можуть стимулювати імунологічні реакції або пригнічувати імунореактивність. Ультразвук — стимулює фагоцитоз, хемотаксис, збільшує концентрацію й афінність рецепторів на активованих лімфоцитах. На цій властивості засновано його застосування в медицині. Опромінення селезінки через шкіру призводить до зниження алергічних проявів при бронхіальній астмі, збільшує кількість Т-супресорів. Опромінення тимуса у дітей при низькому рівні Т-лімфоцитів (до 25 %) дає добрий результат: збільшує їх кількість, відновлює співвідношення популяцій Th/Ts.
Неспецифічна активна переважна імунотерапія. Заснована на індукції неспецифічного активного пригнічення імунореактивності. Це використання гістаміну, гістаглобуліну за схемою при внутрішньошкірному введенні, починаючи з мінімальних доз, для вироблення блокуючих антитіл класу IGG. Частіше застосовується препарат гістаглобулін — комплекс гістаміну на гамма-глобуліні. Він стимулює утворення антигістамінних антитіл, які зв’язують гістамін при патохімічній фазі анафілаксії. Протипоказання: вагітність, гострі алергічні реакції.
Адаптивна стимулююча імунотерапія. Заснована на застосуванні та сприйнятті імунокомпетентними клітинами неспецифічних стимулів від гормонів тимуса й інших чинників імунітету, введених іззовні. Ці ефекти властиві гормонам тимуса, кісткового мозку, селезінки, лімфовузлів. Тимозин, тималін, тактивін використовують для лікування первинних і вторинних імунодефіцитів, пухлин. Вони відновлюють порушені ланки імунітету, кількість Т-лімфоцитів, стимулюють клітинний імунітет, фагоцитоз, процеси регенерації тканин і кровотворення, покращують метаболізм.
Неспецифічна пасивна замісна імунотерапія характеризується тим, що хворому вводять готові неспецифічні чинники імунітету й імунокомпетентних клітин при їх недостатності: пересадка кісткового мозку, лімфоїдної тканини при тяжких імунодефіцитах; переливання крові та її препаратів (ефективні, якщо вони не відрізняються від донора за антигенами гістосумісності, інакше ефекту не буде, оскільки відбувається швидка елімінація клітин); введення імуноглобулінів для пасивної терапії; введення очищених гамма-глобулінів різних класів для відновлення недостатності; введення комплементу, лізоциму для підвищення протиінфекційного захисту.
Неспецифічна пасивна переважна імунотерапія. Спрямована на різні ланки імунітету. Вимагає особливих показань і контролю за імунологічним статусом хворого та клініко-лабораторними даними. Абсолютним показанням до її призначення є алотрансплантація органів і тканин.
Глюкокортикостероїди (преднізолон, метилпреднізолон, дексаметазон, гідрокортизон, кенакорт, тріамцинолон) викликають пригнічення реакцій при алергічних захворюваннях, відторгненні трансплантата, системних захворюваннях сполучної тканини. Вони пригнічують запальні реакції, стабілізують мембрани лейкоцитів і викид нейтрофілів з кісткового мозку, подовжують час їх циркуляції у крові, блокують міграцію, прилипання і накопичення у вогнищах запалення. Гальмують всі фази імунної відповіді, викликають лімфоцитоліз, пригнічують фагоцитоз, проліферацію лімфоцитів і їх взаємодію з іншими клітинами, гальмують ефекторну функцію лімфоцитів.
Цитостатичні препарати:
— антиметаболіти;
— антагоністи пурину (меркаптопурин, азатіоприн, імуран) — гальмують синтез ДНК і РНК, блокують розмноження клітин;
— антагоністи фолієвої кислоти — (метотрексат) гальмують синтез і подвоєння ДНК;
— алкілуючі сполуки (циклофосфан, циклофосфамід, мелфалан, мілеран) руйнують молекулу ДНК, гальмують синтез білка; лейкеран — вибірково діє на лімфоїдну тканину;
— антибіотики (актиноміцин D і C, пуроміцин) — гальмують синтез РНК і білків;
— алкалоїди (вінкристин) — блокують мітоз у метафазі, гальмують синтез білка;
— метаболіти (циклоспорин А) — вибірково пригнічують Т-хелпери, пригнічують T-клітинну чутливість сповільненого типу і утворення антитіл. Ефективні при трансплантації органів. Побічна реакція: сильно виражена нефротоксична дія. Ефект, що інгібірує імунну систем, зворотний.
Нестероїдні протизапальні засоби (аспірин, диклофенак) — пригнічують синтез простагландинів, гістаміну, пригнічують міграцію лейкоцитів, знижують хемотаксис, фагоцитоз, відміняють кооперацію Т- і В-лімфоцитів.
Хинолінові препарати (делагіл, плаквеніл) — інгібують активність ферментів, медіаторів запалення й алергії, пригнічують обмін ДНК. Застосовують найчастіше при системних захворюваннях сполучної тканини (СЧВ, ревматоїдний артрит та ін.).
Антилімфоцитарна сироватка — руйнує лімфоцити і викликає лімфопенію;
— моноклональні антитіла (ритуксимаб) до CD19+ T-лімфоцитів.
Інгібітори алергічних реакцій (інтал, кромолін, задидет) — діють на патохімічну фазу алергії. Антимедіаторні засоби: антигістамінні (димедрол, супрастин, тавегіл, діазолін, фенкарол, цетиризин, левоцетиризин, лоратадин, дислоратадин, фексофенадин), антисеротонінові препарати (цинаризин, стугерон, перитол) діють на патохімічну фазу, тому не усувають причини алергії, при тривалому застосуванні їх ефективність знижується.
Фізичні чинники (рентгенівське, ультрафіолетове випромінювання) — діють як супресори.
Плазмаферез, гемосорбція — видалення з крові імунологічних чинників (лімфоцити, ЦВК, антигени, антитіла, медіатори) — викликають тимчасовий супресивний ефект і нормалізують імунний статус, особливо при алергії.
Трансфузіологічні методи імунотерапії при інтоксикації. У токсичному періоді захворювань можливість імунокорекції обмежена імунодепресивною дією інтоксикації, якій належить певна роль в імуносупресії організму, пригніченні функціональних показників Т-лімфоцитів і фагоцитозу. Компенсація токсигенної імуносупресії можлива шляхом інфузії препаратів низькомолекулярного полівінілпіролідону: поліглюкін, реосорбілакт, поліоксидоній та ін.
Механізм дезінтоксикаційної дії поліглюкіну, реосорбілакту заснований на здатності зв’язувати в кров’яному руслі токсини і виводити їх з організму. Вони оберігають імунокомпетентні клітини від імуносупресивної дії інтоксикації. Їх слід застосовувати поєднано з лікарськими препаратами, використовуваними в токсичному періоді: антибактеріальними, серцево-судинними. При цьому поліглюкін, реосорбілакт підсилюють ефективність антибактеріальної терапії.
Одним із компонентів крові є плазма, що справляє антитоксичну дію. Дія нативної концентрованої плазми на імунну систему виявляється в заповненні недостатності імуноглобулінів, медіаторів, цитокінів і компонентів комплементу. Використання її дозволило встановити ефект у відновленні функціональної активності Т-лімфоцитів, особливо при високій активності запального процесу. Позитивний імунний вплив плазми виявляється тільки в токсичному періоді. Суть імунокоригуючої дії плазми полягає в контрдії імуносупресивним чинникам, властивим гострій фазі запалення. Це мікроорганізми, вторинні продукти запалення, лікарські препарати. Імунокоригуючий вплив плазми нетривалий. Лабораторними критеріями показання до трансфузії нативної концентрованої плазми є недостатність клітинного імунітету й імуноглобулінів.
Імунотропні лікарські засоби
Перш за все слід визначити, що розуміють під терміном «імунотропні лікарські препарати». М.Д. Машковський розподіляє препарати, що коригують процеси імунітету (імунокоректори), на імуностимулюючі й імунодепресивні (імуносупресори). Можна виділити і третю группу— імуномодулятори, тобто речовини, що впливають на імунну систему залежно від її початкового стану. Такі препарати підвищують знижені та знижують підвищені показники імунного статусу. Таким чином, за дією на імунну систему імунотропні препарати можна розподілити на імуносупресори, імуностимулятори й імуномодулятори.
Даний розділ присвячений тільки двом останнім видам ліків, і переважно імуностимуляторам.
Характеристика імуномодуляторів
Препарати бактерійного і грибкового походження
Вакцини-імуномодулятори
Вакцини з умовно-патогенних бактерій не тільки підвищують резистентність до конкретного мікроба, але й мають могутній неспецифічний імуномодулюючий і стимулюючий ефект. Це пояснюється наявністю в їх складі ліпополісахаридів, білків та інших речовин — активаторів імунітету, що діють як ад’юванти. Неодмінною умовою при призначенні імуномодулюючої терапії ліпополісахаридами повинен бути достатній рівень клітин-мішеней (тобто абсолютного числа нейтрофілів, моноцитів і лімфоцитів).
Бронхомунал (Broncho-Munal) — ліофілізований лизат бактерій (Str. pneumoniae, H. influence, Str. vindans, Str. pyogenes, Moraxella catarrhalts, S. aureus, K. pneumoniae і Kozaenae). Препарат підвищує кількість Т-лімфоцитів і IGG, IGM, clgA-антитіл, ІЛ-2, ФНП. Застосовують його при лікуванні інфекційних захворювань верхніх дихальних шляхів (бронхіти, риніти, тонзиліти). Капсула містить 0,007 г ліофілізованих бактерій, 10 капсул в упаковці. Призначають по 1 капсулі на день протягом 10 днів на місяць, уродовж 3 місяців. Дітям призначають бронхомунал II, що містить 0,0035 г бактерій у капсулі. Застосовують вранці натщесерце. Можливі диспептичні явища, пронос, болі в епігастрії.
Рибомуніл (Ribomunyl) — містить імуномодулюючі речовини, що є поєднанням бактерійних рибосом (Klebsiella pneumoniae — 35 часток, Streptococcus pneumoniae — 30 часток, Streptococcus pyogenes — 30 часток, Haemophilia influenzae — 5 часток) і протеогліканів мембрани Kl. pneumoniae. Призначається по 1 пігулці 3 рази на день або 3 пігулки на прийом уранці натщесерце, в перший місяць — 4 дні на тиждень протягом 3 тижнів, у подальші 5 місяців — 4 дні на початку кожного місяця. Формує імунітет до інфекційних агентів, забезпечує тривалу ремісію при хронічних бронхітах, ринітах, ангінах, отитах.
Вакцина полікомпонентна (ВП-4 — імуновак) містить антигенні комплекси, виділені із стафілокока, протея, клебсієли пневмонії і кишкової палички К-100; викликає у прищеплених вироблення антитіл до цих бактерій. Крім того, препарат є стимулятором неспецифічної резистентності, підвищує стійкість організму до умовно-патогенних бактерій. Корелює рівень Т-лімфоцитів, підсилює синтез IGA і IGG у крові та slgA в слині, стимулює утворення МУЛ-2 та інтерферону. Вакцина призначена для імунотерапії хворих (вік 16–55 років) з хронічними запальними і обструктивними захворюваннями органів дихання (хронічний бронхіт, хронічне обструктивне захворювання легенів, інфекційнозалежна і змішана форми бронхіальної астми). Інтраназально вводять: 1-ша доба — 1 крапля в один носовий хід; 2-га доба — по 1 краплі в кожен носовий хід; 3-тя доба — по 2 краплі в кожен носовий хід. З 4-ї доби після початку імунотерапії препарат уводять під шкіру підлопаткової ділянки 5-кратно з інтервалом 3–5 діб, по черзі змінюючи сторону введення: 1-ша ін’єкція — 0,05 мл; 2-га — 0,1 мл; 3-тя — 0,2 мл; 4-та — 0,4 мл; 5-та — 0,8 мл. При пероральному способі застосування вакцини через 1–2 доби після закінчення интраназального введення препарат приймають перорально 5-кратно з інтервалом 3–5 днів: 1-й прийом — 2,0 мл; 2-й — 4,0 мл; 3-й — 4,0 мл; 5-й прийом — 4,0 мл.
Стафілококова вакцина містить комплекс термостабільних антигенів. Застосовується для створення протистафілококового імунітету, а також для підвищення загальної резистентності. Вводиться підшкірно в дозі 0,1–1 мл щодня протягом 5–10 днів.
Імудон (Imudon) — пігулка містить ліофільну суміш бактерій (лактобактерії, стрептококи, ентерококи, стафілококи, клебсієли, коринебактерії псевдодифтерійні, фузиформні бактерії, кандиди альбіканс). Застосовують у стоматології при пародонтитах, стоматитах, гінгівітах та інших запальних процесах слизової оболонки порожнини рота. Призначають по 8 пігулок/добу (по 1–2 шт. через 2–3 години); пігулку тримають у роті до повного розчинення.
ІРС-19 (IRS-19) — дозований аерозоль для інтраназального застосування (60 доз, 20 мл) містить лізат бактерій (диплококи пневмонії, стрептококи, стафілококи, нейсерії, клебсієли, морацели, паличка інфлюенци та ін.). Стимулює фагоцитоз, підвищує рівень лізоциму, clgA. Застосовують при ринітах, фарингітах, тонзилітах, бронхітах, бронхіальній астмі з ринітом, отитах. Роблять 2–5 уприскувань на добу в кожну ніздрю до зникнення інфекції.
Бактерійні та дріжджові субстанції
Нуклєїнат натрію. Препарат натрієвої солі нуклеїнової кислоти отримують методом гідролізу дріжджових клітин із подальшим очищенням. Є нестабільною сумішшю 5–25 видів нуклеотидів. Має поліпотентну стимулюючу активність щодо клітин імунітету: збільшує фагоцитарну активність мікро- і макрофагів, утворення цими клітинами активних кислотних радикалів, що приводить до посилення бактерицидної дії фагоцитів, підвищує титри антитоксичних антитіл. Призначається всередину в пігулках у таких дозах на 1 прийом: дітям 1-го року життя — по 0,005–0,01 г, від 2 до 5 років — по 0,015–002 г, від 6 до 12 років — по 0,05–0,1 г. Щоденна доза складається з двох-трьох разових доз, розрахованих на вік хворого. Дорослі отримують не більше 0,1 г на 1 прийом 4 рази на добу.
Пірогенал. Препарат отриманий з культури Pseudomonas aeroginosa. Малотоксичний, але викликає гарячку, короткочасну лейкопенію, що потім зміняється лейкоцитозом. Особливо ефективна діє на систему клітин фагоцитарної системи, тому часто використовується в комплексній терапії затяжних і хронічних запальних захворювань респіраторного тракту та інших локалізацій. Вводиться внутрішньом’язово. Дітям віком до 3 років ін’єкції не рекомендуються. Дітям старшим за 3 роки вводиться доза від 3 до 25 мкг (5–15 мінімальних пірогенних доз — МПД) на ін’єкцію залежно від віку, але не більше 250–500 МПД. Для дорослих звичайна доза становить 30–150 мг (25–50 МПД) на одну ін’єкцію, максимальна — 1000 МПД. Курс терапії включає від 10 до 20 ін’єкцій, при цьому необхідний контроль показників периферичної крові й імунного статусу.
Пірогеналова проба — тест при лейкопенічних станах для стимуляції екстреного викиду з клітинних депо незрілих форм гранулоцитів. Уводять препарат у дозі 15 МПД на 1 м2 площі тіла. Інша формула розрахунку — 0,03 мкг на 1 кг маси тіла. Протипоказаний при вагітності, гострих гарячках, лейкопеніях автоімунного генезу.
Препарати дріжджів містять нуклеїнові кислоти, комплекс природних вітамінів і ферментів. Їх використовують при бронхітах, фурункульозах і ранах, анеміях, у періоді одужання після тяжких захворювань. До 5–10 г дріжджів додають 30–50 мл теплої води, розтирають і витримують 15–20 хвилин у теплому місці до утворення піни. Суміш збовтують і випивають за 15–20 хвилин до їди 2–3 рази на день протягом 3–4 тижнів. Клінічний ефект з’являється через тиждень, імунологічний — пізніше. Для зменшення диспепсії препарат розбавляють молоком або чаєм.
Синтетичні імуномодулятори
Лікопід. Напівсинтетичний препарат, належить до мурамілдипептидів, близьких до бактерійних. Є фрагментом клітинної стінки бактерій. Отриманий з клітинної стінки M. lysodeicticus.
Препарат підвищує загальну опірність організму до патогенного чинника перш за все внаслідок активації клітин фагоцитарної системи імунітету (нейтрофілів і макрофагів). При пригнічуючому кровотворенні, наприклад, викликаному хіміотерапією або опромінюванням, застосування лікопіду приводить до відновлення числа нейтрофілів. Лікопід активує Т- і В-лімфоцити. Показання: гострі та хронічні гнійно-запальні захворювання; гострі та хронічні захворювання дихальних шляхів; ураження шийки матки вірусом папіломи людини; вагініт; гострі та хронічні вірусні інфекції: офтальмогерпес, герпетичні інфекції, оперізувальний лишай; туберкульоз легенів; трофічні виразки; псоріаз; імунопрофілактика застудних захворювань.
Призначають курси залежно від захворювання. При хронічних інфекціях дихальних шляхів (бронхіти) у стадії загострення — по 1–2 табл. (1–2 мг) під язик упродовж 10 днів. Дітям призначають пігулки по 1 мг.
Протипоказаний при вагітності. Підвищення температури тіла до 38 °С, що виникає іноді після прийому препарату, не є протипоказанням.
Реосорбілакт. Використовується для дезінтоксикації. Можливо, чинить імуномодулюючу дію при лікуванні хронічних обструктивних захворювань легенів, ревматизму, кишкових інфекцій. Уводять дорослим 100–200 мл, дітям 2,5 року — 5 мл/кг внутрішньовенно краплинно (40–80 крапель/хв) через день.
Дибазол (Dibazolum) — судинорозширювальний, гіпотензивний засіб. Препарат має адаптогений та інтерферогений ефекти, підсилює синтез білків і нуклеїнових кислот, експресію IL-2, рецепторів на N-хелперах. Використовується при гострих інфекціях (бактерійних і вірусних). Оптимальним слід вважати поєднання дибазолу з лікопідом. Призначається в пігулках по 0,02 г (разова доза — 0,15 г), ампули 1; 2; 5 мл 0,5% або 1% розчин протягом 7–10 днів. Дітям раннього віку — 0,001 г/добу, до років — 0,003 г/добу, дошкільного віку — 0,0042 г/добу.
Слід контролювати артеріальний тиск, особливо у дітей підліткового віку, в яких дибазол може викликати порушення регуляції тонусу судин.
Димексид (диметилсульфоксид) випускається у флаконах по 100 мл, має унікальну проникаючу здатність у тканини через рН = 11. Справляє протизапальний, протинабряклий, бактерицидний та імуномодулюючий ефекти. Стимулює фагоцити і лімфоцити. У ревматології застосовують 15% розчин для аплікацій на суглоби при ревматоїдному артриті. Використовують при гнійно-септичних і бронхолегеневих захворюваннях. Курс — 5–10 аплікацій.
Ізопринозин (гропринозин) — суміш 1 частини інозину і 3 частин р-ацето-амідобензоєвої кислоти. Стимулює клітини фагоцитарного ряду і лімфоцити, вироблення цитокінів, IL-2, що істотно змінює функціональну активність лімфоцитів периферичної крові та їх специфічні імунологічні функції. Шляхом диференціювання 0-клітин у Т-лімфоцити посилюється активність цитотоксичних лімфоцитів. Препарат майже нетоксичний і добре переноситься хворими. Побічні ефекти і ускладнення не описані. Має виражений інтерфероногенний ефект, використовується при лікуванні гострих і затяжних вірусних інфекцій (герпетична інфекція, кір, гепатити А і В та ін.). Стимулює зрілі В-клітини. Приймається всередину у вигляді пігулок (500 мг) в дозі 50–100 мг на 1 кг маси тіла на день. Добова доза розподіляється на 4–6 прийомів. Тривалість курсу — 5–7 днів. Показання: вторинні імунодефіцитні захворювання, особливо при герпетичних інфекціях.
Імунофан (Imunofan) — гексапептид (аргініл-альфа-аспартил-лізил-валін-тирозил-аргінін) чинить імунорегулюючу, детоксикаційну, гепатопротективну дію та викликає інактивацію вільнорадикальних і перекисних з’єднань. Дія препарату розвивається протягом 2–3 годин і продовжується до 4 місяців; імунофан нормалізує перекисне окислення ліпідів, інгібує синтез арахідонової кислоти з подальшим зниженням рівня холестерину в крові та продукції медіаторів запалення. Через 2–3 доби прийому підсилює фагоцитоз. Імунокоригуюча дія препарату настає через 7–10 діб, підсилює проліферацію Т-лімфоцитів, збільшує продукцію ІL-2, синтез антитіл, інтерферону. Ампули (1 мл 0,005% розчину препарату). Призначають підшкірно, в/м щодня або через 1–4 дні на 1 курс — 5–15 ін’єкцій. При герпетичній цитомегаловірусній інфекції, токсоплазмозі, хламідіозі, пневмоцистозі — 1 ін’єкція через дві доби, курс лікування — 10–15 ін’єкцій.
Галавіт (Galavit) — похідне амінофталгідрозиду з протизапальною та імуномодулюючою активністю. Рекомендується при вторинній імунній недостатності і хронічних рецидивуючих, уповільнених інфекціях різних органів і локалізацій. Призначають в/м по 200 мг — 1 доза, потім по 100 мг 2–3 рази на день до зменшення інтоксикації або припинення запалення. Підтримуючий курс — через 2–3 дні. Апробований при фурункульозі, кишкових інфекціях, аднекситах, герпесі, хіміотерапії раку; в інгаляціях при хронічних бронхітах.
Фамотидин — блокатор Н2-гістамінових рецепторів, пригнічує Т-супресори, стимулює T-хелпери, експресію IL-2-рецепторов і синтез імуноглобулінів.
Індуктори інтерферону стимулюють вироблення ендогенного інтерферону.
Аміксин — стимулює утворення a-, b-, g-інтерферонів, підсилює антитілоутворення, має антибактеріальний і противірусний ефект Застосовують для лікування гепатиту А і ентеровірусних інфекцій (по 1 табл. — 0,125 мг для дорослих і 0,06 мг — для дітей протягом 2 днів, потім перерва 4–5 днів, курс лікування — 2–3 тижні), для профілактики вірусних інфекцій (грип, ГРЗ, ГРВІ) — по 1 табл. 1 раз на тиждень, упродовж 3–4 тижнів. Протипоказаний при вагітності, хворобах печінки, нирок.
Арбідол — противірусний препарат. Справляє інгібуючу дію на віруси грипу А і В, має інтерфероніндукуючу активність, стимулює гуморальні та клітинні реакції імунітету. Для лікування вірусних інфекцій призначають по 0,1 г 3 рази на день до їди протягом 3–5 днів, потім по 0,1 г 1 раз на тиждень, протягом 3–4 тижнів. Дітям 6–12 років — по 0,1 г кожні 3–4 дні протягом 3 тижнів профілактично в період епідемії грипу. Протипоказаний хворим із серцево-судинними захворюваннями, захворюваннями печінки і нирок.
Неовір — індукує синтез альфа-інтерферону, активує стовбурові клітини, NK, Т-лімфоцити, макрофаги. У гострому періоді герпес-інфекції призначають 3 ін’єкції по 250 мг з інтервалом 16–24 години і ще 3 ін’єкції з інтервалом 48 годин. У міжрецидивному періоді — 1 ін’єкція на тиждень у дозі 250 мг (2 мл) протягом місяця. При урогенітальному хламідіозі — 5–7 ін’єкцій по 250 мг з інтервалом 48 годин. Антибіотики призначають у день другої ін’єкції.
Циклоферон — 12,5% розчин для ін’єкцій — 2 мл, пігулки по 0,15 г, мазь 5% по 5 мл. Стимулює утворення a-, b-, g-інтерферонів (до 80 Од/мл), збільшує рівень CD4+- і Сd4+-Т-лімфоцитов при ВІЛ-інфекції. Рекомендується при герпесі, цитомегаловірусній інфекції (ЦМВ), гепатитах, ВІЛ-інфекції, розсіяному склерозі, виразковій хворобі шлунка, ревматоїдному артриті. Разова доза — 2 мл, 0,25–0,5 мг, в/м або в/в на 1, 2, 4, 6, 8, 11, 14, 17, 20, 23, 26, 29-й день. Дітям — по 6–10 мг/кг/добу в/в або в/м. Пігулки по 0,3–0,6 г 1 раз на добу. Призначають при грипі та респіраторних інфекціях; мазь — при герпесі, вагінітах, уретритах.
Кагоцел — синтетичний препарат на основі карбоксиметилцелюлози і поліфенолу — госиполу, пігулки по 12 мг. Індукує синтез a- і b-інтерферонів. Вже після одноразового прийому вони продукуються протягом тижня. Для лікування грипу і ГРВІ дорослим призначають у перші два дні по 2 пігулки 3 рази на добу, в подальші два дні — по 1 пігулці 3 рази на день. Усього на курс — 18 пігулок, тривалість курсу — 4 дні.
Препарати, які отримують з клітин і органів системи імунітету
Тимусні пептиди і гормони. Найважливішою особливістю тимусних пептидів як гормонів є короткочасність і короткодистанційність їх дії на клітини-мішені. Цим багато в чому визначається терапевтична тактика. Лікувальні препарати отримують різними способами з екстрактів тимуса тварин.
Тімусна недостатність може бути гострою і хронічною. Гостра тимусна недостатність формується при інтоксикаціях, фізичному або психоемоційному стресі, на тлі тяжких інфекційних процесів. Хронічна характеризує Т-клітинні й комбіновані форми імунодефіцитів. Тимусну недостатність не слід коригувати імуностимулюючими діями, вона повинна заміщатися препаратами тимусних пептидів-гормонів.
Тималін — комплекс пептидів тимуса телят. Ліофілізований порошок у флаконах по 10 мг розчиняють в 1–2 мл ізотонічного розчину хлориду натрію. Вводять в/м дорослим по 5–20 мг (30–100 мг на курс), дітям до 1 року — по 1 мг; 4–6 років — по 2–3 мг; 4–14 років — 3,5 мг протягом 3–10 днів. Рекомендується при гострих і хронічних вірусних і бактерійних інфекціях, опіках, виразках, інфекційній бронхіальній астмі; хворобах, що асоціюються з імунодефіцитом.
Тактивін — комплекс поліпептидів тимуса телят. Випускається у флаконах по 1 мл 0,01% розчину. При хронічних неспецифічних захворюваннях легенів оптимальна доза тактивіну становить 1–2 мкг/кг. Препарат вводиться по 1 мл (100 мкг) підшкірно протягом 5 днів, потім 1 раз на тиждень протягом 1 міс. Надалі проводяться 5-денні щомісячні повторні курси. Рекомендується при гнійно-септичних процесах, лімфолейкозі, офтальмогерпесі, пухлинах, псоріазі, розсіяному склерозі і захворюваннях, що асоціюються з імунодефіцитом.
У клінічній практиці використовують три види препаратів людського імуноглобуліну: нативна плазма, імуноглобулін для внутрішньом’язового введення й імуноглобулін для внутрішньовенного введення.
Автогемотрансфузія є альтернативою алогенної гемотрансфузії. При планових операціях рекомендується (Шандер, 1999) завчасна заготовка автокрові з уведенням еритропоетину 1 раз на тиждень у дозі 400 Од/кг упродовж 3 тижнів, а також рекомбінантних стимуляторів лейкопоезу (ГМ-КСФ), IL-11, стимулюючого тромбоцитопоез.
Лейкоцитарна маса використовується як засіб замісної терапії при імунодефіцитних станах за фагоцитарною системою. Доза лейкомаси становить 3–5 мл на 1 кг маси тіла.
Стовбурові клітини — автологічні й алогенні, кістковомозкові та виділені з крові, здатні відновлювати функції органів і тканин внаслідок диференціювання в зрілі клітини.
Плазма крові нативна (рідка, заморожена) містить не менше 6 г загального білка в 100 мл, у тому числі альбуміну 50% (40–45 г/л), альфа-1-глобуліну — 45%; альфа-2-глобуліну — 8,5% (9–10 г/л), бета-глобуліну 12% (11–12 г/л), гамма-глобуліну — 18% (12–15 н/л). У ній можуть міститися цитокіни, ABO-антигени, розчинні рецептори. Випускається у флаконах або пластикатних мішках по 50–250 мл. Плазму нативну слід застосовувати в день її виготовлення (не пізніше 2–3 годин після виділення з крові). Заморожену плазму можна зберігати при температурі –25 °С і нижче протягом 90 днів. При температурі –10 °С термін зберігання до 30 днів.
Переливання плазми здійснюють з урахуванням сумісності по групах крові (АВО). На початку переливання необхідно проводити біологічну пробу і при виявленні ознак реакції припинити трансфузію.
Імуноглобулін людський нормальний внутрішньом’язовий. Препарати виготовляються з суміші понад 1000 сироваток крові донорів, завдяки чому містять широкий спектр антитіл різної специфічності, що відображає стан колективного імунітету контингенту донорів. Призначаються для профілактики інфекційних захворювань: гепатиту, кору, кашлюку, менінгококової інфекції, поліомієліту.
Внутрішньовенні імуноглобуліни (ВІГ) безпечні в плані перенесення вірусних інфекцій, містять достатню кількість IgG3, відповідального за нейтралізацію вірусів, мають активність Fc-фрагмента. Показання до застосування:
1. Захворювання, при яких ефект ВІГ переконливо доведений:
— первинні імунодефіцити (Х-зв’язана агаммаглобулінемія; загальний варіабельний імунодефіцит; транзиторна гіпогаммаглобулінемія дітей; імунодефіцит з гіперглобулінемією-М; дефіцит підкласів імуноглобуліну-G; дефіцит антитіл з нормальним рівнем імуноглобулінів; тяжкі комбіновані імунодефицити всіх типів; синдром Віскотта — Олдрича; атаксія-телеангіектазія; карликовість з вибірково короткими кінцівками; X-зв’язаний лімфопроліферативний синдром.
— вторинні імунодефіцити: гіпогаммаглобулінемія; профілактика інфекцій при хронічному лімфолейкозі; профілактика цитомегаловірусної інфекції при алогенній пересадці кісткового мозку й інших органів; синдром відторгнення при алогенній пересадці кісткового мозку; хвороба Кавасакі; СНІД у педіатричній практиці; хвороба Гійєна — Барре; хронічні демієлінізуючі запальні полінейропатії; гостра і хронічна тромбоцитопенічна пурпура, зокрема у дітей, і пов’язана з ВІЛ-інфекцією; автоімунна нейропенія.
2. Захворювання, при яких ВІГ імовірно ефективний: злоякісні новоутворення з дефіцитом антитіл; профілактика інфекцій при мієломній хворобі.
3. Захворювання, при яких застосування ВІГ, можливо, буде ефективним: судоми, що не купіруються; системний червоний вовчак (СЧВ); дерматоміозит, екзема; ревматоїдний артрит, опікова хвороба; м’язова атрофія Дюшена; цукровий діабет; тромбоцитопенічна пурпура, пов’язана з уведенням гепарину; некротичний ентероколіт; ретинопатія; хвороба Крона; множинна травма, рецидивуючий середній отит; псоріаз; перитоніт; менінгіт; менінгоенцефаліт.
Особливості клінічного застосування ВІГ
Існує декілька варіантів лікувально-профілактичного застосування імуноглобулінів: замісна терапія при імунодефіцитах, ускладнених інфекцією; імунотерапія хворих із тяжкою інфекцією (сепсис); переважна ІТ при автоалергічних і алергічних захворюваннях.
Гіпогаммаглобулінемії зазвичай зустрічаються у дітей з активними бактерійними інфекціями. У таких випадках імунотерапію слід проводити в режимі насичення, одночасно з активною протимікробною хіміотерапією. Проводять переливання нативної (свіжої або кріоконсервованої) плазми в разовій дозі 15–20 мл/кг маси тіла.
ВІГ уводять у добовій дозі 400 мг/кг внутрішньовенно краплинно або інфузійно по 1 мл/кг/год недоношеним і 4–5 мл/кг/год доношеним дітям. Недоношеним дітям з масою тіла менше 1500 г і рівнем IGG 3 г/л і нижче ВІГ уводять для профілактики інфекцій. При імунодефицитах з низьким рівнем IGG у крові ВІГ уводять до досягнення концентрації IGG у крові не нижче за 4–6 г/л. При тяжких гнійно-запальних захворюваннях уводять 3–5 ін’єкцій щодня або через день до 1–2,5 г/кг. У початковий період інтервали між вливаннями можуть бути 1–2 дні, наприкінці — до 7 днів. Достатніми виявляються 4–5 уведень, так що за 2–3 тижні хворий у середньому отримує 60–80 мл плазми, або 0,8–1,0 г ВІГ на 1 кг маси тіла. За місяць переливається не більше 100 мл плазми, або 1,2 г ВІГ на 1 кг маси тіла хворого.
Інтраглобін — ВІГ, містить в 1 мл 50 мг IGG і близько 2,5 мг IGA. Застосовують при імунодефіцитах, інфекціях, автоімунних захворюваннях.
Пентаглобін — ВІГ, збагачений IGM, містить: IGM — 6 мг, IGG — 38 мг, IGA — 6 мг в 1 мл. Застосовують при сепсисі, інших інфекціях, імунодефіциті: новонародженим — 1 мл/кг/год, по 5 мл/кг щодня — впродовж 3 днів; дорослим — 0,4 мл/кг/год, потім 0,4 мл/кг/год, далі безперервно 0,2 мл/кг до 15 мл/кг/год протягом 72 годин — 5 мл/кг упродовж 3 днів, за необхідністю — повторний курс.
Октагам — ВІГ, що містить в 1 мл 50 мг білків плазми, з них — 95% IGG; менше 100 мкг IGA і менше 100 мкг IGM. Близький до нативного IGG плазми крові, присутні всі субкласи IGG. Показання: природжена агаммаглобулінемія, варіабельні та комбіновані імунодефіцити, тромбоцитопенічна пурпура, хвороба Кавасакі, пересадка кісткового мозку.
При імунодефіциті препарати вводять до рівня IGG у плазмі крові 4–6 г/л. Початкова доза — 400–800 мг/кг, з подальшим уведенням 200 мг/кг кожні 3 тижні. Для досягнення рівня IGG 6 г/л необхідно ввести 200–800 мгр/кг на місяць. Для контролю визначають рівень IGG у крові.
Для лікування і профілактики інфекцій дози ВІГ залежать від виду інфекційного процесу. Як правило, його вводять якомога раніше. При цитомегаловірусної інфекції доза повинна становити 500 мг/кг щотижня протягом 12 тижнів, тому що період напіввиведення підкласу IgG3, відповідального за нейтралізацію вірусу, — 7 днів, а клінічно інфекція виявляється між 4–12-м тижнем після інфікування. Одночасно призначають противірусні препарати, що діють синергічно.
Для профілактики неонатального сепсису у недоношених дітей масою тіла від 500 до 1750 г рекомендується вводити від 500 до 900 мг/кг/добу IGG для підтримки його концентрації не менше 800 мг/кг під контролем рівня IGG у крові. Підвищення рівня IGG зберігається в середньому 8–11 днів після введення. Введення IGG вагітним після 32-го тижня знижувало ризик інфекції у новонароджених.
Препарати ВІГ застосовують і для лікування сепсису, особливо поєднано з антибіотиками. Рекомендований рівень у крові — понад 800 мг/кг.
Після алогенної трансплантації кісткового мозку для профілактики ЦМВ й інших інфекцій ВІГ уводять щотижня протягом 3 місяців, а потім 500 мл/кг кожні 3 тижні протягом 9 місяців.
При лікуванні автоімунних захворювань дози становлять 250–1000 мл/кг протягом 2–5 днів кожні 3 тижні. Дітям з автоімунною тромбоцитопенічною пурпурою вводять по 400 мл/кг упродовж 2 днів, дорослим — 1 г/кг протягом 2 або 5 днів.
Механізм дії імуноглобулінів залежить від стану Fc-рецепторів лейкоцитів: зв’язуючись з ними, імуноглобуліни підсилюють функції при інфекції і, навпаки, пригнічують при алергії.
Антирезусний імуноглобулін пригнічує у резус-негативної жінки синтез антитіл проти резус-позитивного плода за типом зворотного зв’язку.
Механізм дії IGG полягає в специфічному і неспецифічному ефекті. Специфічний ефект пов’язаний з дією невеликої кількості завжди присутніх антитіл. Неспецифічний — з імуномодулюючим ефектом. Обидва ефекти зазвичай опосередкують через Fc-рецептори лейкоцитів. Зв’язуючись з Fc-рецепторами лейкоцитів, імуноглобуліни активують їх, зокрема фагоцитоз. Якщо серед молекул імуноглобуліну є антитіла, то вони можуть опсонувати бактерії або нейтралізувати віруси.
Моноклональні антитіла мишей проти лімфоцитів і цитокінів людини застосовують для пригнічення автоімунних реакцій, трансплантаційного імунітету. Нижче наведені деякі варіанти використання моноклональних антитіл:
— антитіла проти CD20 В-лімфоцитів для імуносупресії (мабтера);
— антитіла проти рецепторів до інтерлейкіну-2 — при загрозі відторгнення алотрансплантата нирки;
— антитіла проти IGE — при тяжких алергічних реакціях (ксолар).
Препарати кісткового мозку, лейкоцитів і селезінки
Мієлопід отримують з культури кістковомозкових клітин свиней. Мієлопід стимулює протипухлинний імунітет, фагоцитоз, клітини-антитілопродуценти, проліферацію гранулоцитів і макрофагів у кістковому мозку. Мієлопід використовується при лікуванні септичних, затяжних і хронічних інфекційних захворювань бактерійної природи, вторинних імунодефіцитів, оскільки має здатність підсилювати синтез антитіл у присутності антигенів. Мієлопід (флакон 5 мг) уводять в/м щодня або через день. Разова доза — 0,04–0,06 мг/кг. Курс терапії складається з 3–10 ін’єкцій через день.
Лейкоцитарний чинник перенесення (трансфер-фактор) — група біологічно активних речовин, що екстрагуються з лейкоцитів здорових або імунізованих донорів за допомогою багатократних послідовних заморожувань і розморожувань. Трансфер-фактори підсилюють гіперчутливість сповільненого типу до конкретних антигенів. Препарат перешкоджає розвитку імунологічної толерантності, підсилює диференціювання Т-клітин, хемотаксис нейтрофілів, утворення інтерферонів, синтез імуноглобулінів (в основному класу М). Разова доза становить для дорослих 1–3 одиниці сухої речовини. Використовується в лікуванні первинних імунодефіцитів, особливо макрофагального типу і терапії вторинних імунодефіцитів лімфоїдного типу (при дефектах диференціювання і проліферації Т-клітин, порушенні хемотаксису і презентації антигенів).
Цитокіни — група біологічно активних глікопептидів-медіаторів, що виділяються імунокомпетентними клітинами, а також фібробластами, клітинами ендотелію, епітелію.
Беталейкін — рекомбінантний IL-lв, випускається в ампулах по 0,001; 0,005 або 0,0005 мг (5 ампул). Стимулює лейкопоез при лейкопеніях, викликаних цитостатиками і опромінюванням, диференціювання імунокомпетентних клітин. Застосовують в онкології, при післяопераційних ускладненнях, затяжних, гнійно-септичних інфекціях. Уводять в/в краплинно в дозі 5 нг/кг для імуностимуляції; 15–20 нг/кг для стимуляції лейкопоезу щодня на 500 мл 0,9% розчину натрію хлориду протягом 1–2 год. Курс — 5 інфузій.
Ронколейкін — рекомбінантний IL-2. Показання: ознаки імунодефіциту, гнійно-запальні захворювання, сепсис, перитоніт, абсцеси і флегмони, піодермії, туберкульоз, гепатит, СНІД, онкологічні захворювання. При сепсисі вводять по 0,25–1 мг (25 000–1 000 000 MО) в 400 мл 0,9% розчину натрію хлориду в/в краплинно зі швидкістю 1–2 мл/хв протягом 4–6 год., при онкологічних захворюваннях — 1–2 млн ОД 2–5 разів з інтервалами 1–3 дні, по 25 000 MО в 5 мл фізіологічного розчину вводять при синуситах у верхньощелепну або лобову пазухи; інсталяції в уретру при хламідіозі щодня по 50 000 MО (14–20 діб); перорально при ієрсиніозах і діареях — по 500 000–2 500 000 МО в 15–30 мл дистильованої води натще щоденно протягом 2–3 днів. Ампули по 0,5 мг (500 000 MО), 1 мг (1 000 000 MО).
Нейпоген (філграстим) — рекомбінантний гранулоцитарний колонієстимулюючий фактор (Г-КСФ) стимулює формування функціонально активних нейтрофілів і частково моноцитів у перші 24 години після введення, активує гемопоез. Застосовують при нейтропеніях хіміотерапії, для профілактики інфекцій у дозі 5 мкг/кг/добу в/в або п/ш через 24 години після циклу лікування протягом 10–14 днів. При природженій нейтропенії — 12 мкг/кг/добу п/ш щодня.
Лейкомакс (молграмостим) — рекомбінантний гранулоцитарний макрофагальний колонієстимулюючий фактор (ГМ-КСФ). Застосовують при лейкопеніях у дозі 1–10 мкг/кг/добу, підшкірно за показаннями.
Граноцит (ленограстим) — гранулоцитарний колонієстимулюючий фактор, стимулює проліферацію попередників гранулоцитів, нейтрофілів. Застосовують при нейтропеніях по 2–10 мкг/кг/добу протягом 6 днів.
Лейкінферон — є комплекс цитокінів першої фази імунної відповіді, що включає IFN-a, IL-1, IL-6, IL-12, TNF-a, MIF. При бактеріальних інфекціях курс лікування повинен бути інтенсивним (через день по 1 амп., в/м) і лише при відновленні підтримуючого імунітету (2 рази на тиждень по 1 амп., в/м).
Класифікація інтерферонів за їх походженням наведена в табл. 1.
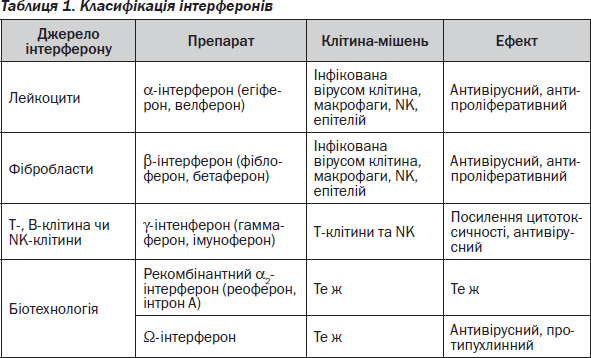
Інтерферони в дозах до 2 млн MО викликають імуностимулюючий ефект, а їх високі дози (10 млн MО) — імуносупресію.
Необхідно пам’ятати, що всі препарати інтерферонів можуть спричинювати гарячку, грипоподібний синдром, нейтропенії і тромбоцитопенії, алопецію, дерматити, порушення функції печінки і нирок та інші ускладнення.
Лейкоцитарний a-інтерферон (егіферон, велферон) використовується як профілактичний препарат у формі місцевих аплікацій на слизову оболонку в епідемічні періоди і при лікуванні ранніх стадій гострих респіраторних та інших вірусних захворювань. При вірусних ринітах необхідне введення інтраназально достатньо великої дози (3 ґ 106 MО) 3 рази на день у ранній період захворювання. Препарат швидко виводиться зі слизом й інактивується його ферментами. Застосування його понад тиждень може викликати посилення запалення. Очні інтерферонові краплі використовують при вірусних ураженнях ока.
Людський імунний g-інтерферон (гаммаферон) викликає цитотоксичний ефект, модулює активність Т-лімфоцитів і активує В-клітини. При цьому препарат може пригнічувати антитілоутворення, фагоцитоз і модифікувати відповідь лімфоцитів. Ефект гаммаінтерферону на Т-клітини зберігається 4 тижні. Застосовують при псоріазі, ВІЛ-інфекції, атопічному дерматиті, пухлинах.
Дози препаратів інтерферону для парентерального введення добирають індивідуально: від декількох тисяч одиниць на 1 кг маси тіла до декількох мільйонів одиниць на 1 ін’єкцію. Курс — 3–10 ін’єкцій. Побічні реакції: грипоподібний синдром.
Роферон-А — рекомбінантний інтерферон альфа-2а вводять в/м (до 36 млн MО) або п/ш (до 18 млн MО). При волосато-клітинному лейкозі — 3 млн МО/добу в/м упродовж 16–24 тижнів; мієломна хвороба — 3 млн MО 3 рази на тиждень в/м; саркомі Калоші та ниркоклітинній карциномі — 18–36 млн MО на добу; вірусному гепатиті В — 4,5 млн MО в/м 3 рази на тиждень протягом 6 місяців.
Віферон — рекомбінантний інтерферон a-2b застосовують у вигляді свічок (по 150 тис. MО, 500 тис. MО, 1 млн MО), мазь (40 тис. MО в 1 г). Призначають при інфекційно-запальних захворюваннях (ГРВІ, пневмонія, менінгіт, сепсис та ін.), гепатитах, герпесі шкіри і слизових оболонок — 1 раз на день або через день у свічках; при герпесі — додатково змащують уражені ділянки шкіри маззю 2–3 рази на добу. Дітям — свічки по 150 тис. MО 1 ґ 3 рази через 8 годин упродовж 5 днів; при гепатитах — по 500 тис. MО.
Реаферон (інтераль) — рекомбінантний інтерферон a2 призначають при гепатиті В, вірусному менінгоенцефаліті внутрішньом’язово по 1–2 ґ 106 MО 2 рази на день упродовж 5–10 днів, потім дозу знижують. При грипі, кору може застосовуватися інтраназаль-Ко; при генітальному герпесі — мазь (0,5 ґ 106 МО/г), оперізувальному лишаї — внутрішньом’язово по 1 ґ 106 MО на день протягом 3–10 днів. Використовують також для лікування пухлин.
Вітаміни
Під впливом вітамінів змінюється активність біохімічних процесів у клітинах, у тому числі імунологічних. Деякі форми імунологічної недостатності асоціюються з дефіцитом тих або інших вітамінів. Прикладом може бути первинна форма дефекту фагоцитозу — синдром Чедіака — Хігасі. Аскорбінова кислота нормалізує активність Т-лімфоцитів і нейтрофілів у хворих із початково пониженими показниками. Проте високі дози (10 г) викликають імунодепресію.
Вітамін Е (токоферолу ацетат, a-токоферол) — міститься в соняшниковій, кукурудзяній, соєвій, обліпиховій олії, яйцях, молоці, м’ясі. Має антиоксидантні й імуностимулюючі властивості. Застосовують при м’язовій дистрофії, порушенні статевої функції, при хіміотерапії. Призначають усередину і внутрішньом’язово по 0,05–0,1 г на добу впродовж 1–2 міс. Призначення вітаміну Е в добовій дозі 300 MО протягом 6–7 днів перорально збільшує кількість лейкоцитів, Т- і В-лімфоцитів.
Фітоімуномодулятори. Настої, відвари трав мають імуномодулюючу (імуностимулюючу) активність.
Елеутерокок при нормальному імунному статусі не змінює показники імунітету. Має інтерфероногенну активність. При дефіциті числа Т-клітин нормалізує показники, підсилює функціональну активність Т-клітин, активує фагоцитоз, неспецифічні реакції імунітету. Застосовують по 2 мл спиртного екстракту за 30 хвилин до їди 3 рази на день упродовж 3–4 тижнів. У дітей для профілактики рецидивів ГРЗ — по 1 краплі/1 рік життя 1–3 рази на добу протягом 3–4 тижнів.
Женьшень. Підвищує працездатність і загальну опірність організму до захворювань і несприятливих дій, не викликає шкідливих побічних явищ і може застосовуватися тривалий час. Корінь женьшеня — сильний збудник ЦНС, не дає негативних ефектів, не порушує сон. Препарати женьшеня стимулюють тканинне дихання, збільшують газообмін, покращують склад крові, нормалізують ритм серця, підвищують світлочутливість очей, прискорюють процеси загоєння, пригнічують життєдіяльність деяких бактерій, підвищують стійкість до радіації. Препарати з нього рекомендується застосовувати в осінньо-зимовий період. Найбільш стимулюючий ефект спостерігається при використанні порошку женьшеня і настоянки на спирті 40°. Разове дозування становить 15–25 крапель спиртової настоянки (1 : 10), або 0,15–0,3 г порошку женьшеня. Приймати 2–3 рази на день до їди курсами по 30–40 днів, після чого зробити перерву.
Ехінацея (Echinacea purpurea) чинить імуностимулюючу, протизапальну дію, активує макрофаги, секрецію цитокінів, інтерферонів, стимулює Т-клітини. Препарати ехінацеї застосовують для профілактики респіраторних захворювань в осінньо-весняний період, а також для лікування вірусних і бактерійних інфекцій верхніх дихальних шляхів, сечостатевого тракту та ін. Рекомендується 40 крапель 3 рази на день, розбавлені водою. Підтримуючі дози — 20 крапель 3 рази на день перорально протягом 8 тижнів.
Імунал — настій 80% соку ехінацеї пурпурної, 20% етанолу. Призначають по 20 крапель всередину кожні 2–3 години при ГРЗ, грипі, потім 3 рази на день. Курс — 1–8 тижнів.
Біостимулятори — адаптогени: настоянка лимоннику, відвари і настої череди, чистотілу, календули, фіалки триколірної, солодкового кореня і кульбаби мають імунокоригуючий ефект.
Бактеріоімунотерапія
Дисбіози слизових оболонок відіграють важливу роль у патології. Антибіотикотерапія, цитостатична і променева терапія викликають порушення біоценозу слизових оболонок, у першу чергу кишечника, і тоді виникають дисбактеріози. Пробіотичні лактобактерії і біфідобактерії, колібактерії, виділяючи коліцини, інгібують зростання патогенних бактерій.
Лактобактерії — антагоністи патогенних мікробів, виділяють ферменти і вітаміни. Рекомендується призначати поєднано зі специфічними бактеріофагами, що пригнічують патогенну флору. Недоцільно застосовувати при кандидозах, оскільки їх кислоти підсилюють зростання грибів.
Біфідумбактерин сухий — висушені живі біфідобактерії. Дорослим — по 5 пігулок 2–3 рази на день за 20 хв. до їди. Курс — до 1 міс. Дітям — у флаконах, розводять теплою кип’яченою водою (1 пігулка на 1 чайну ложку) по 1–2 дози 2 рази на день.
Застосовують при дисбактеріозах, ентеропатіях, штучному вигодовуванні дітей, лікуванні недоношених, гострих кишкових інфекціях (дизентерія, сальмонельоз та ін.), хронічних захворюваннях кишечника (гастрит, дуоденіт, коліт), променевій і хіміотерапії пухлин, кандидозних вагінітах, непереносимості їжі, харчовій алергії, дерматитах, екземі, для нормалізації мікрофлори слизової оболонки ротової порожнини при стоматитах, пародонтитах, цукровому діабеті, хронічних захворюваннях печінки і підшлункової залози, роботі в шкідливих і екстремальних умовах.
Біфікол сухий — живі висушені біфідобактерії і кишкова паличка vrt7. Дорослим і дітям старше за 3 роки — за 20–30 хв. до їди по 3–5 табл. 2 рази на день, запивати водою. Курс — 2–6 тижнів.
Біфіформ містить не менше 107 Bifidobacterium lobgum, а також 107 Епterococcus faecium в капсулах. При дисбактеріозі I–II ступеня — по 1 капсулі 3 рази на день, курс — 10 днів; при дисбактеріозі II–III ступеня — збільшення курсу до 2–2,5 тижня.
Лінекс — комбінований препарат, містить три компоненти природної мікрофлори з різних відділів кишечника: в одній капсулі — 1,2 ґ 107 живих ліофілізованих бактерій Bifidobacterium infantis, Lactobacillus, Cl. dophilus і Str. faecium, стійких до антибіотиків і хіміопрепаратів. Підтримують мікробіоценоз у всіх відділах кишечника — від тонкої до прямої кишки. Призначають: дорослим — по 2 капсули 3 рази на день, запиваючи кип’яченою водою, молоком; дітям до 2 років — по 1 капсулі 3 рази на день, запиваючи рідиною або змішуючи з нею вміст капсули.
Колібактерин сухий — висушена жива кишкова паличка, штам M-l7, що є антагоністом для патогенних мікробів, стимулює імунітет, а також ферменти і вітаміни. Дорослим — 3–5 табл. 2 рази на день за 30–40 хв. до їди, запивають лужною мінеральною водою. Курс — 3 тижні — 1,5 місяця.
Хілак форте містить продукти метаболічної активності пробіотичних штамів лактобацил і нормальних мікроорганізмів кишечника — кишкової палички і фекального стрептокока: молочна кислота, амінокислоти, жирні кислоти, лактоза. Сумісно з прийомом антибіотиків. Не рекомендується одночасне застосування антацидних препаратів унаслідок можливої нейтралізації молочної кислоти, що входить до складу хілака форте. Призначають у дозі 20–40 крапель 3 рази на день протягом 2–3 тижнів (дітям грудного віку — 15–30 крапель 3 рази на добу), приймають у невеликій кількості рідини до або під час їди, виключаючи молоко і молочні продукти.
Гастрофарм — живі ліофілізовані клітини Lactobacillus bulgaricus-51 і метаболіти їх життєдіяльності (молочна і яблучна кислоти, нуклеїнові кислоти, ряд амінокислот, поліпептиди, полісахариди). Всередину, 3 рази на добу, розжовуючи з невеликою кількістю води. Разова доза для дітей становить 0,5 пігулки, для дорослих — 1–2 пігулки.
Імуномодулюючі ефекти антибіотиків
Умовно-патогенні мікроби не викликають хвороби у більшості людей і є нормальними мешканцями шкіри і слизових оболонок. Причина їх активації — недостатня резистентність організму — імунодефіцит. Тому основою інфекційно-запальних хвороб є природжені або придбані, гострі та хронічні імунодефіцити, що створюють сприятливі умови для розмноження мікробів, які в нормі постійно елімінуються факторами імунітету. Прикладом поширеного гострого імунодефіциту є синдром застуди, коли на тлі гіпотермії організму пригнічується природна резистентність до умовно-патогенних мікробів.
Виходить, що без відновлення реактивності організму пригнічення тільки мікрофлори часто є недостатнім для повного одужання. Більше того, чимало антибактеріальних засобів пригнічують імунітет, створюють умови для контамінації організму резистентними до антибіотиків штамами. Ще більше посилює проблему поширене профілактичне застосування антибактеріальних засобів при вірусних інфекціях. Основні шляхи вирішення проблеми: одночасне застосування антибіотиків і засобів, що нормалізують пригнічені ланки системи імунітету; додаткове застосування засобів імунореабілітації; максимальне збереження та відновлення ендоекології організму. Можливі два види впливу антибіотиків на імунну відповідь: пов’язані з лізисом або пошкодженням бактерій і обумовлені прямим впливом на клітини імунної системи.
1. Ефекти, опосередковані пошкодженими бактеріями:
— інгібіція синтезу клітинної стінки (пеніциліни, кліндаміцин, цефалоспорини, карбапенеми та ін.) — знижує стійкість бактерійних клітин до дії бактерицидних чинників лейкоцитів і макрофагів;
— інгібіція синтезу білка (макроліди, рифампіцин, тетрациклін, фторхінолони та ін.) викликає зміни клітинної мембрани мікроорганізмів і може підсилювати фагоцитоз внаслідок зниження експресії на поверхні бактерійних клітин білків з антифагоцитарними функціями, в той же час ці антибіотики пригнічують імунну відповідь у зв’язку з порушенням синтезу білка в клітинах системи імунітету;
— дезінтеграція мембрани грамнегативних бактерій і підвищення її проникності (аміноглікозиди, поліміксин В) збільшує чутливість мікроорганізмів до дії бактерицидних чинників.
2. Ефекти антибіотиків обумовлені звільненням з мікроорганізмів при їх руйнуванні біологічно активних речовин: ендотоксинів, екзотоксинів, глікопептидів та ін. Невеликі дози ендотоксинів необхідні для нормального розвитку імунітету, роблять сприятливий вплив, стимулюють неспецифічну резистентність до бактерійних і вірусних інфекцій, а також до раку. Це видно на прикладі кишкової палички, яка є нормальним мешканцем кишечника. При її руйнуванні виділяється невелика кількість ендотоксину, що стимулює місцевий і загальний імунітет. Тому при таких затяжних інфекціях часто ефективні препарати бактерійних ліпополісахаридів — продигіозан, пірогенал і лікопід. Проте при тяжкій інфекції і виділенні великої кількості ендотоксину в потік крові індуковані ним цитокіни (IL-1, TNF-a) можуть викликати пригнічення фагоцитозу, виражений токсикоз аж до токсикосептичного шоку зі зниженням серцево-судинної діяльності. З іншого боку, інтенсивний лізис великої кількості бактерій і виділення ендотоксинів можуть призвести до побічних реакцій типу Джаріша — Герксгеймера.
Ефекти, обумовлені прямим впливом антибіотиків на систему імунітету:
— бета-лактамні антибіотики підсилюють фагоцитоз і хемотаксис лейкоцитів, але у великих дозах можуть пригнічувати антитілоутворення і бактерицидність крові;
— цефалоспорини, зв’язуючись з нейтрофілами, підвищують їх бактерицидність, хемотаксис і окислювальний метаболізм у хворих з імунодефіцитами;
— гентаміцин знижує фагоцитоз і хемотаксис гранулоцитів і РБТЛ.
— макроліди (еритроміцин, рокситроміцин і азитроміцин) стимулюють функції фагоцитів, бактерицидність, хемотаксис, синтез цитокінів (IL-1 та ін.).
— фторхінолони підсилюють проліферацію клітин імунної системи, підвищують синтез IL-2, фагоцитоз і бактерицидність;
— тетрациклін, доксициклін пригнічують фагоцити і синтез антитіл.
Імуномодулюючі ефекти антибіотиків на систему імунітету призводять до розвитку алергічних реакцій. Основою є взаємодія антибіотиків як гаптену з клітинами системи імунітету і активація специфічної імунної відповіді.
Основні критерії призначення імуномодулюючих препаратів
Лікарські засоби, дозволені як ІТЛЗ до медичного застосування за кордоном, і основні захворювання, при яких вони призначаються, наведені в табл. 2. Основні лікарські препарати, дозволені до медичного застосування як ІТЛЗ в Україні та Росії, наведені в табл. 3.
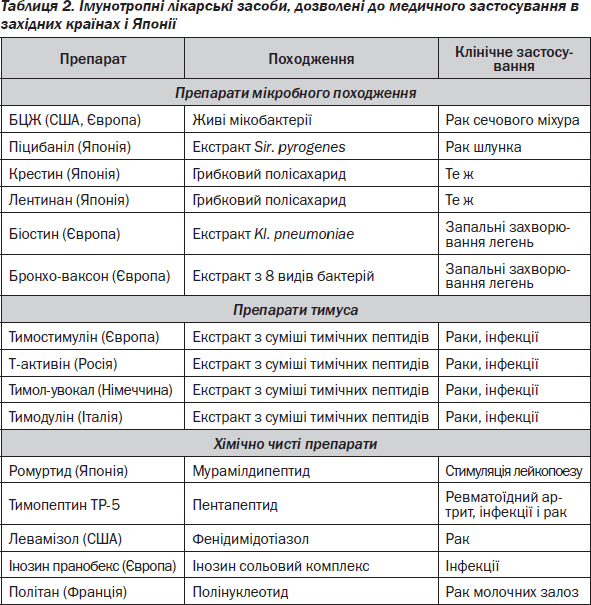
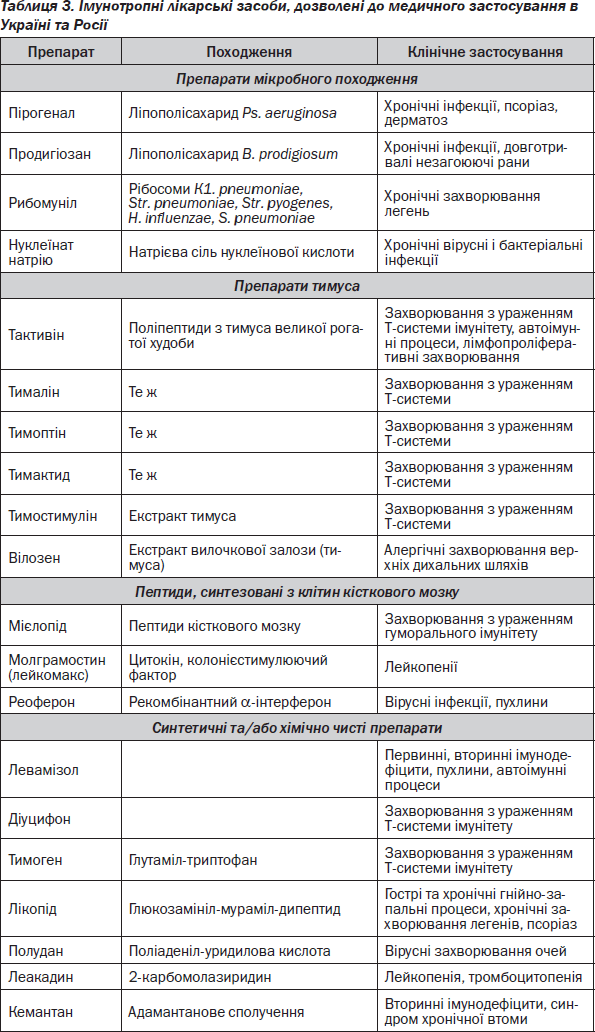
Підставою для проведення імунотерапії є результати клиніко-імунологічного дослідження. На підставі даних цього обстеження можна виділити три групи людей:
1. Особи, які мають клінічні ознаки порушення імунітету і зміни імунологічних показників.
2. Особи, які мають клінічні ознаки порушення імунної системи за відсутністю змін імунологічних показників, що виявляються за допомогою звичайних лабораторних тестів.
3. Особи, які мають зміни імунологічних показників, клінічних ознак недостатності імунної системи.
Головною мішенню дії препаратів мікробного походження є клітини моноцитарно-макрофагальної системи, природним завданням яких є елімінація мікроба з організму. Вони підсилюють функціональну активність цих клітин, стимулюючи фагоцитоз. Паралельно з цим відбувається й активація цитотоксичної функції макрофагів, що виявляється в їх здатності руйнувати in vivo пухлинні клітини. Активовані моноцити і макрофаги починають синтезувати цитокіни: IL-1, IL-3, TNF, колонієстимулюючий фактор та ін. Наслідком цього є активація як гуморальної, так і клітинної ланки імунітету.
Мішенню для дії препаратів тимічного походження є Т-лімфоцити, що виявляється індукцією синтезу Т-клітинами цитокінів і посиленням проліферації, диференціювання і цитотоксичних властивостей.
Мішенню для дії препаратів кістковомозкового походження є В-лімфоцити, що виявляється посиленням синтезу антитіл.
Вибір імуномодулюючого препарату і схеми його застосування визначається лікарем-імунологом залежно від тяжкості основного захворювання, супутньої патології, типу виявленого імунологічного дефекту.
Правила призначення імунотропних препаратів
При ураженні клітин моноцитарно-макрофагальної системи застосовуються: поліоксидоній — в дозі від 6 до 12 мг; лікопід — в дозі 1, 10 мг. При найбільш тяжких формах ураження використовуються препарати гранулоцитарно-макрофагальних колонієстимулюючих факторів: молграмостим (лейкомакс) 150, 300, 400 мкг; філграстим (нейпоген) 300, 480 мкг. Для замісної терапії використовується лейкомаса.
При дефектах клітинної ланки імунітету застосовується один із таких препаратів: поліоксидоній — у дозі від 6 до 12 мг; тактивін 0,01% розчин — у дозі 1 мл п/ш; тимоптин — у дозі 100 мкг; тимоген 0,01% розчин — 1 мл в/м; тималін — 10 мг в/м 1 раз на день або через день.
При порушенні синтезу антитіл В-лімфоцитами показані: мієлопід 0,003 г; поліоксидоній — в дозі від 6 до 12 мг.
При порушенні гуморального імунітету (альфа- або гіпогаммаглобулінемії) проводиться замісна терапія препаратами імуноглобулінів: сандоглобулін — 1,0; 3,0; 6,0 і 12 г у флаконі; октагам — 50, 100, 200 мл у флаконі; інтраглобін — 2,5; 5,0 г; імуноглобулін нормальний людський для в/в введення — 25 мл; біавен — 1,0; 2,5 г/кг, а також препаратами, що мають у складі IgM, — пентаглобін 5% — 10,0; 20,0; 50,0 мл. Замісна підтримуюча терапія проводиться в режимі насичення (рівень імуноглобуліну G не менше 400 мкг/мл) під контролем лікаря-імунолога.
Основи імунотерапії вірусних інфекцій:
1. Активація внутрішньоклітинного противірусного захисту (інтерферон).
2. Активація фагоцитозу і кілерів (поліоксидоній).
3.Скріплення вірусів після руйнування уражених клітин і виходу вірусних частинок у периферичну кров (специфічні гамма-глобуліни, плазма крові поєднано з антибіотиками і противірусними препаратами — таміфлю).
4. Збільшення синтезу противірусних антитіл (гропринозин).
Тривалість лікування в стаціонарі — від 20 до 30 днів.
Додаткова терапія — екстракорпоральні методи імунокорекції — плазмаферез, імуносорбція, екстракорпоральна імунофармакотерапія.
Вимоги до результатів лікування: купірування клінічних проявів імунної недостатності, зменшення частоти рецидивів захворювання, нормалізація або тенденція до нормалізації початково змінених показників імунітету.
Тривалість усунення імунологічних порушень становить від 30 днів до 6–9 місяців і залежить від властивостей препарату, маркерного показника і характеру захворювання.
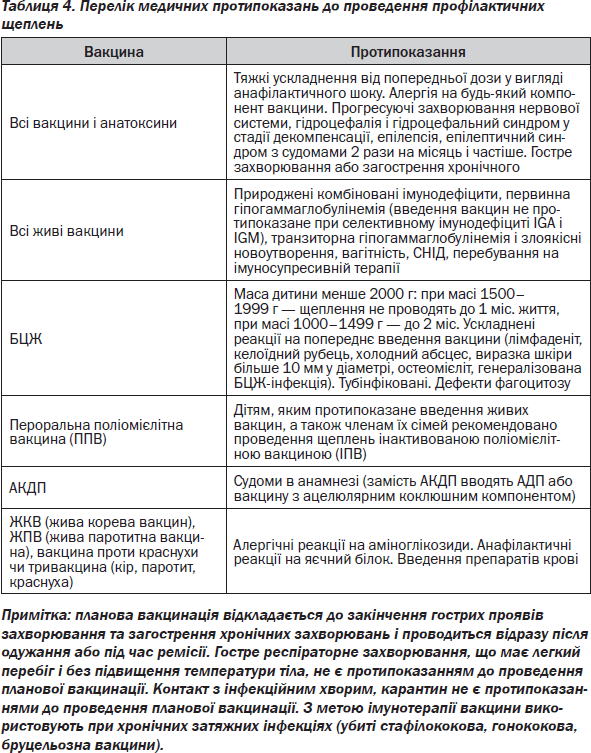
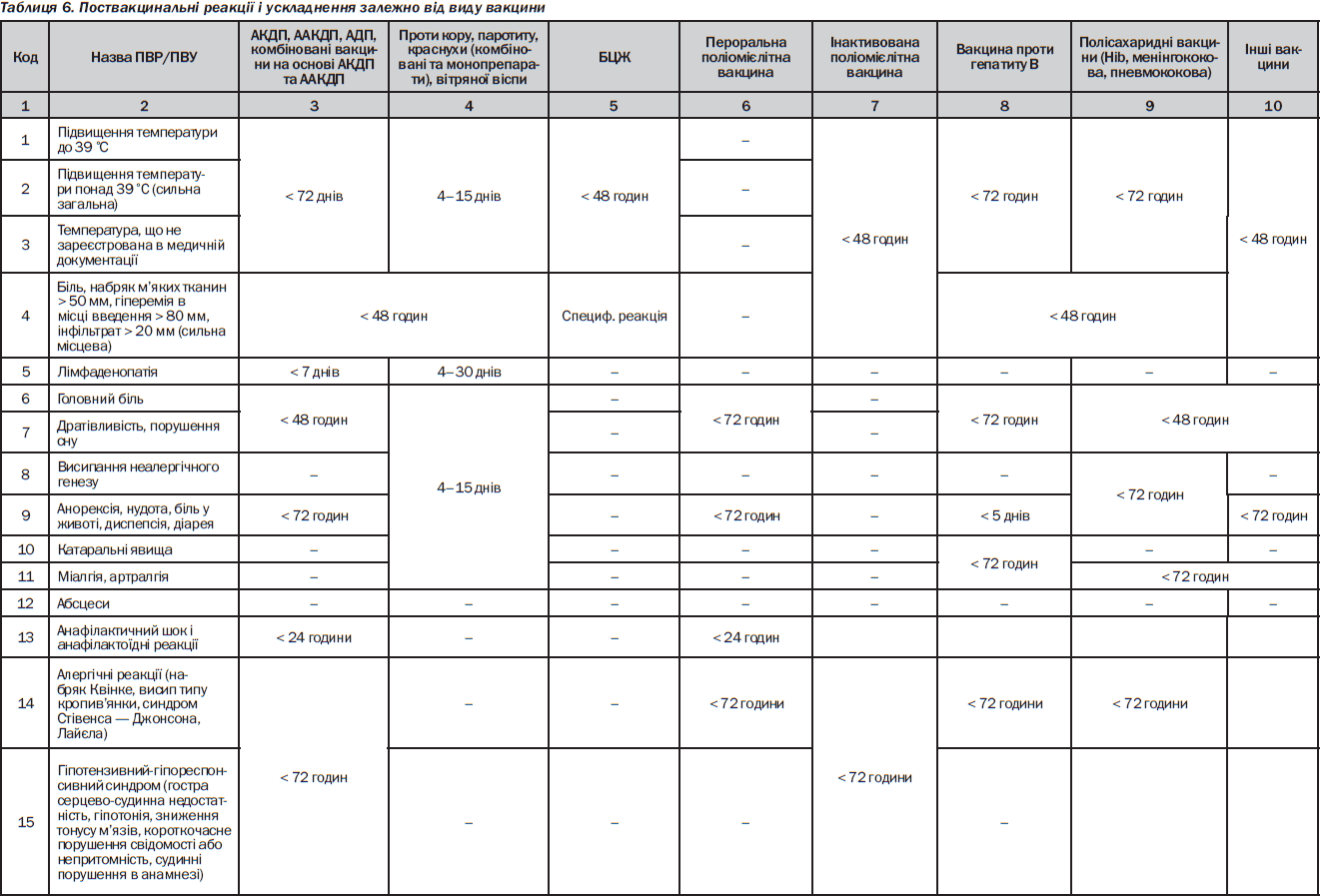
Хвороби та ускладнення, обумовлені імунотерапією й імунопрофілактикою
У процесі імунотерапії (ІТ) й імунопрофілактики (ІП) можливе виникнення індукованих ними захворювань. Вони зазвичай обумовлені підвищенням реактивності організму і розвитком алергічних і псевдоалергічних реакцій, зниженням реактивності і розвитком імунодефіцитів, порушенням метаболізму і індукцією ферментопатій. Відповідно до видів ІТ розрізняють такі захворювання:
— хвороби, викликані активною імунотерапією й ІП (поствакцинальні ускладнення, див. далі);
— хвороби, що виникли у зв’язку з пасивною ІТ (анафілактичний шок, сироваткова хвороба);
— патологія імуномодуляції: а) імунодепресивний синдром; б) синдроми імуностимуляції (алергічні, автоімунні та лімфопроліферативні захворювання); в) непередбачувані патологічні імуномодуляції (у зв’язку з порушенням експресії рецепторів або секреції імунотропних чинників);
— інші неспецифічні ускладнення (метаболічні, токсичні та ін.).
Патологія імуномодуляції, в якій слід розрізняти синдроми імунодепресії й імуностимуляції, достатньо часто зустрічається у випадках неадекватного і неправильного застосування імунотерапевтичних засобів (ІТЗ). Використання імуномодуляторів завжди припускає пригнічення одних ланок системи імунітету (СІ) при стимуляції інших. Для профілактики ускладнень важливо контролювати як пригнічуючі, так і стимулюючі ефекти з тим, щоб вони не набували патологічного характеру.
Імунодепресія небезпечна можливістю ускладнень у вигляді бактерійної, грибкової і вірусної інфекцій. Причому чим сильніше пригнічення імунітету, тим вірогідніше їх виникнення. При місцевому застосуванні імунодепресантів ускладнення перш за все настають у вогнищі їх дії внаслідок пригнічення місцевих захисних реакцій і у зв’язку з модифікацією метаболізму тканин. Наприклад, застосування аерозолів глюкокортикостероїдів індукує кандидози слизових оболонок дихальних шляхів.
Синдром імуностимуляції клінічно виявляється у вигляді алергічних і автоімунних захворювань, його прояви — це різні клінічні форми лікарської алергії (анафілактичний шок, кропив’янка і набряк Квінке, токсикодермія, вісцелярні ураження). Реакції перебігають за негайним і сповільненим типом і можуть бути як дійсними алергічними, так і псевдоалергічними. Лікарські реакції нерідко індукують і автоімунні захворювання (автоімунні гемолітичні анемії, лейкопенії та ін.). Імуностимуляція може бути причиною розвитку лімфопроліферативних синдромів (лімфоми, лімфолейкози та ін.).
Застосування імунотерапевтичних препаратів може призвести до появи ускладнень, таких як гіперстимуляції відповідної ланки СІ або, навпаки, до пригнічення синтезу окремих чинників СІ і до виникнення алергічних реакцій на домішки при недостатньому ступені очищення препарату. Ці ефекти виявляються різними видами порушень: метаболічними, токсичними і алергічними, викликаними зміною не тільки функцій СІ, але й нервової і ендокринної систем.
Токсичні та метаболічні ускладнення зазвичай обумовлені прямою дією ІТЗ на відповідну тканину. Більшість препаратів викликають характерні для них ускладнення.
Цитостатики пригнічують проліферацію клітин, кровотворення; глюкокортикостероїди модифікують усі види обміну речовин, через що виникає цілий ряд ускладнень; імуномодулятор левамізол (декарис) пригнічує лейкопоез, викликає агранулоцитози і шкірні висипи та ін. Чимало негативних ефектів імуномодуляторів пов’язано з їх недостатньо виборчою тропністю до СІ, впливом на інші органи і системи. Рекомбінантні, генно-інженерні препарати — інтерферони, інтерлейкіни, як правило, викликають гарячку, загальне нездужання, лейкопенії або лейкоцитоз та інші негативні ефекти.
Для попередження розвитку ускладнень імунотерапії й імунопрофілактики необхідне обґрунтування проведених заходів, наявність показань і оцінка можливих протипоказань. Це стосується як профілактичної протиінфекційної імунізації, так і протирецидивної імунопрофілактики при алергії, імуномодуляції й імунодепресивної терапії. Активна імунотерапія зазвичай протипоказана при більшості гострих тяжких захворювань.
Імунопрофілактика
Імунізація населення з метою створення імунітету проти інфекцій дозволила попередити або різко знизити захворюваність на віспу, поліомієліт, кір, дифтерію, вірусний гепатит.
Основна мета імунізації — індукція або підвищення специфічного імунітету, що перевищує рівень вірулентності відповідного інфекту, тобто ліквідація існуючого відносного імунодефіциту чутливих індивідів.
Імунопрофілактика інфекційних хвороб — спосіб попередження їх розвитку шляхом створення активного або пасивного імунітету. Імунотерапія — спосіб пригнічення інфекції, що виникла, за допомогою підвищення імунітету.
Для активної ІП і ІТ використовують вакцини, а для пасивної — протиінфекційні антисироватки.
Вакцини (лат. vacca — корова) — препарати із збудників захворювання або їх протективні антигени, призначені для створення активного специфічного імунітету з метою профілактики і лікування інфекцій. За способом отримання вакцини класифікуються на живі, убиті, хімічні, штучні, генно-інженерні й анатоксини.
Живі ослаблені вакцини отримують шляхом зниження вірулентності мікроорганізмів при культивуванні їх у несприятливих умовах або при пасивуванні на малосприйнятливих тваринах. До живих вакцин належать вакцини проти сказу, туберкульозу, чуми, туляремії, сибірської виразки, грипу, поліомієліту, кору та ін. Живі вакцини створюють напружений імунітет, схожий із природним постінфекційним. Як правило, живі вакцини вводять одноразово, оскільки вакцинний штам знаходиться в організмі.
Убиті вакцини готують зі штамів мікроорганізмів з високою імуногенністю, які інактивують нагріванням, ультрафіолетовим опромінюванням або хімічними речовинами. До таких вакцин належать вакцини проти кашлюку, лептоспірозу, кліщового енцефаліту та ін. Нерідко використовують не цілі клітини, а їх екстракти або фракції.
Виділення з мікроорганізмів протективних антигенів дозволило отримати хімічні вакцини. Прикладом такої вакцини є хімічна холерна вакцина, яка складається з анатоксину-холерогену і ліпополісахариду, що витягує з клітинної стінки холерного вібріона.
Аналогами бактерійних хімічних вакцин є вірусні субодиничні вакцини, що складаються з гемаглютиніну і нейрамінідази, виділених із вірусу грипу (інфлувак, ваксигрип, грипол). Хімічні субодиничні вакцини менш реактогенні. Для підвищення імуногенності до них додають ад’юванти (гідроксид алюмінію, алюмінієво-калієвий галун та ін.), а також імуномодулятори (поліоксидоній у вакцині — грипол).
Анатоксини отримують шляхом обробки екзотоксинів розчином формаліну. При цьому токсин втрачає свої токсичні властивості, але зберігає антигенну структуру та імуногенність, тобто здатність викликати утворення антитоксичних антитіл. Використовуються для створення антитоксичного імунітету при дифтерії, правці й інших інфекціях, збудники яких продукують екзотоксини.
При створенні генно-інженерних вакцин застосовують перенесення генів, контролюючих потрібні антигенні детермінанти, в геном інших мікроорганізмів, які починають синтезувати відповідні антигени. Прикладом таких вакцин може бути вакцина проти вірусного гепатиту В, що містить HBs-антиген. Її отримують при вбудовуванні гену, контролюючого утворення HBs-антигену, в геном клітин еукаріот (наприклад, дріжджів).
ДНК-вакцина є нуклеїновою кислотою патогену, яка при введенні в організм викликає синтез білків та імунну відповідь на них.
За складом вакцини можуть бути моновакцинами (1 мікроорганізм), дивакцинами (2 мікроби) або полівакцинами (декілька мікробів). Приклад полівакцини — асоційована кашлюк-дифтерійно-правцева вакцина (АКДП), містить убиті бактерії кашлюків, дифтерійний і правцевий анатоксини. Рибомуніл — полікомпонентна вакцина з рибосом і пептидоглікану мікробів, персистує у верхніх дихальних шляхах.
Показання для вакцинації
Деякі вакцини (табл. 5) використовують для обов’язкової планової вакцинації дітей: протитуберкульозна вакцина БЦЖ, поліомієлітна, паротитна, краснушна, АКДП, проти гепатиту В (HBs). Інші вакцини застосовують при небезпеці професійних захворювань (наприклад, протизоонозних інфекцій), або для введення людям у певних районах (наприклад, проти кліщового енцефаліту). Для попередження поширення епідемій (наприклад, при грипі) показана вакцинація за епідеміологічними показаннями. Ефективність вакцинації залежить від створення достатнього імунного прошарку населення (колективного імунітету), для чого необхідна вакцинація 95 % людей. Вакцинація передбачає створення у здорових придбаного (адаптивного) активного специфічного протиінфекційного імунітету до відповідного інфекту (вірусу, бактерії).
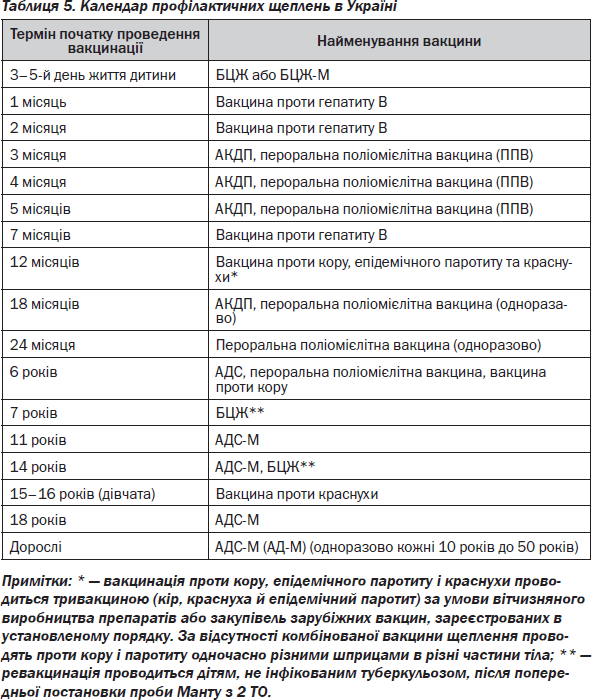
Імунна відповідь на введення вакцини залежить від її вигляду (жива, убита, анатоксин), віку особи, яка вакцинується (новонароджений, дорослий), і від того, первинно або повторно вводиться вакцина.
В імунній відповіді на введення вакцини беруть участь макрофаги, Т-лімфоцити (ефекторні — цитотоксичні, регулярні — хелпери, супресори, Т-клітини пам’яті), В-лімфоцити (і В-клітини пам’яті), що продукуються плазматичними клітинами антитіла (IgM, -G, -А), а також цитокіни (монокіни, лімфокіни).
Після введення вакцини макрофаги захоплюють антигенний матеріал, розщеплюють його внутрішньоклітинно і представляють фрагменти антигену на своїй поверхні в імуногенній формі (епітопи). Т-лімфоцити розпізнають представлені макрофагом антигени і активують В-лімфоцити, які перетворюються на клітини, що продукують антитіла (плазматичні клітини).
При надмірній продукції AT до процесу підключаються Т-супресори, крім того на IgG можуть вироблятися антиідіопатичні AT, що перериває процес вироблення AT.
Періоди первинної імунної відповіді за рівнем антитіл:
Перший — латентний, інтервал часу між уведенням антигену (вакцини) в організм і появою антитіл у крові. Його тривалість становить 1–2 тижні. У цей період антитіла в крові не визначаються.
Другий — період підйому рівня антитіл, для якого характерне швидке наростання рівня антитіл у крові. Тривалість цього періоду становить 3–4 тижні. Першими з’являються антитіла IgM-класу, через 7 днів і пізніше наростає рівень IgG-антитіл (окрім новонароджених і дітей раннього віку). Значно пізніше (14–21-й день) спостерігається підйом рівня IgA-антитіл.
Вторинне введення вакцин індукує швидке збільшення кількості IgG-антитіл, подальші ревакцинації ще більше стимулюють їх утворення. Відбувається це внаслідок швидкого вступу до реакції В- і Т-клітин пам’яті. Якщо інфект (вірус, бактерія, токсин) нейтралізується IgG-антитілами, що спостерігається при деяких вірусних і позаклітинних бактерійних інфекціях (кір, дифтерія, грип), то їх наявність забезпечує створення імунітету. Оптимальний період часу між першим і другим уведенням вакцини — 1–2 місяці.
Третій — період зниження рівня антитіл у крові — настає після досягнення максимального рівня антитіл у крові, причому їх кількість знижується спочатку швидко, а потім повільно протягом декількох років.
Механізми специфічного клітинного імунітету (Т-кілери, В-лімфоцити) поєднано з клітинами природженого імунітету (макрофаги, гранулоцити) визначають виникнення імунітету практично до всіх інфекцій, зокрема до «антитілозамінних», проте їх участь при стандартному дослідженні вакцинованих зазвичай не враховується, хоча саме вона є визначальною. Дане твердження стосується перш за все живих вакцин, що мають строгі обмеження до застосування за наявності відхилень у системі імунітету, а також у період реконвалесценції після перенесених інфекційних захворювань, включаючи ГРЗ.
Основою збереження імунітету є імунологічна пам’ять, що виникає після синтезу IgG-антитіл. Тому в дітей раннього віку, у яких переважає IgM-відповідь і немає синтезу IgG-антитіл або він слабкий, імунологічна пам’ять на вакцину не формується. Цю проблему долають ревакцинацією в пізнішому віці, хоча це і небайдуже для організму. Носії пам’яті — довгоживучі імунні Т- і В-лімфоцити індукують швидку вторинну імунну відповідь на інфект при його надходженні в організм, що і забезпечує імунітет.
До одних інфектів імунітет зберігається довічно (кір, поліомієліт, кашлюк, паротит), до інших — довго (дифтерія, правець, сибірська виразка та ін.), до третіх — короткочасно (грип, черевний тиф, дизентерія та ін.), що залежить від антигенної мінливості збудників і механізмів імунітету до нього.
Вимоги до вакцин
Вакцини повинні бути: а) високоімуногенними і створювати достатньо стійкий імунітет; б) нешкідливими і не викликати побічних реакцій; в) не містити інших мікроорганізмів.
Слід зазначити, що всі вакцини — імуномодулятори, тобто змінюють реактивність організму: підвищуючи її проти даного мікроорганізму, вони можуть знижувати її щодо іншого. Чимало вакцин, стимулюючи реактивність, ініціюють алергічні й автоімунні реакції. Особливо часто такі побічні ефекти вакцин спостерігають у хворих на алергічні захворювання (табл. 4.).
Шляхи введення вакцин: накожно (проти віспи і туляремії), внутрішньошкірно (БЦЖ), підшкірно (АКДП), перорально (поліомієлітна), інтраназально (протигрипозна), внутрішньом’язово (проти гепатиту В).
Вакцини, особливо живі, для збереження властивостей вимагають особливих умов зберігання і транспортування (постійно на холоді — «холодний ланцюг» при температурі +5…+8 °C).
Календар щеплень декларує терміни щеплень для кожної вакцини, правила застосування і протипоказання (табл. 5.). Чимало вакцин, згідно з календарем щеплень, через певні проміжки часу вводять повторно — роблять ревакцинацію. Через вторинну імунну відповідь, у зв’язку з наявністю анамнестичної реакції, відповідь посилюється, титр антитіл збільшується.
Протиінфекційні вакцини календаря профілактичних щеплень
Вакцина кашлюк-дифтерійно-правцева адсорбована (АКДП) для профілактики кашлюку, дифтерії, правця. Містить в 1 мл убиті бактерії кашлюку (20 млрд), а також дифтерійний (30 одиниць) і правцевий (10 ЕД) анатоксини. Сорбент — алюмінію гідроксид, консервант — мертіолят. Уводять з 3-місячного віку внутрішньом’язово по 0,5 мл триразово з інтервалом 45 діб, ревакцинацію в 18 місяців проводять одноразово. Імунітет проти кашлюку зберігається у 70–80 % вакцинованих, проти дифтерії і правця — у 95 %. Дітям, які перенесли кашлюк, уводять АДС-анатоксини.
Дітям, прищепленим АКДП-вакциною одноразово, роблять одну ін’єкцію, ревакцинація через 9–12 місяців, прищепленим АКДП-вакциною двократно — ревакцинація через 9–12 місяців.
Тетракок — адсорбована комбінована вакцина для профілактики дифтерії, правця, кашлюку і поліомієліту. На відміну від попередньої має консерванти — 2-феноксіетанол, формальдегід. Містить 30 MО дифтерійного анатоксину, 60 MО — правцевого, 4 MО убитої вакцини кашлюку, по 1 дозі інактивованих вірусів поліомієліту типів 1, 2, 3. Дітям віком 3 місяці — 4 роки роблять 3 ін’єкції внутрішньом’язово з інтервалом 1–2 місяця і ревакцинацію через рік. Імунітет до 4 інфекцій зберігається протягом 5 років. Реактогенність — гарячка, неврологічні ускладнення, обумовлені бактеріями кашлюків.
Ацелюлярна АКДП-вакцина інфанрикс включає кашлюки-анатоксин, гемаглютинін і мембранний протеїн, а також дифтерійний і правцевий анатоксини. Менш реактогенна, ніж АКДП. Уводять по 0,5 мл в 3, 4, 5 і 6 місяців в/м; ревакцинація в 18 місяців одноразово. Існують комбіновані варіанти цієї вакцини з гепатитною, поліомієлітною та ін.
Анатоксин дифтерійно-правцевий очищений адсорбований рідкий (АДО-анатоксин). В 1 мл міститься 60 флокулюючих одиниць (LF) дифтерійного 20 сполучних одиниць (ЄС) правцевого анатоксинів, адсорбент — алюмінію гідроксид, консервант — мертіолят. Профілактика дифтерії і правця у дітей віком від 3 місяців до 6 років, які перехворіли на кашлюк або мають протипоказання до введення АКДП-вакцини. У перші дві доби після щеплення можливі гарячка, незначна гіперемія і набряк у місці ін’єкції, алергічні реакції. Вводять 0,5 мл в/м 2 ін’єкції з інтервалом 1 місяць, ревакцинація через 9–12 місяців.
Анатоксин дифтерійно-правцевий очищений адсорбований зі зменшеним умістом антигенів рідкий. В 1 мл міститься 10 LF дифтерійного і 10 ЄС правцевого анатоксинів, адсорбент — алюмінію гідроксид, консервант — мертіолят. Профілактика дифтерії і правця у дітей віком 6 років і старше, підлітків і дорослих. По 0,5 мл в/м або п/ш при первинній вакцинації двократно з інтервалом 1–1,5 місяця, при ревакцинації — одноразово.
Анатоксин дифтерійний очищений адсорбований зі зменшеним умістом антигену рідкий. В 1 мл міститься 10 LF дифтерійного анатоксину, адсорбент — алюмінію гідроксид, консервант — мертіолят; 0,5 мл в/м або п/ш одноразово. Профілактика дифтерії у дітей віком 6 років і старше. Для того, щоб отримати повний курс імунізації, необхідно 2 введення АД-М-анатоксину з інтервалом 30 днів, ревакцинацію проводять через 6–9 місяців, потім чергові ревакцинації через 10 років АДС-М-анатоксином. АД-М-анатоксин — один із найменш реактогенних препаратів.
Вакцина туберкульозна (БЦЖ) суха для внутрішньошкірного введення забезпечує формування імунітету проти туберкульозу у 70–80 % людей. Проте в останні роки ефективність її знизилася. Протипоказання: для новонароджених з масою тіла менше 2500 г; генералізована БЦЖ-інфекція в інших дітей у сім’ї, імунодефіцит (первинний). Для решти груп: позитивна і сумнівна реакція Манту з 2 ТО ППД-л, туберкульоз або інфікування мікобактеріями в анамнезі.
Вакцина туберкульозна БЦЖ-М для профілактики туберкульозу у недоношених і ослаблених дітей вводиться внутрішньошкірно, доза містить удвічі менше (0,025 мг) мікобактерій, ніж БЦЖ. Ампули по 20 доз (0,5 мг).
Вакцина корова культуральна жива суха виготовлена з вакцинного штаму Л-16 вірусу, вирощеного в культурі клітин ембріонів японських перепелів, містить 20 мкг гентаміцину, желатин і білки сироватки крові великої рогатої худоби. Для профілактики кору в дітей і підлітків, вакцинація — у віці 12 місяців по 0,5 мл підшкірно. Ревакцинація в 6 років. За епідпоказаннями вводять дітям віком понад 12 місяців. Протипоказана при алергії на аміноглікозіди і перепелині яйця, а також при імунодефіцитах.
Тримовакс містить живі, атенуйовані віруси кору — 1000 тканинних цитопатогенних доз-50 (ТЦИД-50), паротиту (5000 ТЦИД-50) краснухи (1000 ТЦИД-50), вводять дітям у 12 місяців, підшкірно або внутрішньом’язово, а в 6 років — ревакцинація тільки проти кору.
Пероральна поліомієлітна вакцина (ППВ) типів 1, 2 і 3. Тривалентний препарат із живих штамів Себіна вірусу поліомієліту типів 1, 2 і 3. Показання: планова профілактика поліомієліту в дітей старше за 3 місяці; екстрена профілактика поліомієліту за епідемічними показаннями, проведення національних днів імунізації проти поліомієліту. Побічні ефекти: можлива кропив’янка, набряк Квінке, украй рідко у прищеплених або в осіб, які контактували з прищепленими, виникають вакциноасоційовані захворювання (у 1 з 2–3 млн прищеплених). Дози: по 2 або 4 краплі (залежно від форми випуску) всередину трикратно в 3, 4, 5 і 6 місяців, ревакцинація триразова в 18, 20 місяців і 14 років. Щеплення за епідемічними показаннями проводять при захворюванні поліомієлітом. ВООЗ поставила глобальним завданням ліквідацію поліомієліту до третього тисячоліття.
Інактивована поліомієлітна вакцина для профілактики імовакс поліо (ІПВ) Забезпечує формування імунітету до поліовірусів типів 1, 2 і 3. Дози: з 3 місяців — по 0,5 мл п/ш або в/м, триразово з інтервалом не менше 1 місяця, ревакцинація через 1 рік після останньої ін’єкції, потім кожні 10 років. Можлива поява еритеми в місці ін’єкції, в окремих випадках незначне підвищення температури тіла.
Жива гіператенуйована вакцина для профілактики краснухи рудивакс — ліофілізована рідина, отримана методом культивування вакцинного штаму Шварц на первинній культурі курячих ембріонів, містить людський альбумін, сліди неоміцину.
Вакцина проти кору, паротиту і краснухи жива MMR II. Attenuvax — жива корова вакцина, приготована в первинній культурі клітин курячого ембріона з додатково атенуйованого штаму Ендерс-вірусу; Mumps-vax — жива вакцина паротиту зі штаму Джерілл Лінн, приготована в первинній культурі клітин курячого ембріона; Meruvax II — жива краснушна вакцина зі штаму RA27/3 атенуйованого вірусу краснухи, вирощеного в культурі диплоїдних клітин людини WI-38. В одній прищепній дозі не менше 1000 Тцд-50 вірусу кору, 20 000 Тцд50 вірусу паротиту, 1000 Тцд5о вірусу краснухи і не більше 25 мкг неоміцину. Дози: 0,5 мл п/ш (переважно в зовнішню верхню частину плеча). Перша вакцинація в 12–15 місяців, друге щеплення в 6 років. На практиці дана вакцина може застосовуватися для підлітків і дорослих.
Рекомбінантні вакцини для профілактики гепатиту В є очищеним білком поверхневого антигену вірусу гепатиту В (HBsAg). Виділений з дріжджів-продуцентів, переважно Saccharomyces cerevisiae, адсорбований на гелі алюмінію гідроксиду, консервант — мертіолят. Дози: вводять в/м дорослим у дельтоподібний м’яз, дітям — у передньобоковую частину стегна. Згідно з календарем щеплень вакцинація проти гепатиту В проводиться новонародженим у перші 12 годин життя, потім через 1 місяць і через 5–6 місяців одночасно з третьою дозою АКДП-препарату; для вакцинації новонароджених, матері яких є носіями HBsAg, при цьому першу дозу вводять у перші 24 години після народження, бажано одночасно з імуноглобуліном проти гепатиту В (у передньобокову частину різних стегон).
Вакцина гепатиту В рекомбінантна дріжджова рідка комбіотех. Вакцинацію дітей до року проводять згідно з календарем щеплень проти вірусного гепатиту В. Разова доза для дорослих і дітей старших за 11 років становить 1 мл (20 мкг HBsAg), для дітей віком до 10 років — 0,5 мл (10 мкг HBsAg). Пацієнтам відділення гемодіалізу вводять подвійну дозу для дорослих (2 мл).
Вакцина проти гепатиту В ДНК рекомбінантна ебербіовак. Для дорослих і дітей старших за 10 років — 20 мкг (1 мл), для новонароджених і дітей молодших за 10 років — 10 мкг (0,5 мл).
Противірусні вакцини
Інфлювак — субодинична вакцина, вирощена на курячих ембріонах. В 1 дозі (0,5 мл) міститься 15 мкг гемаглютиніну типу A (підтипи H1N1 і H3N2) і типу В. Антигенний склад вакцини щорічно оновлюється. Інактивація формаліном, консервант — мертіолят. Дози: дорослим і підліткам (з 14 років) 0,5 мл глибоке п/к або в/м введення одноразово. Раніше невакцинованим рекомендується вводити 2 дози вакцини з інтервалом у 4 тижні. Хворим з імунодефіцитами і дітям віком до 6 років — по 0,5 мл двократно з інтервалом у 4 тижні. Можлива вакцинація дітей, починаючи з 6-місячного віку, вагітних жінок — з 2–3-го триместру і в період лактації. Форма випуску: шприці 0,5 мл.
Грипол — вакцина грипозна тривалентна полімер-субодинична, містить протективні поверхневі антигени гемаглютиніну і нейрамінідази, виділених з вірусів грипу А і В, у комплексі з імуностимулятором поліоксидонієм. Призначена для профілактичної імунізації проти грипу осіб від 6 до 60 років. Випускається в ампулах по 0,5 мл (1 доза). Дози: дітям від 6 місяців до 3 років — 0,5 мл двократне в передньобокову частину стегна з інтервалом 3–4 тижні. З 3 років і дорослим 0,5 мл одноразове, в/м або глибоко п/ш у верхню третину зовнішньої поверхні плеча.
Ваксигрип — інактивована спліт-вакцина. Містить очищені білки вірусів грипу типів A (H1N1, H3N2) і В. Антигенний склад вакцини змінюється щорічно відповідно до рекомендацій ВООЗ. Вакцина отримана з вірусів грипу, вирощених на курячих ембріонах, консервант — мертіолят. У 1 дозі (0,5 мл) по 15 мкг гемаглютиніну кожного підтипу (типу) вірусів грипу. Дози: дорослим 0,5 мл глибоке п/ш або в/м у верхню третину зовнішньої поверхні плеча на декілька сантиметрів нижче за плечовий суглоб, одноразово. Дітям віком 6–7 місяців — по 0,25 мл двократно з інтервалом 4–6 тижнів (дітям, раніше імунізованим грипозною вакциною, — однократно).
Флюарикс — розщеплена грипозна вакцина, містить очищені білки вірусів грипу типів А (H3N2) і В, інактивовані формаліном. У 1 дозі (0,5 мл) по 15 мкг гемаглютиніну кожного підтипу, консервант — мертіолят. Показання: активна профілактика грипу з 6 місяців. Дози: дорослим і дітям старшим за 6 років — 0,5 мл глибоке п/ш або в/м введення у верхню третину зовнішньої поверхні плеча одноразово. Дітям віком 1–6 років — по 0,25 мл двократно з інтервалом 4–6 тижнів (дітям, раніше імунізованим грипозною вакциною, одноразово). Форма випуску: шприці 0,5 мл.
Хаврикс. Доза (0,5 мл) містить 720 ОД антигену вірусу гепатиту А, інактивованого формальдегідом і адсорбованого на алюмінію гідроксиді, і сліди неоміцину. Консервант — 2-феноксіетанол.
Вакцина герпетична культуральна інактивована суха для профілактики рецидивів і лікування тяжкої, тривало перебігаючої герпетичної інфекції. Містить убиті формаліном віруси простого герпесу I і II типів, вирощені в культурі фібробластів курячих ембріонів (є гентаміцин). Вводяться в період ремісії внутрішньошкірно по 0,1–0,2 мл 5 разів з інтервалом 3–4 дні.
Вакцина антирабічна культуральна концентрована очищена інактивована суха. Містить штам фіксованого вірусу сказу Внуково-32, вирощеного в культурі клітин нирок сірійських хом’яків, інактивований УФО і формальдегідом. У 1 мл міститься не менше 2,5 MО і канаміцин сульфат. Для профілактики сказу у ветеринарів, собаківників, тваринників, мисливців, лаборантів.
Профілактичний курс імунізації, що проводять особам, професійно пов’язаним із ризиком зараження сказом (співробітники ветеринарних діагностичних лабораторій, мисливці, лісники, працівники боєнь, особи, які працюють з «вуличним» вірусом сказу), складається з 3 внутрішньом’язових уведень вакцини в товщу дельтоподібних м’язів плеча в дозі 1,0 мл на 0, 7 і 30-й день. Через 3 тижні після 3-го введення вакцини доцільно досліджувати сироватку крові прищепленого на вміст віруснейтралізуючих антитіл. Якщо титр антитіл буде менший за 0,5 MО (1 : 50), то слід увести 4-ту дозу вакцини (3,0 мл). Одноразова ревакцинація рекомендується через 1 рік 1 мл і далі через кожні 3 року, якщо особа продовжує перебувати в зоні високого ризику.
Лікувальна і профілактична імунізація укушених, подряпаних, ослинених скаженими тваринами. Курс застосування — внутрішньом’язово по 1 мл на 0, 3, 7, 14, 30, 90-ту добу після укусу. При тяжких і середньої тяжкості укусах застосовують поєднано з антирабічним імуноглобуліном.
Протипоказання до застосування вакцин із профілактичною метою:
— гострі інфекційні і неінфекційні захворювання;
— хронічні захворювання у стадії загострення;
— у стадії ремісії щеплення проводять не раніше ніж через місяць після одужання;
— інтервал після останнього щеплення повинен бути не менше 1 місяця, інакше антитіла, що збереглися після попереднього введення вакцини, здатні інактивувати антиген, що вводиться.
— алергічні реакції на білок курячого яйця.
При температурі вище за 37,5 °С вакцинацію не проводять.
Лікувальні вакцини
Після вакцинації стимулюється як специфічний, так і неспецифічний імунітет. Тому багато вакцин використовують з лікувальною метою як імуномодулятори при лікуванні не тільки захворювань з етіологічно певним мікроорганізмом, але й поза таким зв’язком як імуностимулятори.
Вакцина бруцельозна лікувальна. В 1 мл міститься 1 млрд убитих нагріванням Brucella abortus і Brucella melitensis у співвідношенні 2 : 1, консервант — фенол. Показання: лікування гострого, підгострого і хронічного бруцельозу у стадії декомпенсації. Мінімальна доза для внутрішньовенного введення — 200 тис., максимальна — 250 млн мікробних клітин. Вакцину вводять в/ш у різні місця, віддалені один від одного на 40–60 мм (у ділянці суглобів плеча і стегна), в об’ємі 0,1 мл; мінімальна доза — 200 тис., максимальна — 300 млн мікробних клітин. При нормальній реактивності вводять по 1, 5, 10, 15, 20, 25 і 50 млн мікробних тіл з інтервалами 3–5 діб. При гіперреактивності інтервал між уведенням збільшують до 3–5 діб.
Вакцина гонококова. Убита гонококова вакцина є стимулятором активного імунітету проти гонококової інфекції. Застосування показане при недостатній ефективності антибіотикотерапії, при повільно перебігаючих рецидивах, торпідних і хронічних формах захворювання, у чоловіків з ускладненою і в жінок із висхідною гонореєю (при стиханні гострих запальних явищ), у гінекологічній практиці при лікуванні запальних процесів. Дози: вакцину вводять в/м в сідничну ділянку або п/ш. Початкова доза при ускладненій гонореї — 0,2–0,3 мл, при торпідній і хронічній формах — 0,3–0,4 мл. Препарат уводять з інтервалом 1–2 доби залежно від реакції, дозу збільшують кожного разу на 0,15–0,3 мл.
Анатоксин стафілококовий очищений рідкий. В 1 мл міститься 12 ± 2 одиниць зв’язування стафілококового анатоксину. Викликає утворення специфічних антитіл до екзотоксину стафілокока і має імуномодулюючі властивості. Показання: специфічна імунотерапія дорослих, які хворіють на гостру або хронічну стафілококову інфекцію. Дози: вводять п/к під кут лопатки. Повний курс лікування включає 7 ін’єкцій з інтервалом 2 доби в наростаючих дозах: 0,1; 0,3; 0,5; 0,7; 0,9; 1,2 і 1,5 мл. При швидкому клінічному ефекті курс можна скоротити до 5 ін’єкцій.
Вакцина стафілококова лікувальна рідка. Комплекс розчинних термостабільних антигенів, отриманий з суспензії мікробних клітин стафілокока, прогрітих при 100 °С протягом 1 години. Показання: лікування гноячкових захворювань шкіри стафілококової етіології (фурункули, карбункули, гідраденіти, піодермія та ін.). Дози: вводять п/ш в ділянку плеча або в підлопаткову ділянку щодня. Початкова доза 0,2 мл (дорослим і дітям із 7 років) або 0,1 мл (дітям від 6 місяців до 7 років), потім щодня протягом 8 діб збільшують дозу на 0,1 мл (усього 9 ін’єкцій). Кожну подальшу ін’єкцію роблять на відстані 20–30 мм від місця попередньої ін’єкції або в іншу руку.
Вакцина стафілококова суха для імунотерапії. Стафілококова вакцина суха для імунотерапії складається з водорозчинних антигенів стафілокока. Має антигенспецифічну активність щодо стафілокока, індукує у прищеплених вироблення антитіл. Разом із специфічною дією є активним імуномодулятором, що стимулює неспецифічну реактивність організму. Застосовують для лікування хворих із затяжною хронічною стафілококовою інфекцією або при її асоціації з інфекціями іншої етіології. Дози: вакцину вводять під шкіру нижнього кута лопатки. Місце введення обробляється розчином йоду або спиртом. Мінімальний курс складається з 5 ін’єкцій з інтервалом 3–4 доби. Доза вакцини на 1 ін’єкцію — 0,1 мл, у подальшому 0,2 мл.
Поствакцинальні реакції і ускладнення
Поствакцинальні реакції (ПВР) — це побічні клінічні та лабораторні ознаки нестійких, небажаних, патологічних (функціональних) змін в організмі, щеплення, що виникають у зв’язку з проведенням (зберігаються 3–5 днів і самостійно минають).
Поствакцинальні реакції розподіляються на місцеві і загальні.
Місцеві поствакцинальні реакції: ущільнення тканин; гіперемія, що не перевищує 80 мм у діаметрі; легка хворобливість у місці введення вакцини.
До загальних поствакцинальних реакцій належать реакції, не пов’язані з локалізацією уколу, і такі, що зачіпають весь організм: генералізований висип; підвищення температури тіла; порушення сну, неспокій; головний біль; запаморочення, короткочасна непритомність; у дітей — тривалий незвичайний плач; ціаноз, похолодання кінцівок; лімфоаденопатія; анорексія, нудота, біль у животі, диспепсія, діарея; катаральні явища, не пов’язані з початком ГРЗ до або відразу після щеплення; міалгія, артралгія.
У цілому звичайні побічні реакції — це в більшості випадків реакції організму на введення чужорідного антигену, що відображають процес вироблення імунітету. Наприклад, причиною підвищення температури тіла, що виникло після щеплення, є викид у кров особливих посередників імунної реакції — прозапальних інтерлейкінів. Якщо побічні реакції мають нетяжкий характер, то в цілому це навіть сприятлива у плані вироблення імунітету ознака. Наприклад, невелике ущільнення, що виникло в місці щеплення вакциною проти гепатиту В, свідчить про активність процесу вироблення імунітету, а це означає, що щеплена людина буде реально захищена від інфекції.
За тяжкістю перебігу поствакцинальні реакції розподіляються на звичайні й тяжкі (сильні). До тяжких реакцій належать місцеві реакції: у місці введення препарату набряк м’яких тканин понад 50 мм у діаметрі, інфільтрат понад 20 мм, гіперемія більша за 80 мм у діаметрі, і загальні: підвищення температури тіла понад 39 °С.
Місцеві реакції розвиваються відразу після введення препарату, обумовлені в основному баластними речовинами вакцин.
Терміни появи загальних вакцинальних реакцій:
— для неживих вакцин — 1–3 дні після імунізації (у 80–90 % випадків 1-ша доба);
— для живих вакцин — з 5–6-го до 12–14-го дня, з піком проявів з 8-го до 11-го дня після щеплення.
Поствакцинальні реакції не є протипоказанням для проведення подальших щеплень даною вакциною.
Поствакцинальні ускладнення (ПВУ) — це стійкі функціональні та морфологічні зміни в організмі, що виходять за межі фізіологічних коливань і призводять до значних порушень стану здоров’я.
Поствакцинальні ускладнення не сприяють розвитку імунітету. До ускладнень не зараховують події, що співпадають за часом із проведеною вакцинацією (наприклад, інтеркурентне захворювання в поствакцинальному періоді). Поствакцинальні ускладнення перешкоджають повторному введенню тієї ж вакцини.
Можливі причини поствакцинальних ускладнень: недотримання протипоказань; індивідуальні особливості того, хто вакцинується; «програмна помилка» (порушення правил і техніки вакцинації); неналежна якість вакцини, в тому числі що виникає при порушеннях транспортування й зберігання.
Загальноприйняті критерії зв’язку події в поствакцинальному періоді з вакцинацією:
— патологічні процеси, що виникають після щеплення («несприятливі події» або «побічні ефекти» — за термінологією ВООЗ), не слід вважати поствакцинальними ускладненнями до тих пір, поки не буде встановлений їх можливий причинно-наслідковий, а не тільки тимчасовий, зв’язок з вакцинацією;
— епідеміологічні (велика частота у вакцинованих, ніж у невакцинованих);
— клінічні (схожість поствакцинального ускладнення з ускладненням відповідної інфекції, час появи після щеплення);
— вірусологічні (наприклад, відсутність дикого поліовірусу при поліомієліті, що асоціюється з вакциною).
У табл. 6 наведені основні поствакцинальні реакції і ускладнення залежно від виду вакцини.
Імунні антисироватки й імуноглобуліни
Серотерапія і серопрофілактика — використання препаратів сироватки крові з метою лікування або профілактики інфекційних захворювань. Імунні сироватки й імуноглобуліни застосовують при багатьох інфекціях як з метою екстреної імунопрофілактики (при безпосередній загрозі захворювання), так і з метою імунотерапії для створення штучного пасивного імунітету.
Гетерологічні (ксеногенні) антисироватки отримують шляхом гіперімунізації коней й інших тварин, від яких можна забрати достатньо багато крові. Існують антимікробні й антитоксичні сироватки, останні застосовуються найчастіше. Силу антитоксичних сироваток вимірюють у міжнародних одиницях (MО) за здатністю нейтралізувати певну дозу токсину. До антитоксичних належать протидифтерійна, протиправцева, протигангренозна, протиботулінична і протистафілококова сироватки.
Антитоксичні сироватки необхідно вводити якомога раніше від початку захворювання, оскільки антитіла здатні нейтралізувати токсин тільки до його адсорбції на клітинах-мішенях.
Сироватки вводять після обов’язкового попереднього визначення алергії до кінського білка, оскільки вони можуть викликати шок і сироваткову хворобу, особливо при повторному введенні. Для цього за методом Безредко кінську сироватку в розведенні 1 : 100 в об’ємі 0,1 мл вводять внутрішньошкірно в передпліччя (ампула маркірована червоним кольором). Результат враховують через 20–30 хвилин. За відсутністю вираженої шкірної реакції (менше 1 см у діаметрі) вводять 0,1 мл нерозведеної сироватки підшкірно. За браком реакції вводять решту дози.
Новим напрямом отримання гетерологічних антитіл є моноклональні антитіла, що отримують з мишачих гібридом.
Протиправцева сироватка кінська (ППС) застосовується для профілактики та лікування правця. Отримують після імунізації коней правцевим анатоксином. З метою профілактики вона застосовується при травмах з порушенням цілісності шкірних і слизових покривів. ППС уводять підшкірно в дозі 3000 MО. He підлягають профілактичній імунізації за допомогою сироватки особи, яким проведена імунізація препаратом, що містить правцевий анатоксин, менше ніж 2 роки тому. Сироватка протипоказана особам з алергією на кінський білок або яким раніше вводили дану сироватку; таким необхідний донорський протиправцевий імуноглобулін.
З лікувальною метою протиправцева сироватка вводиться при появі перших симптомів правця в можливо ранні терміни, в дозі 100–200 тис. MО, внутрішньовенно, краплинним методом і 5–10 тис. MО внутрішньом’язово в тканини, що оточують рану.
Екстрена специфічна профілактика правця
Екстрену профілактику правця (табл. 7) проводять активно-пасивним методом у таких випадках:
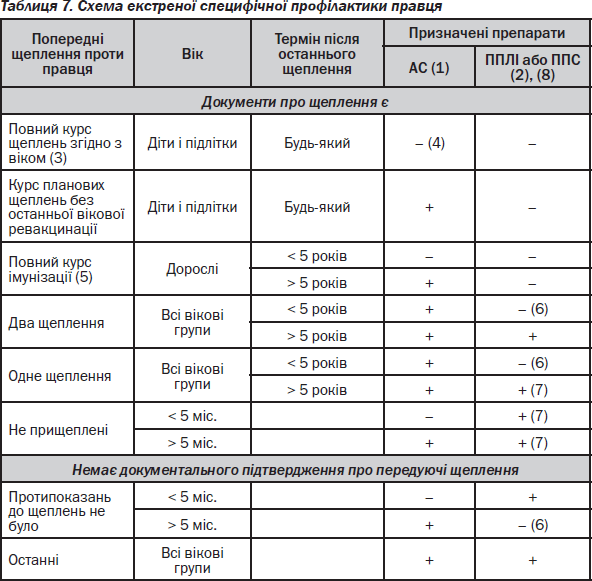
— при травмах з порушенням цілісності шкірних покривів і слизових оболонок;
— обмороженнях і опіках II, III і IV ступенів;
— абортах і пологах поза медичними установами;
— гангрені або некрозі тканин будь-якого типу, абсцесах;
— укусах тваринами;
— проникаючих пошкодженнях шлунково-кишкового тракту.
Для екстреної профілактики правця застосовують АП-анатоксин (можливе використання і АДП-М-анатоксину), протиправцевий людський імуноглобулін (ППЛІ) або використовують протиправцеву сироватку, кінську очищену концентровану рідку (ППС).
АС-анатоксин уводять підшкірно в підлопаткову ділянку. ППЛІ вводять у дозі 250 MО внутрішньом’язово у верхньозовнішній квадрант сідниці. ППС уводять підшкірно в дозі 3000 MО. Перед уведенням ППС для виявлення чутливості до чужорідного білка ставлять внутрішньошкірну пробу з розведенням у співвідношенні 1 : 100 сироваткою, яка знаходиться в коробці з препаратом (ампула маркірована червоним кольором), відповідно до інструкції, що додається.
На введення протиправцевої сироватки можливі алергічні реакції: негайні, такі, що настають відразу після введення (анафілактичний шок) або через декілька годин; ранні — на 2-гу — 6-ту добу після введення (гостра кропив’янка, набряк Квінке) і віддалені — на 2-му тижні та пізніше (сироваткова хвороба).
Ці реакції виявляються симптомокомплексом сироваткової хвороби (підвищення температури тіла, поява на шкірі різноманітного висипу, свербіння, болів у суглобах, припухлості лімфатичних вузлів, збільшення печінки і селезінки та ін.), в окремих випадках — анафілактичним шоком.
З огляду на можливість розвитку анафілактичного шоку за кожним прищепленим передбачено спостереження протягом 1 року. У разі появи перших ознак ускладнення повинна бути надана адекватна медична допомога (див. «Шок анафілактичний. Сироваткова хвороба»).
Антирабічний імуноглобулін (АІГ) рідкий виділяють з сироватки крові коней, імунізованих вакциною проти сказу. Він застосовується негайно в комбінації з антирабічною вакциною при захворюванні або укусах людини підозрілою або скаженою твариною по 40 МО/кг навколо ран і в їх глибину і внутрішньом’язово в місця, куди не вводили вакцину.
Екстрена профілактика сказу
Екстрену профілактику сказу проводять антирабічною культуральною інактивованою сухою вакциною (Кокав або Рабівак). Разом із вакциною при средньотяжких і тяжких пошкодженнях застосовують антирабічний імуноглобулін (кінський) — гетерогенний, отриманий з гіперімунної кінської сироватки.
Лікувально-профілактичну імунізацію проводять особам, інфікованим (можливо інфікованим) вірусом сказу при укусах, пораненнях, ослиненні, нанесеними тваринами, відповідно до спеціально розробленої схеми залежно від тяжкості пошкодження і стану здоров’я тварин (або відсутності даних про це).
Вакцина антирабічна культуральна очищена концентрована інактивована суха (вакцина Кокав антирабічна культуральна інактивована суха (Рабівак) — вакцинний вірус сказу, штам Внуково-32. Одна доза — 1,0 мл, активність — 2,5 МО/мл. Препарат випускається в комплекті з розчинником: 1,0 мл дистильованої води в ампулі. Вакцину зберігають і транспортують при температурі від +2 до +8 °С.
Імуноглобулін антирабічний з кінської сироватки випускають в ампулах по 5,0; 10,0 мл у розведенні 1 : 100, по 1,0 мл в ампулі (для визначення чутливості хворого до кінської сироватки). Хворому проводять пробу на переносимість кінської сироватки. Для цього за методом Безредко імуноглобулін антирабічний у розведенні 1 : 100 в об’ємі 0,1 мл уводять внутрішньошкірно в передпліччя. Результат враховують через 20–30 хвилин. За відсутністю вираженої шкірної реакції (менше за 1 см у діаметрі) вводять 0,1 мл нерозведеного імуноглобуліну антирабічного підшкірно. За браком реакції через 20–30 хв. дозу антирабічного імуноглобуліну вводять з розрахунку 40 MО на 1 кг маси тіла хворого внутрішньом’язово навколо рани і в глибину рани. Якщо анатомічне розташування пошкодження (кінчики пальців та ін.) не дозволяє ввести всю рекомендовану дозу навколо рани, то залишок імуноглобуліну вводять внутрішньом’язово в інші місця (м’яз сідниці, верхня частина стегна, плеча, лопатки). Зазвичай вводять по 2,5 мл імуноглобуліну антирабічного в 2 місця в товщу раневої поверхні і дельтоподібних м’язів плеча або в сідниці.
Лікувально-профілактична імунізація проводиться відповідно до схеми (табл. 8). Курс імунізації слід почати негайно, як тільки людина, яка постраждала, звернулась по медичну допомогу. Протипоказання відсутні. Якщо проводитиметься комбіноване лікування антирабічним імуноглобуліном (АІГ) і антирабічною вакциною (Кокав), то обидва препарати вводять одночасно (спочатку вводять АІГ, потім Кокав у різні місця).
Особам, які щепляться повторно, курс вакцинації може бути скорочений з урахуванням тривалості й давності попереднього курсу, а також характеру укусу та відомостей про тварину. Якщо постраждалий був раніше імунізований з профілактичною метою або піддався курсу вакцинації протягом 7–12 днів і більше і з моменту вакцинації минуло не більше 3 місяців, то при ослиненні й легких укусах вакцинація не потрібна. Курс вакцинації менше 7 днів не враховується. При тривалішому інтервалі між вакцинацією і контактом з твариною (але не більше 1 року) достатньо скороченого курсу вакцинації по 1,0 мл у 0, 3 і 7-й дні, якщо минув рік і більше або був проведений неповний курс імунізації, то діють відповідно до наведеної схеми лікувально-профілактичних щеплень Кокав і АІГ.
Реакції на введення антирабічного імуноглобуліну
На введення вакцини й імуноглобуліну може виникнути місцева реакція: почервоніння, припухлість і загальне підвищення температури тіла. Можливий розвиток алергічних реакцій: сироваткова хвороба.
Сироватка протидифтерійна кінська очищена застосовується з лікувальною метою за медичними показаннями після внутрішньошкірної проби. Отримують після імунізації коней дифтерійним анатоксином. При тяжкій клінічній формі дифтерії або в запущених випадках сироватку вводять у дозі 30–150 тис. MО, підшкірно, внутрішньом’язово або внутрішньовенно в ділянку сідниць або стегон.
Сироватки протиботуліничні типів А, В, Е очищені концентровані рідкі використовуються з лікувальною метою, а також у ряді випадків для профілактики ботулізму. Їх уведення необхідне після шкірної проби (0,1 мл, 1 : 100) в якомога ранні терміни після встановлення діагнозу ботулізму. До виявлення типу збудника проводиться лікування полівалентною сироваткою типів А, В, Е, що вводиться в дозі 10 тис. MО, розведення в 200 мл підігрітого розчину натрію хлориду, внутрішньовенно, дози збільшують при тяжкій формі.
З профілактичною метою здоровим людям, які спожили харчовий продукт, що викликав захворювання на ботулізм, протиботулінична сироватка типів А, В, Е вводиться в дозі 5 тис. MО внутрішньом’язово одноразово.
Сироватка антитоксична протигангренозна полівалентна очищена концентрована рідка випускається у вигляді полівалентного препарату до токсинів Clostridium perfringens, Closridium novyi, Clostridium septicum. З профілактичною метою сироватка застосовується при пораненнях різного характеру, що супроводжуються великим пошкодженням м’язової тканини, ускладнених відкритих переломах, при забрудненні ран землею у випадках вогнепальних поранень. Доза сироватки для профілактики — 30 тис. MО (по 10 тис. MО кожного компоненту). Для лікування хворих газовою гангреною використовуються значно великі дози — не менше 150 тис. MО (по 50 тис. MО кожної моновалентної сироватки), які вводяться внутрішньовенно 1 мл за 5 хв., потім 1 мл/хв (після перевірки шкірною пробою на чутливість до кінського білка).
Протисинєгнійний імуноглобулін виробляється з сироватки овець, застосовують при тяжкій синєгнійній інфекції.
Імуноглобулін проти кліщового енцефаліту з сироватки коней рідкий, призначений для профілактики кліщового енцефаліту у разі присмоктування кліщів у вогнищах кліщового енцефаліту. Вводиться одноразово у віковому дозуванні. Обов’язкове проведення внутрішньошкірної проби з розведеним імуноглобуліном.
Імуноглобулін протилептоспірозний з сироватки волів, гіперімунізованих лептоспірозним антигеном — сумішшю убитих культур штамів 6 серологічних груп лептоспір. Препарат застосовують у гострий період з першого дня захворювання, особливо при тяжких формах, вводять внутрішньом’язово. Для дорослих і дітей з 14 років — 5,0–10,0 мл, для дітей 8–13 років — 3,0 мл. Загальна доза для дорослих і дітей з 14 років не повинна перевищувати 20,0–30,0 мл, для дітей 8–13 років — 10,0 мл. Обов’язкове проведення внутрішньошкірної проби з протилептоспірозним імуноглобуліном у розведенні 1 : 100.
Глобулін протисибіровиразковий кінський рідкий містить антитіла до збудника сибірської виразки. З профілактичною метою препарат вводять внутрішньом’язово одноразово в можливо короткі терміни після підозрюваного зараження в дозі 20–25 мл дорослим, 12 мл — підліткам і 5–8 мл дітям до 14 років. Лікувальна доза становить 30–50 мл при середньотяжкому і тяжкому перебігу хвороби і 75–100 мл при сепсисі. Проведення внутрішньошкірної проби з імуноглобуліном у розведенні 1 : 100 в дозі 0,1 мл перед уведенням глобуліну обов’язкове.
Лактоглобулін протиколіпротейний коров’ячий для перорального застосування сухий є очищеною фракцією глобулінів молозива імунізованих корів. Містить антитіла до патогенних Escherichia coli серогруп 026 055, 0111, 0119, Proteus vulgaris серогрупи 043 і Proteus mirabihs серогрупи 035. Лактоглобулін приймають за 20–30 хв до годування. Вміст флакону розводять кип’яченою водою кімнатної температури з розрахунку 10 мл на одну дозу препарату. Препарат призначають дітям віком до 6 місяців — по 2 дози 2 рази на добу протягом 7–14 діб; у тяжких випадках можна збільшити кратність прийому препарату до 3 разів на добу і продовжити курс лікування до 21 доби.
Алогенні антисироватки отримують з сироватки крові донорів, заздалегідь вакцинованих специфічними антигенами. Препарати імуноглобулінів, отримані з нормальної або імунної сироватки, вводять внутрішньом’язово, а спеціальні, дезагрегуючі імуноглобуліни — внутрішньовенно.
Нормальний донорський імуноглобулін містить чимало антитіл різної специфічності, направлених проти всіх інфекцій, перенесених донором, або що утворилися в результаті вакцинації. Як правило, такі імуноглобуліни використовують для імунотерапії затяжних, уповільнених інфекцій.
Внутрішньовенний імуноглобулін (ВІГ) показаний для замісної терапії при первинних імунодефіцитах (агаммаглобулінемія) і при вторинних імунодефіцитах при тяжких гнійно-септичних захворюваннях.
Імуноглобулін людини нормальний для в/м уведення, випускається в ампулах по 1,5 мл. Застосовується для профілактики кору, інфекційного гепатиту, кашлюку, менінгококової інфекції, поліомієліту грипу, тому що містить невелику кількість антитіл проти цих інфектів.
Профілактика кору. З 3 міс., як що не хворів на кір і невакцинований, не пізніше 4 діб після контакту з хворим: дітям — 1,5 або 3 мл (залежно від стану здоров’я і часу з моменту контакту), дорослим — 3 мл одноразово.
Профілактика поліомієліту. Неприщепленим або таким, що не пройшли повний курс вакцинації дітям, якомога раніше після контакту з хворим на паралітичну форму поліомієліту — 3–6 мл одноразово.
Профілактика гепатиту А. Дітям 1–6 років — 0,75 мл, 7–10 років — 1,5 мл, старшим за 10 років і дорослим — 3 мл одноразово; повторне введення за показаннями не раніше ніж через 2 місяця.
Профілактика і лікування грипу. Дітям віком до 2 років — 1,5 мл, 2–7 років — 3 мл, старшим за 7 років і дорослим — 4,5–6 мл одноразово. При тяжких формах грипу показано повторне введення через 24–48 годин.
Профілактика кашлюку. Не хворіючим на кашлюк дітям — по 3 мл двократно з інтервалом 24 години.
Профілактика менінгококової інфекції. Дітям від 6 міс. до 7 років, не пізніше 7 діб після контакту з хворим на генералізовану форму інфекції (незалежно від серогрупи збудника) — 1 мл (до 3 років включно) або 3 мл (старшим за 3 роки).
Гіперімунні імуноглобуліни цілеспрямованої дії отримують з сироватки крові спеціально імунізованих донорів. Ці препарати містять високий титр антитіл до відповідних збудників і використовують для екстреної імунотерапії й імунопрофілактики правця, грипу, кліщового енцефаліту, стафілококової інфекції.
Імуноглобулін людини антистафілококовий застосовують для лікування захворювань стафілококової етіології у дітей і дорослих. При генералізованій стафілококовій інфекції імуноглобулін вводять в/м 1 раз на добу. Мінімальна разова доза становить 5 МО антиальфастафілолізину на 1 кг маси тіла (для дітей до 5 років разова доза — не менше ніж 100 МО). При локалізованій стафілококовій інфекції мінімальна разова доза препарату — не менше ніж 100 МО. Курс лікування — 3–5 ін’єкцій, які вводять щоденно або через день залежно від тяжкості захворювання, стану хворого і терапевтичного ефекту. Випускається в ампулах по 3 мл (1 доза — 100 МО), 5 мл (1 доза — 100 МО).
Протиправцевий донорський імуноглобулін. З метою його отримання заздалегідь відбирають донорів з числа осіб, імунізованих правцевим анатоксином. Донорів імунізують повторно правцевим анатоксином і через 3 тижні з їх крові виділяють гамма-глобулінову фракцію за кількістю правцевого антитоксину 12–14 MО на 1 мл. Протиправцевий донорський імуноглобулін використовують для екстреної профілактики правця у людей із підвищеною чутливістю до кінського білка.
Імуноглобулін людини проти вірусу герпесу простого 1-го типу для в/м введення. Застосовують для лікування гострої або загострення хронічної герпесвірусної інфекції 1-го типу (herpes labialis). Уводять імуноглобулін по 4,5 мл (3 ампули) в/м 1 раз у 3 дні, до 5 ін’єкцій. Випускається в ампулах по 1,5 мл у вигляді 10% розчину імунологічно активної фракції білка.
Імуноглобулін людини проти вірусу герпесу простого 2-го типу для в/м введення. Застосовують для лікування гострої або загострення хронічної герпесвірусної інфекції 2-го типу (herpes genitalis). Первинна і рецидивуюча генітальна герпетична інфекція — в/м 1,5 мл (1 доза) один раз на три дні. Курс лікування — 7 ін’єкций, а також місцево — обробка пухирчастих герпетичних висипань. Герпетична генітальна інфекція у вагітних жінок — перший курс лікування проводять після 12 тижнів вагітності. Препарат уводять в/м 1,5 мл (1 доза) 1 раз у три дні, всього 6 ін’єкцій. Другий курс проводять після 36 тижнів вагітності. Препарат вводять в/м 1,5 мл (1 доза) 1 раз у три дні, 6 ін’єкцій. Препарат також застосовується у вигляді місцевих інстиляцій в уретру і піхву. Імуноглобулін вводять інтравагінально шприцем без голки протягом 5 днів після попереднього промивання піхви фізіологічним розчином. Випускається в ампулах по 1,5 мл.
Зостевір (імуноглобулін проти вірусу Varialla zoster людини рідкий) для в/м введення. Застосовують для лікування гострої або загострення хронічної герпесвірусної інфекції 6-го типу (herpes zoster), також ослабленим хворим з імунодефіцитами після імуносупресії, пересадки кісткового мозку. Вводять імуноглобулін по 3 мл (2 ампули) в/м, 1 раз у 3 дні до 9 ін’єкцій. Випускається в ампулах по 1,5 мл.
Герпімун-6 (імуноглобулін проти вірусу герпесу 6-го типу людини рідкий) для в/м введення. Застосовують для лікування хворих на герпетичну інфекцію з ураженням нервової системи, викликану вірусом герпесу 6-го типу. Вводять в/м по 3 мл (2 ампули по 1,5 мл) один раз у три дні до 9 ін’єкцій. Випускається в ампулах по 1,5 мл.
Імуноглобулін людини антицитомегаловірусний. Застосовують для лікування цитомегаловірусної інфекції у дорослих і дітей. Вводять в/м 1 раз на добу. Для лікування ЦМВ-інфекції у новонароджених вводять по 0,5 мл на 1 кг маси тіла на добу з інтервалом 2–3 доби. Курс лікування — до 3 ін’єкцій. Для лікування ЦМВ-інфекції у дітей молодшого віку вводять по 1,5 мл (1 ампула) з інтервалом між ін’єкціями 5 діб. Курс лікування — до 5 ін’єкцій. Жінкам із тяжким акушерським анамнезом, у тому числі вагітним, — по 1,5 мл (1 ампула) 1 раз у 3 дні. Курс лікування — до 5 ін’єкцій. При ураженні ЦНС у дорослих вводять по 4,5 мл (3 ампули по 1,5 мл) 1 раз у 3 дні. Курс лікування — до 5 ін’єкцій. Випускається в ампулах по 1,5 мл.
Цитобіотект (імуноглобулін антицитомегаловірусний людини рідкий для внутрішньовенного введення) застосовують: при гострій інфекції ЦМВ у недоношених новонароджених і грудних дітей; за показаннями дітям з первинними і вторинними імунодефіцитами; для лікування ЦМВ-інфекції у реципієнтів після трансплантації кісткового мозку або органів і тканин. Вводять внутрішньовенно краплинно (1 мл/хв). Одноразова доза — 50 МО/кг маси тіла. При трансплантації введення (1 мл/кг маси тіла) слід починати в день попередній перед трансплантацією і в день трансплантації. Терапія маніфестуючої інфекції — 2 мл/кг кожні два дні до зникнення клінічних симптомів. Випускається у флаконах: 10% розчин — 10 мл, 5 % — 50 мл.
Імуноглобулін людини проти вірусу Епштейна — Барр. Застосовують для лікування захворювань, викликаних вірусом Епштейна — Барр, у тому числі енцефаліту, енцефаломієліту, менінгоенцефаліту, арахноенцефаліту, арахноїдиту, енцефалополірадикуліту, інфекційного мононуклеозу. Дорослим імуноглобулін вводять внутрішньом’язово по 4,5 мл (3 ампули по 1,5 мл) 1 раз у три дні. Курс лікування — до 5 ін’єкцій. Для лікування інфекційного мононуклеозу ВЕБ-етіології дітям старшим за 3 роки імуноглобулін уводять внутрішньом’язово по 3 мл (2 ампули по 1,5 мл) 1 раз у 3 дні. Курс лікування — до 5 ін’єкцій. Випускається в ампулах по 1,5 мл.
Гепатоімун (імуноглобулін проти вірусу гепатиту В людини рідкий) Термінова профілактика гепатиту В: після контакту з інфікованим матеріалом (кров, плазма, сироватка), після поранення медичними інструментами. При потраплянні інфекційного матеріалу на слизові оболонки (у рот, очі та ін.). З метою термінової профілактики гепатиту В препарат вводять в/м у дозі 6–10 МО на 1 кг маси тіла якомога раніше після контакту (протягом 24–48 годин). Термінова профілактика у дорослих і дітей старших за 10 років, які належать до груп підвищеного ризику інфікування вірусом гепатиту В (контактні в осередках гепатиту В, перед операціями, гемотрансфузіями, гемодіалізом та ін.), не щеплених проти гепатиту В, препарат уводять з розрахунку 6–8 МО на 1 кг маси тіла. Дітям віком до 10 років препарат уводять у дозі 100 МО. Випускається в ампулах по 1 мл (1 мл — 50 МО).
Імуноглобулін людини антихламідійний застосовують для лікування хламідійної інфекції (ураження урогенітальних шляхів — сальпінгіт, сальпінгоофорит, кольпіт, уретрит, простатит, цистит, уретропростатит, невиношування вагітності, безпліддя та ін.). Для лікування урогенітальної хламідійної інфекції у дорослих, в тому числі вагітних жінок, імуноглобулін вводять по 1,5 мл (1 доза) 1 раз у 3 дні в/м до 6 ін’єкцій. Препарат також застосовується у вигляді місцевих інстиляцій в уретру і піхву в дозі 1,5 мл (1 ампула). Випускається в ампулах по 1,5 мл (1 доза).
Уреаплазма-імун (імуноглобулін проти Urea plasma urealiticum людини рідкий) застосовують для лікування уреаплазмозу. Препарат вводять в/м по 3 мл (2 ампули по 1,5 мл) 1 раз у 3 дні до 7 ін’єкцій. Випускається в ампулах по 1,5 мл (1 доза).
Мікоплазма-імун (імуноглобулін проти р120 Mycoplasma hominis людини рідкий) застосовують для лікування мікоплазмозу. Препарат вводять в/м по 3 мл (2 ампули по 1,5 мл) 1 раз у 3 дні до 7 ін’єкцій. Випускається в ампулах по 1,5 мл (1 доза).
Імуноглобулін людини проти Toxoplasma Gondii застосовують для лікування токсоплазмозу (ураження урогенітальних шляхів, жінкам із тяжким акушерським анамнезом, у тому числі вагітним). Перший курс лікування вагітних жінок з симптомами токсоплазмової інфекції або хронічного токсоплазмозу і пов’язаної з ним акушерської патології проводиться після 12–15 тижнів вагітності. Імуноглобулін вводять в/м по 1,5 мл 1 раз у 3 дні курсом 7–10 ін’єкцій. Другий курс лікування проводиться після 30 тижнів вагітності за такою самою схемою. Перший курс лікування хворих із симптомами ураження урогенітальних шляхів на фоні токсоплазмозу проводиться за такою ж схемою. Пацієнткам-жінкам призначають другий курс лікування імуноглобуліном через 4 тижні після першого, під наглядом лікаря. Випускається в ампулах по 1,5 мл (1 доза).
Імуноглобулін людини антирезус Rh0(D) застосовують Rh0(D)-негативним жінкам не сенсибілізованим Rh0(D)-антигеном — таким, які не виробили резус-антитіл, народивши Rh0(D)-позитивну дитину, а також при штучному перериванні вагітності жінкам, не сенсибілізованим Rh0(D)-антигеном у випадку резус-позитивної належності Rh0(D) крові чоловіка. Імуноглобулін вводять по 7 мл (1 доза) в/м одноразово. Породіллі — протягом перших 48 годин після пологів. При штучному перериванні вагітності — безпосередньо після закінчення операції, під спостереженням лікаря. Випускається во флаконах по 7 мл (1 доза).
Імуноглобулін для профілактики і лікування кліщового енцефаліту готують з сироваток крові імунізованих донорів з підвищеним рівнем антитіл до вірусу кліщового енцефаліту. У випадках присмоктування кліщів вводять в/м одноразово — 1 мл 10% розчину дітям до 12 років, від 16 років і старшим — по 3 мл. Для лікування вводять по 3 мл в/м через 10–12 годин у перші 3 дні.
Препарати на основі моноклональних антитіл, що отримуються з антитілоутворюючих гібридних клітин тварин і людини. Основним напрямом їх застосування є пригнічення збудника або модифікація імунної відповіді шляхом скріплення деяких ключових його чинників моноклональними антитілами. Наприклад, отримані такі антитіла проти респіраторно-синцитіального вірусу; ФНП-b для пригнічення запалення при сепсисі, CD20+-лімфоцитів для лікування ревматоїдного артриту і СЧВ.
Імунореабілітація
Імунореабілітація (ІР) — комплекс імунологічних, імунокорегуючих, соціальних, екологічних, біомедичних заходів імунопрофілактики, направлених на відновлення (нормалізацію, досягнення клініко-імунологічної ремісії, зникнення або мінімалізацію рецидивів при хронічній формі) зміненої імунологічної реактивності хворого, популяції або певного контингенту населення.
Спеціалізована імунореабілітація проводиться при захворюваннях, у патогенезі яких превалюють симптоми імунопатології (автоімунні й імунодефіцитні захворювання) і для неї методи імунокорекції є провідними.
Прикладна імунореабілітація використовується при решті захворювань, де необхідна базисна терапія.
Комплексна програма імунореабілітаціи включає такі періоди:
— клінічний (14–45 днів) — базисна імунореабілітація з використанням методів імунокорекції, направлених на відновлення функцій імунної системи;
— амбулаторний (до 3 років) — відновна імунореабілітація, застережлива, рецидиви;
— санаторно-курортний — підтримуюча імунореабілітація, застосована після зникнення ознак хвороби.
Індивідуальна імунореабілітація направлена на хворого з імунодефіцитом з метою відновлення реактивності, або на хворого з алергією для зниження підвищеної реактивності.
Популяційна імунореабілітація направлена на відновлення системи імунітету групи населення. Імунореабілітації можуть піддаватися колективи підприємств з виробництвом, що має шкідливі умови праці, приводить до зміни реактивності — імуномодуляції. Ця ІР колективу тісно пов’язана з соціальною ІР, що передбачає комплекс засобів для поліпшення умов праці та соціального захисту. Імунореабілітація особливо необхідна населенню, що проживає в екологічно несприятливих регіонах, таких як зони Чорнобиля, Семипалатинська та інші забруднені радіонуклідами райони.
Екологічна імунореабілітація — це усунення імунотропних дій чинників зовнішнього середовища, що призводять до тимчасових імуномодуляцій у здорових людей і стійких імуномодуляцій у хворих, що реалізовуються як імунодефіцити, алергія, автоімунні захворювання, лімфопроліферативні синдроми. Тому заходи щодо ліквідації забруднення навколишнього середовища — повітря, води, рослин, отримання екологічно чистої їжі — становлять основу екологічної ІР. Переселення, зміна місцевості, особливо для чутливих людей, на більш-менш тривалий період — один із заходів екологічної імунореабілітації організму. Якщо такі заходи супроводжуються поліпшенням соціально-економічних умов життя і системою оздоровчих заходів, то вони є основою комплексної імунореабілітації. Іноді цих заходів досить для усунення транзиторних, тимчасових несприятливих імуномодуляцій.
Проте при стійких імуномодуляціях, ускладнених клінічними проявами інфекційно-запальних або алергічних захворювань, потрібний додатковий комплекс заходів і засобів як нелікарської, так і лікарської дії, на організм у вигляді обгрунтованих схем імунореабілітації.
Застосування імунокорегуючих, імуномодулюючих засобів повинно обґрунтовуватися як клінічними, так і лабораторними даними обстеження хворого. Переважно на першому етапі використовувати засоби рослинного походження типу препаратів ехінацеї і адаптогенів, які за необхідністю можна комбінувати з тимічними імуномодуляторами, які не дають ускладнень.
Кожен віковий період вимагає особливих підходів до ІТ і ІР, пов’язаних з особливостями вікової імунопатології: у дітей — це природжена імунопатологія й імунодефіцити, що виявляються як вірусно-бактерійні процеси; у юнацький період — це особливості подальшого становлення і модуляції системи імунітету, в середньому віці — професійні й екологічні види патології; у літньому віці — системно-соматичні, комбіновані порушення.