Газета «Новости медицины и фармации» Антимикробная терапия и пульмонология (408) 2012 (тематический номер)
Вернуться к номеру
Применение поливалентного механического бактериального лизата Респиброн с целью профилактики рецидивирующих респираторных инфекций: метаанализ исследований
Авторы: Mario Cazzola, Department of Internal Medicine, Unit of Respiratory Clinical Pharmacology, University of Rome ‘Tor Vergata’, Department of Pulmonary Rehabilitation, San Raffaele Pisana Hospital, IRCCS, Rome, Italy, Sreedhar Anapurapu, Department of Biometrics, SPRIM Advanced Life Sciences, Milan, Italy, Clive P. Page, Sackler Institute of Pulmonary Pharmacology, Institute of Pharmaceutical Science, King’s College London, London, UK
Версия для печати
Введение
Несмотря на прогресс современной медицины, инфекции дыхательных путей встречаются часто и остаются основной причиной заболеваемости, смертности и экономических расходов во всем мире. По статистике, ежегодно на 1000 зарегистрированных пациентов приходится 300–400 консультаций врачей общей практики [1]; кроме того, респираторные инфекции являются самой частой причиной назначения антибиотиков [2]. Существует два типа клинически значимых заболеваний дыхательных путей: обострения хронического бронхита или хронического обструктивного заболевания легких (ХОЗЛ) и рецидивирующие инфекции дыхательных путей [3].
Рецидивирующие респираторные заболевания встречаются часто как у детей, так и у взрослых. При этих состояниях поражаются верхние и нижние дыхательные пути, а их причиной могут быть различные патогены. В то время как вирусы, такие как вирусы гриппа, парагриппа, респираторно-синцитиальный вирус, аденовирусы, риновирусы, остаются первичной причиной заболевания, рецидивы могут быть вызваны различными бактериями, включая Acinetobacter spp., Chlamydia pneumoniae, Enterobacteriaceаe, Haemophilus influenzae, Legionella pneumophila, Moraxella catarrhalis, Mycoplasma pneumoniae, Nocardia asteroids, Pasturella multocida, Pseudomonas aeruginosa, Staphylococcusaureus, Stenotrophomonasmaltophilia, Streptococcuspneumoniaeи Streptococcuspyogenes(группа A) [3].
Возбудителей инфекций, в частности бактерии, вирусы и атипичные патогены, выявляют в 80 % случаев обострений хронического бронхита и ХОЗЛ [4]. У пациентов с ХОЗЛ отмечается ослабление местной защиты, частая колонизация бактериями и потому — предрасположенность дыхательных путей к развитию инфекций [5]. Исследования мокроты и бронхоскопия показали, что M.catarrhalis, H.influenzae и S.pneumoniae являются самыми распространенными микроорганизмами, связанными с обострением ХОЗЛ [4, 5], хотя обострение заболевания также может быть вызвано и другими бактериями (например, Pseudomonas и Staphylococcus) [4, 5]. Многие из этих бактерий могут вызывать хроническую колонизацию дыхательных путей, что приводит к развитию инфекционного процесса после простой вирусной инфекции или под воздействием средовых факторов. С другой стороны, значительная часть инфекций при ХОЗЛ может быть вызвана новыми для пациента штаммами бактерий [6].
Для пациентов с ХОЗЛ характерны частые обострения. По существу, последние связаны с повышением заболеваемости и смертности, более быстрым снижением функции легких и ухудшением состояния здоровья [7]. В ходе исследования ECLIPSE (Evaluation of COPD Longitudinally to Identify Predictive Surrogate Endpoints) было установлено, что по мере прогрессирования ХОЗЛ обострения учащаются и становятся более тяжкими, и, что интересно, самым важным определяющим фактором частых обострений является анамнез обострений [8]. Эти данные подтверждают предположение о том, что среди пациентов, более склонных к частым обострениям, некоторые страдают более легкими формами заболевания, имеют особый фенотип восприимчивости, который относительно стабилен в течение времени и может быть диагностирован на основании сообщений пациента о ранее перенесенных эпизодах, при которых проводилось лечение. Ввиду значительного повышения заболеваемости и смертности, связанной с обострениями ХОЗЛ, профилактика последних является основной целью лечения ХОЗЛ и глобальным приоритетом.
Одним из подходов к лечению респираторных инфекций является неспецифическое повышение иммунного ответа или усиление врожденных защитных механизмов. Для повышения иммунной реакции на патогены, в частности на бактерии, могут применяться различные терапевтические подходы — антибиотикопрофилактика и вакцинация бактериальными лизатами. В течение многих лет с целью смягчения симптомов и профилактики инфекций дыхательных путей применяли иммуномодуляторы для перорального приема, изготовленные из лиофилизированных бактериальных экстрактов [9]. По данным предыдущего метаанализа предполагали, что такое лечение может оказывать влияние на обострения, но качество исследований, включенных в анализ, в целом было низким [10]. Однако в последнем количественном обобщенном анализе OM-85 BV (Broncho-vaxom®), в котором объединили данные 13 рандомизированных плацебо-контролируемых клинических исследований с участием 2066 пациентов, не наблюдали эффективности бактериальных лизатов в профилактике обострений ХОЗЛ [11]. В различных исследованиях были получены вариабельные данные в отношении частоты госпитализаций, балльных оценок симптомов, применения антибиотиков или стероидов [11].
OM-85 BV является продуктом щелочного протеолиза лизатов следующих бактерий: H.influenzae, S.pneumoniae, Klebsiella pneumoniae, Klebsiella ozaenae, S.aureus, Staphylococcus pyogenes, Streptococcus viridans и M.catarrhalis. К сожалению, щелочной лизис может приводить к денатурации белков с последующим снижением иммуногенности бактериальных антигенов, что ведет к менее выраженному усилению иммунной реакции [12].
Поливалентный механический бактериальный лизат* (PMBL*) — бактериальный лизат, полученный путем механической дезинтеграции (лизиса) бактерий — наиболее частых возбудителей заболеваний верхних и нижних дыхательных путей (S.aureus, S.viridans, S.pyogenes, K.pneumoniae, K.ozaenae, H.influenzae serotype B, M.catarrhalis и S.pneumoniae) [13]. Механический метод особенно эффективен, так как позволяет добиться лизиса 80–100 % бактерий. Примечательно, что в сравнении с другими методами лизиса механический лизис не нарушает структуру антигенов: это обеспечивает превосходные антигенные свойства препарата [13]. Лизат индуцирует специфичную иммуностимуляцию против всех штаммов бактерий, антигены которых содержатся в PMBL* и которые являются наиболее частыми причинами респираторных инфекций [13].
Целью данного систематического обзора является анализ доступных доказательств эффективности PMBL* в профилактическом лечении инфекций дыхательных путей.
Методы
Этот систематический обзор был выполнен в соответствии с рекомендациями QUORUM [14].
Отбор исследований
Был проведен систематический поиск релевантных клинических исследований (без языковых ограничений) в таких базах данных, как Rection, Pub Med, Inist, Toxline, Google Scholar и Scirus, по таким терминам, как «PMBL*», «поливалентный лизат», «ХОЗЛ», «механический лизат» и «подъязычная вакцина».
В анализ включали исследования, в которых проводили рандомизированное сравнение лечения PMBL* с плацебо, другим конвенциональным бактериальным лизатом или отсутствием лечения (контроль) у взрослых с хроническим бронхитом и ХОЗЛ или туберкулезом и у детей с острыми/рекуррентными инфекциями дыхательных путей. Исследования по профилактике инфекций у здоровых субъектов или по изучению влияния на иммунологические показатели не включали. Включали данные коротких сообщений научных конференций в случаях, если в них были четко описаны методы исследования, а отчет по результатам был надлежащим.
Извлечение данных и оценка валидности
Для каждого из выбранных исследований получали следующую информацию: основной автор, год издания, данные о дизайне исследования, изучаемые методы лечения (тип препарата и схема лечения, продолжительность лечения), пациенты (ХОЗЛ + бронхит, туберкулез, взрослые или дети), конечные точки исследования, частота и тип побочных реакций.
Качество отобранных исследований оценивали по пятибалльной шкале [15], учитывая ряд факторов, влияющих на качество исследования: методы рандомизации, слепое исследование и описание случаев исключения и выхода из исследования.
Два независимых эксперта оценивали качество исследований. Отличия в оценках определял консенсус, основываясь на первоначальной статье/отчете.
Статистический анализ
Первичным критерием эффективности было предупреждение обострений или острых инфекций дыхательных путей. Определения понятий обострения или острой инфекции дыхательных путей были взяты из оригинальных исследований.
Исследования были сгруппированы в двойные слепые плацебо-контролируемые рандомизированные, а затем разделены на подгруппы: ХОЗЛ + бронхит, исследования с участием детей или пациентов с туберкулезом. Данные разделены на данные группы лечения и группы плацебо.
Общую оценку в конце лечения рассчитывали с использованием средних значений как для группы лечения, так и для группы плацебо.
Совокупная оценка эффективности лечения против плацебо и соответствующие 95% доверительные интервалы (95% CI) были рассчитаны с помощью метода разницы средних значений для непрерывных переменных [16].
Для обобщения оценок рассматривали модель постоянных эффектов и модель случайных эффектов в зависимости от наличия статистической гетерогенности. Статистическую гетерогенность определяли как I2 statistic gt; 50% [17]. Для оценки гетерогенности включенных в анализ клинических исследований рассчитывали Cochrane Q [18]. При P-значениях < 0,10 однородность считали неприемлемой.
Cтатистический анализ проводили с помощью программы Excel, а также CMA версии 2.2.
Результаты представлены в виде относительных рисков (RR) и количества пациентов, которых необходимо пролечить, чтобы 1 получил эффект (NNTB), с соответствующими 95% Cl.
Результаты
Отбор исследований
Было выявлено девятнадцать потенциально подходящих исследований [19–37] (рис. 1). Три из них были исключены, потому что в них было недостаточно данных об общем количестве пациентов, которые получали лечение, и/или об общем количестве эпизодов инфекций/обострений [34–36]. Еще одно исследование было исключено из-за неподходящего дизайна [37]. Таким образом, в конечный анализ было включено 15 рандомизированных клинических исследований (RCTs) [19–33], в которых принимали участие 2557 субъектов.

Исходы
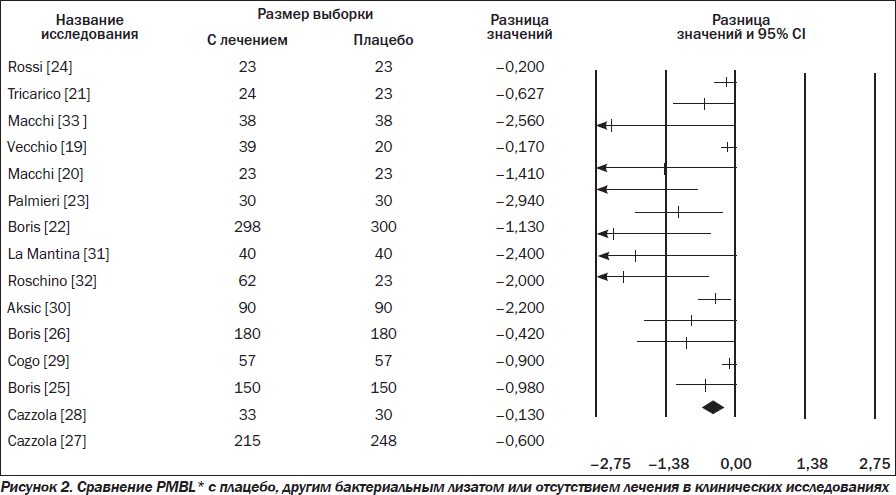
Эффективность PMBL* определяли, учитывая количество рецидивов инфекций дыхательных путей. Согласно обобщенным данным исследований, применение PMBL* приводит к значительному уменьшению частоты инфекций по сравнению с плацебо (RR –0,513; 95% CI –0,722... –0,303; p = 0,00) (рис. 2). Мы также рассчитали годичный показатель NNTB для предотвращения 1 эпизода инфекции. Частота инфекций среди пациентов, которые получали PMBL*, составила 1,27, а у пациентов группы плацебо — 2,01, абсолютное снижение риска — 0,87 и NNTB — 1,15.
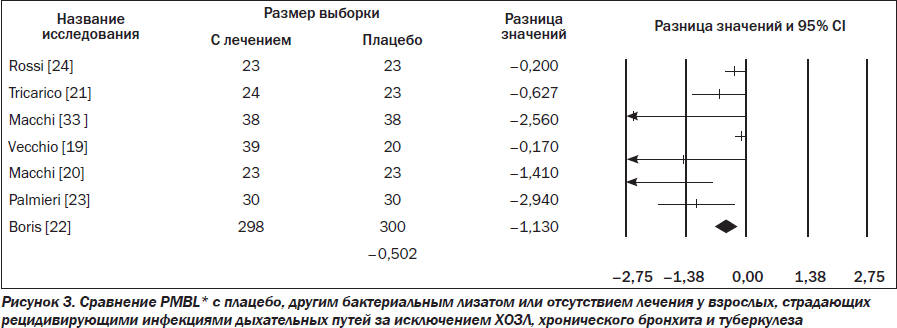
Были доступны данные субанализа 7 RCTs с участием взрослых пациентов, страдающих рецидивирующими инфекциями дыхательных путей, отличными от ХОЗЛ, хронического бронхита и туберкулеза (475 пациентов получали лечение PMBL*, а 457 — плацебо), согласно которым PMBL* оказывает значительное положительное влияние, сокращая общую частоту инфекций (RR –0,502; 95% CI –0,824... –0,181; p = 0,002) (рис. 3).
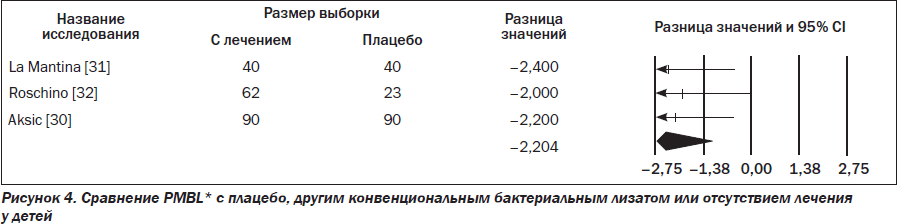
Данные трех RCTs, в которых изучали влияние PMBL* у детей (192 участника получали активное лечение, а 153 — плацебо), свидетельствовали о положительном эффекте PMBL* (RR –2,204; 95% CI –3,260... –1,147; p = 0,00) (рис. 4).
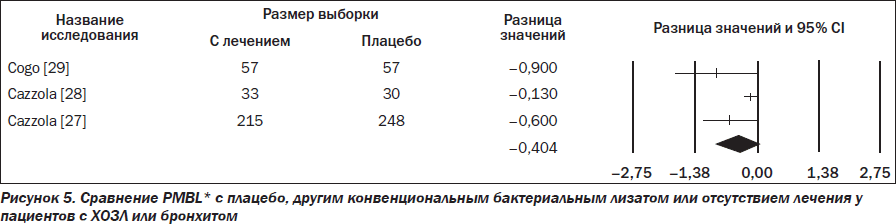
В трех RCTs (305 участников получали активное лечение, а 335 — плацебо) изучали эффективность PMBL* в профилактике обострений у пациентов с ХОЗЛ или бронхитом (RR –0,404; 95% CI –0,864–0,057), но разница между PMBL* и плацебо не была статистически значимой (p = 0,086) (рис. 5).
Данные двух RCTs, в которых изучали эффективность PMBL* у пациентов с туберкулезом (330 участников получали лечение, а 330 — плацебо), свидетельствовали о существенном положительном эффекте PMBL* (RR –0,502; 95% CI –0,890... –0,114; p = 0,011) (рис. 6).
Результаты статистического анализа не предполагали никаких потенциальных искажений (ошибок) в отношении как качества исследования, так и публикации.
Обсуждение
Результаты этого метаанализа свидетельствуют о том, что у пациентов, получающих PMBL*, инфекции дыхательных путей встречаются реже. Данный метаанализ объективен, потому что включает данные RCTs, неопубликованные исследования и статьи, написанные на других языках, а не только на английском.
Выводы, основанные на результатах данного метаанализа (положительного или отрицательного), могут предоставить полезную информацию, а его популярность, по крайней мере отчасти, связана с тем, что он упрощает и облегчает жизнь как обозревателей, так и читателей [38]. Однако обобщение всей информации, содержащейся в клинических исследованиях, в единый показатель относительного риска может слишком упростить очень сложный вопрос [38]. Тем не менее в медицине метаанализы рандомизированных плацебо-контролируемых исследований рассматриваются как наивысший уровень доказательности [39]. При стандартном подходе к метаанализу предполагается, что отдельные исследования лишены ошибок, связанных с отбором (и ошибок, связанных с качеством/валидностью данных) [40].
Мы считаем вопрос об эффективности PMBL* у детей особенно интересным, так как рецидивирующие инфекции дыхательных путей в детском возрасте наблюдаются часто. Согласно предыдущему систематическому обзору, очищенные бактериальные экстракты для перорального применения лишь умеренно эффективны в профилактике острых респираторных заболеваний у детей [42], хотя в другом анализе сообщалось, что бактериальные иммуностимуляторы, в основном OM-85 BV, который является продуктом щелочного протеолиза бактериальных лизатов, более эффективны у пациентов с высоким риском развития рецидивирующих инфекций дыхательных путей [43]. Различия в результатах нашего исследования и метаанализа, проведенного Steurer-Stey and colleagues [42], можно объяснить отличиями исследуемых популяций, но нельзя исключить более высокую активность PMBL*, полученного посредством механического лизиса — метода, который, как уже подчеркивалось ранее, не изменяет структуру антигенов и, следовательно, может приводить к более специфической реакции в виде образования антител на поверхностные антигены патогенных бактерий. Эта точка зрения поддерживается данными исследования La Mantia and colleagues [31], которые продемонстрировали большую эффективность PMBL* по сравнению с обычным бактериальным лизатом у детей с назофарингитом, и/или средним отитом, и/или рецидивирующим фаринготонзиллитом.
Анализ подгруппы RCTs, в ходе которых изучали влияние PMBL* при ХОЗЛ или бронхите, показал положительную тенденцию в плане профилактики обострений ХОЗЛ. Стоит отметить, что предыдущий систематический обзор 13 рандомизированных плацебо-контролируемых клинических исследований по сравнению эффективности бактериальных лизатов с плацебо показал, что лечение может оказывать влияние на осложнения, но большинство исследований были низкого качества и не показали убедительного влияния в плане профилактики осложнений [10]. Кроме того, по результатам одного систематического обзора OM-85 BV, в котором изучали исходы, сообщается, что нет четких доказательств какой-либо клинической пользы подобного лечения [11]. Результаты нашего метаанализа указывают на существование тенденции к улучшению результатов в случае применения PMBL* у пациентов с ХОЗЛ. Эти данные не достигли статистической значимости ввиду небольшого количества исследований с участием пациентов с ХОЗЛ. Мы уже упоминали работу Кого и коллег [29], в которой лечение PMBL* приводило к значительному сокращению абсолютного числа обострений, их длительности и тяжести, а также необходимости в применении антибиотиков и к снижению расходов на лечение этих пациентов в течение периода лечения по сравнению с аналогичным периодом прошедшего года, в течение которого антибактериальная профилактика не проводилась. В другом исследовании 178 пациентов были случайно распределены на две разные группы: пациенты первой получали PMBL*, а второй — плацебо [27]. После завершения лечения за пациентами наблюдали в течение 9 месяцев. Частота достижения клинических конечных точек была гораздо ниже в группе, которая получала лизат, чем в группе плацебо. Лечение PMBL* также привело к значительному снижению частоты (215 против 248 случаев) и длительности (10,6 против 15,8 дня) обострений, а также к сокращению потребления антибиотиков (–270 доз) и продолжительности госпитализации (275 против 590 дней). Вероятно, невозможность достижения статистической значимости в данном метаанализе связана c третьим RCT, в котором была показана положительная тенденция, но статистическая значимость не достигнута из-за небольшого количества пациентов [28]. В этом исследовании изучали значение добавления PMBL* к существующей терапии комбинацией сальметерол/флутиказон у пациентов с ХОЗЛ (прогнозируемый показатель FEV1 < 60 %). Хорошо известно, что комбинация сальметерол/флутиказон позволяет значительно снизить ежегодное количество обострений по сравнению с плацебо [44]. Следовательно, включение PMBL* позволило в большей мере снизить количество обострений в год (0,67 в группе без PMBL* и 0,54 — в группе с PMBL*), количество обострений, при которых требуется лечение пероральными кортикостероидами, и показатель частоты госпитализации [28].
Существует мало данных об эффективности применения бактериальных экстрактов в лечении пациентов, перенесших туберкулез. Результаты данного метаанализа дают основания поддерживать применение PMBL* у пациентов этой группы. Следовательно, мы считаем, что PMBL* должен рассматриваться в качестве возможного терапевтического средства для лечения пациентов, перенесших туберкулез, с дисфункцией дыхательных путей, страдающих рецидивирующими инфекциями дыхательных путей.
В завершение стоит отметить, что результаты данного метаанализа свидетельствуют о том, что PMBL* эффективен в профилактике инфекций дыхательных путей как у детей, так и у взрослых. Тем не менее мы полностью согласны с Braido and colleagues [3], что, даже несмотря на внушающие оптимизм результаты проанализированных исследований, полезным представляется проведение дальнейших исследований с большим количеством пациентов, отобранных в зависимости от заболевания и его тяжести, продуманным дизайном в плане процедур «ослепления» и рандомизации. Это позволит получить доказательства еще более высокого уровня, поддерживающие более широкое применение PMBL* для профилактики инфекций дыхательных путей.
Перевод К. Кремца
Оригинал статьи опубликован в
Pulm. Pharmacol. Ther. 2012 Feb; 25(1): 62-8. Epub 2011 Nov 27
Список литературы находится в редакции