Журнал «Медицина неотложных состояний» Том 21, №2, 2025
Вернуться к номеру
Топічне використання комбінованих препаратів ніфедипіну та лідокаїну в післяопераційному періоді після гемороїдектомії, при гострому гемороїдальному тромбозі та геморої в поєднанні з хронічною анальною тріщиною
Авторы: Саволюк С.І., Завертиленко Д.С.
Національний університет охорони здоров’я України імені П.Л. Шупика, м. Київ, Україна
Рубрики: Медицина неотложных состояний
Разделы: Клинические исследования
Версия для печати
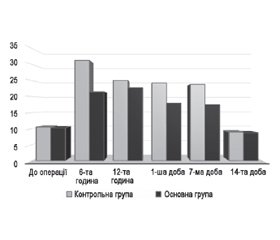
Актуальність. Геморой є однією з найбільш поширених патологій у професійній діяльності хірурга, що становить значну соціально-економічну проблему для населення та системи охорони здоров’я країн усього світу. Хірургічне лікування, а саме гемороїдектомія за Milligan-Morgan, є одним із основних та ефективних методів лікування пацієнтів цієї категорії із гемороєм ІІІ–ІV стадії. Однією з найбільших проблем у ранньому післяопераційному періоді є розвиток у пацієнтів больового синдрому, що потребує впровадження заходів, націлених на його зниження. У структурі хвороб товстої кишки анальна тріщина трапляється досить часто. Щонайменше 20 % пацієнтів із симптоматичним гемороєм мають анальні тріщини. У госпітальній проктологічній захворюваності анальні тріщини стоять на шостому місці та становлять 5–7 % випадків. Їх медикаментозне лікування ґрунтується на зменшенні спазму анального сфінктера для поліпшення кровотоку та загоєння. Проблемами, що поєднують вищенаведені патології, є спазм внутрішнього анального сфінктера та біль. Отже, пошуки оптимального їх купірування продовжуються. Мета дослідження: оцінити та порівняти вплив місцевого застосування ніфедипіну в комбінації з лідокаїном (Ніфекаїн), а також місцевого використання глюкокортикоїдів у поєднанні з лідокаїном на рівень післяопераційного болю, болю після дефекації у пацієнтів після гемороїдектомії за Milligan-Morgan; оцінити ефективність впливу топічного засобу на основі ніфедипіну та лідокаїну (Ніфекаїн) на рівень болю, а також болю після дефекації у пацієнтів з гострим гемороїдальним тромбозом І–ІІ стадії; оцінити застосування «медикаментозної сфінктеротомії» у вигляді місцевого нанесення крему з ніфедипіном та лідокаїном як альтернативного хірургічному методу лікування хронічної анальної тріщини в поєднанні з гемороєм І–ІІ стадії; оцінити переносимість та безпеку такого лікування. Матеріали та методи. Відповідне дослідження базувалось на даних пацієнтів, що проходили лікування та були прооперовані на базах кафедри хірургії та судинної хірургії Національного університету охорони здоров’я України імені П.Л. Шупика у період з квітня 2023 року до квітня 2024 року. У дослідження було включено результати, отримані в процесі курації таких груп: група І та ІІ — пацієнти після гемороїдектомії; група ІІІ — пацієнти з гострим гемороїдальним тромбозом І–ІІ стадії; група IV — пацієнти з гемороєм І–ІІ стадії в поєднанні з хронічною анальною тріщиною. Результати. Група І та ІІ — пацієнти після гемороїдектомії. Тривалість стаціонарного лікування: І група — 26,48 ± 5,76 години та ІІ група — 26,24 ± 5,64 години. Готовність пацієнтів до виписки за шкалою PT-RHDS: І група — 6,94 ± 0,37 бала; ІІ група — 7,02 ± 0,33 бала. Рівень болю за шкалою ACCS І та ІІ (у міліметрах) у визначені часові терміни становив: на 6-ту післяопераційну годину — 31,21 ± 4,32 проти 21,41 ± 4,09; 12-ту годину — 25,02 ± 3,49 проти 22,68 ± 3,87; на 1-шу добу — 24,21 ± 3,62 проти 17,92 ± 3,79; 7-му добу — 23,78 ± 3,46 проти 17,51 ± 3,57; 14-ту добу — 8,91 ± 2,74 проти 8,70 ± 2,68 відповідно. Група ІІІ — пацієнти з гострим гемороїдальним тромбозом І–ІІ стадії. Після 7 днів терапії кремом з ніфедипіном у комбінації з лідокаїном (Ніфекаїн) полегшення болю відмічалось у 84,8 %. Зникнення тромбозу гемороїдального вузла у всіх пацієнтів відбулося через 14 днів терапії. У пацієнтів не спостерігалося жодних системних побічних ефектів або значних аноректальних кровотеч. Група IV — пацієнти з гемороєм І–ІІ стадії в поєднанні з хронічною анальною тріщиною. Застосування ректального крему Ніфекаїн усувало біль вже після першої дефекації. Загоєння (епітелізація) хронічної анальної тріщини було досягнуте через 21 день терапії у 94,55 % пацієнтів. Ми не спостерігали жодних системних побічних ефектів у пацієнтів, які застосовували крем. Висновки. Місцеве застосування крему Ніфекаїн, що є комбінацією ніфедипіну та лідокаїну, дозволяє у коротші терміни досягти зниження післяопераційного больового синдрому після відкритої гемороїдектомії за Milligan-Morgan порівняно з комбінацією місцевих глюкокортикоїдів та лідокаїну. Місцеве застосування крему з ніфедипіном у комбінації з лідокаїном (Ніфекаїн) при гострому тромбозі гемороїдальних вузлів І–ІІ стадії полегшує біль та набряк, зменшує розміри геморою та дискомфорт. Застосування ректального крему Ніфекаїн у пацієнтів з гемороєм І–ІІ стадії в поєднанні з хронічною анальною тріщиною усуває біль вже після першої дефекації та сприяє епітелізації тріщини.
Background. Hemorrhoids are among the most common pathologies in surgical practice, presenting a significant socio-economic problem for the population and healthcare systems globally. Surgical treatment, particularly Milligan-Morgan hemorrhoidectomy, is one of the main and most effective methods for treating patients with stage III–IV hemorrhoids. One of the major problems in the early postoperative period is the development of pain syndrome, which necessitates measures aimed at its reduction. Anal fissure is also a common condition among colonic diseases. At least 20 % of patients with symptomatic hemorrhoids have anal fissures. In the structure of hospital proctologic morbidity, anal fissures rank sixth and account for 5–7 % of cases. Their medical treatment is based on reducing anal sphincter spasm to improve blood flow and promote healing. The common issues between the above-mentioned conditions are internal anal sphincter spasm and pain, and the search for optimal management continues. The purpose was to evaluate and compare the effect of topical use of nifedipine combined with lidocaine (Nifecaine) versus topical glucocorticoids combined with lidocaine on postoperative pain levels and pain after defecation in patients following Milligan-Morgan hemorrhoidectomy; to assess the efficacy of the nifedipine and lidocaine topical preparation (Nifecaine) on pain levels and post-defecation pain in patients with stage I–II acute thrombosed hemorrhoids; to evaluate the use of “medical sphincterotomy” in the form of topical nifedipine and lidocaine cream application as an alternative to surgical treatment of chronic anal fissure combined with stage I–II hemorrhoids; to evaluate the tolerability and safety of such treatment. Materials and methods. This study was based on data from patients treated and operated on at the Department of Surgery and Vascular Surgery of the Shupyk National Healthcare University of Ukraine from April 2023 to April 2024. The study included data from the following patient groups: groups I and II — patients after hemorrhoidectomy; group III — patients with stage I–II acute thrombosed hemorrhoids; group IV — patients with stage I–II hemorrhoids combined with chronic anal fissure. Results. Groups I and II — patients after hemorrhoidectomy. Hospital stay duration: group I — 26.48 ± 5.76 hours; group II — 26.24 ± 5.64 hours. Discharge readiness on PT-RHDS: group I — 6.94 ± 0.37 points; group II — 7.02 ± 0.33 points. The pain level according to the ACCS I and II (in millimeters) at the specified time points was: at the 6th postoperative hour — 31.21 ± 4.32 versus 21.41 ± 4.09; at the 12th hour — 25.02 ± 3.49 versus 22.68 ± 3.87; at the 1st day — 24.21 ± 3.62 versus 17.92 ± 3.79; at the 7th day — 23.78 ± 3.46 versus 17.51 ± 3.57; at the 14th day — 8.91 ± 2.74 versus 8.7 ± 2.68, respectively. Group III — patients with stage I–II acute thrombosed hemorrhoids. After 7 days of therapy with nifedipine and lidocaine cream (Nifecaine), pain relief was reported in 84.8 % of patients. Thrombosis resolution occurred in all patients within 14 days. No systemic side effects or significant anorectal bleeding were observed. Group IV — patients with stage I–II hemorrhoids combined with chronic anal fissure. Use of Nifecaine rectal cream relieved pain after the first defecation. Healing (epithelialization) of the chronic fissure occurred in 94.55 % of patients by day 21. No systemic side effects were reported in patients who used cream. Conclusions. Topical application of Nifecaine cream, a combination of nifedipine and lidocaine, provides faster postoperative pain relief after open Milligan-Morgan hemorrhoidectomy compared to a combination of topical glucocorticoids and lidocaine. Topical application of nifedipine and lidocaine cream (Nifecaine) for acute thrombosed hemorrhoids stage I–II relieves pain and swelling, reduces hemorrhoid size and discomfort. Nifecaine rectal cream use in patients with stage I–II hemorrhoids and chronic anal fissure eliminates pain after the first defecation and promotes fissure epithelialization.
геморой; гемороїдектомія; післяопераційний біль; Milligan-Morgan; тромбоз гемороїдального вузла; хронічна анальна тріщина; сфінктеротомія; крем з ніфедипіном та лідокаїном
hemorrhoids; hemorrhoidectomy; postoperative pain; Milligan-Morgan; thrombosed hemorrhoids; chronic anal fissure; sphincterotomy; nifedipine and lidocaine cream
Вступ
Матеріали та методи
Група І та ІІ — після гемороїдектомії
Група ІІІ — гострий гемороїдальний тромбоз І–ІІ стадії
Група IV — пацієнти з гемороєм І–ІІ стадії в поєднанні з хронічною анальною тріщиною
Результати
Група І та ІІ
/52.jpg)
Група ІІІ
Група IV
Обговорення
Висновки
- Tournu G, Abramowitz L, Couffignal C, Juguet F, Snjoux A, Berger S, et al.; GREP study group; MG-PREVAPROCT study group. Prevalence of anal symptoms in general practice: a prospective study. BMC Fam Pract. 2017 Aug 3;18(1):78. doi: 10.1186/s12875-017-0649-6. Erratum in: BMC Fam Pract. 2019 Jan 17;20(1):14. PMID: 28774265; PMCID: PMC5543599.
- Sun Z, Migaly J. Review of Hemorrhoid Disease: Presentation and Management. Clin Colon Rectal Surg. 2016 Mar;29(1):22-9. doi: 10.1055/s-0035-1568144. PMID: 26929748; PMCID: PMC4755769.
- Sheikh P, Rgnier C, Goron F, Salmat G. The prevalence, cha–racteristics and treatment of hemorrhoidal disease: results of an international web-based survey. J Comp Effect Res. 2020;9(17):1219-32.
- Feleshtynsky JP, Noyes AJ. Simultaneous treatment for anal fissure and hemorrhoids. Paediatric surgery (Ukraine). 2023;2(79). doi: https://doi.org/10.15574/PS.2023.79.66.
- Kashtalyan M, Shapovalov V, Yenin R, Makukha A. The first experience of surgical treatment of hemorrhoids using the wireless Doppler operating complex Trilogy HAL-RAR Unit. Kharkiv Surgical School. 2021;1:21-24. https://doi.org/10.37699/2308-7005.1.2021.04.
- Guttenplan M. The Evaluation and office management of hemorrhoids for the gastroenterologist. Curr Gastroenterol Rep. 2017 Jul;19(7):30. doi: 10.1007/s11894-017-0574-9. PMID: 28567655.
- Rubbini M, Ascanelli S, Fabbian F. Hemorrhoidal disease: is it time for a new classification? Int J Colorectal Dis. 2018 Jun;33(6):831-833. doi: 10.1007/s00384-018-3060-4. Epub 2018 Apr 28. PMID: 29705941.
- Bhatti MI, Sajid MS, Baig MK. Milligan-Morgan (Open) versus ferguson haemorrhoidectomy (closed): a systematic review and мeta-analysis of published randomized, controlled trials. World J Surg. 2016;40(6):1509-19.
- Medina-Gallardo A, Curbelo-Pea Y, De Castro X, Roura-Poch P, Roca-Closa J, De Caralt-Mestres E. Is the severe pain after Milligan-Morgan hemorrhoidectomy still currently remaining a major postoperative problem despite being one of the oldest surgical techniques described? A case series of 117 consecutive patients. Int J Surg Case Rep. 2017;30:73-75. doi: 10.1016/j.ijscr.2016.11.018. Epub 2016 Nov 15. PMID: 27960130; PMCID: PMC5153430.
- Jin J, Unasa H, Bahl P, Mauiliu-Wallis M, Svirskis D, Hill A. Can Targeting Sphincter Spasm Reduce Post-Haemorrhoidectomy Pain? A Systematic Review and Meta-Analysis. World J Surg. 2023 Feb;47(2):520-533. doi: 10.1007/s00268-022-06807-3. Epub 2022 Nov 10. PMID: 36357803; PMCID: PMC9803754.
- Zolfagharnezhad H, Khalili H, Mohammadi M, Niknam S, Vatanara A. Topical Nifedipine for the Treatment of Pressure Ulcer: A Randomized, Placebo-Controlled Clinical Trial. Am J Ther. 2021 Jan-Feb 01;28(1):e41-e51. doi: 10.1097/MJT.0000000000000936. PMID: 31241491.
- De Cassai A, Boscolo A, Tonetti T, Ban I, Ori C. Assignment of ASA-physical status relates to anesthesiologists’ experience: a survey-based national-study. Korean J Anesthesiol. 2019 Feb;72(1):53-59. doi: 10.4097/kja.d.18.00224. Epub 2018 Nov 14. PMID: 30424587; PMCID: PMC6369346.
- Grossi E, Borghi C, Cerchiari EL, Della Puppa T, Francucci B. Analogue chromatic continuous scale (ACCS): a new method for pain assessment. Clin Exp Rheumatol. 1983 Oct-Dec;1(4):337-40. PMID: 6681150.
- De Lange JS, Jacobs J, Meiring N, Moroane B, Verster T, Olorunju S, Mashola MK. Reliability and validity of the Readiness for Hospital Discharge Scale in patients with spinal cord injury. S Afr J Physiother. 2020 May 7;76(1):1400. doi: 10.4102/sajp.v76i1.1400. PMID: 32537524; PMCID: PMC7276478. https://www.marquette.edu/nursing/documents/adult-pt-rhds-short-form-english.pdf.
- Ottaiano R, Sebastiano M, Bondarenko L, Iudina O. Pharmacokinetic Characteristics of a Nifedipine and Lidocaine Fixed Combination in the Form of Rectal Cream: Two Decades Data Analysis. Innov Biosyst Bioeng [Internet]. 2021 Apr 6;5(1):27-36.
- Perrotti P, Dominici P, Grossi E, et al. Pharmacokinetics of Anorectal Nifedipine and Lidocaine (Lignocaine) Ointment following Haemorrhoidectomy. Clin. Drug Investig. 2009;29:243-256. https://doi.org/10.2165/00044011-200929040-00003.
- Perrotti P, Dominici P, Grossi E, Cerutti R, Antropoli C. Topical nifedipine with lidocaine ointment versus active control for pain after hemorrhoidectomy: results of a multicentre, prospective, rando–mized, double-blind study. Can J Surg. 2010 Feb;53(1):17-24. PMID: 20100408; PMCID: PMC2810010.
- Thomson JP, Akwary OE. Disorders of the anal canal. In: Sabiston DC Jr, ed. Textbook of surgery: the biological basis of modern surgical practice. 14th ed. Philadelphia: WB Saunders, 1991:958-72.
- Oh C. Acute thrombosed external hemorrhoids. Mt Sinai J Med. 1989;56:30-2.
- Schussman LC, Lutz LJ. Outpatient management of hemorrhoids. Primary Care. 1986;13:527-41.
- Goldberg SM, Nivatvongs S, Rothenberger DA. Colon, rectum, and anus. In: Schwartz SI, ed. Principles of surgery, 5th ed. New York: McGraw-Hill, 1989:1225-314.
- Chrysos E, Xynos E, Tzovaras G, Zoras OJ, Tsiaoussis J, Vassilakis J. Effect of nifedipine on rectoanal motility. Dis Colon Rectum. 1996;39:212-6.
- Cook TA, Brading AF, Mortensen NJ. Differences in contractile properties of anorectal smooth muscle and the effects of calcium channel blockade. Br J Surg. 1999;86:70-5.
- Cook TA, Brading AF, Mortensen NJ. Effects of nifedipine on anorectal smooth muscle in vitro. Dis Colon Rectum. 1999;42:782-7.
- Antropoli C, Perrotti P, Rubino M, et al. Nifedipine for local use in conservative treatment of anal fissures: preliminary results of a multicenter study. Dis Colon Rectum. 1999;42:1011-5.
- Cook TA, Smilgin Humphreys MM, Mortensen NJ. Oral nifedipine: educes resting anal pressure and heals chronic anal fissures. Br J Surg. 1999;86:1269-73.
- Triggle DJ. Calcium, calcium channels, and calcium channel antagonists. Can J Physiol Pharmacol. 1990;68:1474-81.
- Keighley MR, Buchmann P, Minervini S, Arabi Y, Alexander-Williams J. Prospective trials of minor surgical procedures and high-fibre diet for haemorrhoids. Br Med J. 1979;2:967-9.
- Eisenstat T, Salvati EP, Rubin RJ. The outpatient management of acute hemorrhoidal disease. Dis Colon Rectum. 1979;22:315-7.
- Muller-Lobeck H. Gradual conservative treatment of hae–morrhoids. Coloproctology. 1993;1:4-8.
- Thanapongsathorn W, Vajrabukka T. Clinical trial of oral diosmin (Daflon) in the treatment of hemorrhoids. Dis Colon Rectum. 1992;35:1085-8.
- Deutsch AA, Kaufman Z, Reiss R. Hemorrhoids: a plea for nonsurgical treatment. Isr J Med Sci. 1980;16:649-54.
- Gorfine SR. Treatment of benign anal disease with topical nitroglycerin. Dis Colon Rectum. 1995;38:453-7.
- Loder PB, Kamm MA, Nicholls RJ, Phillips RK. Reversible chemical sphincterotomy by local application of glyceryl trinitrate. BJS. 1994;81:1386-9.
- Arabi Y, Alexander-Williams J, Keighley MR. Anal pressures in hemorrhoids and anal fissure. Am J Surg. 1977;134:608-10.
- Lin JK. Anal manometric studies in hemorrhoids and anal fissures. Dis Colon Rectum. 1989;32:839-42.
- Farouk R, Duthie GS, MacGregor AB, Bartolo DC. Sustained internal sphincter hypertonia in patients with chronic anal fissure. Dis Colon Rectum. 1994;37:424-9.
- Bleday R, Pena JP, Rothenberger DA, Goldberg SM, Buls JG. Symptomatic hemorrhoids: current incidence and complications of operative therapy. Dis Colon Rectum. 1992;35:477-81.
- Hansen JB, Jorgensen SJ. Radical emergency operation for prolapsed and strangulated haemorrhoids. Acta Chir Scand. 1975;141:810-2.
- Hager T. Frequent anal and perianal disorders and their treatment. Fortschr Med. 1978;96:1584-8.
- Thomson WH. The nature of haemorrhoids. BJS. 1975;62:542-52.
- Morgado PJ, Suarez JA, Gomez LG, Morgado PJ Jr. Histoclinical basis for a new classification of hemorrhoidal disease. Dis Colon Rectum. 1988;31:474-80.
- Katoh N, Hirano S, Kishimoto S, Yasuno H. Calcium channel blockers suppress the contact hypersensitivity reaction (CHR) by inhibiting antigen transport and presentation by epidermal Langerhans cells in mice. Clin Exp Immunol. 1997;108:302-8.
- Oshiro H, Kobayashi I, Kim D, Takenaka H, Hobson RW 2nd, Duran WN. L-type calcium channel blockers modulate the microvascular hyperpermeability induced by plateletactivating factor in vivo. J Vasc Surg. 1995;22:723-39.
- Балтайтіс Ю.В., Короленко В.Б., Матюшко Р.П. Хірургічне лікування тромбозу гемороїдальних вузлів. Клін. хір. 1987. № 2. С. 13-15.
- Коплатадзе А.М., Бондарєв Ю.А., Камалов М.А. Ефективність нових методик гемороїдектомії у хворих з гострим тромбозом гемороїдальних вузлів. Хірургія. 1988. № 5. С. 125-129.
- Коплатадзе А.М., Бондарєв Ю.А., Камалов М.А. Показання та терміни проведення гемороїдектомії у хворих з гострим тромбозом гемороїдальних вузлів. Хірургія. 1989. № 2. С. 148-152.
- Коплатадзе А.М., Бондарєв Ю.А., Камалов М.А. Хірургічні методи лікування хворих на гострий тромбоз гемороїдальних вузлів. Вісн. хір. 1989. № 11. С. 140-143.
- Коротенко С.І. Раннє оперативне втручання при гострому тромбозі гемороїдальних вузлів. Клін. хір. 1980. № 7. С. 70.
- Lund JN, Scholefield JH. Aetiology and treatment of anal fissure. Br J Surg. 1996;83:1335-44.
- Schouten WR, Briel JW, Auwerda JJ, De Graaf EJ. Ischaemic nature of anal fissure. Br J Surg. 1996;83:63-5.
- Oh C, Divino CM, Steinhagen RM. Anal fissure: 20-year experience. Dis Colon Rectum. 1995;38:378-82.
- Jost WH. One hundred cases of anal fissure treated with botulin toxin: early and long-term results. Dis Colon Rectum. 1997;40:1029-32.
- Maria G, Cassetta E, Gui D, Brisinda G, Bentivoglio AR, Albanese A. A comparison of botulinum toxin and saline for the treatment of chronic anal fissure. N Engl J Med. 1998;338:217-20.
- Schouten WR, Briel JW, Boerma MO, Auwerda JJ, Wilms EB, Graatsma BH. Pathophysiological aspects and clinical outcome of intra-anal application of isosorbide dinitrate in patients with chronic anal fissure. Gut. 1996;39:465-9.
- Lund JN, Scholefield JH. A randomized, prospective, double-blind, placebo-controlled trial of glyceryl trinitrate ointment in treatment of anal fissure. Lancet. 1997;349:11-4.
- Kennedy ML, Sowter S, Nguyen H, Lubowski DZ. Glyceryl trinitrate ointment for the treatment of chronic anal fissure: results of a placebo-controlled trial and longterm follow-up. Dis Colon Rectum. 1999;42:1000-6.
- Carapeti EA, Kamm MA, Phillips RK. Topical diltiazem and betanachol decrease anal sphincter pressure and heal anal fissures without side effects. Dis Colon Rectum. 2000;43:1359-62.
- Altomare DF, Rinaldi M, Milito G, et al. Glyceryl trinitrate for chronic anal fissure-healing or headache? Results of a multicenter, randomized, placebocontrolled, double-blind trial. Dis Colon Rectum. 2000;43:174-81.
- Carapeti EA, Kamm MA, McDonald PJ, Chadwick SJ, Melville D, Phillips RK. Randomized controlled trial shows that glyceryl trinitrate heals anal fissures, higher doses are not more effective, and there is a high recurrence rate. Gut. 1999;44:727-30.
- Carapeti EA, Kamm MA, Evans BK, Phillips RK. Topical diltiazem and bethanechol decrease anal sphincter pressure without side effects. Gut. 1999;45:719-22.
- Knight JS, Birks M, Farouk R. Topical diltiazem ointment in the treatment of chronic anal fissure. Br J Surg. 2001;88:553-6.
- Perrotti P, Antropoli C, Noschese G, et al. Topical nifedipine for conservative treatment of acute haemorrhoidal thrombosis. Colorectal Dis. 2000;2:18-21.
- Perrotti P, Antropoli C, Molino D, De Stefano G, Antropoli M. Conservative treatment of acute thrombosed external hemorrhoids with topical nifedipine. Dis Colon Rectum. 2001;44:405-9.
- Nothmann BJ, Schuster MM. Internal anal sphincter derangement with anal fissure. Gastroenterology. 1974;67:216-220.
- Hancock BD. The internal sphincter and anal fissure. Br J Surg. 1977;64:92-95.
- Tranqui P, Trottier DC, Victor JC, Freeman JB. Nonsurgical treatment of chronic anal fissure: nitroglycerin and dilatation versus nifedipine and botulinum toxin. Can J Surg. 2006;49:41-45.
- Jensen SL, Lund F, Nielsen OV, Tange G. Lateral subcutaneous sphincterotomy versus anal dilatation in the treatment of fissure in ano: a prospective randomized study. Br Med J. 1984;289:528-30.
- Nyam DC, Pemberton JH. Long-term results of lateral internal sphincterotomy for chronic anal fissure with particular reference to incidence of fecal incontinence. Dis Colon Rectum. 1999;42:1306-10.
- Khubchandani IT, Reed JF. Sequelae of internal sphincte–rotomy for chronic anal fissure in ano. Br J Surg. 1989;76:431-4.
- Jost WH, Schanne S, Militz H, Schimrigk K. Perianal thrombosis following injection therapy into the external anal sphincter using botulin toxin [letter]. Dis Colon Rectum. 1995;38:781.
- Brisinda G, Maria G, Bentivoglio AR, Cassetta E, Gui D, Albanese A. A comparison of injections of botulinum toxin and topical nitroglycerin ointment for the treatment of chronic anal fissure. N Engl J Med. 1999;341:65-9.
- Jonard P, Essamri B. Diltiazem and internal anal sphincter [letter]. Lancet. 1987;1:754.
- Jonas M, Neal KR, Abercrombie JF, Scholefield JH. A randomized trial of oral vs. topical diltiazem for chronic anal fissures. Dis Colon Rectum. 2001;44:1074-8.
- Opie LH. Calcium channel antagonists in the treatment of coronary artery disease: fundamental pharmacological properties relevant to clinical use. Prog Cardiovasc Dis. 1996;38:273-90.
- Katz AM, Hager WD, Messineo FC, Pappano AJ. Cellular actions and pharmacology of the calcium-channel blockers drugs. Am J Med. 1984;77:2-10.
- Fleischmann JD, Huntley HN, Shingleton WB, Wentworth DB. Clinical and immunological response to nifedipine for the treatment of interstitial cystitis. J Urol. 1991;146:1235-9.

/50.JPG)
/51.jpg)
/51_2.jpg)
/52_2.jpg)
/53.jpg)
/54.jpg)