Журнал «Медицина неотложных состояний» Том 17, №8, 2021
Вернуться к номеру
Гемостаз та запалення у пацієнтів із політравмою
Авторы: Філик О.В., Вишинська М.Б.
Львівський національний медичний університет ім. Данила Галицького, м. Львів, Україна
Рубрики: Медицина неотложных состояний
Разделы: Клинические исследования
Версия для печати
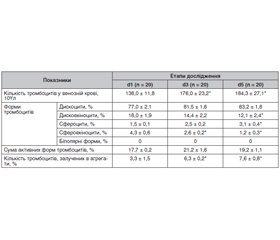
Актуальність. Причинами смерті при тяжких травмах є як ушкодження, несумісні з життям, так і тяжкі кровотечі. Коагулопатію, асоційовану з травмою, виявляють у 46 % пацієнтів уже на місці події та у 60 % пацієнтів — при надходженні на лікування. Мета: встановити наявність зв’язку між показниками загальної відповіді організму на запалення та показниками судинно-тромбоцитарного і коагуляційного гемостазу у пацієнтів з політравмою. Матеріали та методи. Проведено проспективне обсерваційне дослідження 20 пацієнтів віком від 19 до 55 років з політравмою, які перебували на лікуванні у відділенні анестезіології з ліжками інтенсивної терапії в Комунальному некомерційному підприємстві «8-ма міська клінічна лікарня м. Львова». Пацієнтів оцінювали за Injury Severity Score (ISS) та шкалою APACHE II (Acute Physiology And Chronic Health Evaluation II) з урахуванням тривалості синдрому загальної відповіді організму на запалення і лікування у відділенні інтенсивної терапії (ВІТ) та госпіталізації. Етапи дослідження: надходження на лікування у ВІТ (d1), третя доба (d3), п’ята доба (d5). Основними оцінюваними клінічними маркерами були показники: загальної відповіді організму на запалення, судинно-тромбоцитарного гемостазу (внутрішньосудинна активація тромбоцитів, агрегація тромбоцитів, індукована адреналіном і аденозиндифосфатом), коагуляційного гемостазу (міжнародне нормалізоване відношення, активований частковий тромбопластиновий час, рівень загального фібриногену та D-димерів). Результати. Встановлено наявність вірогідного (p < 0,05) позитивного кореляційного зв’язку між співвідношенням рівнів дискоехіноцитів до сфероехіноцитів та рівнем загального фібриногену на етапі d1, а також тенденцію (p = 0,09) до наявності позитивного кореляційного зв’язку між цим співвідношенням та температурою тіла пацієнта. Виявлено вірогідний (p < 0,05) зворотний кореляційний зв’язок між цим співвідношенням і рівнем тяжкості стану пацієнтів за шкалою APACHE II та прямий вірогідний (p < 0,05) кореляційний зв’язок із тривалістю госпіталізації у ВІТ, а також тенденції до зворотного кореляційного зв’язку з тяжкістю ушкоджень за шкалою ISS (p = 0,07) та до прямого кореляційного внаслідок Systemic Inflammatory Response Syndrome (SIRS) (p = 0,12). Висновки. У пацієнтів із політравмою встановлено: наявність вірогідного (p < 0,05) позитивного кореляційного зв’язку між співвідношенням дискоехіноцити/сфероехіноцити та рівнем загального фібриногену; тенденцію (p = 0,09) до позитивного кореляційного зв’язку між цим співвідношенням та температурою тіла пацієнта; вірогідний (p < 0,05) зворотний кореляційний зв’язок з рівнем тяжкості стану пацієнтів за шкалою APACHE II; прямий вірогідний (p < 0,05) кореляційний зв’язок з тривалістю госпіталізації у ВІТ; тенденцію (p = 0,07) до зворотного кореляційного зв’язку з тяжкістю ушкоджень за шкалою ISS та тенденцію (p = 0,12) до прямого кореляційного зв’язку з тривалістю SIRS.
Background. Causes of death due to severe injuries are both injuries incompatible with life and severe bleedings. Trauma-induced coagulopathy is usually found in 46 % of patients at the scene and in 60 % of individuals upon admission to the hospital. The purpose of the study was to establish the relationship between systemic inflammatory response syndrome (SIRS) and vascular-platelet and coagulation hemostasis parameters in patients with polytrauma. Materials and methods. We completed a prospective observational study and included 20 patients aged 19 to 55 years with polytrauma who were admitted to the Department of Anesthesiology with Intensive Care at Lviv City Clinical Hospital No. 8. Patients’ state was evaluated according to the Injury Severity Score (ISS) and Acute Physiology and Chronic Health Evaluation (APACHE II) score. We also took into account the duration of SIRS, the length of intensive care unit (ICU) stay, and hospital stay. Stages of the study: the day of admission to ICU (d1), the third day (d3), the fifth day (d5). The major clinical markers evaluated were: SIRS parameters, vascular-platelet hemostasis (intravascular platelet activation, adrenaline- and adenosine diphosphate-induced platelet aggregation), coagulation hemostasis (international normalized ratio, activated partial thromboplastin time, level of total fibrinogen and D-dimers). Statistical analysis was performed using variation statistics methods. The correlation dependence was performed with Spearman’s rank correlation coefficient. We determined significance level (p), and the differences were considered statistically significant at p < 0.05. Results. We have found a significant (p < 0.05) positive correlation between discocytes to spherocytes ratio and the level of total fibrinogen on stage d1, as well as a tendency (p = 0.09) to the presence of a positive correlation between this ratio and the patient’s body temperature. There was a significant (p < 0.05) inverse correlation between this ratio and the patient’s health status according to APACHE II, and a direct significant (p < 0.05) correlation with the length of ICU stay, as well as trends to an inverse correlation with the severity of injuries according to ISS (p = 0.07) and to a direct correlation with the duration of SIRS (p = 0.12). Conclusions. Patients with polytrauma had a significant (p < 0.05) positive correlation between the discocytes to spherocytes ratio and level of total fibrinogen, a tendency (p = 0.09) to a positive correlation between this ratio and the patient’s body temperature, a significant (p < 0.05) inverse correlation with the patient’s health status according to APACHE II, a direct significant (p < 0.05) correlation with the length of ICU stay, a trend (p = 0.07) to an inverse correlation with the severity of injuries according to ISS and a tendency (p = 0.12) to a direct correlation with duration of SIRS.
політравма; гемостаз; запалення; дискоехіноцити; сфероехіноцити
polytrauma; hemostasis; inflammation; discocytes; spherocytes
Вступ
Матеріали та методи
Результати та обговорення
Висновки
- Injury prevention and trauma care. Health Emergency and Disaster risk management fact sheets. December 2017. https://cdn.who.int/media/docs/default-source/disaster-mngmt/risk-management-injuries-december2017.pdf?sfvrsn = 34d5d5ce_1&download = true
- Floccard B., Rugeri L., Faure A. et al. Early coagulopathy in trauma patients: an on-scene and hospital admission study. Injury. 2012. 43. 26-32.
- Shakur H., Roberts I., Bautista R. et al. CRASH-2 trial collaborators. Effects of tranexamic acid on death, vascular occlusive events, and blood transfusion in trauma patients with significant haemorrhage (CRASH-2): a randomised, placebo-controlled trial. Lancet. 2010. 376. 23-32.
- Gauss T., Campion S., Kerever S., Eurin M., Raux M., Harrois A. & Hamada S. Fibrinogen on Admission in Trauma score. European journal of anaesthesiology. 2018. 35(1). 25-32.
- Moore E.E., Moore H.B., Kornblith L.Z., Neal M.D., Hoffman M., Mutch N.J., Schöchl H., Hunt B.J. & Sauaia A. Trauma-induced coagulopathy. Nature reviews. Disease primers. 2021. 7(1). 30. https://doi.org/10.1038/s41572-021-00264-3
- Sang Y., Roest M., de Laat B., de Groot P.G. & Huskens D. Interplay between platelets and coagulation. Blood reviews. 2021. 46. 100733. https://doi.org/10.1016/j.blre.2020.100733
- Henriksen H.H., Grand A.G., Viggers S., Baer L.A., Solbeck S., Cotton B.A., Matijevic N., Ostrowski S.R., Stensballe J., Fox E.E., Chen T.A., Holcomb J.B., Johansson P.I., Cardenas J.C. & Wade C.E. Impact of blood products on platelet function in patients with traumatic injuries: a translational study. The Journal of surgical research. 2017. 214. 154-161. https://doi.org/10.1016/j.jss.2017.02.037
- Britten M.W., Lümers L., Tominaga K., Peters J. & Dirkmann D. Glycocalyx components affect platelet function, whole blood coagulation, and fibrinolysis: an in vitro study suggesting a link to trauma-induced coagulopathy. BMC anesthesiology. 2021. 21(1). 83. https://doi.org/10.1186/s12871-021-01300-1
- Spahn D.R., Bouillon B., Cerny V., Duranteau J., Filipescu D., Hunt B.J. & Rossaint R. The European guideline on management of major bleeding and coagulopathy following trauma. Critical care. 2019. 23(1). 1-74.
- Torres C. & Haut E.R. Prevention, diagnosis, and management of venous thromboembolism in the critically ill surgical and trauma patient. Current opinion in critical care. 2020. 26(6). 640-647.
- Savioli G., Ceresa I.F., Caneva L., Gerosa S. & Ricevuti G. Trauma-Induced Coagulopathy: Overview of an Emerging Medical Problem from Pathophysiology to Outcomes. Medicines (Basel, Switzerland). 2021. 8(4). 16. https://doi.org/10.3390/medicines8040016
- Peralta R., Al Thani H. & Rizoli S. Coagulopathy in the surgical patient: trauma-induced and drug-induced coagulopathies. Current opinion in critical care. 2019. 25(6). 668-674.
- Frith D. & Brohi K. The pathophysiology of trauma-induced coagulopathy. Current opinion in critical care. 2012. 18(6). 631-636.
- Kornblith L.Z., Moore H.B. & Cohen M.J. Trauma-induced coagulopathy: The past, present, and future. Journal of thrombosis and haemostasis. 2019. 17(6). 852-862. https://doi.org/10.1111/jth.14450
- Margetic S. Inflammation and haemostasis. Biochemia me-dica. 2012. 22(1). 49-62.
- Foley J.H. & Conway E.M. Cross talk pathways between coagulation and inflammation. Circulation research. 2016. 118(9). 1392-1408.
- Pertseva T.O., Tverdokhlib I.V. & Chub D.I. Кількісна морфологічна характеристика тромбоцитарного гемостазу у хворих на цукровий діабет 1 та 2 типу в залежності від швидкості клубочкової фільтрації. Morphologia. 2018. 12(4). 64-72.
- Weisel J.W. & Litvinov R.I. Red blood cells: the forgotten player in hemostasis and thrombosis. Journal of Thrombosis and Haemostasis. 2019. 17(2). 271-282.

/74.jpg)
/75.jpg)
/76.jpg)