Журнал «Медицина неотложных состояний» Том 17, №5, 2021
Вернуться к номеру
Фактори ризику тромбоемболічних ускладнень у пацієнток із підвищеним індексом маси тіла в періопераційному періоді лапароскопічної міомектомії
Авторы: Максимець Т.О.
Одеський національний медичний університет, м. Одеса, Україна
Медичний центр «Мати та дитина» ТОВ «Неомед 2007», м. Київ, Україна
Рубрики: Медицина неотложных состояний
Разделы: Клинические исследования
Версия для печати
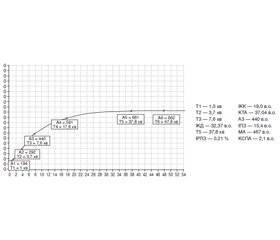
Актуальність. Міома матки — одне з найпоширеніших захворювань у гінекологічний практиці та становить, за даними різних авторів, від 32 до 70 %. У 80 % випадків міома спостерігається у жінок репродуктивного віку. Одним з основних методів хірургічного лікування міоми матки у жінок репродуктивного віку є лапароскопічна міомектомія. Велика кількість переваг даного методу хірургічного лікування призводить в багатьох випадках до недооцінки наявного ризику, такого як тромбонебезпека у жінок із підвищеним індексом маси тіла (ІМТ). Мета даного дослідження — виявлення стану тромбонебезпеки для проведення адекватної комплексної тромбопрофілактики пацієнток із підвищеним індексом маси тіла в періопераційному періоді при лапароскопічній міомектомії, використовуючи інструментальний метод діагностики — низькочастотний п’єзоелектричний гемовіскозиметр. Матеріали та методи. Пацієнтки 30–45 років, які підлягають лапароскопічній міомектомії (n = 60). Пацієнтки були розподілені на 3 групи залежно від величини індексу маси тіла та вибору методу тромбопрофілактики. До 1-ї групи (16 пацієнток) увійшли хворі з ІМТ < 30 кг/м2, яким медикаментозна тромбопрофілактика не проводилась. До 2-ї групи (18 пацієнток) увійшли хворі з ІМТ > 30 кг/м2, які з метою тромбопрофілактики отримували еноксапарин в дозі 2000 анти-Ха МО/0,2 мл підшкірно (при ІМТ 30–40 кг/м2) та 4000 анти-Ха МО/0,4 мл підшкірно (при ІМТ > 40 кг/м2). До 3-ї групи (26 пацієнток) увійшли хворі з ІМТ > 30 кг/м2, які з метою тромбопрофілактики отримували еноксапарин та пентоксифілін. Результати. За даними низькочастотного вібраційного п’єзоелектричного гемовіскозиметра були виявлені статистично вірогідні (р < 0,05) відхилення від референтних величин показників гемостазіограми в бік структурної (збільшення показника максимальної щільності згустка (МА)) та хронометричної (прискорення часу утворення фібрин-тромбоцитарної структури згустка (Т5), зміщення точки желювання (Т3) вліво, підвищення показника інтенсивності коагуляційного драйву (ІКД)) гіперкоагуляції, підвищення тромбінової активності (підйом показника константи тромбінової активності (КТА), скорочення часу досягнення константи тромбіну (Т2)), активації судинно-тромбоцитарної ланки гемостазу (скорочення періоду початку реакції (Т1), збільшення показника інтенсивності контактної коагуляції (ІКК)), пригнічення літичної активності (зниження показника інтенсивності лізису та ретракції згустка) крові в 2-й і 3-й групах пацієнтів. На першу добу після оперативного втручання в 2-й і 3-й групах відмічається вірогідне збільшення (порівняно з доопераційними показниками) таких хронометричних показників, як Т1, Т2, Т5; зниження структурного показника МА, а також вірогідне зниження КТА, ІКД, що підтверджує ефективність антитромботичної терапії. Однак у 2-й групі спостерігається підвищена активність судинно-тромбоцитарної ланки гемостазу порівняно з 3-ю групою, вищий показник ІКК, коротший час Т1, Т2, а також вищий показник КТА. На 5-ту добу після оперативного втручання в усіх групах пацієнтів відмічався нормокоагуляційний тренд гемостатичного потенціалу. Висновки. Використання низькочастотної п’єзоелектричної гемовіскозиметрії дозволяє вірогідно та швидко оцінити кінетику тромбоутворення.
Background. Uterine fibroid is one of the most common diseases in gynaecological practice accounting from 32 to 70 % according to various authors. In 80 % of cases, fibroids are observed in women of reproductive age. Laparoscopic myomectomy is one of the main methods of surgical treatment for uterine fibroids in women of reproductive age. A large number of advantages of this method of surgical treatment in many cases lead to underestimation of the existing risks such as the risk of thrombosis in women with elevated body mass index (BMI). The purpose of this study is to detect the risk of thrombosis in adequate comprehensive thromboprophylaxis of patients with elevated BMI in the perioperative period of laparoscopic myomectomy using an instrumental method of diagnosis such as low-frequency piezoelectric blood viscometer. Materials and methods. Patients aged 30–45 years undergoing laparoscopic myomectomy (n = 60) were examined. They were divided into 3 groups depending on the BMI and thromboprophylaxis method. Group 1 (n = 16) included women with the BMI < 30 kg/m2, who did not receive thromboprophylaxis. Group 2 (n = 18) consisted of patients with the BMI > 30 kg/m2, who were treated with enoxaparin thromboprophylaxis at a dose of 2,000 anti-Xa IU/0.2 ml subcutaneously (at the BMI of 30–40 kg/m2) and 4,000 anti-Xa IU/0.4 ml subcutaneously (at the BMI > 40 kg/m2). Third group (n = 26) included individuals with the BMI > 30 kg/m2 who received enoxaparin and pentoxifylline for thromboprophylaxis. Results. The low-frequency piezoelectric blood viscometry revealed statistically significant (p < 0.05) deviations from the reference values of the coagulogram towards structural (increased maximum clot density) and chronometric hypercoagulation (acceleration of the time of formation of fibrin-platelet structure T5, shift of the blood clotting time T3 to the left, an increase in the intensity of coagulation drive), elevated thrombin activity (an increase in the constant of thrombin activity, a decrease in T2 time), activation of vascular-platelet hemostasis (reduced period of T1 reaction onset, increased intensity of contact coagulation), inhibition of the lytic activity (a decrease in the intensity of retraction and lysis of the clot) in groups 2 and 3. On the first day after surgery in groups 2 and 3, there was a significant increase (compared to preoperative indicators) in the chronometric indicators such as T1, T2 and T5; a decrease in the structural indicator of maximum clot density, as well as a significant decrease in the constant of thrombin activity, intensity of contact coagulation, which confirms the effectiveness of antithrombotic therapy. However, group 2 reported an increase in the activity of vascular-platelet hemostasis, higher intensity of contact coagulation compared to group 3, shorter T1 and T2 time, and the constant of thrombin activity was higher. On the 5th day after surgery, a normocoagulation trend of hemostatic potential was observed in all groups of patients. Conclusions. The use of low-frequency piezoelectric blood viscometry allows reliably and quickly assessing the kinetics of thrombosis formation.
міома матки; індекс маси тіла; фактори ризику; лапароскопія; тромбонебезпека; тромбопрофілактика
uterine fibroid; body mass index; risk factors; laparoscopy; risk of thrombosis; thromboprophylaxis
Вступ
Матеріали та методи
Результати та обговорення
Висновки
- Адамян Л.В., Зарубиани З.Р., Киселев С.И. Лапароскопия и гистерорезектоскопия в хирургическом лечении миомы матки у женщин детородного возраста. Акушерство и гинекология. 2014. № 3. С. 40-44.
- Parker W.H. Etiology, symptomatology, and diagnosis of uterine myomas. Fertil. Steril. 2015. Vol. 87. Р. 725-736.
- Cullen D.J., Coyle J.P., Teplick R., Long M.C. Cardiovascular, pulmonary, and renal effects of massively increased intra-abdominal pressure in critically ill patients. Crit. Care Med. 1989. Vol. 17(2). Р. 118-121. doi: 10.1097/00003246-198902000-00002.
- Jamal M.H., Corcelles R., Shimizu H. et al. Thromboembolic events in bariatric surgery: a large multiinstitutional referral center experience. Surg. Endosc. 2015. Vol. 29. Р. 376-380.
- Bartlett M.A., Mauck K.F., Daniels P.R. Prevention of venous thromboembolism in patients undergoing bariatric surgery. Vasc. Health Risk. Manag. 2015. Vol. 11. Р. 461-477. doi: 10.2147/VHRM.S73799.
- Козаченко А.В. Особенности эстрогенного статуса и содержания рецепторов эстрогенов и прогестерона у больных миомой матки. Тез. докл. форума «Пути развития современной гинекологии». 2015.
- Спиридонова Н.В., Басина Е.И. Клинико-прогностические аспекты содержания аутоантител к TRM-03 у пациенток с миомой матки репродуктивного возраста. Практическая медицина. 2016. № 1(93). С. 85-90.
- Винокурова Е.А. Влияние оперативного лечения на гемокоагуляцию у больных раком и миомой тела матки. Российский вестник акушера-гинеколога. 2008. Т. 8. № 1. С. 8-12.
- Robertson D., Lefebvere G., Leyland N. et al. Adhesion prevention in gynaecological surgery. Journal of obstetrics and gynaecology Canada. 2010. Vol. 32. № 6. Р. 598-608.
- Давыдов А.И., Чочаева Е.М., Пашков В.М., Лебедев В.А. и др. Предоперационная подготовка больных миомой матки: целесообразность и эффективность. Вопросы гинекологии, акушерства и перинатологии. 2015. № 14(6). С. 54-60.
- Буриков М.А., Сказкин И.В., Шульгин О.В., Кинякин А.И., Сокиренко И.А., Волкова Н.В. Особенности профилактики интраоперационных тромбоэмболических осложнений у пациентов с морбидным ожирением. Клиническая практика. 2018. Т. 9. № 3. С. 44-47.
- Тарабрін О.О., Сажин Д.С., Сухонос Р.Є., Володичев Д.С., Потапчук Ю.О., Суслов О.С., Тарабрін П.О. Порівняння інструментальних методів дослідження гемостазу. Клінічна анестезіологія та інтенсивна терапія. 2018. № 1. С. 23-28.
- Тарабрин О.А. Нарушения системы гемостаза у онкологических больных. Онкогинекология. 2015. № 3. С. 48-56.
- Удут В.В., Тютрін І.І., Тарабрін О.О., Тарабрін П.О. Низькочастотна п’єзотромбоеластографія цільної крові (алгоритми діагностики та корекції гемостазіологічних розладів). 2018. С. 9-58.
- Хоробрых О.С. Проблемы оказания анестезиологических пособий у пациенток с ожирением в акушерстве. Здравоохранение Югры: опыт и инновации. 2018. № 4. С. 41-45.
- Клигуненко О.М., Кріштафор Д.А. Тромбопрофилактика при ожирении: обзор современных рекомендаций. Український медичний часопис. 2019. № 3(2). С. 8-11. DOI: 10.32471/umj.1680-3051.131.157638.

/103.jpg)
/103_2.jpg)
/104.jpg)