Журнал «Медицина неотложных состояний» Том 16, №8, 2020
Вернуться к номеру
Периоперационный менеджмент антитромботических препаратов
Авторы: Тарасенко С.А.(1, 2), Дубров С.А.(1, 2), Суслов Г.Г.(1, 2), Мазниченко В.А.(1, 2)
(1) — Национальный медицинский университет им. А.А. Богомольца, г. Киев, Украина
(2) — Киевская городская клиническая больница № 17, г. Киев, Украина
Рубрики: Медицина неотложных состояний
Разделы: Справочник специалиста
Версия для печати
На базі аналізу мультидисциплінарних рекомендацій останніх років із Франції, Італії, Іспанії, Великої Британії, США, Польщі, рекомендацій Європейської асоціації анестезіологів, Американського коледжу торакальних лікарів та інших світових професійних лікарських спілок систематизовані дані щодо менеджменту прямих та непрямих антикоагулянтів, включаючи нові оральні антикоагулянти, антитромбоцитарних препаратів у періопераційному періоді для запобігання підвищеній кровоточивості та мінімізації тромбоемболічних ускладнень після інвазивних процедур. Також проаналізовано режими відміни та відновлення антитромботичної терапії при виконанні нейроаксіальних блокад, при виконанні як оперативних, так і діагностичних втручань у пацієнтів, які перенесли судинну катастрофу. Наведені алгоритми для зручного сприйняття інформації та запам’ятовування.
На базе анализа мультидисциплинарных рекомендаций последних лет из Франции, Италии, Испании, Великобритании, США, Польши, рекомендаций Европейского общества анестезиологов, Американского колледжа торакальных врачей и других мировых профессиональных организаций систематизированы данные по менеджменту прямых и непрямых антикоагулянтов, включая новые пероральные антикоагулянты, антитромбоцитарных препаратов в периоперационном периоде для предотвращения повышенной кровоточивости и минимизации тромбоэмболических осложнений после инвазивных процедур. Также проанализированы режимы отмены и восстановления антитромботической терапии при выполнении нейроаксиальных процедур, при выполнении как оперативных, так и диагностических вмешательств у пациентов, перенесших сосудистую катастрофу. Приведены алгоритмы для удобного восприятия информации и запоминания.
Based on the analysis of recent multidisciplinary recommendations from France, Italy, Spain, Great Britain, USA, Poland, the guidelines of the European Society of Anesthesiology and Intensive Care, the American College of Chest Physicians, etc. and other world professional organizations, data were systematized on the use of direct and indirect anticoagulants, including new oral anticoagulants, antiplatelet agents, in the perioperative period to prevent increased bleeding and minimize thromboembolic complications after invasive procedures. We have also analyzed the regimens of discontinuation and reinitiation of antithrombotic therapy when performing neuraxial procedures, both surgical and diagnostic interventions in patients after a vascular accident. Algorithms for convenient information perception and memorization are presented.
гепарини; антитромбоцитарні препарати; антагоністи вітаміну К; нові оральні антикоагулянти; пері-операційний менеджмент
гепарины; антитромбоцитарные препараты; антагонисты витамина К; новые оральные антикоагулянты; периоперационный менеджмент
heparins; antiplatelet agents; vitamin K antagonists; new oral anticoagulants; perioperative management
Введение
Предоперационная оценка риска тромбоэмболических и геморрагических осложнений
1. Оценка риска кровотечения
2. Оценка риска тромбоэмболических осложнений
Периоперационный менеджмент антикоагулянтных и противотромбоцитных препаратов
3. Периоперационный менеджмент антагонистов витамина К
/125_2.jpg)
/125_3.jpg)
4. Периоперационный менеджмент новых оральных антикоагулянтов
/128.jpg)
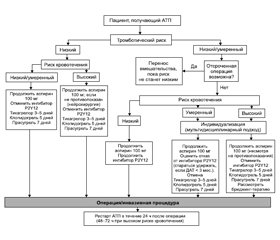
5. Периоперационный менеджмент противотромбоцитных препаратов
6. Периоперационный менеджмент антикоагулянтных и противотромбоцитных препаратов для пациентов, нуждающихся в нейроаксиальных процедурах
Нестероидные противовоспалительные препараты и аспирин
Выводы
- Baron T.H., Kamath P.S., McBane R.D. Management of antithrombotic therapy in patients undergoing invasive procedures. N. Engl. J. Med. 2013. 368. 2113-24. DOI: 10.1056/NEJMra1206531
- Vivas D., Roldán I., Ferrandis R., Marín F., Roldán V., Tello-Montoliu A., Ruiz-Nodar J.M., Gómez-Doblas J.J., Martín A., Llau J.V., Ramos-Gallo M.J., Muñoz R., Arcelus J.I., Leyva F., Alberca F., Oliva R., Gómez A.M., Montero C., Arikan F., Ley L., Santos-Bueso E., Figuero E., Bujaldón A., Urbano J., Otero R., Hermida J.F., Egocheaga I., Llisterri J.L., Lobos J.M., Serrano A., Madridano O., Ferreiro J.L. Expert reviewers. Perioperative and Periprocedural Management of Antithrombotic Therapy: Consensus Document of SEC, SEDAR, SEACV, SECTCV, AEC, SECPRE, SEPD, SEGO, SEHH, SETH, SEMERGEN, SEMFYC, SEMG, SEMICYUC, SEMI, SEMES, SEPAR, SENEC, SEO, SEPA, SERVEI, SECOT and AEU. Rev. Esp. Cardiol. (Engl. Ed.). 2018 Jul. 71 (7). 553-564. English, Spanish. doi: 10.1016/j.rec.2018.01.029.
- Clinical Excellence Commission, 2018, Guidelines on Perioperative Management of Anticoagulant and Antiplatelet Agents are available at: https://www.cec.health.nsw.gov.au/__data/assets/pdf_file/0006/458988/Guidelines-on-perioperative-management-of-anticoagulant-and-antiplatelet-agents.pdf (last rewieved november 2020)
- Глумчер Ф.С. и др. Тромбоэмболия легочной артерии. Киев: Издатель Заславский А.Ю., 2016. 523 с.
- Manchikanti L., Falco F.J., Benyamin R.M., Caraway D.L., Kaye A.D., Helm S. 2nd, Wargo B.W., Hansen H., Parr A.T., Singh V., Swicegood J.R., Smith H.S., Schultz D.M., Malla Y., Hirsch J.A. Assessment of bleeding risk of interventional techniques: a best evidence synthesis of practice patterns and perioperative management of anticoagulant and antithrombotic therapy. Pain Physician. 2013 Apr. 16 (2 suppl.). SE261-318. PMID: 23615893.
- Godier A., Fontana P., Motte S., Steib A., Bonhomme F., Schlumber-ger S., Lecompte T., Rosencher N., Susen S., Vincentelli A., Gruel Y., Albaladejo P., Collet J.P., members of the French Working Group on perioperative haemostasis (GIHP). Management of antiplatelet therapy in patients undergoing elective invasive procedures. Proposals from the French Working Group on perioperative haemostasis (GIHP) and the French Study Group on thrombosis and haemostasis (GFHT). In collaboration with the French Society for Anaesthesia and Intensive Care Medicine (SFAR). Anaesth. Crit. Care Pain. Med. 2018 Aug. 37 (4). 379-389. doi: 10.1016/j.accpm.2017.12.012. Epub. 2018 Jan. 5. PMID: 29309950.
- Беляев А.В. Связующая (бриджинг) терапия антикоагулянтами в анестезиологии и интенсивной терапии: Руководство. 2-е изд., перераб. и доп. К.: КИМ, 2014. 95 с.
- Keeling D., Tait R.C., Watson H. Perioperative management of anticoagulation and antiplatelet therapy. Br. J. Haematol. 175. 602-613. https://doi.org/10.1111/bjh.14344.
- Spyropoulos A.C., Al-Badri A., Sherwood M.W., Douketis J.D. Periprocedural management of patients receiving a vitamin K antagonist or a direct oral anticoagulant requiring an elective procedure or surgery. Journal of Thrombosis and Haemostasis. 2016. 14. 875-85.
- Sticherling C., Marin F., Birnie D., Boriani G., Calkins H., Dan G.A. et al. Antithrombotic management in patients undergoing electrophysiological procedures: a European Heart Rhythm Association (EHRA) position document endorsed by the ESC Working Group Thrombosis, Heart Rhythm Society (HRS), and Asia Pacific Heart Rhythm Society (APHRS). Europace. 2015. 17. 1197-214.
- Douketis J.D., Spyropoulos A.C., Kaatz S., Becker R.C., Caprini J.A., Dunn A.S., Garcia D.A., Jacobson A., Jaffer A.K., Kong D.F., Schulman S., Turpie A.G., Hasselblad V. & Ortel T.L. Perioperative bridging anticoagulation in patients with atrial fibrillation. New England Journal of Medicine. 2015. 373. 823-833.
- American College of Cardiology/American Heart Association. 2014 AHA/ACC/HRS Guideline for the Management of Patients With Atrial Fibrillation. Journal of the American College of Cardiology. 2014. 64 (21).
- Douketis J., Spyropolous A.C., Spencer F.A., Mayr M., Jaffer A.K., Eckman M.H. et al. Perioperative management of antithrombotic therapy. Antithrombotic therapy and prevention of thrombosis, 9th ed: American College of Chest Physicians. Evidence-based clinical practice guidelines. Chest. 2012. 141 (2 Ssuppl.). e326S-e50S.
- Tran H.A., Chunilal S.D., Harper P.L., Tran H., Wood E.M., Gallus A.S. An update on concensus guidelines for warfarin reversal. The Medical Journal of Australia. 2013. 198 (4).
- Eijgenraam P., Ten Cate H. & Ten Cate-Hoek A. Safety and efficacy of bridging with low molecular weight heparins: a systematic review. Journal of Thrombosis and Haemostasis. 2013. 11. 13.
- Kozek-Langenecker S.A., Ahmed A.B., Afshari A. et al. Management of severe perioperative bleeding: guidelines from the European Society of Anaesthesiology. First update 2016. Eur. J. Anesthesiol. 2017. 34. 332-395. First update 2016. Eur. J. Anaesthesiol. 2017 Jun. 34 (6). 332-395. doi: 10.1097/EJA.0000000000000630.
- Essebag V., Healey J.S., Ayala-Paredes F., Kalfon E., Coutu B., Nery P. et al. Strategy of continued vs interrupted novel oral anticoagulant at time of device surgery in patients with moderate to high risk of arterial thromboembolic events: The BRUISE CONTROL-2 trial. American Heart Journal. 2016. 173. 102-7. 4.
- Healey J.S., Eikelboom J., Douketis J., Wallentin L., Oldgren J., Yang S., Themeles E., Heidbuchel H., Avezum A., Reilly P., Connolly S.J., Yusuf S. & Ezekowitz M. Periprocedural bleeding and thromboembolic events with dabigatran compared with warfarin: results from the Randomized Evaluation of Long-Term Anticoagulation Therapy (RE-LY) randomized trial. Circulation. 2012. 126. 343-348.
- Lai A., Davidson N., Galloway S.W. & Thachil J. Periope-rative management of patients on new oral anticoagulants. [Erratum appears in Br. J. Surg. 2014 Nov. 101 (12). 1624]. British Journal of Surgery. 2014. 101. 742-749.
- Kitchen S., Gray E., Mackie I., Baglin T. & Makris M. Measurement of non-coumarin anticoagulants and their effects on tests of Haemostasis: Guidance from the British Committee for Standards in Haematology. British Journal of Haematology. 2014. 166. 830-841.
- Heidbuchel H., Verhamme P., Alings M., Antz M., Diener H.C., Hacke W., Oldgren J., Sinnaeve P., Camm A.J. & Kirchhof P. Updated European Heart Rhythm Association Practical Guide on the use of non-vitamin K antagonist anticoagulants in patients with nonvalvular atrial fibrillation. Europace. 2015. 17. 1467-150
- CAPRIE Steering Committee. A randomised, blinded, trial of clopidogrel versus aspirin in patients at risk of ischaemic events (CAPRIE). CAPRIE Steering Committee. Lancet. 1996. 348. 1329-39.
- Singla S., Sachdeva R. & Uretsky B.F. The risk of adverse cardiac and bleeding events following noncardiac surgery relative to antiplatelet therapy in patients with prior percutaneous coronary intervention. Journal of the American College of Cardiology. 2012. 60. 2005-2016.
- Smith P.K., Goodnough L.T., Levy J.H., Poston R.S., Short M.A., Weerakkody G.J. & Lenarz L.A. Mortality benefit with prasugrel in the TRITON-TIMI 38 coronary artery bypass grafting cohort: risk-adjusted retrospective data analysis. Journal of the American College of Cardiology. 2012. 60. 388-396.
- Soo C.G., Torre P.K., Yolland T.J. & Shatwell M.A. Clopidogrel and hip fractures, is it safe? A systematic review and meta-analysis. BMC Musculoskeletal Disorders. 2016. 17. 136
- Godier A., Fontana P., Motte S., Steib A., Bonhomme F., Schlumberger S., Lecompte T., Rosencher N., Susen S., Vincentelli A., Gruel Y., Albaladejo P., Collet J.P. Members of the French Wor-king Group on perioperative haemostasis (GIHP). Management of antiplatelet therapy in patients undergoing elective invasive procedures. Proposals from the French Working Group on perioperative haemostasis (GIHP) and the French Study Group on thrombosis and haemostasis (GFHT). In collaboration with the French Society for Anaesthesia and Intensive Care Medicine (SFAR). Anaesth. Crit. Care Pain Med. 2018 Aug. 37 (4). 379-389. doi: 10.1016/j.accpm.2017.12.012. Epub 2018 Jan 5. PMID: 29309950.
- Rossini R., Musumeci G., Capodanno D., Lettieri, C., Limbruno U., Tarantini G., Russo N., Calabria P., Romano M., Inashvili A., Sirbu V., Guagliumi G., Valsecchi O., Senni M., Gavazzi A. & Angiolillo D.J. Periopera tive management of oral antiplate let therapy and clinical outcom es in coronary stent patients undergoing surgery: results of a multicent re registry. Thrombosis and Haemostasis. 2015. 113. 272-282
- Cardiac Society of Australia and New Zealand. Guidelines for the management of antiplatelet therapy in patients with coronary stents undergoing non-cardiac surgery. Heart Lung Circ. 2010 Jan. 19 (1). 2-10. doi: 10.1016/j.hlc.2009.10.008. Epub. 2009 Dec. 31. PMID: 20045378.
- Mehran R., Baber U., Steg P.G., Ariti C., Weisz G., Witzenbichler B., Henry T.D., Kini A.S., Stuckey T., Cohen D.J., Berger P.B., Iakovou I., Dangas G., Waksman R., Antoniucci D., Sartori S., Krucoff M.W., Hermiller J.B., Shawl F., Gibson C.M., Chieffo A., Alu M., Moliterno D.J., Colombo A., Pocock S. Cessation of dual antiplatelet treatment and cardiac events after percutaneous coronary intervention (PARIS): 2 year results from a prospective observational study. Lancet. 2013 Nov. 23. 382 (9906). 1714-22. doi: 10.1016/S0140-6736 (13)61720-1. Epub. 2013 Sep. 1. PMID: 24004642.
- Malec-Milewska M. i in. Protokoły w anestezjologii i intensywnej terapii. Pod redacją naukową prof. M. Malec-Milewska. Lublin: Makmed. 2018. 792 s.
- Abualsaud A.O., Eisenberg M.J. Perioperative management of patients with drug-eluting stents. J. Am. Coll. Cardiol. Interv. 2010. № 3. Р. 131-142.
- Alshawabkeh L.I., Prasad A., Lenkovsky F. et al. Outcomes of a preoperative ‘‘bridging’’ strategy with glycoprotein IIb/IIIa inhibitors to prevent perioperative stent thrombosis in patients with drugeluting stents who undergo surgery necessitating interruption of thieno-pyridine administration. EuroIntervention. 2013. 9. 204-211.
- Mantz J., Samama C.M., Tubach F. et al. Impact of preoperative maintenance or interruption of aspirin on thrombotic and bleeding events after elective noncardiac surgery: the multicenter, randomized, blinded, placebo-controlled, STRATAGEM trial. Br. J. Anaesth. 2011. 107. 899-910.
- Кучин Ю.Л., Тарасенко С.А. Региональная анестезия у пациентов с травмой: проблемы антикоагулянтной и дезагрегантной терапии. Травма. 2011. № 1 (12). С. 103-110.
- Horlocker T.T., Vandermeuelen E., Kopp S.L., Gogarten W., Leffert L.R., Benzon H.T. Regional Anesthesia in the Patient Recei-ving Antithrombotic or Thrombolytic Therapy: American Society of Regional Anesthesia and Pain Medicine Evidence-Based Guidelines (Fourth Edition). Reg. Anesth. Pain Med. 2018 Apr. 43 (3). 263-309. doi: 10.1097/AAP.0000000000000763.
- Levy J.H., Faraoni D., Spring J.L., Douketis J.D., Samama C.M. Managing new oral anticoagulants in the perioperative and intensive care unit setting. Anesthesiology. 2013. 118 (6). 1466-74.
- Nair A.S., & Rayani B.K. New anticoagulants and antiplatelet agents in perioperative period: Recommendations and controversies! Indian journal of anaesthesia. 2017. 61 (5). 448-449. https://doi.org/10.4103/ija.IJA_252_17
- Benzon H.T., Avram M.J., Green D., Bonow R.O. New oral anticoagulants and regional anaesthesia. British Journal of Anaesthesia. 2013 Dec. Vol. 111 (suppl. 1). P. 96-113. https://doi.org/10.1093/bja/aet401
- Narouze S., Benzon H.T., Provenzano D.A., Buvanendran A., De Andres J., Deer T.R. et al. Interventional spine and pain procedures in patients on antiplatelet and anticoagulant medications: Guidelines from the American Society of Regional Anesthesia and Pain Medicine, the European Society of Regional Anaesthesia and Pain Therapy, the American Academy of Pain Medicine, the International Neuromodulation Society, the North American Neuromodulation Society, and the World Institute of Pain. Reg. Anesth. Pain Med. 2015. 40. 182-212.

/123.jpg)
/124.jpg)
/125.jpg)
/126.jpg)
/126_2.jpg)
/127.jpg)
/129.jpg)
/130.jpg)
/130_2.jpg)
/131.jpg)
/132.jpg)