Журнал «Медицина неотложных состояний» Том 16, №5, 2020
Вернуться к номеру
Токсикологія кумаринів: огляд літератури й аналіз випадку отруєння похідними 4-гідроксикумарину
Авторы: Маркова С.О.(1), Курділь Н.В.(2), Зінов’єва М.Л.(2), Студзинська Я.В.(1), Ващенко Л.К.(1), Пісоченко К.В.(1), Зацаринська О.І.(1), Прийма Т.В.(1)
(1) — Міська лікарня швидкої медичної допомоги, м. Миколаїв, Україна
(2) — ДП «Науковий центр превентивної токсикології, харчової та хімічної безпеки імені академіка Л.І. Медведя Міністерства охорони здоров’я України», м. Київ, Україна
Рубрики: Медицина неотложных состояний
Разделы: Справочник специалиста
Версия для печати
Актуальність. Широке застосування антикоагулянтних родентицидів на основі кумаринів у більшості країн світу і в Україні обумовлює регулярне виникнення випадків отруєнь серед населення. Мета — ознайомлення практичних лікарів із біологічними і токсичними ефектами похідних 4-гідроксикумарину на прикладі окремого клінічного спостереження. Матеріали та методи. Проведено аналіз сучасних джерел наукової інформації за останні 20 років, присвячених дослідженню біологічних і токсичних ефектів кумаринів. Розглянуто клінічний випадок отруєння похідними 4-гідроксикумарину в жінки 40 років, яка лікувалася на базі токсикологічного відділення лікарні швидкої медичної допомоги м. Миколаєва. Застосовані такі методи: аналітичний, системного і порівняльного аналізу. Результати. Пацієнтка Д., 40 років, доставлена в ургентному порядку до лор-відділення міської лікарні № 4 м. Миколаєва з носовою кровотечею в червні 2018 р. Після огляду лікарем пацієнтка була госпіталізована, призначена гемостатична, антибактеріальна терапія і виконана передня тампонада носових ходів. Через дві доби на фоні прогресуючої коагулопатії (протромбіновий індекс (ПТІ) < 5 %; міжнародне нормалізоване відношення (INR) > 10) пацієнтка була переведена до реанімаційного відділення, де розпочато введення гемостатиків (вітамін К 20 мг 3–4 рази на добу), антибіотиків, кристалоїдів, донорської одногрупної плазми. На 4-ту добу від моменту надходження до лікарні було з’ясовано, що пацієнтка Д. страждає від шизофренії і, зі слів матері, ймовірно, прийняла невідому дозу щурячої отрути на основі похідних 4-гідроксикумарину. У реанімаційному відділенні пацієнтка Д. проходила лікування протягом 14 діб, після стабілізації стану була переведена до токсикологічного відділення лікарні швидкої медичної допомоги м. Миколаєва, де перебувала на лікуванні та реабілітації ще 25 діб, після чого була переведена до психіатричної лікарні. Висновки. Проблема гострих отруєнь похідними 4-гідроксикумарину залишається актуальною в клінічній практиці. Використання антидоту (вітаміну К) дає позитивний результат при своєчасному зверненні пацієнта за медичною допомогою. Біологічними маркерами токсичного процесу є показники INR, ПТІ, число тромбоцитів, а також інші показники, що характеризують систему згортання крові. Слід пам’ятати, що тяжка коагулопатія з розвитком внутрішніх кровотеч ускладнює діагностику гострого отруєння антикоагулянтами і нерідко є причиною, з якої хірургічні ускладнення у вигляді кровотечі трактуються як основне захворювання.
Актуальность. Широкое применение антикоагулянтных родентицидов на основе кумаринов в большинстве стран мира и в Украине определяет регулярное возникновение случаев отравлений среди населения. Цель — ознакомление практических врачей с биологическими и токсическими эффектами производных 4-гидроксикумарина на примере отдельного клинического наблюдения. Материалы и методы. Проведен анализ современных источников научной информации за последние 20 лет, посвященных исследованию биологических и токсических эффектов кумаринов. Рассмотрен клинический случай отравления производными 4-гидроксикумарина у женщины 40 лет, проходившей лечение на базе токсикологического отделения больницы скорой медицинской помощи г. Николаева. Применены следующие методы: аналитический, системного и сравнительного анализа. Результаты. Пациентка Д., 40 лет, доставлена в ургентном порядке в лор-отделение городской больницы № 4 г. Николаева с носовым кровотечением в июне 2018 года. После осмотра врачом пациентка была госпитализирована, назначена гемостатическая, антибактериальная терапия и выполнена передняя тампонада носовых ходов. Через двое суток на фоне прогрессирующей коагулопатии (протромбиновый индекс (ПТИ) < 5 %; международное нормализованное соотношение (INR) > 10) пациентка была переведена в реанимационное отделение, где начато усиленное введение гемостатических препаратов (витамин К 20 мг 3–4 раза в сутки), антибиотиков, кристаллоидов, донорской одногруппной плазмы. На 4-е сутки с момента поступления в больницу выяснилось, что пациентка Д. страдает шизофренией и, по словам матери, вероятно, приняла неизвестную дозу крысиного яда на основе производных 4-гидроксикумарина. В реанимационном отделении пациентка находилась в течение 14 дней и после стабилизации состояния была переведена в токсикологическое отделение больницы скорой медицинской помощи г. Николаева, где продолжила лечение и реабилитацию еще в течение 25 суток, после чего была переведена в психиатрическую больницу. Выводы. Проблема острых отравлений производными 4-гидроксикумарина остается актуальной в клинической практике. Использование антидота (витамина К) дает положительный результат при своевременном обращении пациента за медицинской помощью. Биологическими маркерами токсического процесса являются показатели INR, ПТИ, число тромбоцитов, а также другие показатели, характеризующие систему свертывания крови. Следует помнить, что тяжелая коагулопатия с развитием внутренних кровотечений затрудняет диагностику острого отравления антикоагулянтами и нередко является причиной, по которой хирургические осложнения в виде кровотечения трактуются как основное заболевание.
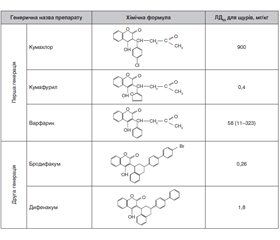
Background. The widespread use of coumarin-based anticoagulant rodenticides in most countries of the world and in Ukraine determines the regular occurrence of poisonings among the population. Purpose of the work: to familiarize general practitioners with the biological and toxic effects of 4-hydroxycoumarin derivatives using a separate clinical observation. Materials and methods. The analysis was performed of modern sources of scientific information about the biological and toxic effects of coumarins over the past 20 years. A clinical case of poisoning with 4-hydroxycoumarin derivatives in a 40-year-old woman undergoing treatment at the toxicology department of City Emergency Hospital in Mykolaiv was considered. The methods of analytical, systemic and comparative analysis were applied. Results. On the basis of 4-hydroxycoumarin, a number of substances with anticoagulant properties of different efficacy were synthesized: brodifacoum, dicoumarol, warfarin, which are used as drugs for the prevention of thrombosis and embolism in a number of diseases, and pesticides — means of deratization. Rodenticides belonging to the 4-hydroxycoumarin group (superwarfarins) are used to kill rats and mice. Superwarfarins block vitamin K-dependent γ-carboxylation of glutamic acid residues in prothrombin precursors 100 times stronger (in equimolar ratio) than warfarin. In addition, their half-life reaches 120 days, and for warfarin it is 42 hours. The plasma content of factors II, VII, IX and X is reduced. As the concentration of coagulation factors decreases, clinical manifestations of their deficiency occur (usually on day 2 or day 3). Swallowing a small amount of poison can hardly harm the body. Multiple doses over several days or weeks can lead to serious poisoning and even death. Bleedings in the urogenital system, gastrointestinal tract, nosebleeds occur most often. The mechanism of coumarin anticoagulant intoxication is disrupting the cellular recirculation of the blood clotting factor — vitamin K, which results in secondary coagulopathy. This class of substances is characterized by high biological activity and toxicity. Case study. Patient D., a 40-year-old woman, was urgently admitted to the ENT department of the Mykolaiv City Hospital 4 with nosebleed in June 2018. The patient was treated in the ENT department during 2 days, but nosebleed recurred. Due to the negative changes in urine tests, acute haemorrhagic cystitis was diagnosed. The patient was examined by urologist and gynaecologist, but she refused hospitalization to the urological department and was referred to the therapeutic department for further treatment. However, due to the progressive coagulopathy (prothrombin index 65 %), the patient D. was transferred to the intensive care unit. Haemostatics, antibiotics, intravenous injection of crystalloids, single-donor plasma were used. However, the patient’s condition continued to worsen, coagulopathy was progressing (prothrombin index < 5 %; international normalized ratio > 10). The cause of severe coagulopathy remained unclear. The medical history of the patient was re-examined by doctors, and it was found that patient D. had schizophrenia. One year before, she has similar symptoms and was treated in the haematology department with the symptoms of coagulopathy during one week. Combining these facts, doctors suspected poisoning with unknown substance with a clear anticoagulant effect. A detailed survey of the patient’s mother revealed that shortly before the disease, patient D. had purchased a rat poison based on 4-hydroxycoumarin derivatives, and may have taken it for several days. This version was later confirmed. In the intensive care unit, patient D. was treated for 14 days, and after that she was transferred to the toxicology department of the Mykolaiv City Emergency Hospital, where she was treated and underwent rehabilitation for 25 days. Unfortunately, it was not possible to accurately determine the dose and period of poison use. During the entire period of stay in the toxicology department, symptomatic treatment for coagulopathy was performed with the use of vitamin K (vikasol, 20 mg, 3–4 times a day) and other haemostatics and symptomatic therapy. Prolonged nasal tamponade caused complications such as nasal septum perforation and pressure ulcer of the upper lip and nostrils on the left, which led to a long period of treatment by the ENT doctor. After wound healing and stabilization of laboratory parameters, patient D. was transferred to a psychiatric hospital with the diagnosis: acute rodenticide (4-hydroxycoumarin derivative) poisoning. Suicidal attempt. Toxic coagulopathy. Repeated nosebleeds. Haemorrhagic cystitis. Post-haemorrhagic anaemia. Pressure ulcer of the left sinus and upper lip on the left. Nasal septum perforation. Mental illness. This case demonstrated that clinical diagnosis of secondary coagulopathy is sometimes challenging. If it is impossible to carry out chemical and analytical studies (liquid chromatography — mass spectrometry) on the coumarin content in the patient’s blood, then the quality of collecting anamnesis vitae and anamnesis morbi, dynamic monitoring of haemostatic parameters, blood biochemical indices and clinical parameters of the blood and urine play a key role in establishing the diagnosis. Conclusions. The problem of acute poisonings with 4-hydroxycoumarin derivatives remains relevant in clinical practice. The use of an antidote (vitamin K) gives a positive result with timely treatment of a patient. Biological markers of the toxic process are international normalized ratio, prothrombin index, platelet count, and other haemostatic parameters, which characterize the coagulation system. It should be remembered that severe coagulopathy with the development of internal bleeding complicates the diagnosis of acute poisoning with anticoagulants and is often the reason why surgical complications such as bleeding are interpreted as the underlying disease.
антикоагулянтні родентициди; отруєння; огляд
антикоагулянтные родентициды; отравления; обзор
anticoagulant rodenticides; poisoning; review
Вступ
Матеріали та методи
Результати
/14.jpg)
/14_2.jpg)
/16.jpg)
Клінічний випадок отруєння похідним 4-гідроксикумарину
Обговорення
Висновки
- Tran M.H., King N.C. Epidemiology and symptomatology of long acting anticoagulant rodenticide poisoning. J. Epidemiol. Res. 2015. V. 2. № 2. P. 1-8. DOI: https://doi.org/10.5430/jer.v2n2p1.
- Pereira T.M., Franco D.P., Vitorio F., Kummerle A.E. Coumarin compounds in medicinal chemistry: some important examples from the last years. Current Topics in Medicinal Chemistry. 2018. V. 18. № 2. Р. 124-148. DOI: 10.2174/1568026618666180329115523.
- Lake B.G. Coumarin metabolism toxicity and carcinogenicity: relevance for human risk assessment. Food and Chemical Toxicology. 1999. № 37. Р. 423-453. DOI: 10.1016/s0278-6915(99)00010-1.
- Egan D., O’Kennedy R., Moran E. et al. The pharmacology, metabolism, analysis and applications of coumarin and coumarin-related compounds. Drug Metab. Rev. 1990. № 22. Р. 503-529. DOI: 10.3109/03602539008991449.
- Dexeus F.H., Logothetis С.J., Sella A.F. et al. Phase II study of coumarin and cimetidine in patients with metastatic renal cell сarcinoma. J. Clm. Oncol. 1990. № 8. Р. 325-329. DOI: 10.1200/JCO.1990.8.2.325.
- Cox D., O’Kennedy R., Thornes R.D. The rarity of liver toxicity in patients treated with coumarin (1,2-benzopyrone). Hum. Toxicol. 1989. № 8. Р. 501-506. DOI: 10.1177/096032718900800612.
- Morris L., Welsby P.D., Morris L. Side-effects of coumarin. Postgrad. Med. J. 1995. № 71. Р. 701-702. DOI: 10.1136/pgmj.71.841.701-a.
- Lake B.G. Investigations into the mechanism of coumarin-induced hepatotoxicity in the rat. Arch. Toxicol. Suppl. 1984. № 7. P. 16-29. DOI: 10.1007/978-3-642-69132-4_2.
- Lake B.G., Evans J.G. Effect of pretreatment with some mixed-function oxidase enzyme inducers on the acute hepatotoxicity of coumarin in the rat. Food Chem. Toxicol. 1993. № 31. P. 963-970. DOI: 10.1016/0278-6915(93)90005-j.
- Beckley-Kartey S.A.J., Hotchkins S.A.M., Capel M. Comparative in vitro skin absorption and metabolism of coumarin (1,2-benzopyrone) in human, rat, and mouse. Toxicology and Applied Pharmacology. 1997. № 145. Р. 34-42. DOI: 10.1006/taap.1997.8154.
- Ratanasavanh D., Lamiable D., Biour M. et al. Metabolism and toxicity of coumarin on cultured human, rat, mouse and rabbit hepatocytes. Phundamental clinical pharmacology. 1996. V. 10. № 6. Р. 504-510. DOI: 10.1111/j.1472-8206. 1996. tb00607.x.
- Born S.L., Api A.M., Ford R.A. et al. Comparative metabolism and kinetics of coumarin in mice and rats. Food Chem. Toxicol. 2003. № 41. Р. 247-258. DOI: 10.1016/s0278-6915(02)00227-2.
- Koenigs L.L., Peter R.M., Thompson S.J. et al. Mechanism-based inactivation of human liver cytochrome P450 2A6 by 8-methoxypsoralen. Drug Metabolism and Disposition. 1997. № 25. Р. 1407-1415. PMID: 9394031.
- Fentem J.H., Fry J.R. Species differences in the metabolism and hepatotoxicity of coumarin. Comp. Biochem. Physiol. 1993. № 104. P. 1-8. DOI: 10.1016/0742-8413(93)90102-q.
- Rietjens I., Boersmaa M., Zaleskaa M., Punt A. Differences in simulated liver concentrations of toxic coumarin metabolites in rats and different human populations evaluated through physiologically based biokinetic (PBBK) modeling. Toxicology in Vitro. 2008. V. 22. № 8. P. 1890-1901. DOI: 10.1016/j.tiv.2008.09.004.
- Evans J.G., Gaunt I.F., Lake B.G. Two-year toxicity study on coumarin in the baboon. Food Cosmet. Toxicol. 1979. № 17. Р. 187-193. DOI: 10.1016/0015-6264(79)90280-3.
- Steensma A., Beamand J.A., Walters D.G. et al. Metabolism of coumarin and 7-ethoxycoumarin by rat, mouse, guinea pig, Cynomolgus monkey and human precision-cut liver slices. Xenobiotica. 1994. № 24. Р. 893-907. DOI: 10.3109/00498259409043288.
- Pelkonen O., Rautio A., Raunio H. et al. CYP 2A6: a human coumarin 7-hydroxylase. Toxicology. 2000. V. 144. Iss. 1–3. P. 139-147. DOI: 10.1016/S0300-483X(99)00200-0.
- Abraham K., Pfister М., Wöhrlin F. Lampen А. Relative bioavailability of coumarin from cinnamon and cinnamon-containing foods compared to isolated coumarin: a four-way crossover study in human volunteers. Molecular nutrition & food research. 2011. V. 55. № 4. P. 644-653. DOI: 10.1002/mnfr.201000394.
- Lake B.G., Gray T.J., Evans J.G. et al. Studies on the mechanism of coumarin-indiced toxicity in rat hepatocytes: Comparison with Investigations into the mechanism and other coumarin metabolites. Toxicol. Appl. Pharmacol. 1989. № 97. Р. 311-323. DOI: 10.1016/0041-008X(89)90336-0.
- Evans J.G., Appleby E.C., Lake B.G. et al. Studies on the induction of cholangiofibrosis by coumarine on the rat. Toxicology. 1989. № 55. p. 207-224. DOI: 10.1016/0300-483X (89)90187-X.
- Peters M.M., Walters D.G., van Ommen B. et al. Effect of inducers of cytochrome P 450 on the metabolism of [3-HC] coumarin by rat hepatic microsomes. Xenobiotica. 1991. № 21. P. 499-514. DOI: 10.3109/00498259209046647.
- Miles J.S., McLaren A.W., Forrester L.M. et al. Identification of the human liver cytochrome P-450 responsible for coumarin 7-hydroxylase activity. Biochem. J. 1990. № 267. p. 365-371. DOI: 10.1042/bj2670365.
- Williams R.T., Millburn P., Smith R.L. The influence of enterohepatic circulation on toxicity of drugs. Ann. N.Y. Acad. Sci. 1965. № 123. Р. 110-113. DOI: 10.1111/j.1749-6632. 1965.tb12249.x.
- Shilling W.H., Crampton R.F., Longland Shilling R.C. Metabolism of coumarin in man. Nature. 1969. № 221. p. 664-665. DOI: 10.1038/221664b0.
- Feuer G., Golberg L., Gibson K. Liver response tests. VII Coumarin metabolism in relation to the inhibition of rat-liver glucose 6-phosphatase. Food Cosmet. Toxicol. 1966. № 4. p. 157-167. DOI: 10.1016/s0015-6264(66)80459-5.
- Jenner P.M., Hagan E.C., Jean M. Taylor, Cook E.L., Fitzhugh O.G. Food Flavouring and compounds of related structure. I. Acute oral toxicity. Fооd Cosmet. Toxicol. 1964. № 2. Р. 327-343. Publisher: Elsevier BV. URI: http://linkinghub.elsevier.com/retrieve/pii/ S0015626464801929.
- Scientific Opinion of the Panel on Food Additives, Flavourings, Processing Aids and Materials in Contact with Food on a request from the European Commission on Coumarin in flavourings and other food ingredients with flavouring properties.The EFSA Journal. 2008. № 793. Р. 1-15. DOI: 10.2903/j.efsa.2008.793.
- NTP Toxicology and Carcinogenesis Studies of Coumarin (CAS No. 91-64-5) in F344/N Rats and B6C3F1 Mice (Gavage Studies). National Toxicology Program. National Toxicology Program technical report series. 1993, Sep. Iss. 422. 340 р. URL: http://www.ncbi.nlm.nih.gov/pubmed/12616289. PMID: 12616289.
- Grasso P., Wright M.G., Gangolli S.D., Hendy R.J. Liver response tests. IX. Cytopathological changes in the enlarged but histologically normal rat liver. Fооd Cosmet. Toxicol. 1974. № 12. Р. 341-350. DOI: 10.1016/0015-6264(74)90006-6.
- Mishkinsky J.S., Goldschmied A., Joseph B. et al. Hypoglycemic effect of Trigonella foenum greacum and Lupinus termis (Leguminosae) seeds and their major alkaloids in alloxan-diabetic and normal rat. Arch. Int. Pharmacodyn. Ther. 1974. V. 210. № 1. Р. 27-37. PMID: 4280278.
- International Agency for Research on Cancer (IARC) — Summaries & Evaluations COUMARIN (Group 3). 2000. V. 77. Р. 193. URL: http://www.inchem.org/documents/iarc/vol77/77-04.html.
- Lacy А., O’Kennedy R. Studies on coumarins and coumarin-related compounds to determine their therapeutic role in the treatment of cancer. Current Pharmaceutical Design. 2004. V. 10. № 3. P. 3797-3811. DOI: 10.2174/1381612043382693.
- Bye A., King H.K. The biosynthesis of 4-hydroxycoumarin and dicoumarol by Aspergillus fumigatus. Fresenius. Biochemical Journal. 1970. № 117. Р. 237-245. DOI: 10.1042/bj1170237.
- Verhoef T.I., Redekop W.K., Daly A.K. et al. Pharmacogenetic-guided dosing of coumarin anticoagulants: algorithms for warfarin, acenocoumarol and phenprocoumon. British journal of clinical pharmacology. 2014. V. 77. № 4. P. 626-641. DOI: 10.1111/bcp.12220.
- Petterino C., Paolo B. Toxicolgy of various anticoagulant rodenticides in animals. Vet. Hum. Toxicol. 2001. № 43. P. 353-360. PMID: 11757996.
- Valchev I., Binev R., Iordanova V. et al. Anticoagulant rodenticide intoxication in animals. Turk. J. Vet. Anim. Sci. 2008. V. 32. № 4. P. 327-243. URL: http://journals.tubitak.gov.tr/veterinary/issues/vet-08-32-4/vet-32-4-1-0607-12.pdf.
- Tubaro А., Del Negro Р., Ragazzi Е. et al. Anti-inflammatory and peripheral analgesic activity of esculetin in vivo. Pharmacol. Res. Commun. 1988. № 20. Suppl. 5. Р. 83-85. DOI: 10.1016/s0031-6989(88)80847-6.
- Synthetic Approaches and Biological Activities of 4-Hydroxycoumarin Derivatives Jae-Chul Jung and Oee-Sook Park. Molecules. 2009. 14. 3. Р. 4790-4803. DOI: 10.1016/s0031-6989(88) 80847-6.
- Chen D.U., Kuo P.Y., Yang D.Y. Design and synthesis of novel diphenacoum-derived, conformation-restricted vitamin K 2,3-epoxide reductase inhibitors. Bioorg. Med. Chem. Lett. 2005. 15. Р. 2665-2668. DOI: 10.1016/j.bmcl.2005.03.005.

/16_2.jpg)
/17.jpg)
/18.jpg)
/19.jpg)