Журнал «Медицина неотложных состояний» Том 16, №4, 2020
Вернуться к номеру
Чинники, пов’язані з ремоделюванням серця у віддаленому періоді, у хворих з інвазивною стратегією лікування гострого коронарного синдрому
Авторы: Целуйко В.Й., Пильова Т.В.
Харківська медична академія післядипломної освіти МОЗ України, м. Харків, Україна
Рубрики: Медицина неотложных состояний
Разделы: Клинические исследования
Версия для печати
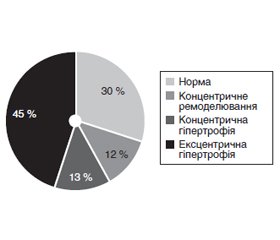
Актуальність. Серцева недостатність є однією з поширених причин смерті у світі. Пацієнти з постінфарктним ремоделюванням мають високий ризику розвитку серцевої недостатності. Важливим є встановлення чинників, що впливають на розвиток ремоделювання серця у віддаленому періоді після гострого коронарного синдрому (ГКС), для запобігання прогресуванню розширення шлуночків, погіршенню їх функції і розвитку серцевої недостатності. Мета: визначити чинники, пов’язані з ремоделюванням серця у віддаленому періоді після ГКС, у хворих з інвазивною стратегією лікування. Матеріали та методи. Обстежені 74 пацієнти з ГКС. Методом ехокардіографії вивчалась динаміка показників, пов’язаних з об’ємом і функцією лівого шлуночка: кінцево-діастолічного індексу (КДІ), кінцево-систолічного індексу (КСІ) і фракції викиду (ФВ) через 1 рік. За параметрами, зазначеними вище, формувались групи дослідження. Типи структурно-геометричного ремоделювання визначали відповідно до принципів A. Ganau. Результати. Досліджені показники при госпіталізації і через 1 рік мають вірогідно значимі відмінності: збільшення розміру лівого передсердя (р = 0,042), збільшення КСІ (р = 0,026) і зменшення індексу відносної товщини стінки лівого шлуночка (р = 0,042). Частота змін параметрів ремоделювання з негативними ознаками залежно від КСІ становила 40,54 %, ФВ — 18,9 % і КДІ — 24,3 %. У пацієнтів групи КСІ-1 було виявлено збільшенні вихідні показники кінцево-діастолічного розміру (КДР) (р = 0,00002), кінцево-систолічного розміру (КСР) (р = 0,00001), розмірів лівого передсердя (р = 0,0005). Пацієнти групи ФВ-1 у гострому періоді мали вірогідно збільшені вихідні значення КСР (р = 0,00001), КДР (р = 0,00002), також переважав рестриктивний тип діастолічної дисфукції (p = 0,007). При надходженні переважали хворі з нормальною геометрією серця й концентричною гіпертрофією, а через 1 рік після ГКС тип ремоделювання змінився в сторону ексцентричної гіпертрофії. Висновки. КСІ та КДІ є більш раннім предиктором післяінфарктного ремоделювання порівняно з ФВ. Рестриктивний тип діастолічної дифункції при надходженні асоціюється з розвитком дезадаптивного ремоделювання лівого шлуночка через 1 рік. Через рік після ГКС тип ремоделювання змінився в сторону ексцентричної гіпертрофії.
Актуальность. Сердечная недостаточность является одной из распространенных причин смерти в мире. Пациенты с постинфарктным ремоделированием имеют высокий риск развития сердечной недостаточности. Важным является установление факторов, влияющих на развитие ремоделирования сердца в отдаленном периоде после острого коронарного синдрома (ОКС), для предотвращения прогрессирования расширения желудочков, ухудшения их функции и развития сердечной недостаточности. Цель: определить факторы, ассоциированные с ремоделированием сердца в отдаленном периоде после ОКС, у больных с инвазивной стратегией лечения. Материалы и методы. Обследованы 74 пациента с ОКС. Методом эхокардиографии изучалась динамика показателей, связанных с объемом и функцией левого желудочка: конечно-диастолического индекса (КДИ), конечно-систолического индекса (КСИ) и фракции выброса (ФВ) через 1 год. По параметрам, указанным выше, формировались группы исследования. Типы структурно-геометрического ремоделирования определяли в соответствии с принципами A. Ganau. Результаты. Изученные показатели при поступлении и через 1 год имеют достоверно значимые различия: увеличение размера левого предсердия (р = 0,042), увеличение КСИ (р = 0,026) и уменьшение индекса относительной толщины стенки левого желудочка (р = 0,042). Частота изменений параметров ремоделирования с негативными признаками в зависимости от КСИ составляла 40,54 %, ФВ — 18,9 % и КДИ — 24,3 %. У пациентов группы КСИ-1 было обнаружено увеличение исходных показателей КДР (р = 0,00002), КСР (р = 0,00001), размеров левого предсердия (р = 0,0005). Пациенты группы ФВ-1 в остром периоде имели достоверно увеличенные исходные значения КСР (р = 0,00001), КДР (р = 0,00002), также преобладал рестриктивный тип диастолической дисфукции (p = 0,007). При поступлении преобладали больные с нормальным типом геометрии сердца и концентрической гипертрофией, а через год после ОКС тип ремоделирования изменился в сторону эксцентрической гипертрофии. Выводы. КСИ и КДИ являются более ранним предиктором постинфарктного ремоделирования по сравнению с ФВ. Рестриктивный тип диастолической дифункции при поступлении ассоциируется с развитием дезадаптивного ремоделирования левого желудочка через 1 год. Через год после ОКС тип ремоделирования изменился в сторону эксцентрической гипертрофии.
Background. Heart failure is one of the leading causes of mortality worldwide. Patients with post-infarction remodeling have high risk of developing heart failure. It is important to identify impact factors influencing the risk of cardiac remodeling in the long-term period after acute coronary syndrome (ACS) preventing the progression of ventricular dilation, deterioration of their function and development of heart failure. The purpose: to identify factors associated with cardiac remodeling after ACS in patients with invasive treatment strategy. Materials and methods. The study included 74 patients who were hospitalized with a diagnosis of ACS in 2015. Echocardiography was used to study the dynamics of left ventricular volume and function: end-diastolic index (EDI), end-systolic index (ESI) and ejection fraction (EF) after 1 year. According to the parameters mentioned above, research groups were formed. Types of structural and geometric remodeling were determined according to the principles of A. Ganau. Results. It was determined that the average values of the studied parameters in patients with ACS upon admission and after 1 year had significant differences, such as left atrial enlargement (p = 0.042), increased ESI (p = 0.026) and decreased relative wall thickness (p = 0.042). The frequency of changes in remodeling parameters, which had negative signs depending on ESI, was 40.54 % with EF of 18.9 % and EDI of 24.3 %. Patients of the ESI-1 group had an increase in baseline end-diastolic volume (EDV) (p = 0.00002), end-systolic volume (ESV) (p = 0.00001) and left atrial size (р = 0.0005). In the acute period, patients of the EF-1 group had significantly increased baseline ESV (p = 0.00001), EDV (p = 0.00002); the restrictive type of diastolic dysfunction also prevailed (p = 0.007). Upon admission, number of patients with normal cardiac geometry and concentric hypertrophy prevailed, and 1 year after ACS, the type of remodeling changed to eccentric hypertrophy. Conclusions. ESI and EDI are earlier predictors of post-infarction remodeling compared to the EF. Restrictive type of diastolic dysfunction at admission is associated with the development of maladaptive left ventricular remodeling in 1 year. One year after ACS, the type of remodeling changed to eccentric hypertrophy.
гострий коронарний синдром; інфаркт міокарда; діастолічна дисфункція; серцева недостатність; прогноз; ремоделювання лівого шлуночка
острый коронарный синдром; инфаркт миокарда; диастолическая дисфункция; сердечная недостаточность; прогноз; ремоделирование левого желудочка
acute coronary syndrome; myocardial infarction; diastolic dysfunction; heart failure; prognosis; left ventricular remodeling
Вступ
Матеріали та методи
/96.jpg)
Результати
Обговорення
Висновки
- van der Bijl Р., Meda М., Rachid A., Goedemans L., Gersh B.J. Left Ventricular Post-Infarct Remodeling: Implications for Systolic Function Improvement and Outcomes in the Modern Era. JACC: Heart Failure. 2020. Vol. 8. Issue 2. P. 131-140.
- Verma А., Meris А., Skali H. et al. Prognostic implications of leftventricular mass and geometry following myocardial infarction: the VALIANT (Valsartanin Acute Myocardial Infarction) Echocardiographic Study. JACC: Cardiovascular Imaging. 2008. Vol. 1. № 5. Р. 582-591. doi: 10.1016/j.jcmg.2008.05.012.
- Агеев Ф.Т. Современная концепция диастолической сердечной недостаточности. Кардиоваскулярная терапия и профилактика. 2010. 9(7). С. 97-104.
- Nguyen T.L., Phan J., Hogan J., Hee L., Moses D., Otton J., Thomas L. Adverse diastolic remodeling after reperfused ST-elevation myocardial infarction: An important prognostic indicator. American Heart Journal. 2016. 180. P. 117-127. doi:10.1016/j.ahj.2016.05.020.
- Гандзюк В.А. Аналіз захворюваності на ішемічну хворобу серця в Україні. Український кардіологічний журнал. 2014. № 3. С. 45-52.
- Ganau A., Devereux R.B., Roman M.J. et al. Patterns of left ventricular hypertrophy and geometric remodeling in essential hypertension. J. Amer. Coll. Cardiology. 1992. Vol. 19. P. 1550-1558.
- Fraccarollo D., Galuppo P., Bauersachs J. Novel therapeutic approaches to post-infarction remodelling. Cardiovascular Research. 2012. Vol. 94. Issue 2. P. 293-303. doi: 10.1093/cvr/cvs109.
- Hammermeister K.E., DeRouen T.A., Dodge H.T. Variables predictive of survival in patients with coronary disease. Selection by univariate and multivariate analyses from the clinical, electrocardiographic, exercise, arteriographic, and quantitative angiographic evaluations. Circulation. 1979. Vol. 59. P. 421-430.
- Ponikowski P., Voors A.A., Anker S.D. et al. 2016 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure: The Task Force for the diagnosis and treatment of acute and chronic heart failure of the European Society of Cardiology (ESC). Developed with the special contribution of the Heart Failure Association (HFA) of the ESC. Eur. Heart J. 2016. 37. P. 2129-2200.
- Bulluck H., Go Y.Y., Crimi G. et al. Defining left ventricular remodeling following acute ST-segment elevation myocardial infarction using cardiovascular magnetic resonance. J. Cardiovasc. Magn. Reson. 2017. 19. 26. doi: 10.1186/s12968-017-0343-9. [PMC free article] [PubMed] [CrossRef] [Google Scholar].
- Ibanez В., James S., Agewall S. 2017 ESC Guidelines for the management of acute myocardial infarction in patients presenting with ST-segment elevation: The Task Force for the management of acute myocardial infarction in patients presenting with ST-segment elevation of the European Society of Cardiology (ESC). European Heart Journal. 2018. Vol. 39. Issue 2. P. 119-177. URL: https://doi.org/10.1093/eurheartj/ehx393.
- Lieb W., Gona Р., Larson M.G. et al. The Natural History of Left Ventricular Geometry in the Community. JACC: Cardiovascular Imaging. 2014. Vol. 7. Issue 9. P. 870-878. doi: 10.1016/ j.jcmg.2014.05.008.
- Sharkawi M.A., Kochar А. Heart Failure Prevention Post-Myocardial Infarction: 5 Things to Know. MHS Disclosures. 2020. May 28.
- Mentzer G., Hsich E.M. Heart Failure with Reduced Ejection Fraction in Women Epidemiology, Outcomes, and Treatment. Heart Fail. Clin. 2019. Vol. 15(1). P. 19-27. doi: 10.1016/j.hfc.2018.08.003.

/97.jpg)
/98.jpg)
/99.jpg)
/100.jpg)
/101_2.jpg)