Журнал «Медицина неотложных состояний» №8(103), 2019
Вернуться к номеру
Роль моніторингу показників гемодинаміки й киснево-транспортної функції у пацієнтів із тяжкою політравмою в гострому періоді
Авторы: Матолінець Н.В.
Львівський національний медичний університет імені Данила Галицького, м. Львів, Україна
Рубрики: Медицина неотложных состояний
Разделы: Клинические исследования
Версия для печати
Мета роботи: встановити взаємозв’язок клінічних і лабораторних показників шоку й оцінити роль моніторингу гемодинамічної та киснево-транспортної функції у пацієнтів із тяжкою політравмою в гострому періоді. Матеріали та методи. Обстежені 70 пацієнтів із тяжкою політравмою, які знаходилися на стаціонарному лікуванні у відділенні анестезіології та інтенсивної терапії Комунального некомерційного підприємства «Клінічна лікарня швидкої медичної допомоги м. Львова» за період з 2014 по 2019 р. Оцінку киснево-транспортної функції проводили розрахунковими методами за рівняннями Фіка, визначаючи індекс доставки кисню, індекс споживання кисню та коефіцієнт екстракції O2. За допомогою методики неінвазивного розрахункового безперервного вимірювання серцевого викиду (Estimated Continuous Cardiac Output — esCCO) проводили моніторинг показників центральної гемодинаміки. Результати. При госпіталізації у хворих відмічалось зниження середнього артеріального тиску і зростання частоти серцевих скорочень в середньому до 53,2 ± 2,0 мм рт.ст. і 113,9 ± 3,2 уд/хв відповідно, зменшення рівня гемоглобіну в крові — 86,8 ± 5,6 г/л (р < 0,001), зменшення індексу доставки кисню до 381,0 ± 7,8 мл/хв/м2, індексу споживання кисню до 118,7 ± 1,1 мл/хв/м2, компенсаторне зростання коефіцієнту екстракції кисню вище 0,3, суттєве зниження порівняно з нормою серцевого викиду — 3,46 ± 0,10 л/хв та серцевого індексу — 2,18 ± 0,08 л/хв/м2. Нормалізація центральної та периферичної гемодинаміки, показників киснево-транспортної функції на фоні інтенсивної терапії відбувалася протягом перших 12 годин з моменту травмування. Висновки. При тяжкій політравмі в перші години відмічаються церебральні (8,0 ± 1,0 бала за шкалою коми Глазго), циркуляторні та респіраторні шокові порушення, що зумовлює потребу в якісному моніторингу клінічних параметрів та відповідній інфузійній інтенсивній терапії. Тяжкість перебігу політравми вірогідно асоціюється протягом 1-ї та 2-ї доби з рівнем систолічного артеріального тиску нижче 115–120 мм рт.ст. (площа під кривою (AUC) = 0,766, AUC = 0,862, AUC = 0,711; р < 0,001) і кількістю балів за шкалою коми Глазго при госпіталізації ≤ 12 балів (AUC = 0,758; р < 0,001) з високим показником чутливості — 82,4 % (р < 0,001). Проведення індивідуалізованої цілеспрямованої моніторинг-керованої інфузійної терапії із застосуванням методики неінвазивного esCCO дозволяє забезпечити нормалізацію гемодинаміки, перфузії та кисневого статусу у пацієнтів з тяжкою політравмою протягом перших 12 годин інтенсивної терапії.
Цель работы: установить взаимосвязь клинических и лабораторных показателей шока и оценить роль мониторинга гемодинамической и кислородно-транспортной функции у пациентов с тяжелой политравмой в остром периоде. Материалы и методы. Обследованы 70 пациентов с тяжелой политравмой, которые находились на стационарном лечении в отделении анестезиологии и интенсивной терапии Коммунального некоммерческого предприятия «Клиническая больница скорой медицинской помощи г. Львова» за период с 2014 по 2019 г. Оценку кислородно-транспортной функции проводили расчетными методами по уравнениям Фика, определяя индекс доставки кислорода, индекс потребления кислорода и коэффициент экстракции O2. С помощью методики неинвазивного расчетного непрерывного измерения сердечного выброса (Estimated Continuous Cardiac Output — esCCO) проводили мониторинг показателей центральной гемодинамики. Результаты. При госпитализации у больных отмечалось снижение среднего артериального давления и рост частоты сердечных сокращений в среднем до 53,2 ± 2,0 мм рт.ст. и 113,9 ± 3,2 уд/мин соответственно, снижение уровня гемоглобина в крови — 86,8 ± 5,6 г/л (р < 0,001), уменьшение индекса доставки кислорода до 381,0 ± 7,8 мл/мин/м2, индекса потребления кислорода до 118,7 ± 1,1 мл/мин/м2, компенсаторный рост коэффициента экстракции кислорода выше 0,3, существенное снижение по сравнению с нормой сердечного выброса — 3,46 ± 0,10 л/мин и сердечного индекса — 2,18 ± 0,08 л/мин/м2. Нормализация центральной и периферической гемодинамики, показателей кислородно-транспортной функции на фоне интенсивной терапии происходила в течение первых 12 часов с момента травмы. Выводы. При тяжелой политравме в первые часы отмечаются церебральные (8,0 ± 1,0 балла по шкале комы Глазго), циркуляторные и респираторные шоковые нарушения, что обусловливает потребность в качественном мониторинге клинических параметров и соответствующей инфузионной интенсивной терапии. Тяжесть течения политравмы достоверно ассоциируется в течение 1-х и 2-х суток с уровнем систолического артериального давления ниже 115–120 мм рт.ст. (площадь под кривой (AUC) = 0,766, AUC = 0,862, AUC = 0,711; р < 0,001) и количеством баллов по шкале комы Глазго при поступлении ≤ 12 баллов (AUC = 0,758; р < 0,001) с высоким показателем чувствительности — 82,4 % (р < 0,001). Проведение индивидуализированной целенаправленной мониторинг-управляемой инфузионной терапии с применением методики неинвазивного esCCO позволяет обеспечить нормализацию гемодинамики, перфузии и кислородного статуса у пациентов с тяжелой политравмой в течение первых 12 часов интенсивной терапии.
Background. The purpose was to establish the relationship between clinical and laboratory indicators of shock and to evaluate the role of monitoring of hemodynamic and oxygen transport function in patients within the acute period of severe polytrauma. Materials and methods. The study includes 70 patients with severe polytrauma who were treated in the Intensive Care Unit of the Lviv Emergency Hospital from 2014 to 2019. The oxygen transport function was assessed using Fick’s calculation methods, determining the oxygen delivery index, the oxygen consumption index, and O2 extraction ratio. The monitoring of central hemodynamics was performed using the non-invasive estimated continuous cardiac output. Results. Upon admission, the patients had a decrease in mean arterial pressure to 53.2 ± 2.0 mmHg and heart rate increased to an average of 113.9 ± 3.2 bpm. Blood hemoglobin levels were reduced to 86.8 ± 5.6 g/l (p < 0.001). The oxygen delivery index was decreased to 381.0 ± 7.8 ml/min/m2 and the oxygen consumption index — up to 118.7 ± 1.1 ml/min/m2. A compensatory increase of O2 extraction ratio above 0.3 was observed together with a significant decrease in the cardiac output — 3.46 ± 0.10 l/min and cardiac index — 2.18 ± 0.08 l/min/m2. Normalization of central and peripheral hemodynamics and indexes of oxygen transport function was achieved as a result of intensive care during the first 12 hours from the moment of injury. Conclusions. In the first hours of severe polytrauma, cerebral disorders (8.0 ± 1.0 points on the Glasgow Coma Scale), respiratory and circulatory shock disorders occur, which require high-quality monitoring of clinical parameters and infusion intensive care. A severe clinical course of polytrauma is likely associated with a systolic blood pressure below 115–120 mmHg (area under curve (AUC) = 0.766, AUC = 0.862, AUC = 0.711; p < 0.001) for days 1 and 2 and Glasgow Coma Scale ≤ 12 points upon admission (AUC = 0.758; p < 0.001), with a high sensitivity of 82.4 %, p < 0.001. The conduction of individualized goal-directed monitor-guided fluid therapy using non-invasive estimated continuous cardiac output was accompanied by a normalization of hemodynamics, perfusion, and oxygen status in patients with severe polytrauma within the first 12 hours of intensive care.
політравма; шок; кисневий статус; esCCO; інфузійна терапія
политравма; шок; кислородный статус; esCCO; инфузионная терапия
multiple trauma; shock; oxygen status; estimated continuous cardiac output; infusion therapy
Вступ
Проблема травматизму набула епідемічного характеру в зв’язку з безперервним ростом захворюваності та летальності в усьому світі. Політравма є третьою за частотою причиною смерті в усіх вікових групах після онкологічних і серцево-судинних захворювань, і, згідно з прогнозами Всесвітньої організації охорони здоров’я, до 2020 року вона може вийти на друге місце [1].
В Україні щорічно травми різної тяжкості отримують понад 4,5 млн людей. За абсолютними показниками летальних випадків травматизм посідає друге місце після серцево-судинних захворювань, а серед осіб працездатного віку — перше. З числа померлих від дорожньо-транспортних пригод в Україні 18,6 % постраждалих помирають на госпітальному етапі, а 84 % — безпосередньо на місці пригоди. У 80 % постраждалих із травматичними ушкодженнями смерть настає у перші шість годин, головним чином від некомпенсованого шоку [2].
Згідно із сучасним визначенням, шок — це загрозлива для життя, генералізована форма гострої недостатності кровообігу, при якій доставка кисню до клітин і тканин недостатня для підтримки нормального аеробного метаболізму. По суті, це дисбаланс між доставкою субстратів і потребою в них на клітинному рівні. Слід розрізняти такі наслідки шоку, як загальне порушення кровообігу в організмі, що призводить до системної відповіді, і місцева ішемія з реперфузією. Гіпоперфузія тканин пов’язана з низкою компенсаторних серцево-судинних і нейроендокринних реакцій. Величина шокового впливу залежить від вираженості та тривалості шоку. Наслідки шоку можуть коливатися від мінімальних фізіологічних порушень, що закінчуються повним відновленням, до глибоких циркуляторних порушень, рецепторних дисфункцій та смерті [3, 4]. Швидка діагностика шоку та якісний безперервний моніторинг життєво важливих функцій в гострому періоді травми дозволяють зменшити показники летальності та ускладнень і скоротити термін перебування пацієнтів у відділенні інтенсивної терапії (ІТ) [5]. З 2014 р. діє консенсус Європейського товариства інтенсивної терапії, присвячений циркуляторному шоку, який є найпоширенішим, і його гемодинамічному моніторингу [6].
Моніторинг дозволяє клініцистам виявляти характер і ступінь патології та допомагає оцінити реакцію на терапію. Серцево-судинна система — це система органів, яка найчастіше потребує контролю в умовах критичного стану, що допомагає виявити наявність і характер шоку шляхом визначення частоти серцевих скорочень та ритму, оцінки стану системної резистентності судин [7].
На сьогодні в розумінні патофізіології гострого періоду травми все більше уваги приділяється метаболічному напрямку, який надає велике значення ролі обмінних процесів у розвитку критичного стану на фоні гіпоксії. Це зумовлено тим, що для роботи всіх функціональних систем організму необхідна енергія. В умовах гіпоксії зароджуються метаболічні порушення, енергетичний голод, активізація вільнорадикального окиснення, які призводять до порушення тканинного дихання на рівні мітохондрій і роблять свій внесок у розвиток тріади смерті. Проблема гіпоксії не може бути вирішена без забезпечення енергетичного субстрату, здатного повернути процеси окиснення в клітині на звичний аеробний шлях [8, 9].
Нормалізація гемодинаміки і перфузії — одна з основних складових цілеспрямованої інтенсивної терапії критичних станів, яка забезпечує покращення результатів лікування пацієнтів з політравмою. Мета моніторингу гемодинаміки, волемії, крововтрати, гемокоагуляції і метаболізму полягає в отриманні даних для визначення цілей терапевтичного впливу на фізіологічні мішені з метою покращення серцевого викиду, доставки кисню, підтримки адекватної перфузії тканин та утилізації кисню [10, 11].
Мета роботи: встановити взаємозв’язок клінічних і лабораторних показників шоку і оцінити роль моніторингу гемодинамічної та киснево-транспортної функції у пацієнтів із тяжкою політравмою в гострому періоді.
Матеріали та методи
Обстежено 70 пацієнтів із тяжкою політравмою, які знаходилися на стаціонарному лікуванні у відділенні анестезіології та інтенсивної терапії (ВАІТ) Комунального некомерційного підприємства «Клінічна лікарня швидкої медичної допомоги м. Львова» (КНП «КЛШМД м. Львова») за період з 2014 по 2019 р. Середній вік постраждалих становив 41,9 ± 2,4 року, із них 56 (80 %) осіб чоловічої статі та 14 (20 %) жіночої. Стратифікація пацієнтів групи дослідження проводилась згідно із ступенем тяжкості травматичних пошкоджень за шкалою ISS, середня кількість балів у пацієнтів становила 27,2 ± 1,3 бала, що підтверджувало наявність у них тяжкої політравми. Тяжкість стану та прогнозування летальності оцінювали за шкалою APACHE II: середні значення в середньому становили 8,4 ± 0,6 бала, імовірний ризик смерті при надходженні — 27,2 %, інфекційних ускладнень — 21,3 %.
Стандартні лабораторні дослідження проводилися в клінічній лабораторії КНП «КЛШМД м. Львова». Проводили динамічну оцінку загальноклінічних досліджень крові та сечі, біохімічного аналізу крові, глюкози крові, показників системи гемостазу. Рівень біохімічних показників крові визначали на автоматичному аналізаторі BioChem FC-360 (High Technology Inc., США). Кислотно-основний стан та показники водно-електролітного балансу визначали за допомогою аналізатора Medica EasyStat REF 7010 (Нідерланди).
Оцінку киснево-транспортної функції проводили розрахунковими методами за рівняннями Фіка, визначаючи індекс доставки кисню, індекс споживання кисню та коефіцієнт екстракції O2 [12].
Індекс доставки кисню (Oxygen Delivery Index, DO2I), мл/хв/м2, розраховували за формулою:
DO2I = CtaO2 × CI,
де CtaO2 — загальний вміст кисню в артеріальній крові, мл/л2; СІ — серцевий індекс, л/хв/м2. В нормі величина індексу доставки кисню дорівнює 520–720 мл/хв/м2.
Індекс споживання кисню (Oxygen Delivery Index, VO2I), мл/хв/м2, розраховували за формулою:
VO2I = (CtaO2 – CtvO2) × CI,
де CtaO2 — загальний вміст кисню в артеріальній крові, мл/л2; CtvO2 — загальний вміст кисню у венозній крові, мл/л2; СІ — серцевий індекс, л/хв/м2. В нормі величина індексу споживання кисню дорівнює 130–170 мл/хв/м2 (4 мл/кг/хв).
В нормі коефіцієнт екстракції O2 (О2ЕR = = VO2/DO2, тобто CtaO2 – CtvO2)/CtaO2) становить 0,2–0,3, тобто тільки 20–30 % доставленого кисню споживається клітинами організму.
Коли потреба в O2 перевершує можливість його доставки, то коефіцієнт екстракції вище 25 %. Якщо доставка O2 перевищує потребу, то коефіцієнт екстракції нижче 25 %. Якщо доставка O2 знижена помірно, споживання кисню не змінюється завдяки збільшенню екстракції O2 (насичення гемоглобіну киснем в змішаній венозній крові знижується); в цьому випадку VO2 не залежить від доставки. При подальшому зниженні DO2 досягається критична точка, в якій VO2 стає прямо пропорційним DO2 [13]. Тому з метою верифікації впливу гемодинамічних чинників на показники кисневого обміну ми використовували моніторинг показників центральної гемодинаміки за допомогою методики неінвазивного розрахункового безперервного вимірювання серцевого викиду Estimated Continuous Cardiac Output (esCCO).
Результати
При госпіталізації у пацієнтів із тяжкою політравмою спостерігалися зміни шкірних покривів із сповільненим кровотоком нігтьового ложа і симптомом білої плями — 4,2 ± 0,2 с, що характеризувало виражене порушення мікроциркуляції. Також у пацієнтів групи дослідження були наявні порушення свідомості різного ступеня, обумовлені як тяжкістю гіповолемічного шоку на тлі політравми, так і черепно-мозковою травмою як складовою поєднаної травми. За шкалою коми Глазго (ШКГ) реєстрували в середньому 8,0 ± 1,0 (8,0; 11,0) бала. Це підтверджено при проведенні кореляційного аналізу, де бали за ШКГ корелювали з тяжкістю травми при госпіталізації (R = –0,84, р < 0,001).
Наявність церебральної (< 8 балів за ШКГ) та дихальної (тахіпное > 30 за 1 хв, брадипное < 10 за 1 хв) недостатності при надходженні у пацієнтів з політравмою були критеріями переводу на штучну вентиляцію легенів (ШВЛ). Усім пацієнтам із тяжкою політравмою проводилася ШВЛ, середня тривалість ШВЛ у пацієнтів становила 14,9 ± 0,9 доби.
При вивченні компенсаторних і адаптаційних механізмів, спрямованих на підтримку доставки кисню та його споживання, нами проаналізовані показники периферичної та центральної гемодинаміки на фоні інтенсивної терапії гострого періоду тяжкої політравми. При надходженні у постраждалих реєстрували гіпотонію різного ступеня вираженості та тахікардію. Рівень середнього артеріального тиску (САТ) і частоти серцевих скорочень у хворих в середньому був в межах 53,2 ± 2,0 мм рт.ст. і 113,9 ± 3,2 уд/хв відповідно.
Протягом перших 12 годин інтенсивної терапії у пацієнтів реєстрували підвищення рівня САТ на 32,1 % — до 70,3 ± 2,9 мм рт.ст. Через 24 години ІТ середні значення САТ у хворих становили 87,9 ± 2,6 мм рт.ст. (р = 0,016 до попереднього етапу).
За даними ROC-аналізу встановлено, що тяжкість перебігу політравми вірогідно асоціюється протягом 1, 2, 5-ї доби з рівнем систолічного артеріального тиску (сист.АТ) нижче 115–120 мм рт.ст. (площа під кривою (AUC) = 0,766, AUC = 0,862, AUC = 0,711; р < 0,001) і кількістю балів за ШКГ при госпіталізації ≤ 12 балів (AUC = 0,758; р < 0,001) з високим показником чутливості — 82,4 % (р < 0,001) (табл. 1). Таким чином, порушення свідомості до сопору у хворих навіть без черепно-мозкової травми за рахунок гіпоксії та гіпоперфузії мозку свідчить про тяжкий перебіг політравми, незалежно від анатомічної класифікації тяжкості травми.
Рівень сист.АТ протягом першої доби ≤ 115 мм рт.ст. характеризувався високою специфічністю — 88 % (p < 0,001), що підтверджує тяжкість перебігу травматичної хвороби в динаміці на тлі проведення інтенсивної терапії. Слід відзначити високу чутливість сист.АТ ≤ 120 мм рт.ст. на 2-гу і 5-ту добу (82,9 %; p < 0,001 і 80 %, p = 0,002 відповідно), що, на нашу думку, потребує продовження інфузійної терапії під контролем гемодинамічного моніторингу для діагностики та попередження серцево-судинних ускладнень.
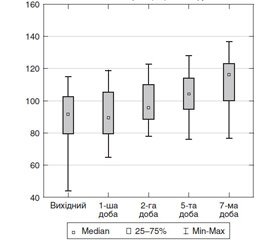
У хворих із тяжкою політравмою при госпіталізації реєстрували анемію — рівень гемоглобіну в крові статистично значуще був нижчим за норму (р < 0,001) і становив 86,8 ± 5,6 г/л, а до кінця 1-ї доби на фоні замісної інфузійно-трансфузійної терапії дещо зростав — до 92,5 ± 4,0 г/л, протягом двох діб інтенсивної терапії вірогідно збільшувався до 97,8 ± 2,1 г/л, і до 10-ї доби ІТ становив 113,1 ± 2,4 г/л (рис. 1).
Індекс доставки кисню у пацієнтів із тяжкою політравмою при надходженні становив 381,0 ± 7,8 мл/хв/м2, через 3 год ІТ вірогідно зростав порівняно з першим етапом і становив 463,3 ± 7,7 мл/хв/м2 (р1 < 0,001). Через 6 та 12 год ІТ DO2I у пацієнтів з тяжкою політравмою продовжував зростати і становив 548,2 ± 22,1 мл/хв/м2 (р = 0,004 до вихідного етапу) та 681,8 ± 38,6 мл/хв/м2 (р = 0,003 до вихідного етапу). Через 24 та 48 год ІТ індекс доставки кисню становив 681,6 ± 15,2 мл/хв/м2 і 670,3 ± ± 15,4 мл/ хв/м2 (табл. 2).
Індекс споживання кисню при надходженні у пацієнтів з тяжкою політравмою становив 118,7 ± 1,1 мл/хв/м2 і зростав через 3 год ІТ до 124,7 ± 1,6 мл/хв/м2. Коефіцієнт екстракції кисню (O2ER) при цьому становив 31 та 27 % відповідно, що свідчило про недостатнє споживання кисню тканинами навіть на фоні інтенсивної терапії в гострому шоковому періоді тяжкої політравми. Через 6 та 12 год ІТ VO2I продовжував зростати і становив 136,8 ± 2,0 мл/хв/м2 і 142,5±4,9 мл/хв/м2 (р = 0,009, р < 0,001 до вихідного етапу відповідно). O2ER при цьому наближався до норми — 25 і 24 % відповідно. Уже через 24 та 48 год ІТ показники доставки та споживання кисню були в межах нормальних значень. Коефіцієнт екстракції кисню наприкінці 1-ї та 2-ї доби ІТ політравми становив в середньому 25 % і підтверджував ефективність проведеної терапії.
Як відомо, рівняння Фіка виражає зв’язок між споживанням O2, артеріовенозною різницею по кисню і серцевим викидом:
Споживання O2 = VO2 = СВ × (CtaO2 – CtvO2).
Після перетворення отримуємо:
CtaO2 – CtvO2 = VO2 × CВ.
Отже, артеріовенозну різницю можна розглядати як міру адекватності доставки кисню. При нормальному споживанні кисню близько 250 мл/хв і серцевому викиді 5000 мл/хв нормальна артеріовенозна різниця, згідно з цим рівнянням, становить 5 мл O2/100 мл крові.
Очевидною є роль показників центральної гемодинаміки (серцевий викид — СВ, серцевий індекс — СІ) у підтримці достатньої доставки кисню та впливі на його споживання. В 1-шу год після надходження у ВАІТ у наших пацієнтів із тяжкою політравмою середні значення центральної гемодинаміки становили: СВ — 3,46 ± 0,10 л/хв, СІ — 2,18 ± 0,08 л/хв/м2, тобто спостерігалося суттєве їх зниження порівняно з нормою. Через 3 год ІТ середні значення СВ статистично значуще збільшилися до 4,06 ± 0,02 л/хв (p = 0,007 до попереднього етапу), СІ — до 2,52 ± 0,11 л/хв/м2 (р = 0,005). Рівень СВ і СІ продовжував зростати до 6 год лікування, коли середні значення становили 4,81 ± 0,17 л/хв (p = 0,045) і 3,09 ± 0,12 л/хв/м2 (р = 0,037) відповідно. На 12-ту год ІТ гострого періоду у хворих з тяжкою політравмою середні значення СВ становили 5,23 ± 0,13 л/хв, СІ — 3,18 ± 0,14 л/хв/м2, що свідчило про чітку тенденцію до зростання, при цьому вірогідно відрізняючись від вихідного етапу дослідження (р < 0,001). Через 1 добу ІТ дані моніторингу центральної гемодинаміки були в межах норми і становили: СВ — 5,51 ± 0,11 л/хв, СІ — 3,25 ± 0,14 л/хв/м2, вірогідно відрізняючись при цьому від вихідного та попереднього етапів дослідження (р < 0,001, р < 0,001 відповідно). На 2-гу добу лікування середні значення показників центральної гемодинаміки у пацієнтів із тяжкою політравмою також були в межах норми (СВ — 5,85 ± 0,12 л/хв, СІ — 3,38 ± 0,18 л/хв/м2 (р = 0,001, р = 0,005 до попереднього етапу відповідно).
Обговорення
У стані тяжкого шоку система кровообігу не здатна доставити достатню кількість кисню для задоволення потреб тканин, що призводить до клітинної дисфункції, в результаті чого виникає клітинна дизоксія з втратою фізіологічної незалежності між доставкою і споживанням кисню, пов’язана з підвищенням рівня лактату [14, 15].
Як бачимо, у наших пацієнтів з тяжкою політравмою в гострому періоді шоку відмічалося зниження доставки і споживання кисню, імовірно, за рахунок кровотечі та дефіциту об’єму циркулюючої крові. При госпіталізації у хворих з тяжкою політравмою реєстрували також виражене зниження СВ та СІ. Коефіцієнт екстракції кисню при цьому через 1–3 год після травми був підвищеним, що було проявом компенсації гіпоперфузії, після 5 год інтенсивної інфузійної протишокової терапії даний показник повертався до норми.
Рівень серцевого викиду змінює вплив шунта на PaO2: при низькому серцевому викиді венозна домішка зменшується, що обумовлено посиленням легеневої вазоконстрикції у відповідь на зниження напруги кисню в змішаній венозній крові. Високий серцевий викид може збільшити венозну домішку за рахунок підвищення напруги кисню в змішаній венозній крові і пов’язаного з ним пригнічення гіпоксичної вазоконстрикції [16].
Найбільш поширена причина гіпоксемії — збільшений альвеолярно-артеріальний градієнт по кисню — А-аDO2 (різниця між напругою кисню в альвеолах і артеріальній крові), що характеризує ефективність обміну кисню. Градієнт А-аDО2 прямо пропорційний обсягу шунтового кровотоку і обернено пропорційний напрузі кисню в змішаній венозній крові. У свою чергу, напруга кисню в змішаній венозній крові залежить від серцевого викиду, споживання кисню і концентрації гемоглобіну [17].
У пацієнтів з тяжкою політравмою у нашій вибірці протягом перших 12–24 годин вдавалось досягти нормалізації параметрів киснево-транспортної функції, що проявилось у підвищенні до фізіологічного рівня індексів доставки і споживання кисню та у зниженні коефіцієнту екстракції кисню нижче 0,3 на фоні індивідуалізованої моніторинг-коригованої інфузійної терапії. Слід зазначити, що при госпіталізації у хворих з тяжкою політравмою реєстрували анемію, вихідний рівень гемоглобіну в крові був 90,0 г/л (79,0; 102,0). Це корелювало з тяжкістю травматичного ушкодження при надходженні (R = 0,69, р < 0,001). Хворим проводилася замісна гемотрансфузійна терапія протягом гострого періоду політравми. Рівень гемоглобіну в крові у цей період вірогідно збільшувався протягом двох діб ІТ до 95,0 г/л (88,0; 110,0). До 10-ї доби ІТ рівень гемоглобіну крові хворих становив 113,0 г/л (103,0; 120,0). Впродовж усього цього періоду зберігався кореляційний зв’язок між рівнем гемоглобіну в крові та тяжкістю травми (R = 0,27, р = 0,034).
Отже, тяжка механічна травма викликає стрімку активацію і швидке виснаження всіх механізмів адаптації з порушенням інтегративних регуляторних функцій центральної нервової системи і призводить до значних розладів гомеостазу, метаболізму та енергозабезпечення клітин з високою частотою ускладнень та летальністю [18].
Зростаюча доказова база вказує на те, що швидка діагностика шоку та якісний безперервний моніторинг життєво важливих функцій в гострому періоді травми забезпечують цілеспрямований підхід до прийняття рішень у контролі системи кровообігу та корекції, дозволяє клініцистам зрозуміти напрямок і тенденцію гемодинамічних змін пацієнта при тяжких травматичних ушкодженнях, об’єктивно визначити оптимальну терапевтичну стратегію з метою зменшення летальності і кількості ускладнень та скоротити термін перебування пацієнтів у відділенні інтенсивної терапії [19, 20].
Висновки
1. При тяжкій поєднаній травмі в перші години відмічаються церебральні (8,0 ± 1,0 бала за ШКГ), циркуляторні та респіраторні порушення, що зумовлювало потребу в моніторингу клінічних параметрів та відповідній інфузійній терапії.
2. При госпіталізації у хворих відмічалось зниження середнього артеріального тиску і зменшення частоти серцевих скорочень в середньому до 53,2 ± 2,0 мм рт.ст. і 113,9 ± 3,2 уд/хв відповідно, зменшення рівня гемоглобіну в крові — 86,8 ± 5,6 г/л (р < 0,001), зменшення індексу доставки кисню до 381,0 ± 7,8 мл/хв/м2, індексу споживання кисню до 118,7 ± 1,1 мл/хв/м2, компенсаторне зростання коефіцієнту екстракції кисню вище 0,3, суттєве зниження порівняно з нормою серцевого викиду — 3,46 ± 0,10 л/хв та серцевого індексу — 2,18 ± 0,08 л/хв/м2.
3. Тяжкість перебігу політравми вірогідно асоціюється протягом 1, 2–5-ї доби з рівнем сист.АТ нижче 115–120 мм рт.ст. (AUC = 0,766, AUC = 0,862, AUC = 0,711; р < 0,001) і кількістю балів за шкалою коми Глазго при госпіталізації ≤ 12 (AUC = 0,758; р < 0,001) з високим показником чутливості — 82,4 % (р < 0,001).
4. Проведення моніторинг-керованої інфузійної терапії з застосуванням методики неінвазивного розрахункового безперервного вимірювання серцевого викиду супроводжується нормалізацією системної, центральної гемодинаміки, показників киснево-транспортної функції протягом перших 12 годин з моменту травми.
Конфлікт інтересів. Автор заявляє про відсутність конфлікту інтересів та власної фінансової зацікавленості при підготовці даної статті.
1. Injuries and violence: the facts 2014. World Health Organization, 2014. http://apps.who.int/iris/bitstream/10665/149798/ 1/9789241508018_eng.pdf.
2. Устінов О.В. Травматизм — головна причина смерті серед молоді та людей віком до 40 років? [Електронний ресурс] 2017. https://www.umj.com.ua/article/114805/travmatizm-golovna-prichina-smerti-sered-molodi-ta-lyudej-vikom-do-40-rokiv.
3. David V. Feliciano, Kenneth L. Mattox, Ernest E. Moore. Trauma. The McGraw-Hill Companies Inc., 2009.
4. Кобеляцкий Ю.Ю., Йовенко И.А., Царев А.В. Интенсивная терапия политравмы с позиций современных международных рекомендаций. Медицина неотложных состояний. 2013. № 7(54). С. 9-15.
5. Vincent J.L., De Backer D. Circulatory shock. N. Eng. J. Med. 2013. V. 369. P. 1726-1734.
6. Cecconi M., De Backer D., Antonelli M., Beale R. et al. Consensus on circulatory shock and hemodynamic monitoring. Task force of the European Society of Intensive Care Medicine. Intensive Care Med. 2014. № 40(12). Р. 1795-815. doi: 10.1007/s00134-014-3525.
7. Iovenko І.А., Kobelyatsky Yu.Yu., Tsarev A.V., Kuzmova E.A., Mashin A.M. Hemodynamic Monitoring in practice Intensive Care Unit. Медицина неотложных состояний. 2016. № 5(76). С. 24-29. DOI: https://doi.org/10.22141/2224-0586.5.76.2016.76433.
8. Левченко Т.В., Кравцов С.А., Корнев А.Н., Шаталин А.В., Дзубан Г.Г. Анализ госпитальной летальности и качества клинической диагностики у пострадавших с политравмой. Политравма. 2014. № 3. С. 24-32.
9. Пурас Ю.В., Талыпов А.Э., Крылов В.В. Исходы лечения у пострадавших с сочетанной черепно-мозговой травмой на госпитальном этапе оказания медицинской помощи. Журнал им. Н.В. Склифосовского. Неотложная медицинская помощь. 2013. № 1. С. 38-45.
10. Кудрявцев Б.П., Саввин Ю.Н., Шабанов В.Э., Шишкин Е.В. Клинические рекомендации по оказанию медицинской помощи пострадавшим с травматическим шоком в чрезвычайных ситуациях. М.: Общероссийская общественная организация специалистов в сфере медицины катастроф, 2015. С. 29.
11. Shere-Wolfe R.F., Galvagno S.M., Grissom T.E. Critical care considerations in the management of the trauma patient following initial resuscitation. Scandinavian Journal of Trauma, Resuscitation and Emergency Medicine. 2012. № 20. Р. 68. doi: 10.1186/1757-7241-20-68.
12. David Chambers, Christopher Huang, Gareth Matthews. Basic Physiology for Anaesthesists. Cambridge University Press, 2015. Р. 321.
13. Бойко В.В., Замятін П.М., Павлов О.О. Кисневий режим на початкових стадіях розвитку травматичної хвороби. Харківська хірургічна школа. 2010. № 6(44). С. 84-87.
14. Тимербаев В.Х., Драгунов А.В., Конохов П.В. Кислородный статус пострадавших с повреждениями органов брюшной полости во время операции. Общая реаниматология. 2017. № 3(13). С. 35-47. DOI: 10.15360/1813-9779-2017-3-35-47.
15. Fröhlich M., Lefering R., Probst C., Paffrath T., Schneider M.M., Maegele M., Sakka S.G., Bouillon B., Wafaisade A.; Committee on Emergency Medicine, Intensive Care and Trauma Management of the German Trauma Society Sektion NIS. Epidemiology and risk factors of multiple-organ failure after multiple trauma: an analysis of 31,154 patients from the TraumaRegister DGU. J. Trauma Acute Care Surg. 2014. № 76(4). Р. 921-928. https://doi.org/10.1097/ta.0000000000000199.
16. Бережной С.Г., Лукач В.Н., Цыганков П.В., Малая Н.С., Фурманова Т.Ю. Оценка показателей кислородного статуса у пациентов в критических состояниях с системной воспалительной реакцией. Анестезиология и реаниматология. 2013. № 3. С. 35-40.
17. Матолінець Н.В., Підгірний Я.М., Нетлюх А.М. Неінвазивний моніторинг гемодинаміки в гострий період політравми як засіб контролю та корекції респіраторних і циркуляторних порушень. Ендоваскулярна нейрорентгенохірургія. 2019. № 2(28). С. 14-23. DOI: 10.26683/2304-9359-2019-2(28).
18. Селиверстов П.А., Шапкин Ю.Г. Оценка тяжести и прогнозирование исхода политравмы: современное состояние проблемы. Современные технологии в медицине. 2017. № 2(9). С. 23-30.
19. Йовенко И.А., Кобеляцкий Ю.Ю., Царев А.В., Кузьмова Е.А., Дубовская Л.Л., Мынка В.Ю., Селезнева У.В. Качественная клиническая практика стартовой интенсивной терапии при боевой и цивильной политравме. Медицина неотложных состояний. 2017. № 2(81). С. 39-50.
20. Стуканов М.М., Юдакова Т.Н., Максимишин С.В., Гирш А.О., Степанов С.С. Показатели, ассоциированные с летальными исходами у больных с травматическим шоком. Политравма. 2015. № 2. С. 37-43.

/47-1.jpg)
/48-1.jpg)
/48-2.jpg)