Журнал «Медицина неотложных состояний» №4(99), 2019
Вернуться к номеру
Інтенсивна терапія компенсованої гастроінтестинальної дисфункції в пацієнтів із черепно-мозковою травмою
Авторы: Вишинська М.Б., Яєчник О.Р.
Львівський національний медичний університет імені Данила Галицького, м. Львів, Україна
Рубрики: Медицина неотложных состояний
Разделы: Клинические исследования
Версия для печати
Особливе місце в галузі інтенсивної терапії посідає субкомпенсована гастроінтестинальна дисфункція в пацієнтів із черепно-мозковою травмою, поєднаною з травмою кісток скелета. Актуальність даного питання пов’язана з високою смертністю в післятравматичному періоді у зв’язку з розвитком гострої поліорганної дисфункції, а гастроінтестинальна дисфунція є одним з основних компонентів поліорганної недостатності. У даній статті поставлено за мету показати вплив інтенсивної терапії гастроінтестинальної дисфункції в стадії компенсації в пацієнтів із черепно-мозковою травмою, поєднаною з травмою кісток скелета, на результати їх лікування. Під час дослідження було сформовано дві групи пацієнтів, однорідні за тяжкістю стану та тяжкістю основної патології. Обидві групи отримували однакове лікування, окрім якого хворим другої групи проводилось раннє ентеральне харчування. В результатах дослідження звертають на себе увагу більш низька летальність та більш швидкий регрес тяжкості стану пацієнтів, зменшення проявів синдрому поліорганної недостатності та синдрому гастроінтестинальної дисфункції в пацієнтів, яким проводилось раннє ентеральне харчування.
Особое место в области интенсивной терапии занимает субкомпенсированная гастроинтестинальная дисфункция у пациентов с черепно-мозговой травмой, сочетанной с травмой костей скелета. Актуальность данного вопроса связана с высокой смертностью в посттравматическом периоде в связи с развитием острой полиорганной дисфункции, а гастроинтестинальная дисфунция является одним из основных компонентов полиорганной недостаточности. В данной статье поставлена цель показать влияние интенсивной терапии гастроинтестинальной дисфункции в стадии компенсации у пациентов с черепно-мозговой травмой, сочетанной с травмой костей скелета, на результаты их лечения. Во время исследования были сформированы две группы пациентов, однородные по тяжести состояния и тяжести основной патологии. Обе группы получали одинаковое лечение, кроме которого больным второй группы проводилось раннее энтеральное питание. В результатах исследования обращают на себя внимание более низкая летальность и более быстрый регресс тяжести состояния пациентов, уменьшение проявлений синдрома полиорганной недостаточности и синдрома гастроинтестинальной дисфункции у пациентов, которым проводилось раннее энтеральное питание.
A special place in the field of intensive care belongs to subcompensated gastrointestinal dysfunction in patients with craniocerebral trauma accompanied by skeletal bone injuries. The urgency of this question is associated with high mortality in the post-traumatic period due to the development of acute multiple organ dysfunction, and gastrointestinal dysfunction is one of the main components of multiple organ failure. The objective of this article is to show the effect of intensive therapy of gastrointestinal dysfunction at the stage of compensation in patients with craniocerebral trauma associated with skeletal bone injuries on the results of their treatment. During the study, two groups of patients were formed, they were homogeneous in terms of severity of patient’s condition and severity of the underlying pathology. Both groups received the same treatment, except for which patients in the second group received early enteral nutrition. The results of the study pay attention to lower mortality and a more rapid regression of severity of patient’s condition, reduced manifestations of multiple organ failure syndrome and gastrointestinal dysfunction syndrome in patients receiving early enteral nutrition.
черепно-мозкова травма; гастроінтестинальна дисфункція компенсована
черепно-мозговая травма; гастроинтестинальная дисфункция компенсированная
craniocerebral trauma; compensated gastrointestinal dysfunction
Вступ
Останнім десятиліттям спостерігається пандемічне поширення черепно-мозкової травми (ЧМТ) у зв’язку із підвищенням темпу життя, збільшенням кількості швидкісних транспортних засобів, індустріалізацією, а також такими явищами, як тероризм, військові конфлікти. У світі щорічно внаслідок ЧМТ гине близько 5 млн осіб [1]. Післятравматичний період у потерпілих із ЧМТ практично завжди ускладнений, що обумовлено розвитком синдрому поліорганної дисфункції (СПОД) та тяжкого сепсису. Приблизно у 80 % хворих із СПОД розвивається гострий респіраторний дистрес-синдром [2]. Однією з провідних ланок патогенезу СПОД є гастроінтестинальна дисфункція (СГІД) [3]. Сучасні погляди базуються на визначенні провідної ролі СГІД у прогресуванні ендогенної інтоксикації (ЕІ) та виникненні загальної відповіді організму на запалення (SIRS) у хворих із ЧМТ [3, 6] за рахунок того, що основним джерелом ендогенної інтоксикації в даної категорії пацієнтів залишається кишка [5].
Розвиток шоку при тяжкій ЧМТ є передумовою появи порушення спланхнічного кровотоку і функцій шлунково-кишкового тракту (ШКТ), відновлення яких відбувається в останню чергу. Тривале перебування пацієнтів із тяжкою ЧМТ у коматозному стані, проведення респіраторної терапії, застосування седативних засобів та міорелаксантів, вазопресорна підтримка сприяють розвитку та прогресуванню СГІД.
Незважаючи на постійне вдосконалення якості діагностики синдрому гастроінтестинальної дисфункції та його інтенсивної терапії в пацієнтів із черепно-мозковою травмою, летальність при даній патології залишається високою [6]. Переважно причиною незадовільних результатів лікування хворих із черепно-мозковою травмою, поєднаною з травмою кісток скелета, є розвиток ендогенної інтоксикації та гнійно-септичних ускладнень, частота яких коливається в межах 19,3–86,0 % і призводить до високої летальності у 25,0–35,0 % осіб [4, 5].
Матеріали та методи
Обстежені 52 хворі з черепно-мозковою травмою, поєднаною з травмою кісток скелета, із синдромом поліорганної дисфункції й ознаками гастроінтестинальної дисфункції в стадії компенсації. З метою об’єктивізації тяжкості процесу проведено бальну оцінку дисфункції ШКТ на основі модифікації методики В.Ф. Саєнко і співавт. (2002) і І.В. Люлько і співавт. (2002), Я.М. Підгірного (2009), В.В. Ніконова і співавт. (2011). Компенсованим СГІД вважали при оцінці 1–2 бали. Усіх пацієнтів розподілено на дві групи, однорідні за віком, статтю, тяжкістю стану, вираженістю проявів СГІД та поліорганної дисфункції. Перша група отримувала терапію, що включала хірургічну санацію вогнища, інфузійну терапію, інотропну і судинну підтримку, респіраторну, антибіотико- та антицитокінову терапію. Друга група пацієнтів, крім вищенаведеної терапії, отримувала раннє ентеральне харчування (РЕХ) сумішшю Nutricomp.
Методика РЕХ: суміш Nutricomp вводили через назогастральний зонд після аспірації залишкового вмісту шлунка. Коли були великі залишкові об’єми шлунка, суміш вводилась інтестинально через назоінтестинальний зонд. Початкова швидкість введення ентеральної суміші становила 0,5 мл/кг/год та коригувалась залежно від переносимості.
Пацієнтам проводилась оцінка загальноклінічних та біохімічних досліджень крові. Інтегральна оцінка тяжкості стану хворих оцінювалася за шкалою АРАСНЕ II, тяжкість поліорганної дисфункції — за шкалою SOFA.
З метою контролю та корекції центральної гемодинаміки, крім таких показників, як артеріальний тиск, систолічний артеріальний тиск, частота серцевих скорочень, центральний венозний тиск, за допомогою ультрасонографії на апараті AlokaSSD-500/SL-450 Siemens (Німеччина) визначали серцевий індекс (СІ).
Дослідження газового складу крові проводили за допомогою апaрата ABL-520 фірми Radiometer Copenhagen (Данія). За величиною СІ й отриманими даними газового складу крові розрахунковим методом (Усенко Л.В., Шифрин Г.А., 1995, 2007; Корячкин В.А., Страшнов В.И., Чуфаров В.Н., 2001) визначали величини постачання та споживання кисню (DO2/VO2), співвідношення раО2/FiO2. Енергетичний баланс клітини визначали за рівнем глюкози, аденозинтрифосфату, лактату (визначали на біохімічному аналізаторі DoctorMuller, Німеччина), пірувату (аналізатор Accutrend, США).
Рівень ендотоксемії оцінювали за рівнем молекул середньої маси (МСМ) (Андрейчик М.А. і співавт., 1998; Назаренко Г.И., Кишкун А.А., 2002), сорбційною здатністю еритроцитів (СЗЕ) та проникністю еритроцитарних мембран (ПЕМ) (Михайлович В.А. і співавт., 1993). Деструктивні зміни в клітинних мембранах характеризують рівень перекисного окислення ліпідів (ПОЛ). Активність ПОЛ оцінювали за рівнем їх первинних продуктів — дієнових кон’югатів (ДК) та вторинних — малонового діальдегіду. Активність процесів ПОЛ визначали за Р.А. Тімірбулатовим, Е.І. Селезневим (1981). Антиоксидантну активність організму визначали за рівнем каталази крові (Чевари С., Андял Т., Штренир Я., 1991; Назаренко Г.И., Кишкун А.А., 2002).
Дослідження проводили в 1-шу (н1, етап 1), на 3-тю (н3, етап 2), 5-ту (н5, етап 3), 7-му (н7, етап 4), 10-ту (н10, етап 5) добу захворювання.
Результати та обговорення
Під час проведення інтенсивної терапії явища SIRS значно швидше регресували у хворих основної групи: зниження температури тіла в них спостерігалось вже на 5-ту добу проведення ІТ (37,1 ± 0,2 °С, р < 0,05), тоді як у хворих контрольної групи — на н10 етапі (37,2 ± 0,3 °С, р < 0,05) (табл. 1). У хворих другої групи швидше регресувала тахікардія (вже на н3 етапі дослідження вона становила 85 ± 5 уд/хв, р < 0,05). У контрольній групі хворих зниження ЧСС наставало лише на н7 етапі дослідження (82 ± 8 уд/хв, р < 0,05).
Зменшення частоти дихання у хворих основної групи наставало вже на 5-ту добу проведення ІТ (20 ± 2 в 1 хв, р < 0,05). Воно корелювало з вірогідним зростанням співвідношення рaO2/FiO2 (355 ± 10, р < 0,05). У хворих контрольної групи цей процес затягувався до 7–10-ї доби. У пацієнтів із СПОД та компенсованим СГІД, яким проводилось РЕХ, швидше зменшувався лейкоцитоз та регресував зсув лейкоцитарної формули вліво (табл. 1). Вже на 5-ту добу проведення ІТ у хворих другої групи спостерігалось зменшення лейкоцитозу до 8,8 ± 1,1 • 109 (р < 0,05), у хворих першої групи воно наставало на н10 етапі дослідження.
Позитивний ефект РЕХ полягає в тому, що зменшується транслокація токсинів із кишки в систему кровообігу. Як видно з даних, які наведені в табл. 2, у хворих із компенсованим СГІД не спостерігалося суттєвих зрушень у системі постачання/споживання кисню (DО2/VO2). Це корелювало з рівнем АТФ в еритроцитах (r = 0,63 при р < 0,05) і 2,3-ДФГ (r = 0,63 при р < 0,05), які також були в межах норми. Можна припустити, що у всіх клітинах організму на такій стадії розвитку СПОД (тяжкість поліорганної дисфункції — 7–8 балів за шкалою SOFA) ще не сформований енергодефіцит, а отже, основною ланкою патогенезу компенсованого СГІД є недостатнє забезпечення ентероцитів нутрієнтами.
Зменшення рівня прозапальних цитокінів, ознак SIRS корелювало зі зниженням ендотоксемії. Вихідне значення ЛІІ у хворих обох груп було вірогідно вищим від норми (р < 0,05), але суттєво між групами не відрізнялося і відповідно становило 1,5 ± 0,5 і 1,6 ± 0,5 ум.од., р > 0,05 (табл. 3). На 5-ту добу у хворих першої групи динаміка ЛІІ мала невірогідний характер (1,3 ± 0,4 ум.од., р > 0,05). У хворих, яким проводилося РЕХ, зниження ЛІІ було вірогідне (0,9 ± 0,2, р < 0,05) порівняно як з вихідним значенням, так і з відповідним показником хворих першої групи. На 7-му добу захворювання у хворих другої групи показник ЛІІ був у межах норми. Зменшення показника ЛІІ до нормального значення у хворих першої групи відбувалося на 10-ту добу проведення інтенсивної терапії.
У хворих із СГІД у результаті катаболізму зростав рівень МСМ (табл. 3). На початку дослідження у хворих обох груп він був майже однаковим і відповідно становив 0,472 ± 0,123 і 0,491 ± 0,153 ум.од. (р < 0,05). Вже на 3-тю добу ІТ у хворих другої групи виявлено зниження рівня МСМ (0,293 ± 0,120 ум.од., р < 0,05). У хворих, яким РЕХ не застосовувалося, їх рівень знижувався на 5-ту добу захворювання (0,320 ± 0,123, р < 0,05). Наприкінці дослідження у хворих, яким проводилося РЕХ, рівень МСМ був у межах норми, у хворих 1-ї групи — все ще перевищував її (0,262 ± 0,100 ум.од., р > 0,05). Ймовірно, РЕХ сприяє зменшенню катаболічних процесів в організмі хворих із компенсованою СГІД. Динаміка інших маркерів ендогенної токсемії, зокрема СЗЕ та ПЕМ, була аналогічною. Вихідні показники СЗЕ у хворих обох груп були підвищені (р < 0,05) і суттєво між собою не відрізнялися (табл. 3). На 3-тю добу цей показник знизився у хворих другої групи і становив 39,7 ± 1,2 % (р < 0,05), з 5-ї доби він знижувався до нормального значення і таким утримувався упродовж всього періоду дослідження. У хворих контрольної групи підвищений рівень СЗЕ залишався до 10-ї доби, коли вперше досягав значення верхньої межі норми (38,2 ± 1,4 %, р = 0,01). ПЕМ у хворих обох груп на початку дослідження була вищою від норми (р < 0,05) і відповідно становила 22,7 ± 0,6 ум.од. і 22,4 ± 0,6 ум.од. На 5-ту добу дослідження у хворих, яким в протокол ІТ було включено РЕХ, ПЕМ була в межах норми (18,4 ± 0,4 ум.од., р < 0,05), у хворих контрольної групи цей показник досягав нормальних значень лише на 10-ту добу захворювання (18,3 ± 0,1 ум.од., р < 0,05), що можна пояснити довшим періодом ендотоксикозу, не останню роль у підтриманні якого відігравав ШКТ.
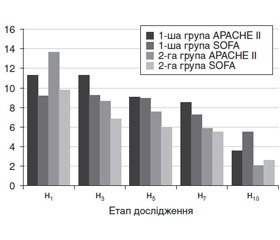
При надходженні у ВАІТ тяжкість стану у хворих обох груп була практично однаковою та за шкалою АРАСНЕ II оцінювалася відповідно в 11,24 ± 1,61 бала (р < 0,05) і 13,64 ± 1,10 бала (р < 0,05). Під час лікування тяжкість стану хворих швидше регресувала у хворих 2-ї групи (рис. 1). Вже на 3-й день захворювання тяжкість стану хворих цієї групи зменшилася і становила 8,58 ± 0,85 бала (р < 0,05). Зниження тяжкості стану пацієнтів за шкалою АРАСНЕ II у 1-й групі хворих було досягнуто на 7-му добу ІТ — 8,52 ± 1,00 бала (р < 0,05). Наприкінці дослідження ці величини відповідно становили 3,6 ± 1,5 (р < 0,05) і 2,1 ± 1,0 бала (р < 0,01).
На початок обстеження тяжкість СПОД у хворих першої і другої групи відповідно становила 9,2 ± 0,5 і 9,8 ± 0,5 бала (р < 0,05) і швидше регресувала у хворих, яким у комплекс ІТ було включено РЕХ. Тяжкість поліорганної дисфункції у хворих контрольної групи упродовж перших семи днів майже не змінювалася (рис. 1), у хворих 2-ї групи вона вірогідно зменшилася на 5-ту добу проведення ІТ — 6,9 ± 0,4 бала (р < 0,05). У хворих 1-ї групи вірогідне зниження поліорганної дисфункції спостерігалося на 7-му добу проведення ІТ — 7,2 ± 0,3 бала (р < 0,05) (рис. 1).
Вихідний стан тяжкості СГІД у хворих першої групи оцінювався у 2,0 ± 0,2 бала, у хворих другої групи — у 2,2 ± 0,2 бала (рис. 2). На 3-й день ІТ зменшення тяжкості СГІД мало вірогідний характер — 1,6 ± 0,2 бала (р < 0,05) у хворих основної групи, тяжкість дисфункції ШКТ у хворих першої групи знижувалася на 7-му добу лікування (1,3 ± 0,2 бала, р < 0,05), хоча все ще залишалася вищою, ніж у хворих другої групи (0,8 ± 0,2 бала, р < 0,05). Така ситуація була і на 10-ту добу перебування хворих у ВАІТ.
Показник інтрамукозного рН на початку дослідження у хворих обох груп був низьким (рис. 3). Застосування РЕХ у хворих із компенсованим СГІД призводило до більш швидкого зростання цього показника на відміну від хворих, яким проводилася стандартна ІТ. Так, у хворих, яким РЕХ було включено в комплекс ІТ, на 5-ту добу захворювання спостерігалося зростання цього показника до 7,26 ± 0,03 (р < 0,05), у хворих першої групи цей показник зростав на 7-му добу ІТ.
Безпосередню ефективність РЕХ оцінювали за рівнем альбуміну в сироватці крові хворого, абсолютною кількістю лімфоцитів і рівнем сечовини крові. РЕХ позитивно впливає на імунний статус організму. Так, кількість лімфоцитів у хворих, в комплекс ІТ яких було включено РЕХ, зростала значно швидше, ніж у хворих контрольної групи (табл. 4). На кінцевому етапі дослідження у хворих контрольної групи все ще була виражена лімфопенія (3,0 ± 0,5 • 103, р < 0,05), у хворих другої групи кількість лімфоцитів у периферичній крові сягала меж норми (4,2 ± 0,5 • 103, р < 0,05).
Перевагою альбуміну як маркера ефективності РЕХ є доступна методика його визначення. Як видно з даних, які наведені в табл. 5, у хворих обох груп на момент надходження у ВАІТ була виражена гіпоальбумінемія (відповідно 22 ± 2 г/л та 21 ± 1 г/л, р < 0,05). У хворих другої групи рівень альбуміну зростав набагато швидше, ніж у хворих контрольної групи. На кінцевому етапі дослідження його рівень у плазмі крові хворих основної групи зростав до 39 ± 2 г/л (р < 0,05), у контрольній групі він все ще був нижчим за норму (29 ± 2 г/л, р < 0,05).
Як відомо, зростання рівня сечовини у критичних хворих вказує на підвищений катаболізм. Проаналізувавши показники сечовини (табл. 6), можна зробити висновок про те, що у хворих, яким проводили РЕХ, зниження її рівня було значно швидшим, ніж у хворих контрольної групи, що може вказувати на зменшення катаболічних процесів в організмі хворого.
Головними проблемами, які виникали при РЕХ, були великий залишковий об’єм шлунка (> 3 мл/кг МТ), що призводило до вимушеного припинення харчування та гіперглікемії. Невдала спроба РЕХ була у 25 % хворих. У 3 % хворих виникала діарея, що була зумовлена застосуванням суміші занадто високої концентрації. При зменшенні концентрації суміші явища діареї припинялися, і через 2–3 доби вдавалося налагодити повноцінне ентеральне харчування.
Висновки
У контрольній групі хворих із компенсованим СГІД летальність становила 16 %. З 25 хворих померло 4 пацієнти. В основній групі хворих із 27 пацієнтів померли 3 хворі, таким чином, летальність становила 11,1 %. Тобто раннє ентеральне харчування не тільки сприяє швидшому регресу ознак СГІД, але і зменшує летальність.
Також можна зробити висновки, що при компенсованій дисфункції ШКТ із метою забезпечення ентероцитів енергетичним і пластичним матеріалом основний акцент терапевтичних заходів повинен бути направлений на забезпечення нутритивної підтримки хворого у вигляді раннього ентерального харчування. Раннє ентеральне харчування призводить до більш швидкого регресу симптомів СГІД і СПОД, зменшення тяжкості стану хворих, тривалості їх перебування в критичному стані і летальності.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів при підготовці даної статті.
1. Rostami E. Traumatic Brain Injury Models in Animals. Methods Mol Biol. 2016. Vol. 1462. P. 47-59.
2. Craniocerebral trauma in the aspects of the evidence-based medicine: an overview of topical international recommendations. Urgent States Medicine. 2014. Vol. 5(60). P. 8-12.
3. Гирш А.О., Довгих В.Г., Мороз В.В. Комбинированная детоксикация у больных с разлитым гнойным перитонитом, протекающим на фоне сахарного диабета. Эфферентная терапия. 2004. № 1. С. 13-16.
4. Григорьев Е.В., Чурляев Ю.А., Сибиль К.В. Клинико-патогенетические варианты повреждения гематоперитонеального барьера при абдоминальном сепсисе. Анестезиология и реаниматология. 2006. № 6. С. 13-15.
5. Григорьев Е.В., Чурляев Ю.А., Сибиль К.В. Клинико-патогенетические варианты повреждения гематоперитонеального барьера при абдоминальном сепсисе. Анестезиология и реаниматология. 2006. № 6. С. 13-15.
6. Гутгиеррез Г., Баллик С. Гипоксия кишечника — двигатель СПОН. Актуальные проблемы анестезиологии и реаниматологии. Освежающий курс лекций (особая папка). Архангельск, 2006. С. 195-201.
7. Підгірний Я.М. Стратегічні напрямки інтенсивної терапії гастроінтестинальної дисфункції як компонента синдрому поліорганної дисфункції. Український журнал екстремальної медицини ім. Г.О. Можаєва. 2009. Т. 10. № 3. С. 135-141.
8. Підгірний Я.М. Гастроінтестинальна дисфункція як компонент поліорганної дисфункції: діагностика та лікування. Український журнал клін. та лаб. діагностики. 2009. № 3. С. 60-64.
9. Komplan L., Kremzar B., Gadzijev E., Prosek M. Effects of early enteral nutrition on intestinal permeability and the developement of multiple organ failure affter mutiple injury. Inten. Care Med. 1999. № 25. Р. 157-161.

/117-1.jpg)
/118-1.jpg)
/119-1.jpg)
/119-2.jpg)
/120-1.jpg)