Журнал «Медицина неотложных состояний» №4(99), 2019
Вернуться к номеру
Патогенетична роль газотрансмітерів та метаболітів орнітинового циклу у формуванні ендотеліальної дисфункції в гострому періоді політравми
Авторы: Матолінець Н.В.
Львівський національний медичний університет імені Данила Галицького, м. Львів, Україна
Рубрики: Медицина неотложных состояний
Разделы: Клинические исследования
Версия для печати
Актуальність. В гострому періоді політравми спостерігається розвиток значних розладів гомеостазу, метаболізму та енергозабезпечення клітин із високою частотою ускладнень та летальністю. Актуальними є дослідження, спрямовані на пошук показників, які б вже при госпіталізації становили собою чутливі маркери тяжкості політравми і прогнозу. Ендотелій регулює основні гемостатичні функції, такі як тонус судин, циркуляція клітин крові, запалення й активність тромбоцитів, а також проліферацію і ріст підлеглих гладких м’язів, діє як бар’єр для контролю обміну нутрієнтами, біомолекулами і месенджерами між кров’ю і навколишніми тканинами. Вивчається роль ендотеліальної дисфункції в поглибленні гіпоксичного ушкодження тканин при травмі. Мета роботи: визначити патогенетичну роль газотрансмітерів сироватки крові та лізату лімфоцитів і метаболітів циклу сечовини в розвитку ендотеліальної дисфункції в гострому періоді політравми. Матеріали та методи. В роботі наведені дані клінічного обстеження та лікування 37 хворих із середньотяжкою і тяжкою політравмою, доставлених у відділення анестезіології та інтенсивної терапії Клінічної лікарні швидкої допомоги м. Львова. Середній вік постраждалих становив 48,4 ± 5,2 року. У дослідження не включали осіб із декомпенсованою хронічною супутньою патологією. Дослідження біохімічних показників виконували на базі лабораторії кафедри біохімії ЛНМУ імені Данила Галицького. Результати. При госпіталізації в сироватці крові потерпілих відмічене статистично значуще зниження вмісту оксиду азоту (NO) на фоні підвищення вмісту його метаболітів (NOx) та сірководню (H2S). Протягом першої доби інтенсивної терапії спостерігалися тенденція до нормалізації вмісту H2S, зростання до рівня контролю рівня NO на фоні подальшого статистично значущого зростання вмісту NOx, рівень H2S наближався до такого в групі контролю і вірогідно знижувався порівняно з вихідним. Вірогідне зниження протягом 24 годин вмісту аргініну та незмінна активність аргіназ вказують на посилений метаболізм аргініну як засобу поповнення дефіциту NO. Вміст сечовини до кінця першої доби в сироватці крові вірогідно зріс, рівень білка статистично значуще знизився. Встановлена негативна кореляція вмісту H2S і активності NO-синтази, що вказує на регуляторний вплив даного газотрансмітеру на активність ферменту. Звертає на себе увагу зміна відношення iNOS до eNOS, а саме збільшення iNOS у пропорції від 14,2 ± 1,1 % на початку лікування до 21,9 ± 1,0 % через 24 години після травми. При цьому підвищується також рівень eNOS, який у фізіологічному стані відіграє стабілізуючу роль у захисті ендотелію. Таким чином, на тлі збільшення iNOS і eNOS існує переважання iNOS над eNOS. Висновки. В гострому періоді політравми на фоні посилення катаболічних процесів спостерігається розвиток ендотеліальної дисфункції, що підтверджується змінами вмісту газотрансмітерів і їх метаболітів у сироватці крові хворих (NO, NOx і H2S), які становлять собою чутливі маркери тяжкості політравми. Інтенсивна терапія протягом доби сприяє тенденції до нормалізації їх вмісту. Вказані зміни поєднуються зі значним підвищенням активності NO-синтаз на противагу незмінній у цей період активності аргіназ, що свідчить про домінування метаболізму аргініну в напрямі синтезу нітроксиду.
Актуальность. В остром периоде политравмы наблюдается развитие значительных расстройств гомеостаза, метаболизма и энергообеспечения клеток с высокой частотой осложнений и летальности. Актуальными являются исследования, направленные на поиск показателей, которые уже при поступлении пациентов представляли бы собой чувствительные маркеры тяжести политравмы и прогноза. Эндотелий регулирует основные гомеостатические функции, такие как тонус сосудов, циркуляция клеток крови, воспаление и активность тромбоцитов, а также пролиферацию и рост подчиненных гладких мышц, действует как барьер для контроля обмена нутриентами, биомолекул и мессенджерами между кровью и окружающими тканями. Изучается роль эндотелиальной дисфункции в углублении гипоксического повреждения тканей при травме. Цель работы: определить патогенетическую роль газотрансмиттеров сыворотки крови и лизата лимфоцитов и метаболитов цикла мочевины в развитии эндотелиальной дисфункции в остром периоде политравмы. Материалы и методы. В работе приведены данные клинического обследования и лечения 37 больных со среднетяжелой и тяжелой политравмой, доставленных в отделение анестезиологии и интенсивной терапии Клинической больницы скорой помощи г. Львова. Средний возраст пострадавших составлял 48,4 ± 5,2 года. В исследование не включали лиц с декомпенсированной хронической сопутствующей патологией. Исследование биохимических показателей проводили на базе лаборатории кафедры биохимии ЛНМУ имени Данила Галицкого. Результаты. При госпитализации в сыворотке крови пострадавших отмечено статистически значимое снижение содержания оксида азота (NO) на фоне повышения содержания его метаболитов (NOx) и сероводорода (H2S). В течение первых суток интенсивной терапии отмечались нормализация содержания H2S, рост к уровню контроля уровня NO на фоне дальнейшего статистически значимого роста содержания NOx, уровень H2S приближался к группе контроля и достоверно снижался в сравнении с исходными данными. Достоверное снижение в течение 24 часов содержания аргинина и неизменная активность аргиназы указывают на усиленный метаболизм аргинина как средства восполнения дефицита NO. Содержание мочевины к концу первых суток в сыворотке крови достоверно выросло, уровень белка статистически значимо снизился. Установлена отрицательная корреляция содержания H2S и активности NO-синтазы, что указывает на регуляторное влияние данного газотрансмиттера на активность фермента. Обращает на себя внимание изменение отношения іNOS к еNOS, а именно увеличение іNOS в пропорции от 14,2 ± 1,1 % в начале лечения до 21,9 ± 1,0 % через 24 часа после травмы. При этом повышается также уровень еNOS, который в физиологическом состоянии играет стабилизирующую роль в защите эндотелия. Таким образом, на фоне увеличения іNOS и еNOS существует преобладание іNOS над еNOS. Выводы. В остром периоде политравмы на фоне усиления катаболических процессов наблюдается развитие эндотелиальной дисфункции, что подтверждается изменениями содержания газотрансмиттеров и их метаболитов в сыворотке крови больных (NO, NOx и H2S), которые представляют собой чувствительные маркеры тяжести политравмы. Интенсивная терапия в течение суток способствует тенденции к нормализации их содержания. Указанные изменения сочетаются со значительным повышением активности NO-синтазы в противовес неизменной в этот период активности аргиназы, что свидетельствует о доминировании метаболизма аргинина в направлении синтеза нитроксида.
Background. Considerable homeostatic, metabolic and cell energy supply disorders occur during acute period of polytrauma, which lead to a high rate of complications and mortality. Investigations aimed to detect highly sensitive biomarkers of polytrauma degree and its prognosis are very urgent. Endothelium regulates main hemostatic functions such as vascular tone, blood cells circulation, inflammatory responses, thrombocytes activity, proliferation and growth of underlying smooth muscles, and acts as a control barrier for nutrients, biomolecules and signaling molecules between blood and surrounding tissues. Significance of endothelial dysfunction in increased cellular hypoxic damage in trauma is studied. The purpose was to determine pathogenic role of gaseous transmitters in blood serum and lymphocyte lysate, and urea cycle metabolites in endothelium dysfunction during acute period of polytrauma. Materials and methods. Data from clinical examination and treatment of 37 patients with moderate and severe polytrauma who were admitted to the intensive care unit (the department of anesthesiology and intensive care) of Lviv Emergency Hospital are presented. The mean age of all patients was 48.4 ± 5.2 years. Patients with decompensated chronic diseases were excluded from the study. Analysis of biochemical markers was performed in laboratory of biochemical department of Danylo Halytsky Lviv National Medical University. Results. There was a statistically significant decrease in nitric oxide (NO) serum level while levels of its metabolites (NOx) and hydrogen sulfide (H2S) were increased at the time of admission. During first 24 hours of intensive care, H2S level normalized, NO level increased to the control one with a simultaneous statistically significant increase of NOx level. H2S level approached to the control group level and was significantly decreasing compared to the baseline. A significant decrease in arginine level and constant arginase activity during 24 hours indicate the intensified arginine metabolism as a way of NO replenishment. Twenty-four hours after the admission, urea serum level significantly increased, exceeded normal range, protein serum level significantly decreased. We found a negative correlation between H2S level and NO-synthase activity, which indicates regulatory influence of this gaseous transmitter on the enzyme activity. However, attention is drawn to the change in the ratio of inducible nitric oxide synthase (iNOS) to endothelial nitric oxide synthase (eNOS), namely, the iNOS increase in the proportion from 14.2 ± 1.1 % at the beginning of the therapy to 21.9 ± 1.0 % 24 hours after the injury. Simultaneously, eNOS level increases that in physiological conditions has a stabilizing influence on endothelium protection. So, while both levels of iNOS and eNOS are increasing, there is a prevalence of iNOS over eNOS. Conclusions. During the acute period of polytrauma, the development of endothelial dysfunction is observed against the background of enhancement of catabolic processes, and this is confirmed by the changes of gaseous transmitters and their metabolites serum levels (NO, NOx і H2S), which are sensitive markers of polytrauma severity. Intensive care during the first day after the admission helps to normalize their levels. The indicated changes are combined with a significant increase in the activity of NO-synthase, as against the unchanged activity of arginases in this period, which indicates the dominance of arginine metabolism in the direction of nitroxide synthesis.
політравма; оксид азоту; NO-синтаза; сірководень; аргінін; аргіназа
политравма; оксид азота; NO-синтаза; сероводород; аргинин; аргиназа
polytrauma; nitric oxide; NO-synthase; hydrogen sulfide; arginine; arginase
Вступ
Тяжка механічна травма викликає стрімку активацію і швидке виснаження всіх механізмів адаптації з порушенням інтегративних регуляторних функцій центральної нервової системи і призводить до значних розладів гомеостазу, метаболізму та енергозабезпечення клітин із високою частотою ускладнень та летальністю [1]. Встановлено, що пошкодження тканин призводить до системного запального синдрому та ендотеліальної дисфункції з наслідками патологічного процесу для різних органів і систем [2, 3]. Провідну роль у цьому механізмі відіграють лімфоцити, ендотеліальні клітини, природні клітини-кілери (NK-клітини), макрофаги, нейтрофіли та моноцити [4–6].
Ендотелій — це активний ендокринний орган, основною функцією якого є збалансоване виділення регуляторних субстанцій, що визначають цілісну роботу системи кровообігу. Всі речовини, синтезовані ендотеліоцитами, можна розподілити на декілька груп, основними з яких є вазоактивні субстанції (вазодилататори і вазоконстриктори), а саме оксид азоту (NO), ендотелін-1, ангіотензин II (можливо, ангіотензин I), простациклін, тромбоксан та ін. Іншу групу становлять гемостатичні й антитромботичні фактори (про- і антикоагулянти) — простациклін, оксид азоту (NO), тромбомодулін, гепариноподібний глюкозаміноглікан, тканинний активатор плазміногена, фактор Віллібранта й ін. [7]. Таким чином, NO є представником обох груп речовин, синтезованих ендотеліоцитами, тобто впливає на різні ланки судинної регуляції в нормі та при патології.
У нормально функціонуючому ендотелії низькі рівні NO постійно вивільняються для підтримки кровоносних судин у стані дилатації. Існує два варіанти фізіологічної секреторної активності ендотелію: базальна або постійна (синтез NO і простацикліну) та стимульована секреція (виділення біологічно активних речовин при стимуляції або пошкодженні ендотелію (ендотелін-1, активатор тканинного плазміногену та ін.).
При впливі різних факторів здатність ендотеліальних клітин звільняти релаксуючі фактори зменшується, тоді як утворення судинозвужуючих факторів зберігається або збільшується, тобто формується стан дисфункції ендотелію [8, 9]. У певних ситуаціях (наприклад, гостра гіпоксія або кровотеча) клітини ендотелію, навпаки, стають причиною вазоконстрикції як за рахунок зниження продукції NO, так і внаслідок посиленого вироблення речовин із вазоконстрикторним ефектом — ендотеліну-1. Таким чином, функції ендотелію складаються як баланс протилежно направлених сил: посилення — послаблення судинного тонусу, агрегація — дезагрегації клітин крові. Кожного разу результат визначається концентрацією синтезованих речовин, між якими існують сувора залежність і рівновага.
Ініціювальна дія NO на процес апоптозу спостерігається при утворенні високих концентрацій NO в клітинах і тканинах, наприклад, при функціонуванні індуцибельної NO-синтази. Очевидно, це зумовлене тим, що при інтенсивній генерації NO різко підвищується ймовірність його перетворення в пероксинітрит, який запускає процес апоптозу [10].
Наростання рівня оксиду азоту є відображенням його ролі як ефектора в розвитку оксидантного процесу, вивільненні нейротрансмітерів та ініціації стрес-реалізуючих реакцій імунонейроендокринної системи [11, 12].
Аргіназа — фермент, що каталізує гідроліз L-аргініну, субстрату для синтезу оксиду азоту, до L-орнітину і сечовини. Поза орнітиновим циклом аргіназа може мати інші функції, зокрема вона забезпечує доступність орнітину для синтезу поліамінів, а також проліну [13].
У людини існує дві ізоформи аргінази, вони схожі між собою за ензиматичною активністю та потребою у мангані, проте відрізняються субклітинною локалізацією, поширенням у різних тканинах, регуляцією експресії та імунологічною реактивністю. Аргіназа I локалізується в цитоплазмі клітин і експресується переважно в печінці. Натомість аргіназа II є мітохондріальним ферментом, у невеликих кількостях він наявний у нирках, мозку, тонкому кишечнику, молочних залозах, макрофагах, проте його майже або зовсім немає в печінці. Аргіназа II гідролізує L-аргінін, знижуючи тим самим синтез оксиду азоту, призводить до розвитку ендотеліальної дисфункції та виникнення цілого ряду кардіоваскулярних патологій [14]. У людини аргіназа I конститутивно експресується в поліморфноядерних нейтрофілах і звільняється під час запалення. Фармакологічне втручання в метаболізм L-аргініну є новою перспективною стратегією в лікуванні раку, автоімунного або набутого порушення імунітету [15].
Два важливі аспекти надмірної активності аргінази можуть бути залучені до патогенезу захворювань. По-перше, надмірно активна аргіназа може зменшувати постачання L-аргініну, необхідного для продукції оксиду азоту NO-синтазою (NOS). По-друге, занадто багато L-орнітину може призвести до структурних проблем у судинній мережі та нейрональної токсичності. Результативні дослідження продемонстрували, що підвищене утворення активних форм кисню і ключові медіатори запалення сприяють цьому патологічному підвищенню активності аргінази [16].
Мета роботи: визначити патогенетичну роль газотрансмітерів сироватки крові та лізату лімфоцитів і метаболітів циклу сечовини в розвитку ендотеліальної дисфункції в гострому періоді політравми.
Матеріали та методи
В роботі наведені дані клінічного обстеження та лікування 37 хворих із політравмою, доставлених у відділення анестезіології та інтенсивної терапії (ВАІТ) Клінічної лікарні швидкої допомоги м. Львова. Середній вік постраждалих становив 48,4 ± 5,2 року. Термін госпіталізації до стаціонару в середньому становив 0,5–1,0 години. На догоспітальному етапі хворим проводились транспортна іммобілізація, введення знеболювальних препаратів, інфузійна терапія.
Ступінь тяжкості травматичних пошкоджень визначали за допомогою шкали Injury Severity Score (ISS), а для прогнозування смертності використовували шкалу APACHE II. Відповідно до стратифікації в дослідження були включені пацієнти із середньотяжкою та тяжкою політравмою. У дослідження не включали осіб із декомпенсованою хронічною супутньою патологією.
Усі пацієнти з політравмою були госпіталізовані в протишокову палату ВАІТ, де проводився комплекс клініко-лабораторних та інструментальних досліджень з оцінкою клінічних ознак травматичного шоку при надходженні.
Обстеження пацієнтів та надання їм медичної допомоги здійснювалися згідно з Протоколом надання медичної допомоги «Політравма» (Наказ МОЗ № 24 від 17.01.2005); Уніфікованим клінічним протоколом екстреної медичної допомоги: Політравма (Наказ МОЗ № 34 від 15.01.2014), Міжнародним протоколом ведення пацієнтів із травмою — Advanced trauma life support (ATLS®): the ninth edition. ATLS Subcommittee; American College of Surgeons, Committee on Trauma (2013) [17].
Протишокова терапія включала зупинку кровотечі, адекватне знеболювання, забезпечення адекватного газообміну. Забезпечувалися центральний венозний доступ шляхом катетеризації підключичної вени, постановка назогастрального зонда, сечового катетера. Об’єм та темп інфузійної терапії визначалися дефіцитом об’єму циркулюючої крові з відновленням гострої крововтрати. Виконувалися екстрені оперативні втручання з метою ліквідації станів, що загрожують життю. Всім хворим проводились корекція водно-електролітної рівноваги та метаболічних порушень, респіраторна терапія за показаннями, призначалися антибактеріальна терапія, аналгоседація, корекція порушень гемостазу, симптоматична терапія.
Дослідження біохімічних показників виконувалося на базі лабораторії кафедри біохімії ЛНМУ імені Данила Галицького. Аналіз газотрансмітерів у сироватці крові та в лізаті лімфоцитів проводили при надходженні та через 24 години інтенсивної терапії.
В сироватці крові визначали концентрацію нітрит-аніону (NO2-) (мкмоль/л), кінцевого стабільного продукту метаболіту NO та суму нітритів NO2 + NO3 (NOx) (мкмоль/л), використовуючи відцентрифуговану при охолодженні кров та реактив Грісса [18]. Рівень гідроген сульфіду (H2S) (мкмоль/л) вимірювали за допомогою реакції з N, N-диметил-парафенилдіаміном, каталізованим FeCl3 [19].
Активність індуцибельної NO-синтази (iNOS), ендотеліальної NO-синтази (eNOS) та сумарну активність NO-синтаз (NOS) у лізаті лімфоцитів визначали за методикою M.Y. Ravaeva, результати повідомляли в нмоль/хв × мл [20].
Дослідження активності аргінази (мкмоль/хв × мл) проводили за методом J.W. Geyer, 1971 [21]. Ензимну активність визначали за кількістю утвореної в реакції сечовини. Дослідження вмісту L-аргініну (мкг/мл) у плазмі крові проводили за методом Т.Л. Алейникової, Г.В. Рубцова (1988) [22].
Рівень сечовини (ммоль/л) та загального білка (г/л) у плазмі крові визначали автоматичним біохімічним аналізатором BioChem FC-360 повністю ферментативним методом кінетичного визначення сечовини (GLDH Method) та фотоколориметричним тестом визначення загального білка (Biuret Method).
Математичний аналіз результатів дослідження здійснювався за допомогою ліцензійних пакетів прикладних програм: табличного редактору Microsoft Office Exсel 2010, пакета статистичного аналізу даних Statistica 6. Порівняння статистичних характеристик у різних групах і в динаміці спостереження проводилось із використанням параметричних і непараметричних критеріїв (з урахуванням закону розподілу). Результати при p < 0,05 вважалися статистично значущими.
Результати та обговорення
Наші дослідження показали неоднозначність змін рівня газотрансмітерів та їх метаболітів у сироватці крові та лізаті лімфоцитів у хворих у гострому періоді політравми.
Існують статистично вірогідні відмінності в рівнях NO, NOS, iNOS і eNOS, H2S у лізаті лімфоцитів на момент госпіталізації та через 24 години після політравми. З перших годин після політравми реєструвалось статистично значуще зниження рівня NO і в сироватці крові, і в лізаті лімфоцитів — в 1,4 раза від норми за рахунок підвищення деградації, пригнічення експресії та інактивації ендотеліальної NO-синтази, а також зниження його синтезу. Це обумовлювало ймовірність розвитку ендотеліальної дисфункції протягом гострого періоду травматичної хвороби. Вихід із травматичного шоку супроводжувався тенденцією до нормалізації рівня NO, що свідчило про ефективність інтенсивної терапії, зокрема рідинної ресусцитації [1, 23].
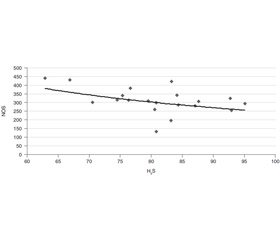
Результати дослідження продемонстрували значне підвищення рівня NO з одночасним зменшенням H2S до кінця першого дня після політравми на тлі інтенсивної терапії та стабілізації гемодинамічних параметрів пацієнтів (рис. 1, 2).
Вміст NO в лізаті лімфоцитів не відрізнявся суттєво від вмісту в сироватці крові з тенденцією до нормалізації впродовж першої доби лікування пацієнтів із політравмою. Рівень H2S у лізаті лімфоцитів був вірогідно вищим, ніж у сироватці крові, проте динаміка протягом першої доби була подібною. На тлі проведення інтенсивної терапії рівень H2S крові зменшувався і досягав норми як у сироватці крові, так і в лізаті лімфоцитів [24].
Результати дослідження продемонстрували значне підвищення рівня NO-синтази за рахунок збільшення рівня як iNOS, так і eNOS. При цьому звертає на себе увагу зміна відношення iNOS до eNOS, а саме збільшення iNOS у пропорції від 14,2 ± 1,1 % на початку лікування до 21,9 ± 1,0 % через 24 години після травми (табл. 1). При цьому підвищувався також рівень eNOS, який у фізіологічному стані відіграє стабілізуючу роль у захисті ендотелію. Таким чином, на тлі збільшення iNOS і eNOS існувало значне переважання iNOS над eNOS.
Протягом першої доби після політравми спостерігалося значне зниження рівня H2S, що може свідчити про дисбаланс між прозапальними ефектами iндуцибельної NOS і протизапальною дією H2S. Зниження рівня гідроген сульфіду, можливо, відбувалось внаслідок вичерпання виробництва H2S у відповідь на політравму, що призводить до послаблення його захисної ролі. H2S виступає також регулятором NO-синтази, про що свідчить встановлена нами негативна кореляція вмісту H2S і активності NOS (рис. 2).
Аргінін є єдиним субстратом для синтезу NO шляхом утворення його метаболітів NOx (NO2 + NO3) і сприяє проліферації і дозріванню Т-клітин людини. Аргінін також метаболізується ферментом аргіназою, що продукує сечовину й орнітин, попередник поліамінів.
При надходженні пацієнтів із політравмою концентрація аргініну в сироватці крові становила 66,6 ± 1,3 мкг/мл, активність аргінази — 0,26 ± 0,01 мкмоль/хв × мл. Вміст сечовини в сироватці крові на момент госпіталізації становив 8,5 ± 0,6 ммоль/л, рівень білка — 58,1 ± 0,9 г/л (табл. 2).
Через добу інтенсивної терапії рівень аргініну в сироватці крові статистично значуще знижувався і становив 59,5 ± 0,9 мкг/мл (t = 4,3, p < 0,001), активність аргінази залишалась в межах 0,27 ± 0,01 мкмоль/хв × мл. Вміст сечовини до кінця першої доби в сироватці крові вірогідно зріс, перевищивши норму, і становив 10,7 ± 0,6 ммоль/л (t = 2,6, p = 0,01), рівень білка знижувався статистично значуще до 53,8 ± 1,1 г/л (t = 3,03, p = 0,02).
Таким чином, наше дослідження показало зниження рівня аргініну на фоні незмінної активності аргіназ, що вказує на посилений рівень метаболізму аргініну — засіб підтримки функції ендотелію шляхом поповнення дефіциту NO, який виникає у пацієнтів із перших годин після травми.
Наші дані збігаються з науковими роботами, де в експерименті на мишах встановлено, що травма збільшувала експресію й активність білка аргінази I селезінки (р = 0,01) протягом 12 год і протягом принаймні 48 год після травми та збігалася з підвищеним вмістом мРНК аргінази I через 24 год (р < 0,05) [25].
Як відомо з літератури, аргіназа, а не iNOS є домінуючим шляхом для метаболізму аргініну, зокрема в імунних клітинах селезінки через 24 год після травми [25]. Наші дані мають певні відмінності, а саме: встановлено зростання активності NO-синтази, особливо iNOS на фоні незмінної активності аргіназ. Це вказує, на наш погляд, на домінування NOS у регуляції метаболізму аргініну в напрямі синтезу нітроксиду, підтримці судинного тонусу, регуляції обміну NO. Причиною цього може бути знижена активність аргініносукцинат-синтази, яка каталізує взаємодію цитруліну з аспартатом, продуктом якої є аргініносукцинат, що відразу ж розщеплюється аргініносукциназою (аргініносукцинат-ліазою) до аргініну та фумарату [26, 27] порівняно з iNOS або/і браком каналювання субстратів між ферментами [28].
Другий етап циклу орнітину (сечовини) полягає в розщепленні аргініну під впливом аргінази на сечовину та орнітин. Мітохондріальні та цитоплазматичні ферменти циклу сечовини утворюють кластери, в яких продукт однієї реакції безпосередньо передається активному центру ферменту, що каталізує наступну. Таким чином, як цитрулін, так і аргініносукцинат, аргінін та орнітин підлягають каналюванню і не розчиняються у цитозолі. У загальний пул метаболітів вивільняється тільки сечовина [6].
У наших пацієнтів із політравмою протягом першої доби сталось вірогідне зростання вмісту сечовини, що є проявом активного катаболізму білка, загальний рівень якого в цей період вірогідно знижувався до 53,8 ± 1,1 г/л (табл. 2). Аспартат, що утворюється у мітохондріях у реакції переамінування між оксалоацетатом та глутаматом, може переноситись у цитозоль, де він виступає донором оксиду азоту в реакції синтезу аргініносукцинату. Ці реакції об’єднують під назвою «аспартат-аргініносукцинатний шунт», що забезпечує зв’язок між окремими метаболічними шляхами, за якими перетворюються аміногрупи та карбонові скелети амінокислот [6]. Власне, наявність суміжних шляхів метаболізму нітросполук дозволяє досягти при стресі, яким є політравма, нормалізації функції ендотелію, зменшення гіпоксії та збереження внутрішніх резервів субстратів для синтезу газотрансмітерів.
Висновки
1. В гострому періоді політравми спостерігається розвиток ендотеліальної дисфункції, що підтверджується статистично значущими змінами рівня газотрансмітерів і їх метаболітів у сироватці крові хворих (NO, NOx, H2S). Концентрації NO та продуктів його окиснення (NOx) у сироватці крові, визначені при госпіталізації, становлять собою чутливі маркери тяжкості політравми.
2. Інтенсивна терапія в гострому періоді політравми протягом доби сприяє нормалізації рівня NO та H2S на фоні статистично значущого зростання вмісту метаболітів NO (NOx) у сироватці крові. Вказані зміни поєднуються зі значним підвищенням активності NO-синтаз, що свідчить про їх домінування в регуляції метаболізму аргініну в напрямі синтезу нітроксиду на противагу незмінній у цей період активності аргіназ. Низький рівень NOx у хворих із вкрай тяжкою травмою при госпіталізації може прогнозувати несприятливий перебіг гострого періоду травматичної хвороби.
3. Протягом першої доби відбувається посилення катаболічних процесів, про що свідчить статистично значуще зростання вмісту сечовини і зменшення рівня білка в сироватці крові. Порівняно із загальними клінічними показниками газотрансмітери швидше і чутливіше реагують на зміни в гомеостазі, що дозволяє використовувати їх як біомаркери тяжкості і прогнозу політравми в гострий період.
Конфлікт інтересів. Автор заявляє про відсутність конфлікту інтересів при підготовці даної статті.
1. Матолінець Н.В. Роль газотрансмітерів у патогенезі органної дисфункції при політравмі. Медицина невідкладних станів. 2018. № 3(90). С. 33-39 (фах.). doi: 10.22141/2224-0586.3.90.2018.129480.
2. Trancă S.D., Petrişor C.L., Hagău N. Biomarkers in polytrauma induced systemic inflammatory response syndrome and sepsis — a narrative review. Romanian Journal of Аnaesthesia and Intensive Сare. 2014. 21(2). Р. 118-122. PMCID: PMC5505349. PMID: 28913443.
3. Roy J., Galano J.-M., Durand T. et al. Physiological role of reactive oxygen species as promoters of natural defenses. The FASEB Journal. 2017. 31(9). Р. 3729-3745. doi: 10.1096/fj.201700170R.
4. Menges T., Engel J., Welters I. et al. Changes in blood lymphocyte populations after multiple trauma: association with posttraumatic complications. Crit. Care Med. 1999. 27(4). Р. 733-40. PMID: 10321662.
5. Pierrakos C., Vincent J.L. Sepsis biomarkers: a review. Crit. Care. 2010. 14. Р. 1-18. doi: 10.1186/cc8872.
6. Namas R.A., Mi Q., Namas R. et al. Insights into the Role of Chemokines, Damage-Associated Molecular Patterns, and Lymphocyte-Derived Mediators from Computational Models of Trauma-Induced Inflammation. Antioxid. Redox Signal. 2015. 23(17). Р. 1370-87. PMCID: PMC4685502, PMID: 26560096.
7. Марков Х.М. О биорегуляторной системе L-аргинин оксид азота. Пат. физиология и эксперим. терапия. 1996. № 1. С. 34-39.
8. Lo Faro M.L., Fox B., Whatmore J.L., Winyard P.G., Whiteman M. Hydrogen sulfide and nitric oxide interactions in inflammation. Nitric Oxide. 2014. 41. Р. 38-47. doi: 10.1016/j.niox.2014.05.014.
9. Gamboa А., Abraham R., Diedrich А. et al. Role of Adenosine and Nitric Oxide on the Mechanisms of Action of Dipiridamole. Stroke. 2005. Vol. 36. P. 2170-2175. doi: 10.1161/01.STR.0000179044.37760.9d.
10. Ванин А.Ф. Оксид азота в биомедицинских исследованиях. Вестн. РАМН. 2000. № 4. С. 3-5.
11. Єлейник М.В. Хірургічна корекція та профілактика порушень ліквородинаміки при лікуванні розривів артеріальних аневризм головного мозку: Автореф. дис… канд. мед. наук: спец. 14.01.05 «нейрохірургія». Київ, 2015. 20 с. Режим доступу: http://library.odmu.edu.ua/catalog/233063
12. Малахов В.А., Монастырский В.О., Дженелидзе Т.Т. Оксид азота и иммунонейроэндокринная система. Междунар. неврол. журнал. 2008. № 3(19). С. 14-18. Режим доступу: http://www.mif-ua.com/archive/article/6143.
13. Wu G., Morris S.M. Jr. Arginine metabolism: nitric oxide and beyond. Biochem. J. 1998. 15. Р. 1-17. PMID 9806879.
14. Якушев В.И., Покровский М.В., Корокин М.В., Покровская Т.Г., Куликовская В.А., Ершов И.Н., Бесхмельницына Е.А., Арустамова А.А., Котельникова Л.В. Аргиназа — новая мишень для фармакологической коррекции эндотелиальной дисфункции. Научные ведомости Белгородского государственного университета. Серия: Медицина. Фармация. 2012. Vol. 20-3. № 22(141). Р. 36-40.
15. Munder M. Arginase: an emerging key player in the mammalian immune system. Br. J. Pharmacol. 2009. 158(3). Р. 638-51. doi: 10.1111/j.1476-5381.2009.00291.x.
16. William Caldwell R., Paulo C. Rodriguez, Haroldo A. Toque, S. Priya Narayanan, Ruth B. Caldwell. Arginase: A Multifaceted Enzyme Important in Health and Disease. Physiol Rev. 2018 Apr 1. 98(2). Р. 641-665. Published online 2018 Feb 7. doi: 10.1152/physrev.00037.2016. PMCID: PMC5966718.
17. Наказ Міністерства охорони здоров’я України від 17 квітня 2014 року № 275. Уніфікований клінічний протокол екстреної, первинної, вторинної (спеціалізованої), третинної (високоспеціалізованої) медичної допомоги та медичної реабілітації при геморагічному інсульті (внутрішньомозкова гематома, аневризмальний субарахноїдальний крововилив) [Електронний ресурс] / Розроб.: М.К. Хобзей, Т.С. Міщенко, А.В. Степененко та ін. Київ, 2014. 99 с.
18. Bryan N.S., Grisham M.B. Methods to detect nitric oxide and its metabolites in biological samples. Free Radic. Biol. Med. 2007. 43(5). Р. 645-657. doi: 10.1016/j.freeradbiomed.2007.04.026.
19. Березовський В.Я., Плотнікова Л.М. Роль ендогенного сірководню в регуляції фізіологічних функцій організму. Медична гідрологія та реабілітація. 2013. № 1. С. 117-122. Режим доступу: https://fz.kiev.ua/journals/2015_ V.61/2015_3/2015_3-28-34.pdf.
20. Раваева М.Ю., Чуян Е.Н. Измерение активности системы оксида азота под действием низкоинтенсивного излучения: Ученые записки Таврического национального университета им. В.И. Вернадского. Серия Биология. Химия. 2011. 24. Р. 201-10.
21. Geyer J.W., Dabich D. Rapid method for determination of arginase activity in tissue homogenates. Anal. Biochem. 1971 Feb. 39(2). Р. 412-7. doi: 10.1016/0003-2697(71)90431-3.
22. Алейникова Т.Л., Рубцова Г.В., Павлова Н.А. Руководство к практическим занятиям по биохимии. Москва: Медицина, 2000.
23. Матолінець Н.В. Динаміка сироваткових рівнів метаболітів оксиду азоту та сульфіду водню як маркерів розвитку органної дисфункції у гострому періоді політравми. Медицина неотложных состояний. 2018. № 4(91). С. 107-113. doi: 10.25284/2519-2078.4(85).2018.151465
24. Matolinets N., Sklyarova H., Sklyarov A. Nitric oxide and hydrogen sulfide markers of acute period of polytraumа. Wiadomości lekarskie. 2018. № 8(85). С. 1489-1492. PMID: 30684329.
25. Bernard A.C., Mistry S.K., Morris S.M. Jr, O’Brien W.E., Tsuei B.J., Maley M.E., Shirley L.A., Kearney P.A., Boulanger B.R., Ochoa J.B. Alterations in arginine metabolic enzymes in trauma. Shock. 2001 Mar. 15(3). Р. 215-9. PMID: 11236905.
26. Мхітарян Л.С., Кучменко О.Б., Євстратова І.Н., Ліпкан Н.Г., Василинчук Н.М., Дроботько Т.Ф. Цитрулін як маркер функціонального стану органів за умов патологічних станів. Український кардіологічний журнал. 2016. 3. С. 109-115.
27. Nelson D.L., Cox M.M. Lehninger Principles of Biochemistry (вид. 5th). W.H. Freeman. 2008. ISBN 978-0-7167-7108-1.
28. Daiber A., Steven S., Weber A. et al. Targeting vascular (endothelial) dysfunction. Br. J. Pharmacol. 2016. doi: 10.1111/bph.13517.

/94-1.jpg)
/95-1.jpg)