Международный неврологический журнал №4 (106), 2019
Вернуться к номеру
Структурно-морфометричні особливості головного мозку у пацієнтів, які перенесли аневризмальний субарахноїдальний крововилив
Авторы: Дуве Х.В.
ДВНЗ «Тернопільський державний медичний університет імені І.Я. Горбачевського МОЗ України», м. Тернопіль, Україна
Рубрики: Неврология
Разделы: Клинические исследования
Версия для печати
Актуальність. Вивчення структурних змін головного мозку після перенесеного аневризмального субарахноїдального крововиливу (аСАК), з’ясування їх зв’язку з функціональним станом пацієнта, когнітивними та психоемоційними розладами сприяє удосконаленню діагностичних підходів та оптимізації прогнозування перебігу захворювання. Мета роботи: оцінити структурно-морфометричні зміни головного мозку у пацієнтів у відновному та резидуальному періодах аСАК. Матеріали та методи. Проведено комплексне обстеження 114 пацієнтів у відновному та резидуальному періодах аСАК. Враховували клініко-анатомічну форму крововиливу, дані Монреальського когнітивного тесту, значення індексу Бартел та модифікованої шкали Ренкіна, оцінку психоемоційної сфери за госпітальною шкалою тривожності і депресії. Оцінювали дані комп’ютерної томографії головного мозку з подальшим визначенням морфометричних показників та індексів. Для статистичної обробки результатів користувались програмами Microsoft Excel 2011, Statistica 10 та SPSS Statistics. Результати. За даними морфометрії, у пацієнтів, які перенесли аСАК, виявляли як внутрішню церебральну атрофію (ЦА), що була вираженою у 41 (35,96 %) пацієнта, легкою та помірною — у 21 (18,43 %), так і зовнішню ЦА, що мала дифузний (у 29,82 % пацієнтів) і фокальний (у 14,03 %) тип. При проведенні розподілу пацієнтів за поширеністю атрофічного процесу лише внутрішню ЦА виявляли у 25,43 % пацієнтів, лише зовнішню — у 17,54 %, змішану — у 28,07 %. Вірогідно вищими за значення контрольної групи були біфронтальний індекс, індекс фронтальних рогів та індекс Шлатенбрандта — Нюрнберга, а також показники співвідношення Еванса (p < 0,01). Зі збільшенням розміру правого та лівого бокового шлуночків показники когнітивного тесту ставали гіршими (r = –0,380; p = 0,000, та r = –0,479; p = 0,000). У групах пацієнтів із внутрішньою та змішаною ЦА встановлено вірогідно нижчі показники когнітивного функціонування, що відповідали помірному когнітивному зниженню. Висновки. У 71,04 % пацієнтів, які перенесли аСАК, було виявлено ЦА: у 25,43 % — внутрішню, у 17,54 % — зовнішню та у 28,07 % — змішану. Встановлено залежність між морфометричними показниками, що є характерними для підкіркової та кіркової ЦА, та вираженістю когнітивного дефіциту.
Актуальность. Изучение структурных изменений головного мозга после перенесенного аневризмального субарахноидального кровоизлияния (аСАК), выяснение их связи с функциональным состоянием пациента, когнитивными и психоэмоциональными расстройствами способствует совершенствованию диагностических подходов и оптимизации прогнозирования течения заболевания. Цель работы: оценить структурно-морфометрические изменения головного мозга у пациентов в восстановительном и резидуальном периодах аСАК. Материалы и методы. Проведено комплексное обследование 114 пациентов в восстановительном и резидуальном периодах аСАК. Учтены клинико-анатомическая форма кровоизлияния, данные Монреальского когнитивного теста, значения индекса Бартел и модифицированной шкалы Ренкина, оценка психоэмоциональной сферы по госпитальной шкале тревоги и депрессии. Оценены данные компьютерной томографии головного мозга с последующим определением морфометрических показателей и индексов. С целью статистической обработки результатов использовались программы Microsoft Excel 2011, Statistica 10 и SPSS Statistics. Результаты. По данным морфометрии, у пациентов, перенесших аСАК, проведено наблюдение как внутренней церебральной атрофии (ЦА), которая была выраженной у 41 (35,96 %) пациента, легкой и умеренной — у 21 (18,43 %), так и внешней ЦА, имевшей диффузный (у 29,82 % пациентов) и фокальный (у 14,03 %) тип. По распространенности атрофического процесса только внутреннюю ЦА выявляли у 25,43 % пациентов, только внешнюю — у 17,54 %, смешанную — у 28,07 %. Достоверно выше значений контрольной группы у обследуемых были бифронтальный индекс, индекс фронтальных рогов и индекс Шлатенбрандта — Нюрнберга, а также показатели соотношения Эванса (p < 0,01). С увеличением размера правого и левого боковых желудочков показатели когнитивного теста ухудшались (r = –0,380; p = 0,000, и r = –0,479; p = 0,000). В группах пациентов с внутренней и смешанной ЦА установлены достоверно более низкие показатели когнитивного функционирования, отвечающие умеренному когнитивному снижению. Выводы. У 71,04 % пациентов, перенесших аСАК, обнаружена ЦА: у 25,43 % — внутренняя, у 17,54 % — внешняя и у 28,07 % — смешанная. Установлена зависимость между морфометрическими показателями, характерными для подкорковой и корковой ЦА, и выраженностью когнитивного дефицита.
Background. Studying structural changes of the brain in patients who suffered from aneurysmal subarachnoid hemorrhage (aSAH), finding out their connection with the functional state of patient, his cognitive and psycho-emotional disorders contributes to the improvement of diagnostic approaches and optimize prediction of the disease course. Materials and methods. We carried out a comprehensive examination of 114 patients in the recovery and residual periods of aSAH. Such parameters were taken into account as clinical and anatomical type of hemorrhage, data of Montreal Cognitive Assessment (MoCA), Barthel index and modified Rankin scale score, the assessment of psycho-emotional state using the Hospital Anxiety and Depression Scale. The brain computed tomography measurements were evaluated and followed by the determination of morphometric parameters and indices. For statistical processing of the results, Microsoft Excel 2011, Statistica 10 and SPSS Statistics were used. Results. According to the morphometry data, patients who underwent aSAH were presented with central cerebral atrophy, severe in 41 (35.96 %) cases, mild and moderate — in 21 (18.43 %), and with cortical cerebral atrophy, diffuse — in 29.82 %, and focal — in 14.03 % of patients. According to the extension of the atrophic process, only central cerebral atrophy was manifested in 25.43 % of patients, only cortical one — in 17.54 % and mixed — in 28.07 %. As a result, bifrontal index, frontal horn ratio, Schaltenbrand-Nürnberger index, as well as Evans ratio were significantly higher compared to the control group (p < 0.01). Moreover, with increasing sizes of the right and left lateral ventricles, the cognitive test scores became worse (r = –0.380; p = 0.000 and r = –0.479; p = 0.000). Significantly lower results of MoCA, which corresponded to moderate level of cognitive impairment, were observed in groups of patients with central and mixed types of cerebral atrophy. Conclusions. Cerebral atrophy was detected in about 71.04 % of patients who had aneurysmal subarachnoid hemorrhage: central — in 25.43 %, cortical — in 17.54 % and mixed — in 28.07 %. The study found the correlation between the morphometric indices typical for subcortical and cortical cerebral atrophy, and the severity of cognitive impairment.
аневризма; субарахноїдальний крововилив; комп’ютерна томографія; церебральна атрофія
аневризма; субарахноидальное кровоизлияние; компьютерная томография; церебральная атрофия
aneurysm; subarachnoid hemorrhage; computed tomography; cerebral atrophy
Вступ
Аневризмальний субарахноїдальний крововилив (аСАК) займає відносно малу частку у структурі цереброваскулярних захворювань (5 %), проте характеризується значною прогностичною несприятливістю, оскільки смертність від даного захворювання коливається в межах від 32 до 67 %, а 10–20 % пацієнтів внаслідок цього мають стійку залежність від сторонньої допомоги [1, 2]. У разі повторного розриву артеріальної аневризми (АА) летальність зростає до 70 % [3]. Особливості патогенетичних механізмів виникнення впливають на формування клініко–анатомічної форми крововиливу: внаслідок розриву АА і локального ушкодження тканини мозку — паренхіматозний, у разі прориву крові у шлуночкову систему або ретроградно (із субарахноїдальних просторів) — вентрикулярний [4]. Такі ланки патогенезу, як набряк, гіпоперфузія, зниження церебрального метаболізму, порушення гомеостазу, а також розвиток ангіоспазму і вторинної ішемії з розвитком порушень ліквородинаміки, визначають кінцевий клінічний результат [5–8].
Найчастіше аСАК — захворювання людей працездатного віку, навіть незначний неврологічний дефіцит впливає на якість їх життя [9]. За даними D.J. Nieuwkamp et al. (2009), через 1 рік після САК відсоток пацієнтів, які не потребують сторонньої допомоги (0–3 бали за шкалою Ренкіна), становив від 36 до 55 % [10]. За даними інших авторів, лише третина пацієнтів після аСАК мають сприятливий прогноз після лікування [11, 12].
Дедалі частіше іноземні науковці у своїх наукових працях приділяють увагу з’ясуванню клінічного значення церебральної атрофії (ЦА), що настає після розриву аневризми [13–16]. Морфологічні зміни, що виявляються при комп’ютерній томографії (КТ) головного мозку в осіб, які перенесли аСАК, різноманітні: дилатація шлуночків, розширення борозен, кістозні та атрофічні зміни; вираженість даних змін є індикатором ступеня ЦА. З’ясовують взаємозалежності між віком та ішемічними ускладненнями і об’ємом паренхіми мозку у резидуальному періоді, а також ускладненнями гострого періоду та функціональним результатом і неврологічним статусом. У результатах низки зарубіжних наукових досліджень описується високий рівень залежності між клініко–нейропсихологічними даними пацієнта та окремими морфометричними показниками, а саме об’ємом мозкової паренхіми та вентрикуло–краніальним індексом [17–20]. Урахування структурних змін головного мозку дозволило б ще більш детально вивчити залишкові явища після аСАК, з’ясувати їх зв’язок із наявним функціональним станом пацієнта, когнітивним дефіцитом, а також із вираженістю психоемоційних порушень.
Мета роботи: оцінити структурно–морфометричні зміни головного мозку у пацієнтів у відновному та резидуальному періодах аСАК.
Матеріали та методи
Проведено комплексне обстеження 114 пацієнтів, із них 64,91 % чоловіків та 35,09 % жінок. Середній вік становив 46,04 ± 0,78 року. Пацієнтів було розпо–ділено за віком: молодий вік (18–44 роки) — 37,72 % хворих, середній (45–59 років) — 62,28 %. Залежно від клініко–анатомічної форми крововиливу виділяли: субарахноїдальний крововилив (САК) — у 45,61 % пацієнтів, субарахноїдально–паренхіматозний (СПК) — у 26,32 %, субарахноїдально–вентрикулярний (СВК) — у 18,42 %, субарахноїдально–паренхіматозно–вентрикулярний (СПВК) — у 9,65 %. Контрольну групу становили 20 здорових осіб, репрезентативних за віком та статтю.
Застосовували загальноприйняте клініко–неврологічне обстеження, визначали ступінь інвалідизації згідно з модифікованою шкалою Ренкіна, проводили оцінку активності повсякденної життєдіяльності (індекс Бартел), використовували нейропсихологічні шкали для оцінки когнітивної сфери (Монреальський когнітивний тест (Monreal Cognitive Assessment — MoCA)), емоційної сфери (госпітальна шкала тривоги і депресії (Hospital Anxiety and Depression Scale — HADS)).
Значення шкали MoCA в загальній групі становило 21,71 ± 0,37 бала, що відповідало помірному когнітивному зниженню. Значення індексу Бартел було на рівні 94,73 ± 1,10 бала, що відповідало легкому ступеню залежності, а шкали Ренкіна — 1,87 ± 0,07 бала, що також можна прирівнювати до легкого ступеня інвалідизації. Рівень тривожності становив 9,50 ± 0,36 бала, депресії — 8,38 ± 0,36 бала і відповідав субклінічним проявам для даних психоемоційних порушень.
Оцінювали дані КТ головного мозку (апарат Asteion–4 Toshiba, Японія) з подальшим визначенням морфометричних показників, а також індексів, що обраховувались на основі даних показників: максимальний зовнішній поперечний розмір черепа (A), максимальний внутрішній розмір на рівні сella media (Aa), внутрішній розмір на рівні краю передніх рогів бокових шлуночків (Ac), внутрішній розмір на рівні базальних гангліїв (Ad), мінімальна відстань між тілами бокових шлуночків (B), максимальна відстань між передніми рогами бокових шлуночків (C) та мінімальна відстань (D), максимальна ширина задніх рогів бокових шлуночків (F), ширина субарахноїдальних просторів (САП), ширина правого та лівого бокових шлуночків (БШ), максимальний розмір ІІІ шлуночка (E), розмір ІV шлуночка, біфронтальний індекс (БФІ), бікаудатний індекс (БКІ), індекс центральної частини бокового шлуночка (ІЦЧБШ), шлуночковий індекс (ШІ), індекс фронтальних рогів (ІФР), індекс Хакмана (ІХ), індекс Шлатенбрандта — Нюрнберга (ІШН), співвідношення Еванса (СЕ).
Факт зовнішньої церебральної атрофії підтверджується вимірюванням розмірів САП. З метою діагностики внутрішньої церебральної атрофії використовуються розміри ІІІ шлуночка, ширина якого в нормі не повинна перевищувати 0,68 см. При розширенні в межах 0,7–0,75 см діагностують легку внутрішню ЦА; 0,76–0,8 см — помірну; 0,8 см та більше — виражену ЦА (Черкасова В.Г., 2004).
Обробка результатів дослідження проводилась за допомогою програми Microsoft Excel 2011 та комп’ютерної системи статистичного аналізу та обробки даних Statistica 10.
Результати та обговорення
Результати морфометрії головного мозку висвітлені у табл. 1. Виявлено вірогідне розширення всієї шлуночкової системи у групі обстежуваних: правого та лівого бокових шлуночків — у 1,6 раза, третього — у 2,08 раза та четвертого — у 1,47 раза, що підтверджує наявність внутрішньої церебральної атрофії у пацієнтів, які перенесли аСАК. При аналізі розмірів ІІІ шлуночка у загальній вибірці нами було виявлено: легку та помірну — у 21 пацієнта (18,43 %) і виражену внутрішню ЦА — у 41 (35,96 %).
Загалом у групі обстежуваних розширення суб–арахноїдальних просторів діагностували у 45,61 % випадків, розширення на рівні полюса лобної частки відбулось у 1,93 раза, а на рівні сільвієвої борозни — у 1,94 раза. Розширені САП на рівні лобної частки спостерігали у 32,45 %, а на рівні сільвієвої щілини — у 42,10 % пацієнтів. Отже, дифузну атрофію було виявлено у 29,82 %, фокальну — у 14,03 % пацієнтів.
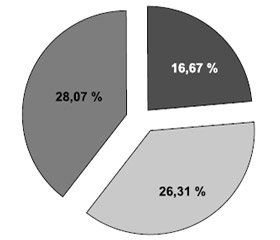
Для детального аналізу типів ЦА, що виявляли в обстежуваних, нами було виділено із загальної вибірки пацієнтів лише з наявністю зовнішньої, внутрішньої та змішаної ЦА (рис. 1). У групі хворих, які мали зовнішню ЦА, дифузний її тип спостерігався у 42,10 % хворих, фокальний — у 57,90 %.
Зміни шлуночкової системи позначились і у показниках морфометричних індексів. Вірогідно вищими за значення контрольної групи були такі індекси, як БФІ, ІФР та ІШН, а також показники СЕ (p < 0,01). Отже, можна говорити про наявність у пацієнтів у відновному та резидуальному періодах аСАК як кіркового, так і підкіркового атрофічного процесу.
За аналізом даних КТ нами також було виявлено множинні кісти у декількох частках головного мозку — у 7,02 % пацієнтів, явища поренцефалії — у 1,75 %, виражений лейкоареоз — у 24,56 %, кальцинати — у 1,75 %, субдуральні гігроми — у 0,04 % хворих (табл. 1).
Проведений кореляційний аналіз дозволив встановити такі взаємозв’язки: вік/правий боковий шлуночок (r = 0,334; p = 0,000); вік/E (третій шлуночок) (r = 0,335; p = 0,000). Зі збільшенням розміру правого та лівого бокових шлуночків показники когнітивного тесту ставали гіршими (r = –0,380; p = 0,000 та r = –0,479; p = 0,000). Було отримано кореляції між результатом MoCA–тесту та такими морфометричними співвідношеннями, як БФІ (r = –0,377; p = 0,000), БКІ (r = –0,340; p = 0,000) та Еванса (r = –0,347; p = 0,000). Слабкі кореляційні залежності було встановлено між рівнем депресії та певними морфометричними показниками: депресія/правий шлуночок (r = 0,214; p = 0,022), депресія/лівий шлуночок (r = 0,193; p = 0,039), депресія/третій шлуночок (r = 0,204; p = 0,029), депресія/БФІ (r = 0,229; p = 0,019).
Сучасні наукові джерела вказують, що не завжди результати шкали Ренкіна та індексу Бартел відображають картину резидуальних структурних змін у головному мозку, і навпаки. Проте нами було отримано деякі кореляційні співвідношення, що підтверджують даний взаємозв’язок, а саме: індекс Бартел/правий боковий шлуночок (r = –0,304; p = 0,001); індекс Бартел/E (третій боковий шлуночок) (r = –0,376; p = 0,000); індекс Бартел/БКІ (r = –0,305; p = 0,001); шкала Ренкіна/E (третій боковий шлуночок) (r = 0,333; p = 0,000).
Було проведено оцінку морфометричних показників і у пацієнтів із різною клініко–анатомічною формою крововиливу (табл. 2).
Хворі на СПК мали вірогідно більші розміри правого (p < 0,05) і лівого (p < 0,01) бокового та третього (p < 0,05) шлуночків порівняно з групою, хворі якої мали крововилив лише у субарахноїдальний простір. Відмінними від групи з перенесеним субарахноїдальним крововиливом були і такі морфометричні параметри, як БФІ (p < 0,05), БКІ (p < 0,01), ШІ (p < 0,05), ІФР (p < 0,01), розміри САП на рівні лобної частки (p < 0,05) та співвідношення Еванса (p < 0,05).
У пацієнтів із СПВК практично всі індекси набували вищих значень порівняно з іншими групами, проте вірогідність було отримано переважно у порівнянні з пацієнтами, які перенесли крововилив лише у субарахноїдальний простір. Відрізнялись такі розміри: правий боковий шлуночок (p < 0,05), лівий боковий шлуночок (p < 0,05), Е (третій шлуночок) (p < 0,05), БКІ (p < 0,01), ШІ (p < 0,05), САП на рівні лобної частки (p < 0,05).
У поодиноких зарубіжних працях автори особливу увагу приділяють дослідженням та трактуванням індексу ІІІ шлуночка (індекс Шлатенбрандта — Нюрнберга), який у нормі становить 30–50, а при наявності у хворого гідроцефалії — зменшується. У досліджуваних групах пацієнтів встановлено вірогідне зниження цього індексу щодо норми, проте найнижчі його значення мають хворі на СПВК (p < 0,01).
З метою встановлення ролі церебральної атрофії у прогресуванні когнітивної дисфункції ми здійснили розподіл пацієнтів на 4 групи: із зовнішньою ЦА — І група, внутрішньою ЦА — ІІ група, змішаною ЦА — ІІІ група та за браком будь–яких проявів ЦА — IV група. Найнижчі результати MoCA–тесту продемонстрували хворі ІІ та ІІІ груп, у яких середній бал становив 20,40 ± 0,73 та 20,90 ± 0,90, відповідно. При цьому вірогідною різниця виявилась у порівнянні з пацієнтами IV групи (23,06 ± 0,45 бала, p < 0,01 — для ІІ групи та p < 0,05 — для ІІІ групи).
Оскільки у 71,04 % пацієнтів було виявлено церебральну атрофію, що корелювала із вираженістю когнітивного дефіциту, слід зосередити лікувальні підходи на корекції даної когнітивної дисфункції.
Висновки
1. У 71,04 % пацієнтів, які перенесли аневризмальний субарахноїдальний крововилив, було виявлено церебральну атрофію: у 25,43 % — внутрішню, у 17,54 % — зовнішню та у 28,07 % — змішану.
2. За поширеністю атрофічного процесу дифузний тип зовнішньої церебральної атрофії встановлено у 29,82 % хворих, фокальний — у 14,03 %.
3. Встановлено залежність між морфометричними показниками, що є характерними для підкіркової та кіркової церебральної атрофії, та вираженістю когнітивного дефіциту.
4. Дослідження морфометричних змін головного мозку дозволяє удосконалити діагностичну тактику та сприяє прогнозуванню когнітивного дефіциту у досліджуваної категорії пацієнтів.
Конфлікт інтересів. Автор заявляє про відсутність конфлікту інтересів при підготовці даної статті.
1. Зозуля И.С. Епідеміологія цереброваскулярних захворювань в Україні. Український медичний часопис. 2011.
2. MacGrory B., Vu L., Cutting S., Marcolini E., Gottschalk C. and Greer D. Distinguishing Characteristics of Headache in Nontraumatic Subarachnoid Hemorrhage. Headache: The Journal of Head and Face Pain. 2018. 58. 364–370. doi: 10.1111/head.13218
3. Petridis A.K., Kamp M.A., Cornelius J.F. et al. Aneurysmal Subarachnoid Hemorrhage. Dtsch. Arztebl. Int. 2017. 114(13). 226–236.
4. Дзяк Л.А., Цуркаленко О.С. Структурно–функціональні особливості перебігу субарахноїдальних крововиливів, зумовлених повторним розривом артеріальних аневризм. Одеський медичний журнал. 2005. 3. 47.
5. Глоба М.В. Предиктори розвитку симптомного церебрального вазоспазму у хворих з аневризматичним субарахноїдальним крововиливом. Збірник наукових праць співробітників НМАПО ім. П.Л. Шупика. 2014. 23(1). 113–120. — Режим доступу: http://nbuv.gov.ua/UJRN/Znpsnmapo_2014_23(1)__18
6. Gupta M., Verma R., Parihar A., Garg R.K., Singh M.K., Malhotra H.S. Perihematomal edema as predictor of outcome in spontaneous intracerebral hemorrhage. J. Neurosci. Rural. Pract. 2014. 5. 48–54.
7. Kobayashi J., Koga M., Tanaka E., Okada Y., Kimura K., Yamagami H., Okuda S., Hasegawa Y., Shiokawa Y., Furui E., Nakagawara J., Kario K., Okata T., Arihiro S., Sato S., Nagatsuka K., Minematsu K., Toyoda K. Continuous antihypertensive therapy throughout the initial 24 hours of intracerebral hemorrhage: the stroke acute management with urgent risk–factor assessment and improvement–intracerebral hemorrhage study. Stroke. 2014. 45. 868–870.
8. Miller B.A. et al. Inflammation, vasospasm, and brain injury after subarachnoid hemorrhage. BioMed Research. International. 2014. 2014.
9. Schwartz C. et al. Long–term neurological outcome and quality of life after World Federation of Neurosurgical Societies Grades IV and V Aneurysmal Subarachnoid Hemorrhage in an Interdisciplinary Treatment Concept. Neurosurgery. 2017. 80(60). 967–974.
10. Nieuwkamp D.J. et al. Changes in case fatality of aneurysmal subarachnoid haemorrhage over time, according to age, sex, and region: a meta–analysis. The Lancet Neurology. 2009. 8(7). 635–642.
11. Singer R.J. et al. Treatment of aneurysmal subarachnoid hemorrhage. UpToDate. Waltham, MA: UpToDate. Retrieved March. 2010.
12. Persson H.C., Carlsson L., Sunnerhagen K.S. Life situation 5 years after subarachnoid haemorrhage. Acta Neurologica Scandinavica. 2018. 137(1). 99–104.
13. Egge A. et al. Outcome 1 year after aneurysmal subarachnoid hemorrhage: relation between cognitive performance and neuroima–ging. Acta Neurologica Scandinavica. 2005. 112(2). 76–80.
14. Bendel P. et al. Atrophic enlargement of CSF volume after subarachnoid hemorrhage: correlation with neuropsychological outcom. American Journal of Neuroradiology. 2010. 31(2). 370.
15. Dupont S., Rabinstein A.A. CT evaluation of lateral ventricular dilatation after subarachnoid hemorrhage: baseline bicaudate index balues. Neurological Research. 2013. 35(2). 103–106.
16. Stehouwer B.L. et al. Magnetic resonance imaging and brain injury in the chronic phase after aneurysmal subarachnoid hemorrhage: A systematic review. International Journal of Stroke. 2018. 13(1). 24–34.
17. Bendel P. et al. Brain atrophy and neuropsychological outcome after treatment of ruptured anterior cerebral artery aneurysms: a voxel–based morphometric study. Neuroradiology. 2009. 51(11). 711–722.
18. Frontera J.A. et al. Acute ischaemia after subarachnoid hae–morrhage, relationship with early brain injury and impact on outcome: a prospective quantitative MRI study. J. Neurol. Neurosurg. Psychiatry. 2015. 86(1). 71–78.
19. Sonesson B. et al. Long–term reintegration and quality of life in patients with subarachnoid hemorrhage and a good neurological outcome: findings after more than 20 years. Journal of Neurosurgery. 2017. 128(3). 785–792.
20. van Donkelaar C.E. et al. Prediction of outcome after subarachnoid hemorrhage: timing of clinical assessment. Journal of Neurosurgery. 2017. 126(1). 52–59.

/22-1.jpg)
/22-2.jpg)
/23-1.jpg)