Резюме
Нами обстежено 38 пацієнтів (11 жінок (28,94 %) та 27 чоловіків (71,06 %)) із віддаленими наслідками легкої закритої черепно-мозкової травми; вік хворих становив від 26 до 58 років (середній вік 43,61 ± 8,24 року). Уміст нейроамінокислот (глутамат, аспартат, ГАМК) у сироватці крові вимірювали спектрофотометричним методом для вивчення їх патогенетичного впливу на формування віддалених наслідків легкої закритої черепно-мозкової травми. Показано, що в пацієнтів із віддаленими наслідками легкої закритої черепно-мозкової травми, які зазнали забій головного мозку легкого ступеня тяжкості (39,48 %), відзначаються найбільш виражені зміни вмісту нейроамінокислот, що проявляються в збільшенні рівня глутамату (246,25 ± 21,39 мкмоль/л порівняно з контрольною групою — 112,75 ± 11,72 мкмоль/л) та зменшенні рівня ГАМК (2,10 ± 1,16 мкмоль/л порівняно з контрольною групою — 6,72 ± 1,59 мкмоль/л). Формування віддалених наслідків легкої закритої черепно-мозкової травми супроводжувалося розладами вегетативної регуляції, що проявлялося в парасимпатичній направленості вегетативного тонусу, виявленій в більшості пацієнтів 1-ї групи (78,26 %) та у 86,67 % пацієнтів 2-ї групи, що може також відігравати значну роль у патогенезі захворювання й формуванні віддалених наслідків легкої закритої черепно-мозкової травми, має важливе клініко-прогностичне значення в подальшому розвитку травматичної енцефалопатії, що треба враховувати при подальшому лікуванні.
Нами обследовано 38 пациентов (11 женщин, 28,94 %, и 27 мужчин, 71,06 %) с отдаленными последствиями легкой закрытой черепно-мозговой травмы; возраст больных составил 26–58 лет (средний возраст 43,61 ± 8,24 года). Содержание нейроаминокислот (глутамат, аспартат, гамма-аминомасляная кислота) в сыворотке крови определяли спектрофотометрическим методом для изучения их патогенетического влияния на формирование отдаленных последствий легкой закрытой черепно-мозговой травмы. Показано, что у пациентов с отдаленными последствиями легкой закрытой черепно-мозговой травмы, которые перенесли ушиб головного мозга легкой степени тяжести (39,48 %), отмечаются наиболее выраженные изменения в содержании нейроаминокислот, проявляющиеся в увеличении уровня глутамата (246,25 ± 21,39 мкмоль/л по сравнению с контрольной группой — 112,75 ± 11,72 мкмоль/л) и уменьшении уровня гамма-аминомасляной кислоты (2,10 ± 1,16 мкмоль/л по сравнению с контролем — 6,72 ± 1,59 мкмоль/л). Формирование отдаленных последствий легкой закрытой черепно-мозговой травмы сопровождается расстройствами вегетативной регуляции, проявляющейся в парасимпатической направленности вегетативного тонуса, выявленной у большинства пациентов 1-й группы (78,26 %) и у 86,67 % пациентов 2-й группы, что может также играть значительную роль в патогенезе заболевания и формировании особенностей клинической картины отдаленных последствий легкой закрытой черепно-мозговой травмы, имеет клинико-прогностическое значение в дальнейшем становлении травматической энцефалопатии, что необходимо учитывать при проведении дальнейшего лечения.
We investigated 38 patients (11 women, 28.94 % and 27 men, 71.06 %) aged from 26 and 58 years with long-term consequences of the mild brain traumatic injury; mean age 43.61 ± 8.24 years. The neuroaminoacids (glutamate, aspartate, γ-aminobutyric acid) blood serum concentration was measured by spectrophotometer method to study their pathogenetic influence on the forming of long-term consequences of the mild brain traumatic injury. It was shown that the patients with long-term consequences of the mild brain traumatic injury with mild brain contusion in their anamnesis (39.48 %) had the prominent changing in neuroaminoacids content, namely high glutamate serum level (246.25 ± 21.39 μmol/l vs controls 112.75 ± 11.72 μmol/l) and decreased γ-aminobutyric acid serum level (2.10 ± 1.16 μmol/l vs controls 6.72 ± 1.59 μmol/l). The forming of long-term consequences of the mild brain traumatic injury was accompanied by vegetative malregulation manifesting in parasympathetic tendency of the vegetative tonus determined in many patients of the first group (78.26 %) and in 86.67 % patients in the second group, that also may play a significant role in the disease pathogenesis and may have important clinical and prognostic value in further development of traumatic encephalopathy. All these findings need to be accounted into consideration during the treatment of this category of patients.
Вступ
Черепно-мозкова травма (ЧМТ) відноситься до найбільш частих та тяжких видів травматизму і є основною причиною смертності серед осіб молодого та середнього віку. За даними ВООЗ, щорічно в світі понад 10 млн людей отримують ЧМТ (Andelic N., 2012); в Україні її частота становить від 2 до 4 випадків на 1000 населення; за даними «швидкої допомоги», в Харкові черепно-мозкові пошкодження становлять 4–5 випадів на 1000 населення на рік (Волошин П.В. та співавт., 1999) [1, 2]. Постраждалі від ЧМТ складають найбільш праце-здатну частину населення, отже, є очевидною соціальна значущість проблеми діагностики та лікування ЧМТ та її наслідків [3, 4]. Віддалені наслідки закритої ЧМТ (ЗЧМТ) мають важливе медико-соціальне та клінічне значення, оскільки, незважаючи на велику кількість робіт вітчизняних та зарубіжних дослідників у цій галузі, багато питань діагностики й патогенезу формування тих або інших психопатологічних розладів та синдромів залишаються не до кінця вивченими й потребують подальшого досконалого дослідження.
Сьогодні немає сумнівів у тому, що в патогенезі віддалених наслідків нейротравми важливими є патологічні зміни різноманітних механізмів: нейротрансмітерних, амінокислотних, дисбаланс у біохімічних системах катехоламінів і нейропептидів [5, 6]. В експериментальних та клінічних роботах зарубіжних дослідників показано, що глутамат, аспартат та гамма-аміномасляна кислота (ГАМК) є модуляторами не тільки судомної й нейропластичної активності головного мозку, вони прямо та опосередковано беруть участь у нейроексайтотоксичному процесі, регулюють основні процеси збудження, формування больового порогу, синаптичну пластичність, емоції, пам’ять [7, 8, 13]. На сьогодні більшою мірою розкриті механізми впливу біогенних амінів та медіаторів на активність центральної нервової системи [9–11].
Визначення вмісту показників нейроамінокислот — глутамату, аспартату та ГАМК — у сироватці крові хворих із віддаленими наслідками легкої закритої ЧМТ, їх зіставлення й виявлення кореляційних відношень із неврологічними даними, функціональним станом вегетативної нервової системи (ВНС) дозволять провести ретельне вивчення клініко-неврологічних та нейромедіаторних особливостей перебігу віддалених наслідків легкої ЗЧМТ залежно від типу травми, тривалості захворювання, характеру ускладнень, що дозволить підвищити якість клінічної діагностики й визначити особливості патогенезу формування віддалених наслідків легкої ЗЧМТ.
Метою даного дослідження було вивчення вмісту нейроамінокислот глутамату, аспартату та гамма-аміномасляної кислоти в сироватці крові хворих із віддаленими наслідками легкої ЗЧМТ та їх впливу на формування тих чи інших неврологічних проявів.
Матеріали та методи
У дослідженні були обстежені хворі з віддаленими наслідками легкої ЗЧМТ (n = 38; середній вік обстежених хворих становив 43,61 ± 8,24 року), які проходили курс лікування в Інституті неврології, психіатрії та наркології; серед них 11 жінок (28,94 %) та 27 чоловіків (71,06 %). Вік хворих варіював від 26 до 53 років. Середній вік захворювання становив 1,50 ± 0,76 року. Контрольна група включала 30 здорових осіб: із них 15 жінок та 15 чоловіків віком від 26 до 35 років; середній вік контрольної групи 27,50 ± 8,33 року.
У роботі вміст глутамату, аспартату та ГАМК в сироватці крові хворих було визначено методом високовольтного електрофорезу з послідовним кількісним аналізом виділених фракцій спектрофотометричним методом [3] на спектрофотометрі СФ-46. У пацієнта брали кров, відстоювали та екстрагували. Екстракцію проводили 96% етиловим спиртом при кип’ятінні проб на водяній бані протягом 10 хв із подальшим центрифугуванням при 5 тис/об, надосадову рідину випарювали насухо при 60 °С. Сухий залишок розчиняли у воді в співвідношенні 0,1 мл крові на 0,15 мл води, наносили на смуги хроматографічного паперу (l = 58 см; d = 8 см).
У дослідженні було використано стандартні зразки ГАМК, глутамінової та аспарагінової амінокислот фірми Sigma (USA). Концентрації стандартів — по 0,025–0,2 мкМ у пробі; об’єм — 0,01 мл. Електрофорез 3 години при Е = 600 V в піридин-оцтовому буфері, після електрофорезу смуги хроматографічного паперу було висушено в потоці повітря протягом 1–2 годин, забарвлення виконували нінгідрином. Плями, відповідно до амінокислот, вирізали, нінгідрин екстрагували 60% спиртом з 0,005% CuSО4. Колориметрування проводили при λ = 540 проти контролю.
Вегетативний тонус оцінювали за допомогою аналізу варіабельності ритму серця (РС), де варіабельність міжімпульсних інтервалів електрокардіограми (ЕКГ) є одним із найбільш важливих маркерів активності ВНС. Вивчення варіабельності серцевого ритму виконували за допомогою варіаційної пульсометрії, методика докладно описана [2], запропонована й стандартизована Європейською та Північноамериканською кардіологічною асоціацією (1996) [12]. Згідно з цими стандартами варіабельність РС вимірювали за коротким (5 хвилин) реєструванням ЕКГ.
Дослідження стану ВНС проводили в стані спокою. Дослідження проводили таким чином: записували ЕКГ у II стандартному відведенні протягом 5 хвилин у хворого після 20-хвилинного спокою в горизонтальному положенні. Для вивчення статистичних параметрів РС вимірювали послідовно 100 кардіоінтервалів R-R, записуючи їх у статистичний ряд, далі кардіоінтервали R-R групували з інтервалом в 0,05 с у діапазоні від 0,40 до 1,3 с, виділяючи, таким чином, 20 діапазонів. Аналіз динамічного ряду інтервалів R-R ми проводили шляхом побудови числових варіаційних пульсограм за допомогою комп’ютерних програм.
Клініко-неврологічне дослідження хворих проводили за загальноприйнятою схемою обстеження; воно включало збір та оцінку анамнезу, визначення неврологічного статусу. Математичний аналіз отриманого цифрового матеріалу здійснювали за допомогою комп’ютерного пакета для обробки статистичної інформації Statistica 6.5.
Результати та обговорення
Під час роботи всі досліджувані хворі були розподілені на дві клінічні групи залежно від типу ЗЧМТ: 1-шу клінічну групу сформували хворі, які зазнали струс головного мозку (n = 23; 60,52 %), 2-гу групу було сформовано з 15 хворих (39,48 %) із віддаленими наслідками ЗЧМТ після забою головного мозку легкого ступеня тяжкості. Систематизацію клінічних проявів захворювання здійснювали на основі класифікації Н.Н. Яхно, Д.Р. Штульмана, 2001 [1]. Найбільш численною була перша група хворих, які зазнали струс головного мозку.
Перша клінічна група складалася із хворих із віддаленими наслідками ЗЧМТ після струсу мозку з частими та вираженими головними болями; серед них 8 жінок та 15 чоловіків. Клініко-неврологічне обстеження виявило наявність розсіяної неврологічної симптоматики, що вказує на ураження мезенцефальних та стовбурових структур головного мозку. З об’єктивних органічних неврологічних симптомів частіше за інші зустрічалися порушення черепно-мозкової іннервації та рефлекторно-рухової сфери у вигляді горизонтального ністагму (18 хворих, 47,36 %), ротаторного ністагму (4 хворих, 10,52 %), порушення координаторної сфери (9 хворих, 23,68 %), атаксія (6 хворих, 15,78 %), асиметрія обличчя (12 хворих, 31,58 %), збільшення гомілкових рефлексів (16 хворих, 42,1 %), патологічних стопних рефлексів (8 хворих, 21,05 %).
Під час дослідження було з’ясовано, що хворі цієї групи мають зміни нейроамінокислот у сироватці крові (табл. 1), рівень ГАМК у сироватці крові був вірогідно знижений на 4,46 мкмоль/л порівняно з контролем (P < 0,05), рівень глутамату був підвищений на 75,84 мкмоль/л порівняно з контрольною групою (P > 0,05).
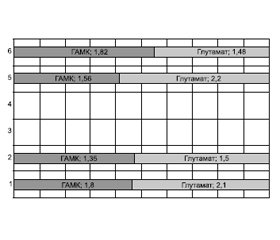
Уміст аспартату практично не відрізнявся від даних контролю (11,61 проти 8,44 у групі контролю). Аналіз ступеня відхилення рівнів від контрольних даних (t-критерій) виявив, що в групах зіставлення спостережувана різниця між показниками ГАМК була: t = 1,8 і t = 1,35 та між показниками глутамату: t = 2,1 й t = 1,5 відповідно (P < 0,05) (рис. 1).
Отже, у хворих 1-ї групи спостерігалося вірогідне зниження вмісту ГАМК в сироватці крові (P < 0,05), що відображає зниження реакцій гальмування в цілому по даній групі хворих та збільшення рівня глутамату.
Друга клінічна група включала пацієнтів із віддаленими наслідками легкої ЗЧМТ, що зазнали забій головного мозку легкого ступеня тяжкості. Під час дослідження нами було з’ясовано, що хворі цієї групи мають найбільш виражені зміни вмісту нейроамінокислот. У табл. 2 наведені рівні амінокислот у сироватці крові хворих 2-ї групи (рівень ГАМК у сироватці крові був статистично вірогідно знижений порівняно з контролем на 4,62 мкмоль/л (P < 0,05), уміст глутамату був підвищений на 133,5 мкмоль/л порівняно зі здоровими учасниками (P < 0,05) та на 57,66 мкмоль/л порівняно з хворими 1-ї групи (P > 0,05)). Уміст аспартату при цьому мав тенденцію до підвищення на 10,09 мкмоль/л порівняно з даними контролю (P > 0,05). Отримані результати свідчать про те, що перебіг віддалених наслідків легкої ЗЧМТ у даної категорії хворих супроводжується певним підвищеним викидом медіаторів збудження, зокрема глутамату й аспартату, та зниженням рівня гальмування, що відображає дуже низький рівень ГАМК. Аналіз ступеня відхилення від контрольних даних (t-критерій) виявив, що в групах зіставлення спостережувана різниця між показниками ГАМК була: t = 1,56 і t = 1,82 та між показниками глутамату: t = 2,2 і t = 1,48 відповідно (P < 0,05) (рис. 1).
Клініко-неврологічне обстеження виявило наявність розсіяної неврологічної симптоматики, частіше за інші зустрічалися горизонтальний ністагм (7 хворих, 46,66 %), порушення координаторної сфери (6 хворих, 40 %), атаксія (4 хворих, 26,66 %), збільшення гомілкових та надгомілкових рефле-ксів (7 хворих), патологічні стопні рефлекси (3 пацієнти).
Отже, у хворих із віддаленими наслідками легкої ЗЧМТ 2-ї групи відзначається чітке підвищення рівня збуджувальних амінокислот (глутамату та аспартату) у сироватці крові при зіставленні з контролем та зниження рівня ГАМК, і ці зміни найбільш виражені в цієї групи пацієнтів.
Найбільш виражені функціонально-біохімічні зміни спостерігали в ланці ГАМК-медіаторної системи; основним шляхом утворення ГАМК, основного гальмового нейромедіатора в тканинах мозку, є синтез із глутамінової кислоти. Крім того, значне зниження вмісту гальмових амінокислот відображає неефективність захисних механізмів гальмування в цілому, що має патогенетичне значення при формуванні віддалених наслідків легкої ЗЧМТ.
У структурі неврологічних синдромів майже в усіх обстежених хворих 1-ї та 2-ї груп зустрічався синдром вегетативної дистонії (21 хворий у 1-й групі, 91,3 %, та 15 хворих у 2-й групі). Вегетативний тонус: більш-менш стабільні характеристики стану вегетативних показників у період відносного спокою, тобто розслабленого неспання. У забезпеченні тонусу беруть активну участь регуляторні апарати, що підтримують метаболічну рівновагу, співвідношення між симпатичною й парасимпатичною системою. Характер тонусу та його спрямованість можуть бути виявлені за допомогою дослідження симптомів, що характеризують стан серцево-судинної системи: пульсу, артеріального тиску систолічного та діастолічного, суб’єктивних скарг (серцебиття або відчуття «завмирання» серця та інші), хвилинного об’єму крові, ЕКГ-показників [2, 12].
Найбільший розкид інтервалів R-R свідчить про вплив блукаючих нервів і дихання, відомий як дихальна синусова аритмія. Залежно від ступеня вираженості високочастотних дихальних коливань РС оцінюють стан вагальних механізмів регуляції. При вивченні функціонального стану вегетативної нервової системи в 78,26 % хворих 1-ї групи та у 86,67 % хворих 2-ї групи спостерігали парасимпатичну направленість вегетативного тонусу (P < 0,01), що має клініко-патогенетичне значення при формуванні віддалених наслідків легкої ЗЧМТ (табл. 2–4).
/57.jpg)
Отже, проведене дослідження свідчить про те, що формування неврологічних розладів та віддалених наслідків навіть легкої ЗЧМТ супроводжується певними вегетативними розладами та вираженим нейроамінокислотним дисбалансом, що може відігравати провідну роль у патогенезі даного захворювання й у формуванні особливостей його клінічної картини, а також має важливе клініко-прогностичне значення в подальшому розвитку травматичної енцефалопатії, що треба враховувати при проведенні лікування таких пацієнтів.
Крім зазначеного вище, у комплексній патогенетичній терапії віддалених наслідків легкої ЗЧМТ необхідно проводити тривалу консервативну патогенетичну терапію препаратами, що покращують метаболічний та нейромедіаторний стан головного мозку. Перспективним є подальше вивчення нейроамінокислот разом з особливостями функціонального стану ензимних систем мозку, що беруть участь у метаболізмі нейроамінокислот та в моделюванні функціональної активності висхідних шляхів та неспецифічної десинхронізації таламокортикальних сомногенних систем мозку.
Висновки
Отже, формування віддалених наслідків легкої закритої черепно-мозкової травми супроводжується нейроамінокислотним дисбалансом та вегетативною дисфункцією. Дане дослідження виявило значне зниження вмісту гальмових нейроамінокислот у хворих як 1-ї групи, так і 2-ї групи (P < 0,05), що відображає неефективність захисних механізмів гальмування. Також результати дослідження показали збільшення вмісту глутамату в пацієнтів 2-ї групи (P < 0,05). При вивченні функціонального стану вегетативної нервової системи в обстежених у 78,26 % хворих 1-ї групи та у 86,67 % хворих 2-ї групи спостерігалася парасимпатична направленість вегетативного тонусу P < 0,01), що має клініко-патогенетичне значення при формуванні віддалених наслідків легкої ЗЧМТ. Необхідним є подальше вивчення нейроамінокислотного дисбалансу у хворих з віддаленими наслідками легкої закритої черепно-мозкової травми для розробки патогенетичних механізмів, диференційно-діагностичних критеріїв та пошуку нових шляхів лікування.
Конфлікт інтересів. Автор заявляє про відсутність конфлікту інтересів при підготовці даної статті.
Список литературы
1. Болезни нервной системы: В 2 т. / Под ред. Н.Н. Яхно, Д.Р. Штульмана. — М.: Медицина, 2001. — 480 с.
2. Вегетативные расстройства: клиника, диагностика, лечение / Под ред. А.М. Вейна. — М.: Медицинское информационное агентство, 2000. — 752 с.
3. Зайцева Г.Н., Тиленева Н.И. Метод хроматографического разделения аминокислот // Лабораторное дело. — 1958. — № 3. — С. 24-30.
4. Крыжановский Г.Н. Детерминантные структуры в патологии нервной системы. — М.: Медицина, 1980. — 360 с.
5. Неврология / Под ред. М. Самуэльса: Пер. с англ. — М.: Практика, 1997. — 638 с.
6. Погодаев К.И. Эпилептология и патохимия мозга. — М.: Медицина, 1986. — 288 с.
7. Herman S.T., Walczak T.S., Bazil C.W. Distribution of partial seizures during the sleep-wake cycle: differences by seizures onset site // Neurology. — 2001. — Vol. 12. — Р. 1453-1459.
8. Danandeh A., Vozella V., Lim J., Oveisi F., Ramirez G. et al. Effects of fatty acid amide hydrolase inhibitor URB597 in a rat model of trauma-induced long-term anxiety // Psychopharmacology. — 2018. — 235(11). — Р. 3211-3221.
9. Scrimgeour A.G., Carrigan C.T., Condlin M.L., Urso M.L. et al. Dietary Zinc Modulates Matrix Metalloproteinases in Traumatic Brain Injury // J. Neurotrauma. — 2018. — 15; 35(20). — Р. 2495-2506.
10. Putatunda R., Bethea J.R., Hu W.H. Potential immunotherapies for traumatic brain and spinal cord injury // Chin. J. Traumatol. — 2018. — 21(3). — Р. 125-136.
11. Ghoshal S., Bondada V., Saatman K.E., Guttmann R.P., Geddes J.W. Phage display for identification of serum biomarkers of traumatic brain injury // J. Neurosci. Methods. — 2016. — 15; 272. — Р. 33-37.
12. Stretti F., Klinzing S., Ehlers U., Steiger P., Schuepbach R., Krones T., Brandi G. Low level of vegetative state after traumatic brain injury in a Swiss Academic Hospital // Anesth. Analg. — 2018. — 127(3). — Р. 698-703.
13. Kobata H. Diagnosis and treatment of traumatic cerebrovascular injury: pitfalls in the management of neurotrauma // Neurol. Med. Chir. — 2017. — 15; 57(8). — Р. 410-417.
/56_2.jpg)

/56.jpg)
/57.jpg)