Журнал «Медицина неотложных состояний» №2(97), 2019
Вернуться к номеру
Лідокаїн у мультимодальній анестезії: панацея сьогодення чи новий модний напрям?
Авторы: Лоскутов О.А.(1, 2), Данчина Т.А.(1, 3), Колесников В.Г.(1, 2), Дружина О.М.(1, 2)
(1) — Національна медична академія післядипломної освіти імені П.Л. Шупика, м. Київ, Україна
(2) — ДУ «Інститут серця МОЗ України, м. Київ, Україна
(3) — Національний військово-медичний клінічний центр «ГВКГ», м. Київ, Україна
Рубрики: Медицина неотложных состояний
Разделы: Клинические исследования
Версия для печати
Робота присвячена дослідженню дії та ефективності методики малоопіоїдної анестезії з використанням внутрішньовенного лідокаїну в кардіохірургії. У дослідження увійшли 28 пацієнтів віком 69,5 ± 6,2 року, яким було виконано аортокоронарне шунтування із штучним кровообігом. Всі пацієнти були прооперовані в умовах ендотрахеального наркозу. Середня тривалість анестезії становила 257,4 ± 19,1 хв. Індукція включала пропофол (1,52 ± 0,05 мг/кг), фентаніл (1–1,5 мкг/кг), лідокаїн — 1 мг/кг, піпекуронію бромід — 0,1 мг/кг. Підтримка анестезії: севофлуран (1,5–2 МАК), кетамін (0,5 мг/кг — одноразово перед розрізом), лідокаїн із безперервною інфузією (1,5–2 мг/кг/год), магнезії сульфат в/в (30 мг/кг). Середня доза фентанілу, що була використана на весь час анестезіологічного забезпечення, становила 1,09 ± 0,03 мкг/кг/год (в середньому — 358,3 ± 27,1 мкг на весь час оперативного втручання). Середній показник оцінки болю за візуальною аналоговою шкалою становив 4,6 ± 1,2, максимальний біль відмічали 27,8 % пацієнтів, а біль середньої та малої інтенсивності — 72,2 %. Запропонована мультимодальна малоопіоїдна методика анестезії з внутрішньовенним лідокаїном забезпечує адекватний аналгезуючий ефект і дозволяє відмовитися від інтраопераційного застосування високих доз наркотичних анальгетиків при виконанні високотравматичних операцій, що підтверджується відсутністю гемодинамічних й ендокринно-метаболічних порушень при її використанні.
Работа посвящена исследованию действия и эффективности методики малоопиоидной анестезии с использованием внутривенного лидокаина в кардиохирургии. В исследование вошли 28 пациентов в возрасте 69,5 ± 6,2 года, которым было выполнено аортокоронарное шунтирование с искусственным кровообращением. Все пациенты были прооперированы в условиях эндотрахеального наркоза. Индукция включала пропофол (1,52 ± 0,05 мг/кг), фентанил (1,46 ± 0,38 мкг/кг), лидокаин 1 мг/кг, пипекурония бромид (0,08 мг/кг). Поддержание анестезии: севофлуран (1,5–2 МАК), кетамин (0,5 мг/кг— однократно перед разрезом), лидокаин непрерывной инфузией (1,5–2 мг/кг/ч), магнезии сульфат в/в (30 мг/кг).
Средний уровень оценки боли по визуальной аналоговой шкале составлял 4,6 ± 1,2 балла. Максимальную интенсивность боли в 1-е сутки отмечали 27,8 % пациентов, средней и малой интенсивности — 72,2 %. Предложенная методика малоопиоидной анестезии с внутривенным лидокаином обеспечивала адекватный анальгезирующий эффект и позволила отказаться от интраоперационного применения рутинных доз фентанила при выполнении кардиохирургических операций, что подтверждается отсутствием гемодинамических и эндокринно-метаболических сдвигов при ее использовании.
The paper considers the action and the effectiveness of multimodal low-opioid anaesthesia with intravenous lidocaine in cardiac surgery. The study included 28 patients aged 69.5 ± 6.2 years who underwent coronary artery bypass grafting under artificial blood circulation. The patients received endotracheal anaesthesia. The induction was performed with propofol (1.52 ± 0.05 mg/kg), fentanyl (1–1.5 μg/kg), pipecuronium bromide (0.1 mg/kg), and lidocaine (1 mg/kg bolus) followed by the continuous infusion of lidocaine (1.5–2 mg/kg/h), sevoflurane (1.5–2 MAC), intravenous magnesium sulphate (30 mg/kg) and ketamine (0.5 mg/kg) once before the incision. The average dose of fentanyl used for the entire period of anesthesiology support was 1.09 ± 0.03 μg/kg/h (358.3 ± 27.1 μg for the duration of surgery). The mean pain level on visual analogue scale was 4.6 ± 1.2. At day one, 27.8 % of patients reported the maximum severity of pain, 72.2 % of individuals had medium or low pain. The offered regimen of low-opioid anaesthesia with intravenous lidocaine can ensure adequate analgesia. It allows refusing the intraoperative use of high doses of fentanyl during highly traumatic operations, as indicated by the absence of hemodynamic and endocrine-metabolic changes.
мультимодальна малоопіоїдна анестезія; внутрішньовенний лідокаїн; аортокоронарне шунтування
мультимодальная малоопиоидная анестезия; внутривенный лидокаин; аортокоронарное шунтирование
multimodal low opioid anesthesia; intravenous lidocaine; coronary bypass
Робота виконана відповідно до основних напрямків науково-дослідної роботи кафедри анестезіології та інтенсивної терапії НМАПО імені П.Л. Шупика «Розробка організаційних та клінічних аспектів підвищення рівня безпеки пацієнтів в анестезіології та інтенсивній терапії» (номер державної реєстрації: 0114U002223).
Вступ
У Швеції 40-х років 1/3 операцій виконувалася під місцевою анестезією новокаїном [1]. Однак новокаїнова анестезія була небезпечним методом знеболювання, що у великому відсотку випадків було пов’язано з алергічними реакціями і впливом великих доз новакаїну на системну гемодинаміку [2]. Саме тому було важливим знайти альтернативний місцевий анестетик, який би мав менше негативних впливів на організм порівняно з новокаїном.
Завдяки двотижневій експериментальній праці шведського хіміка, винахідника Нільса Лофгрена (Nils Löfgren) та його студента Бенгтома Люндквістома (Bengt Lundqvist) світ отримав новий місцевий анестетик — LL30. Нам відомий під комерційною назвою ксилокаїн або лігнокаїн, пізніше — лідокаїн. 15 липня 1943 року винахідники отримали патент на його використання [3].
Тривалий час лідокаїн використовували в клінічній стоматології, і лише в 1960 роки в США кардіологи виявляють, що лідокаїн усуває небезпечні для життя серцеві аритмії, оскільки ним лікували президента Д.Д. Ейзенхауера. Лідокаїн стає всесвітньо відомим анестетиком і препаратом вибору для лікування шлуночкових екстрасистолій [4].
Лідокаїн, 2-діетиламіноацето-2',6'-ксилідид (C14H22N2O), є місцевим анестетиком амідної групи тривалої дії, а також антиаритмічним препаратом класу 1b відповідно до класифікації Вонна Вільямса [5].
Сьогодні місцеві анестетики, зокрема лідокаїн, широко використовують для виконання різних методів регіональної анестезії, забезпечення інтраопераційної анестезії й аналгезії, а також для лікування гострого і хронічного болю. Сьогодні відомі такі способи введення, як нейроаксіальний, периневральний, різні інфільтративні підходи, місцеві, трансдермальний та внутрішньовенний спосіб [6].
Механізм блокування больової чутливості, що викликається лідокаїном, реалізується через блокаду потенціалзалежних натрієвих каналів, що перешкоджає генерації імпульсів у терміналях чутливих нервів і проведенню імпульсів по нервових волокнах. Даний препарат характеризується як швидкодіючий потужний анестетик із мінімальною кардіотоксичністю, що має вазодилатуючі властивості. Він пригнічує проведення не тільки больових імпульсів, але й імпульсів інших модальностей гіпералгезії [7]. Отже, лідокаїн послаблює сенсибілізацію периферичних ноцицепторів та центральну гіперзбудливість через дію блокатора натрієвого каналу [8].
Аналгетичні та антигіпералгезичні властивості внутрішньовенного лідокаїну включають, крім блокади натрієвих каналів, інгібування калієвих і кальцієвих каналів, пригнічення глікенергічної системи, NMDA-рецепторів та Gaq-пов’язаних білкових рецепторів [9].
Лідокаїн має інші способи дії, що пояснюють його клінічну роль при лікуванні периферичного та центрального болю. Він має сильні протизапальні властивості, більш потужні, ніж традиційні протизапальні препарати, із меншою кількістю побічних ефектів [10]. Протизапальні властивості лідокаїну знижують циркулюючі запальні цитокіни [11]. Роль запальних цитокінів визнається під час вторинної гіпералгезії та центральної сенсибілізації [12]. Введення лідокаїну є особливо ефективним для зняття механічної алодинії та гіпералгезії, пов’язаної з хронічним невропатичним болем. Вважається, що цей процес відбувається за допомогою центрального механізму дії [13].
Результати досліджень N. Attal та ін. [14] показали, що внутрішньовенний лідокаїн значно зменшує спонтанний біль та механічну гіпералгезію, що свідчить про те, що лідокаїн впливає на центральні модальності, а не на загальний ефект, що сприяє полегшенню болю. Важливо зазначити, що ці висновки свідчать про те, що критично важливо уникати залежності від візуальної аналогової шкали (ВАШ) як єдиного методу оцінки відповіді на лідокаїн. Якщо внутрішньовенно вводити лідокаїн у субанестетичних дозах, він вибірково блокує передачу больового синдрому в спинному мозку [15], тоді як периферично зменшується спонтанний нейронний розряд із волокон дельта та С, що зменшує передачу ноцицептивного болю [16].
Зазвичай при внутрішньовенному застосуванні місцевого анестетика виникають питання щодо його системної токсичності. Рекомендоване дозування лідокаїну, що застосовується, становить від 1–2 мг/кг вихідної болюсної дози при швидкості інфузії 1,5–3 мг/кг/год. Переважно лідокаїн виводиться через печінку; кліренс плазми становить 10 мл/кг/хв у пацієнтів із нормальною печінковою функцією та кровотоком. Тому при дозуванні ваги слід враховувати функціональний стан печінки. Згідно з дослідженням I.M. Saadawy і співавт. було визначено, що концентрація лідокаїну в плазмі після введення болюсу 2 мг/кг лідокаїну з подальшою безперервною в/в інфузією 2 мг/кг/год виявилася значно нижчою, ніж токсичний рівень [17], виміряна концентрація лідокаїну в плазмі більше 5 мкг/мл рідко зустрічається [9].
Оскільки використання внутрішньовенного лідокаїну як базового анестетика при кардіохірургічних операціях не було достатньо вивчено [18], хоча було виявлено захисний ефект від післяопераційної когнітивної дисфункції, ми вирішили дослідити його дію на прикладі використання в запропонованій нами методиці мультимодальної малоопіоїдної анестезії з використанням внутрішньовенного лідокаїну в кардіохірургії.
Мета: дослідити дію та ефективність методики малоопіоїдної анестезії з використанням внутрішньовенного лідокаїну в кардіохірургії.
Новизна. Дане дослідження є першим в Україні науково-практичним обґрунтуванням використання малоопіоїдної анестезії з використанням внутрішньовенного лідокаїну при проведенні кардіохірургічних операцій.
Матеріали та методи
У дослідження ввійшли 28 пацієнтів (17 (60,7 %) чоловіків та 11 (39,3 %) жінок), яким на базі ДУ «Інститут серця МОЗ України» було проведено аортокоронарне шунтування (АКШ) в умовах штучного кровообігу (ШК) за допомогою методики мультимодальної малоопіоїдної анестезії з використанням внутрішньовенного лідокаїну. Вік пацієнтів коливався від 63 до 76 років (у середньому — 69,5 ± 6,2 року).
Протокол дослідження був схвалений Комітетом з етики ДУ «Інститут серця МОЗ України». На участь в дослідженні пацієнти давали усну та письмову згоду.
Нами були відібрані пацієнти, соматичний стан яких відповідав 3–5 балам за Європейською системою оцінки ризику оперативного втручання для пацієнтів з ІХС.
Середня тривалість оперативного втручання становила 219,3 ± 24,2 хв, середня тривалість анестезії — 257,4 ± 19,1 хв. Середня кількість накладених коронарно-венозних анастомозів — 2,2 ± 0,5.
Всі пацієнти були прооперовані в умовах загальної анестезії.
Індукція складалася з внутрішньовенного введення (в/в) пропофолу в дозі 1,52 ± 0,05 мг/кг, що вводився по 40 мг із проміжком 10–15 с, лідокаїну 1 мг/кг болюсно з одночасним налагодженням безперервної внутрішньовенної інфузії останнього в дозі 1,5–2 мг/кг/год. Після введення гіпнотика всі хворі в/в отримували фентаніл у дозі 1–1,5 мкг/кг.
Після досягнення адекватного рівня анестезії м’язова релаксація досягалася в/в введенням піпекуронію броміду в дозі 0,1 мг/кг, після чого проводилася інтубація трахеї. Внутрішньовенну інфузію лідокаїну продовжували по ходу всієї операції до надходження пацієнта в палату інтенсивної терапії.
Для підтримання анестезії використовували інгаляцію севофлурану по напівзакритому контуру з цільовим підтриманням його концентрації згідно з віковим показником мінімальної альвеолярної концентрації (МАК). Цільову концентрацію севофлурану розраховували за формулою: МАКawake = 0,34 × × МАCтабл. × 2. При дозуванні севофлурану орієнтувалися на показники біспектрального індексу (BIS), підтримуючи їх у межах 40–50 %.
Перед хірургічним розрізом в/в додавали субнаркотичну дозу кетаміну (0,5 мг/кг).
Підтримання аналгезії під час оперативного втручання проводилося введенням фентанілу. Середня доза фентанілу, що була використана на весь час анестезіологічного забезпечення, становила 1,09 ± 0,03 мкг/кг/год (у середньому — 358,3 ± ± 27,1 мкг на весь час оперативного втручання).
Штучна вентиляція легень проводилась повітряно-кисневою сумішшю (FiO2 = 50 %) у режимі нормовентиляції (потік 2 л/хв) під контролем газового складу крові.
Штучний кровообіг проводився в умовах помірної гіпотермії (центральна температура дорівнювала +32 °С). Продуктивність апарата штучного кровообігу в період перфузії становила 2,5 л/хв/м2.
Для захисту міокарда на основному етапі операції використовувалась штучна електрична фібриляція серця, що здійснювалась за допомогою апарата змінного струму (Shtocer, Німеччина). Фібриляція створювалася низьковольтним генератором (частота струму — 50 Гц, напруга струму — 12 вольт, сила струму — 25 мА). При цьому вінцеві судини перфузувалися природним шляхом кров’ю з оксигенатора апарата штучного кровообігу.
Для клінічної оцінки стану гемодинаміки в групі обстеження був використаний моніторинг системних показників кровообігу (моніторні системи IntellsVue MP50, Нідерланди), за допомогою яких оцінювалися ЕКГ, частота серцевих скорочень (ЧСС), інвазивний артеріальний тиск (АТ), рівень периферичної сатурації (SpO2), центральний венозний тиск, індекс периферичної перфузії (ІПП).
Для оцінки ефективності захисту міокарда та впливу анестезії на міокард аналізували: характер відновлення серцевої діяльності після основного етапу операції, дози симпатоміметиків, що застосовувалися в ранньому постперфузійному і післяопераційному періодах, наявність ішемічних змін на ЕКГ, динаміку зростання показників кардіоспецифічних ферментів (МВ-КФК, тропонін І).
Для визначення глибини анестезії використовувався BIS-моніторинг (Aspect Medical System Inc., США). При цьому електроенцефалограму реєстрували в лобових відведеннях за схемою, рекомендованою виробником, із подальшим розрахунком BIS (version 3.1).
Рівень ендокринно-метаболічної відповіді визначався шляхом вимірювання в аналізах крові динаміки лактату та кортизолу. При дослідженні вмісту кортизолу в сироватці крові застосовувався хемілюмінесцентний метод (апарат COBASE 411). Оцінка даних показників проводилася напередодні і в кінці оперативного втручання.
Під час проведення анестезіологічного забезпечення усім пацієнтам виконувалося рутинне визначення кислотно-лужного та газового складу крові.
Для візуалізації коронарного кровотоку і визначення впливу лідокаїну на функціональний стан коронарних судин використовувалася методика коронарографії.
Аналіз отриманих результатів здійснювався на персональному комп’ютері з використанням прикладних програм Exсel 2010 і Statistica 12.0.
Результати та обговорення
Під час індукції в анестезію відмічалося зниження ЧСС до 58,11 ± 7,29 уд/хв (на 19,8 ± 1,4 % щодо вихідних значень) (р = 0,01272) (табл. 1).
Відносна брадикардія (зменшення частоти серцевих скорочень нижче 50 уд/хв), яка була зафіксована у 8 (72,7 %) пацієнтів на даному етапі ми пов’язували із синергізмом використовуваних анестетиків і β-блокаторів, які пацієнти отримували на доопераційному етапі.
На етапі інтубації трахеї відзначалося збільшення ЧСС щодо попередніх значень на 25,8 ± 2,6 % (табл. 1) (р = 0,01136).
Динаміка показників артеріального тиску на етапі індукції демонструвала тенденцію до зниження. Так, показники середнього артеріального тиску порівняно з вихідними даними зменшувалися на 35,1 ± 3,2 % (р = 0,00104) (табл. 1).
Подібні зміни пов’язані з тим, що препарати, які використовувалися для ввідної анестезії, знижували тонус симпатичної нервової системи, перерозподіляли обсяг циркулюючої крові в ємнісну судинну мережу, що сприяло зменшенню переднавантаження. Зі свого боку, зменшення наповнення шлуночків серця приводило до меншого розтягування стінок як лівого, так і правого шлуночка, внаслідок чого згідно з механізмом Франка — Старлінга зменшувало контрактильну здатність міокарда.
Значний внесок у зміну показників системної гемодинаміки зробила периферична вазодилатація, що спостерігалася під час індукції в анестезію. Підтвердженням цього була динаміка ІПП, який наприкінці ввідного наркозу становив 1,83 ± 0,21 од.
(референтні значення — 1,0 од.), що було вище від вихідного рівня на 60,70 ± 4,29 % (р = 0,00131)
(табл. 1).
На етапі підтримування анестезії до хірургічного розрізу після в/в введення субнаркотичних доз кетаміну і вищевказаних доз лідокаїну ЧСС реєструвалася у межах 65,50 ± 6,21 уд/хв, що було менше попередніх значень на 16,4 ± 2,3 % (табл. 1). При цьому показники АТсер. були меншими щодо відповідних значень, зареєстрованих на попередньому етапі, на 10,1 ± 1,7 % (табл. 1). Звертало на себе увагу вірогідне підвищення ІПП, показники якого становили 1,950 ± 0,131 од., що перевищувало попередні значення на 43,6 ± 2,5 % (р = 0,000121) (табл. 1), що свідчило про подальше зниження рівня загальнопериферичного судинного опору.
При цьому показники BIS були в межах 43,6 ± ± 4,2 %. На ЕКГ ми не спостерігали проявів додаткових ішемічних змін щодо вихідної картини.
Під час хірургічного доступу стернотомії та підтримування анестезії до штучного кровообігу динаміка досліджуваних показників (ЧСС, АТ, ІПП, BIS) не мала вірогідних змін (р > 0,1) (табл. 1).
При цьому ми спостерігали зростання показників ІПП, що на етапі підтримування анестезії до початку штучного кровообігу становили 2,12 ± ± 0,09 од. і були більшими від відповідних значень, які ми фіксували після інтубації, на 48,11 ± 1,40 % (р = 0,00132) (табл. 1). Це свідчило про зниження рівня загальнопериферичного судинного опору і вимагало його корекції малими дозами норадреналіну.
Вищенаведені показники гемодинаміки і біспектрального індексу свідчили про адекватність анестезіологічного забезпечення та достатній рівень аналгезії (табл. 1).
Під час проведення штучного кровообігу і в ранньому постперфузійному періоді показники кровообігу у всіх обстежених хворих відповідали гемодинамічному профілю патології, що оперували.
Позитивний вербальний контакт був зафіксований через 18,6 ± 3,4 хв після закінчення анестезії та припинення інгаляції севофлурану.
Всі пацієнти були екстубовані в перші 3 години після закінчення операції. Біохімічні показники газів крові були задовільними, був відсутній метаболічний або дихальний ацидоз, вірогідних змін в аналізах газового складу крові не спостерігалося.
Жоден пацієнт не повідомляв про інтраопераційні події і не пред’являв скарг на будь-які побічні ефекти, які могли бути пов’язані з використанням лідокаїну (аритмія, металевий присмак, шум у вухах і зорові порушення).
Динаміка середніх значень кардіоспецифічних ферментів у всіх пацієнтів була характерною для операцій подібної категорії складності, що свідчило про те, що мультимодальна малоопіоїдна методика анестезії, яка використовувалась в нашому дослідженні, не впливала негативно на міокард і не викликала коронарно-констрикторного ефекту
(табл. 2).
Для визначення адекватності анестезіологічного забезпечення та ступеня антиноцицептивного захисту в роботі була проведена оцінка плазмової концентрації кортизолу, глюкози і лактату.
Рівень кортизолу в ранньому післяопераційному періоді становив 479,3 ± 26,4 нмоль/л, що не перевищувало показників норми (до 700 нмоль/л) і свідчило про відсутність стресової активації функції кори надниркових залоз на хірургічне втручання на тлі анестезіологічного забезпечення, що проводилося.
Середні показники інтраопераційного рівня лактату так само не виходили за межі референтних значень і становили 1,61 ± 0,20 ммоль/л, що свідчило про нормальний рівень тканинної перфузії і тканинного газообміну.
Післяопераційне знеболювання здійснювалося трометаміном кеторолаком внутрішньом’язово 30 мг кожні 8–12 годин упродовж 2 діб. Післяопераційні показники за ВАШ були такими: середній показник становив 4,6 ± 1,2, максимальний біль відмічали 27,8 % пацієнтів, а біль середньої та малої інтенсивності — 72,2 % (1 доба).
Для обґрунтування компетентності мультимодальної малоопіоїдної анестезії з використанням внутрішньовенного лідокаїну доцільно зупинитися на фізіологічних механізмах формування больової чутливості.
Існують два основні класи ноцицепторів, які реагують на різні форми шкідливих подразників. Найбільша група ноцицепторів асоціюється з немієлінізованими аксонами, які також називаються C-волокнами [7]. Друга велика популяція ноцицепторів пов’язана з тонкомієлінізованими аксонами (А-дельта волокна). Також існує ще одна категорія ноцицепторів, що характеризуються унікальними властивостями — «сплячі», або «тихі», ноцицептори [7].
При дії на ноцицептори больових подразників виникає їх деполяризація, і імпульси насамперед надходять по швидкопровідних волокнах групи А-дельта з наступною активацією безмієлінових С-волокон [19]. Передача імпульсів здійснюється за допомогою медіатора болю — субстанції Р (нейропептид), що, вивільняючись із периферичних терміналей, викликає додаткове збудження із різким збільшенням притоку в мозок больової інформації, приєднуючись до плазмових факторів та запальних клітин у місці травми [7, 20] (рис. 1).
Центральна гілка ноцицептора закінчується спинним рогом спинного мозку (або його тригемінального гомолога в стовбурі мозку), де він утворює синаптичні зв’язки з комплексом нейронів, які відіграють різні ролі при ноцицептивній обробці та болях. Деякі інтернейрони створюють зв’язки з моторними нейронами, які генерують ноцицептивні рефлекси абстиненції. Вихідні нейрони спинного мозку, з іншого боку, проектують і передають ноцицептивне послання до ретикулярного утворення стовбура мозку та таламуса. Серед висхідних шляхів, що виникають від спинного мозку, є спиноталамічні та спиноретикулярні шляхи, а також спинопарабрахіально-мигдалевий, що забезпечує більш прямий доступ до лімбічних емоційних ланцюгів мозку (через мигдалину) [21].
Разом із тим механізми, що сприяють розвитку післяопераційного та хронічного болю, набагато складніші, ніж досить прості анатомо-фізіологічні основи миттєвого болю. Важливо усвідомити, що ці больові відчуття — це не лише випадки тимчасового болю, які швидко не вирішуються, вони виникають у контексті та фоні пошкодження тканин або нервів та пов’язані із змінами властивостей не тільки ноцицепторів, але й схем, до яких ці рецептори входять у спинний мозок та на інших рівнях нейраксії [21, 22]. Важливо підкреслити, що на сьогодні лідокаїн залишається єдиним місцевим анестетиком, який застосовується системно для лікування післяопераційного болю й інтраопераційної аналгезії.
Отже, багато досліджень показали, що інтраопераційне внутрішньовенне введення лідокаїну чинить статистично значущий позитивний вплив на післяопераційну аналгезію, що сприяє потенційному зниженню загального споживання опіоїдів, зменшує вираженість післяопераційного болю, зменшує тривалість парезу кишечника та скорочує перебування пацієнтів у стаціонарі [23, 24].
Підсумовуючи, ми можемо зазначити, що лідокаїн є амідним місцевим анестетиком із широким діапазоном механізмів дії, справляє опіоїдні ефекти, блокує натрієві канали, відокремлює білок G, блокує рецептор NMDA, зменшує циркулюючі запальні цитокіни і запобігає вторинній гіпералгезії та центральній сенсибілізації.
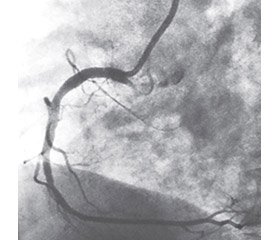
Відповідно до проведених нами досліджень, внутрішньокоронарне введення лідокаїну (яке проводилося з метою профілактики життєзагрожуючих аритмій при стентуванні коронарних артерій), не тільки не викликало спазму вінцевих судин, але й сприяло їх дилатації (рис. 2, 3).
Висновки
1. Використання мультимодальної малоопіоїдної анестезії з внутрішньовенним введенням лідокаїну при оперативних втручаннях у кардіохірургії є ефективним і забезпечує адекватний аналгезуючий ефект під час хірургічного втручання.
2. Дозволяє відмовитися від інтраопераційного застосування високих доз наркотичних анальгетиків при виконанні високотравматичних операцій, що підтверджується відсутністю гемодинамічних й ендокринно-метаболічних порушень при її використанні. А зменшена потреба в застосуванні післяопераційних опіоїдів сприяє скорішій реабілітації пацієнтів та скороченню ліжко-днів.
3. Дана методика не впливала на динаміку кардіоспецифічних ферментів, не відзначалося негативної динаміки на електрокардіограмі, що свідчить про відсутність коронаро-констрикторного ефекту даного методу знеболювання.
Перспективи подальших досліджень. Подальші дослідження будуть спрямовані на впровадження в клінічну практику методики використання мультимодальної малоопіоїдної анестезії з внутрішньовенним введенням лідокаїну при оперативних втручаннях у кардіохірургії, а також розроблення науково обґрунтованого протоколу використання методики малоопіоїдної анестезії в кардіохірургії.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів при підготовці даної статті.
1. Weinberg L., Peake B., Tan C., Nikfarjam M. P harmacokinetics and pharmacodynamics of lignocaine: areview // World J. Anesthesiol. — 2015. — 4. — Р. 17-29.
2. Aldrete J.A., Johnson D.A. Evaluation of intracutaneous testing for investigation of allergy to local anesthetic agents // Ane-sthesia & Analgesia. — 1970. — Vol. 49. — № 1. — Р. 173-181.
3. Lofgren N., Lundqvist B. Studies on Local Anaesthetics II // Svensk Kemisk Tidskrift. — 1946. — Vol. 58. — P. 206-217, 323-335.
4. Lofgren N., Tegner C., Takman B. Studies on Local Anaesthetics XVI // Acta Chemica Scandinavica. — 1957. — Vol. 11. — P. 1724-1737.
5. Williams V. Classification of antiarrhythmic drugs. 1st ed. Sodertaje: AB Astra; 1970.
6. Shah J., Votta-Velis E.G., Borgeat A. Newlocalanesthetics // Best Pract. Res. Clin. Anaesthesiol. — 2018 Jun. — 32(2). — Р. 179-185. doi: 10.1016/j.bpa.2018.06.010. Epub 2018 Jul 3. PMID: 30322458.
7. Shlapak І.P. Anestezіologіyata іntensivnaterapіya: pіdruchnikdlyalіkarіv — іnternіvtaslukhachіvvischikhnavchal'nikhzakladіv 3-4 rіvnyaakreditatsії tazakladіvpіslyadiplomnoї osvіti. — Tom 1. — K.: NіkaPrіnt, 2012. — 550 p.
8. Rogers M., Tang L., Madge D.J., Stevens E.B. The role of sodium channels in neuropathic pain // Seminarsin Cell & Deve-lopmental Biology. — 2006. — 17. — Р. 571-81. DOI: 10.1016/j.semcdb.2006.10.009.
9. Van der Wal S.E., Van den Heuvel S.A., Radema S.A. et al. The in vitro mechanisms and invivo efficacy of intravenous lidocaine on the neuroinflammatory response in acute and chronic pain // Eur. J. Pain. — 2016 May. — 20(5). — Р. 655-74. doi: 10.1002/ejp.794. Epub 2015, Dec 18.
10. Cassuto J., Sinclair R., Bonderovic M. Anti-inflammatory properties of local anesthetics and their present and potential clinical implications // Acta Anaesthesiologica Scandinavica. — 2006. — 50. — Р. 265-82. DOI: 10.1111/j.1399-6576.2006.
00936.x.
11. Hollmann M.W., Durieux M.E. Local anesthetics and the inflammatory response: a new the rapeutic indication? // Anesthesiology. — 2000. — 93. — Р. 858-875.
12. Hu P., McLachlan E.M. Macrophage and lymphocyte invasion of dorsal root ganglia after peripheral nerve lesions in the rat // Neuroscience. — 2002. — 112. — Р. 23. DOI: 10.1016/S0306-4522(02)00065-9.
13. Koppert W., Ostermeier N., Sittl R., Weidner C., Schmelz M. Low-dose lidocaine reduces secondary hyperalgesia by a central mode of action // Pain. — 2008. — 85. — Р. 217-24 p. DOI: 10.1111/j.1529-8027.2000.022-8.x.
14. Attal N., Rouaud J., Brasseur L., Chauvin M., Bouha-ssira D. Systemic lidocaine in pain due to peripheral nerve injury and predictors of response // Neurology. — 2004. — 62. — Р. 218-25. DOI: 10.1212/01.WNL.0000103237.62009.77.
15. Nagy I., Woolf C.J. Lignocaine selectively reduces C fibre-evoked neuronal activity in rat spinal cord in vitro by decreasing N-methyl-D-aspartate and neurokinin receptor-mediated post-synaptic depolarizations; implications for the development of novel centrally acting analgesics // Pain. — 1996. — 64. — Р. 59-70. DOI: 10.1016/0304-3959(95)00072-0.
16. Chabal C., Russell L.C., Burchiel K.J. The effect of intravenous lidocaine, tocainide, and mexiletine on spontaneously active fibers originating in rat sciatic neuromas // Pain. — 1989. — 38. — Р. 333-38. DOI: 10.1016/0304-3959(89)90220-0.
17. Saadawy I.M., Kaki A.M., Abd El Latif A.A., Abd-Elmaksoud A.M., Tolba O.M. Lidocaine vs. magnesium: effect on analgesia after a laparoscopic cholecystectomy // Acta Anaesthesiol. Scand. — 2010 May. — 54(5). — Р. 549-56. DOI: 10.1111/j.1399-6576.2009.02165.x. Available in PC 2018, Feb 25.
18. Wang D., Wu X., Li J., Xiao F., Liu X., Meng M. The effect of lidocaine on early postoperative cognitive dysfunction after coronary artery bypass surgery // Anesth. Analg. — 2002. — 95. — Р. 1134-41.
19. Petho G. Sensory and signaling mechanisms of bradykinin, eicosanoids, platelet-activating factor, and nitric oxide in peripheral nociceptors // Physiol. Rev. — 2012. — Vol. 92, № 4. — Р. 1699-1775 p. DOI: 10.1152/physrev.00048.2010.
20. Ovsyannikov V.G. Zagal’na patologіya: patologіchna fіzіologіya: pіdruchnik, 4-e vid. RostGMU, Ch. I. Zagal’na patofіzіologіya. — 2014. — Р. 320-26. UDK: 16-092(075). BBK 52.5ia7 O-34. [In Ukrainian].
21. Basbaum A.I., Jessel T. The perception of pain. Principles of Neuroscience. — Appleton and Lange, New York, 2000. — Р. 472-91. ISBN-13: 978-0071390118; ISBN-10: 0071390111.
22. Julius D., Basbaum A.I. Molecular mechanisms of nociception // Nature. — Vol. 413. — Sep 2001. — 413. — Р. 203-10 p. DOI: doi.org/10.1038/35093019.
23. Marret E., Rolin M., Beaussier M., Bonnet F. Meta-analysis of intravenous lidocaine and postoperative recovery after abdominal surgery // Br. J. Surg. — 2008. — 95. — Р. 1331-1338.
24. Sun Y., Li T., Wang N., Yun Y., Gan T.J. Perioperative systemic lidocaine for postoperative analgesia and recovery after abdominal surgery: a meta-analysis of randomized controlled trials // Dis. Colon. Rectum. — 2012. — 55. — Р. 1183-1194.

/101-1.jpg)
/101-2.jpg)
/102-1.jpg)
/102-2.jpg)