Журнал «Медицина неотложных состояний» №1(96), 2019
Вернуться к номеру
Динаміка впливу комплексного застосування сорбілакту і L-аргініну на перебіг синдрому ендогенної інтоксикації гнійно-септичного генезу
Авторы: Максимчук Н.О., Коновчук В.М.
Вищий державний навчальний заклад України «Буковинський державний медичний університет», м. Чернівці, Україна
Рубрики: Медицина неотложных состояний
Разделы: Клинические исследования
Версия для печати
Актуальність. Перебіг усіх захворювань, що мають системний характер ушкоджень середньотяжкого ступеня, супроводжується синдромом ендогенної інтоксикації (СЕI). У статті наведено результати динамічного спостереження за показниками СЕІ гнійно-септичного генезу. Мета роботи — вивчити вплив поєднаного застосування сорбілакту і L-аргініну за умови стандартної терапії в динаміці (перший — сьомий дні спостереження) на детоксикаційну функцію нирок і рівень показників CЕІ. Матеріали та методи. У дослідження включені рандомізовані групи: І група (контрольна) — пацієнти з синдромом системної запальної відповіді; ІІ група — хворі з СЕІ, яким проводилась стандартна терапія; ІІІ група — хворі з СЕІ, яким на базі стандартної терапії вводили сорбілакт; IV група — хворі з СЕІ, стандартне лікування яких доповнювалось поєднаним застосуванням сорбілакту і L-аргініну. Результати. Встановлено, що в середовищі фармакотерапевтичних засобів застосування сорбілакт-L-аргінінового комплексу активує детоксикаційну функцію нирок (за кліренсовими характеристиками токсичних речовин — на 216 %; молекул середньої маси — на 244 %) та суттєво зменшує ендогенну інтоксикацію (за клітинно-гуморальним індексом інтоксикації — на 204 %). Висновки. Використання сорбілакт-L-аргінінового комплексу — ефективний засіб впливу на перебіг синдрому ендогенної інтоксикації та активність детоксикаційної функції нирок шляхом зростання активності механізмів елімінації токсинів, що супроводжувалося зниженням токсемії.
Актуальность. Течение всех заболеваний, имеющих системный характер повреждений среднетяжелой степени, сопровождается синдромом эндогенной интоксикации (СЭИ). В статье приведены результаты динамического наблюдения за показателями СЭИ гнойно-септического генеза. Цель работы — изучить влияние сочетанного применения сорбилакта и L-аргинина при стандартной терапии в динамике (первый — седьмой дни наблюдения) на детоксикационную функцию почек и уровень показателей СЭИ. Материалы и методы. В исследование включены рандомизированные группы: I группа (контрольная) — больные с синдромом системного воспалительного ответа; II группа — больные с СЭИ, которым проводилась стандартная терапия; III группы — больные с СЭИ, которым на базе стандартной терапии назначали сорбилакт; IV группа — больные с СЭИ, стандартное лечение которых дополнялось совмещенным применением сорбилакта и L-аргинина. Результаты. Установлено, что в среде фармакотерапевтических средств применение сорбилакт-L-аргининового комплекса активирует детоксикационную функцию почек (по клиренсовым характеристикам токсичных веществ — на 216 %; молекул средней массы — на 244 %) и существенно уменьшает эндогенную интоксикацию (по клеточно-гуморальному индексу интоксикации — на 204 %). Выводы. Использование сорбилакт-L-аргининового комплекса — эффективное средство воздействия на течение синдрома эндогенной интоксикации и активность детоксикационной функции почек путем роста активности механизмов элиминации токсинов, сопровождаемое снижением токсемии.
Background. The course of all diseases with systemic lesions of moderate severity is accompanied by an endogenous intoxication syndrome (EIS). The article presents the results of dynamic observation of the indicators of EIS of purulent-septic origin. The purpose of the study is to investigate the effect of combined use of sorbilact and L-arginine with standard therapy in dynamics (days 1–7 of observation) on the detoxification function of the kidneys and the level of EIS indices. Materials and methods. The study included randomized groups: group I — patients with systemic inflammatory response syndrome; group II — those with EIS, who received standard therapy; group III — patients with EIS, who on the basis of standard therapy received sorbilact; IV group — patients with EIS, whose standard treatment was supplemented by combined use of sorbilact and L-arginine. Results. The use of pharmacotherapeutic agents sorbilact and L-arginine activates the detoxification function of the kidneys (in terms of the clearance characteristics of toxic substances — by 216 %, the middle molecules — by 244 %) and significantly reduces the endogenous intoxication (cell-humoral index of intoxication — by 204 %). Conclusions. The combined use of sorbilact and L-arginine is an effective mean for influencing the course of endogenous intoxication syndrome and the activity of detoxification function of the kidneys, by increasing the activity of the toxin elimination mechanisms, followed by the reduction of toxemia.
синдром ендогенної інтоксикації; сорбілакт; L-аргінін
синдром эндогенной интоксикации; сорбилакт; L-аргинин
syndrome of endogenous intoxication; sorbilact; L-arginine
Вступ
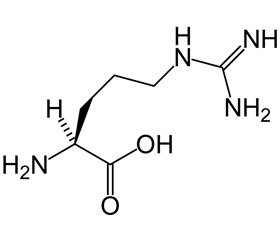
Згідно з погоджувальною конференцією «Сепсис-3», це життєво небезпечна органна дисфункція, викликана порушенням регуляторних процесів відповіді організму на інфекцію [1]. Сепсис нерозривно пов’язаний із розвитком синдрому поліорганних ушкоджень, що призводить до збільшення продукції та накопичення ендотоксинів і, відповідно, розвитку синдрому ендогенної інтоксикації (СЕІ) [2, 3]. Відповідно, поряд із комплексним лікуванням (хірургічною санацією вогнища інфекції, антибіотикотерапією, усуненням водно-електролітних, метаболічних і реологічних порушень) корекція СЕІ виступає важливим патогенетичним методом лікування даних пацієнтів [4]. Незважаючи на застосування екстракорпоральних методів детоксикації, інфузійна терапія залишається основою базисної програми комплексної інтенсивної терапії СЕІ гнійно-септичного генезу [5, 6]. Серед препаратів із вираженими детоксикаційними властивостями важливе місце належить розчинам, до складу яких входять багатоатомні спирти, зокрема сорбілакту [7]. Препарат має широкий спектр позитивних характеристик [8, 9], а його ефективність встановлена клінічно [9–13]. Застосування L-аргініну разом із сорбілактом приховує в собі значний потенціал як активатора токсиновидільної функції, так і нефропротектора [14–16].
Мета роботи — встановити динамічний вплив поєднаного застосування сорбілакту та L-аргініну за умови фонової стандартної терапії на детоксикаційну функцію нирок і рівень показників СЕІ.
Матеріали та методи
Проведено дослідження динамічних (протягом першої — сьомої доби) характеристик СЕІ та детоксикаційної функції нирок пацієнтів протягом наступних періодів:
— перша доба перебування у відділенні реанімації з ліжками інтенсивної терапії (ВРзЛІТ) (період розвитку ранньої вторинної автоагресії);
— четверта доба перебування у ВРзЛІТ (проміжний період);
— сьома доба перебування у ВРзЛІТ (період нестійкої компенсації токсиновидільної функції нирок).
Пацієнти були рандомізовані в чотири групи: І група — 31 хворий із синдромом системної запальної відповіді (ССЗВ), за Міжнародною класифікацією хвороб 10-го перегляду: R-65.2, тобто неінфекційного генезу без органної недостатності; ІІ група — 27 хворих із СЕІ гнійно-септичного генезу, стратифікованого за клітинно-гуморальним індексом інтоксикації (КГІІ) [17] в інтервалі 20–60 балів (середньотяжкий ступінь інтоксикації), яким проводилась стандартна терапія (СТ); ІІІ група — 29 хворих із СЕІ гнійно-септичного генезу за КГІІ 20–60 балів, яким додатково застосовували сорбілакт на фоні СТ (із розрахунку 6–7 мл/кг/год маси тіла внутрішньовенно краплинно зі швидкістю 7–8 мл/хв); IV група — 30 хворих із СЕІ гнійно-септичного генезу за КГІІ 20–60 балів, СТ котрих доповнювали поєднанням сорбілакту з L-аргініном (100 мл 4,2% розчину аргініну гідрохлориду внутрішньовенно краплинно зі швидкістю 10 крапель за 1 хвилину протягом перших 10–15 хв, потім швидкість збільшували до 30 крапель за 1 хвилину).
У дослідження включались хворі з гострою гнійною хірургічною інфекцію різної локалізації, зумовленою асоціацією аеробної грампозитивної та грамнегативної флори в практиці хірургічного відділення абдомінального, проктологічного, травматологічного, отоларингологічного, щелепно-лицевого, акушерсько-гінекологічного профілів після хірургічної санації вогнища інфекції з наступним розвитком вторинної токсичної автоагресії за шкалою КГІІ 20–60 балів (середньотяжкий ступінь інтоксикації).
Хворі протягом першого — сьомого дня дослідження продовжували отримувати СТ відповідно до Surviving Sepsis Campaign 2016 [18] (продовження заходів хірургічної санації джерела інфекції, обґрунтована антибіотикотерапія, відповідна інфузійна терапія, реологічна, метаболічна та ін.), причому схема терапії була погоджена з практичними рекомендаціями KDIGO з гострого ураження нирок [19]. У період фармакологічного простору дослідження від застосування препаратів, що мають сечогінну або кардіотропну дію, утримувалися.
Обов’язковою умовою включення були стабільна гемодинаміка, відсутність показань до штучної вентиляції легень, відсутність протипоказань до об’ємного інфузійного навантаження з боку серцево-судинної, дихальної і сечовидільної системи системи. Тобто передбачалося, що механізми підтримання гомеостазу за умов можливого коморбідного фону мають цілком компенсований характер.
Обставини припинення дослідження були регламентовані критеріями включення (зменшенням КГІІ нижче 20 балів).
Критерієм виключення була поява однієї чи більше обставин, що не були передбачені критеріями включення, зокрема: доповнення схеми інтенсивної терапії гемодіалізом, плазмаферезом, штучною вентиляцією легень, гіпербаричною оксигенацією; значне погіршення загального стану зумовлене активацією коморбідних захворювань чи прогресуванням ускладнень, що вимагало застосування заходів інтенсивної терапії, які не підлягали критеріям включення.
Забір крові та сечі здійснювали через 4 години (± 10 хв) від початку інфузії сорбілакту. КГІІ визначали за шкалою [17]. Сумарну концентрацію токсичних речовин визначали шляхом використання одноклітиних рецепторно-ефекторних систем, наприклад за модифікованим тестом Paramecium caudаtum [20]. Молекули середньої маси (МСМ) визначали за модифікованою методикою [21]. Статистичний аналіз отриманих даних проведено з використанням пакета IBM SPSS Statistics 8, що включав описову статистику (середнє та похибка середнього) і перевірку статистичної гіпотези про однорідність вибірок (t-критерій Стьюдента для залежних вибірок та незалежних вибірок).
Результати
За умов СТ токсичність плазми крові (Рт) у першому періоді в 1,5 раза перевищувала контрольний рівень (р < 0,05) (табл. 1). Статистично вірогідне зменшення показника (на 24,0 ± 8,0 ум.од.т./мл, 14,0 ± 4,6 %, ∆р < 0,05) спостерігалось до другого періоду. У динаміці вірогідне зростання кліренсу токсичних речовин (Стр) відмічено у другому періоді дослідження (∆р < 0,05) із стабілізацією до кінця дослідження, проте СТ була недостатньою для відновлення Стр до рівня контролю (р > 0,05). При застосуванні СТ концентрація МСМ (Рмсм) в плазмі крові на перший день дослідження була значно вищою за контрольний рівень (на 277 %, р < 0,05). У другому періоді їх рівень знижувався на 0,14 ± 0,05 ум.од./мл (19 %, ∆р < 0,05) та стабілізувався до кінця дослідження. У першому періоді при СТ кліренс МСМ (Смсм) був значно нижчим за рівень контролю (на 35 %, р < 0,05). У другому періоді спостерігалось зростання Смсм (на 4,40 ± 1,52 мл/хв, 43,0 ± 16,9 %, ∆р < 0,05) із наступною стабілізацією. При цьому Смсм не досягав контролю. За умов СТ у першому періоді дослідження показник КГІІ значно перевищував рівень контролю (у 5 раз). СТ до четвертого дня зумовлювало зменшення показника КГІІ (на 11,0 ± 3,2 бала, 21,0 ± 6,2 %, ∆р < 0,05), без досягнення контролю.
Під час використання на базі СТ сорбілакту значення Рт зменшувалось у другому періоді дослідження (на 21,0 ± 9,1 ум.од.т./мл, 13,0 ± 5,6 %, ∆р < 0,05). Сорбілакт зумовлював зростання Стр щодо пацієнтів із СТ (р < 0,05) вже на першу добу. Подальше застосування препарату у комплексі терапевтичних заходів спричинило значне зростання Стр (на 1,30 ± 0,61 мл/хв, 81,0 ± 38,5 %, ∆р < 0,05) порівняно із попереднім періодом і наступною стабілізацією (∆р > 0,05). Вірогідне зниження Рмсм при використанні сорбілакту відбувалось на проміжку до другого періоду дослідження (на 0,16 ± 0,07 ум.од./мл, 24,0 ± 11,4 %, ∆р < 0,05). Слід відзначити, що при застосуванні сорбілакту Рмсм знижувалась, але на 77 % (р < 0,05) залишалася більш високою, ніж при ССЗВ. Використання сорбілакту в комплексі СТ у першому періоді зумовлювало зростання Смсм (на 33 %, р < 0,05) порівняно з хворими ІІ групи. У другому періоді зареєстровано значне зростання Смсм (на 12,0 ± 5,2 мл/хв, 88,0 ± 2,3 %, ∆р > 0,05) порівняно з попереднім періодом, а також із ІІ групою у даному періоді (на 75 %, р < 0,05). У третьому періоді дослідження Смсм у групі хворих, які отримували сорбілакт, знижувався (на 5,10 ± 2,21 мл/хв, 21 ± 87 %, ∆р < 0,05), проте залишався вищим (на 36 %, р < 0,05) порівняно із хворими із стандартною терапією. Тобто сорбілакт потенціював природні механізми детоксикації (токсиновидільна функція нирок) і заходи СТ. Загалом при терапії СЕІ сорбілактом Смсм (з першого по сьомий день спостереження) підвищувався на 29 % (р < 0,05) щодо ССЗВ. Статистично вірогідне зменшення КГІІ спостерігалось до другого періоду дослідження (на 16,0 ± 6,4 бала, 33,0 ± 2,6 %, ∆р < 0,05), після чого показник змінювався статистично невірогідно.
Включення у комплексне лікування сорбілакт-L-аргінінового комплексу зумовлювало статистично вірогідне зменшення Рт (р < 0,05) у першому періоді дослідження. У другому періоді зниження Рт у IV групі становило 29,0 ± 12,1 ум.од.т/мл, або 19,0 ± 7,9 % (∆р < 0,05). У третьому періоді Рт стабілізувалась (∆р > 0,05), залишаючись на 25 % більшою (р < 0,05), ніж при ССЗВ. При поєднаному використанні сорбілакту та L-аргініну динаміка змін Стр характеризувалась значним зростанням (на 115 %, ∆р < 0,05) у другому періоді дослідження, з наступною стабілізацією. Застосування в комплексі з сорбілактом L-аргініну зумовлювало зменшення Рмсм у другому періоді порівняно з третьою групою (р < 0,05) та щодо попереднього періоду (на 0,20 ± 0,09 ум.од./мл, 32,0 ± 14,1 %, ∆р < 0,05). Важливо, що і в третьому періоді призначення L-аргініну результувало в подальше зниження Рмсм (на 0,12 ± 0,05 ум.од./мл, 28,0 ± 12,7 %, ∆р < 0,05). При цьому Рмсм IV групи у третьому періоді був найближчим до контролю порівняно з показниками інших груп (Рмсм на 18 %, р < 0,05, більше ССЗВ). Спільне використання L-аргініну та сорбілакту вже в першому періоді дослідження спричинило досягнення показника Смсм рівня контролю (р < 0,05). У другому періоді дослідження Смсм у даній групі значно зростав (на 21,80 ± 8,68 мл/хв, 140,0 ± 51,1 %, ∆р > 0,05) та до кінця дослідження стабілізувався на даному рівні. Загалом при терапії СЕІ сорбілактом та L-аргініном Смсм (з першого по сьомий день) зростав на 138 % щодо ССЗВ. Тобто L-аргінін та сорбілакт (порівняно з сорбілактом) на 109 % (р < 0,05) підвищує Смсм щодо інфузії сорбілакту без L-аргініну. У проміжному періоді чітко окреслюється здатність поєднання вказаних препаратів позитивно впливати на перебіг СЕІ, що відобразилось у значному зниженні показника КГІІ (на 22 %, р < 0,05) порівняно з групою, де застосовували тільки сорбілакт, та порівняно з попереднім періодом дослідження (на 18,0 ± 8,5 бала, 40,0 ± 18,9 %, ∆р > 0,05). У подальшому періоді комбіноване застосування сорбілакту та L-аргініну зумовлювало зменшення показника КГІІ (на 45 %, р < 0,05) порівняно із ІІІ групою. L-аргінін у поєднанні з сорбілактом на 31 % (р < 0,05) знижував КГІІ (р < 0,05) щодо застосування тільки сорбілакту (до сьомого дня лікування). Проте показник КГІІ залишався вищим за рівень контролю (у 2 рази, р < 0,05), тобто його нормалізація мала місце за рамками спостереження.
Обговорення
Ступінь ендотоксикозу залежить від балансу співвідношення між токсиноутворенням та елімінацією ендотоксинів, звичайно, з врахуванням факторів інтенсивної терапії. В цілому зниження концентрації токсичних речовин в плазмі крові, концентрації МСМ в плазмі крові, КГІІ та підвищення кліренсу МСМ до прикінцевого терміну дослідження свідчать за відповідну якість СТ.
На підставі отриманих даних слід вважати, що активація токсиновидільної функції та нефропротекція сорбілактом полягають у наступному. У результаті відсутності природніх механізмів реабсорбції багатоатомних спиртів у проксимальних відділах нефронів препарат здійснює осмотичний діурез подібно до манітолу, та збільшує швидкість клубочкової фільтрації (ШКФ) та фільтраційну фракцію МСМ, зменшує їх реабсорбцію (близько 80 % МСМ реабсорбується в проксимальних відділах нефронів за участі системи пептидаз). Звідси сорбітол розвантажує канальці нирок від виконання цієї роботи, особливо за умови гострого ураження нирок при СЕІ гнійно-септичного генезу: збільшує екскрецію МСМ, у тому числі тих, що мають вазоконстрикторний ефект, що, у свою чергу, призведе до зменшення загального периферичного опору судин та збільшенням ШКФ.
Таким чином, долучення L-аргініну зумовлює підсилення впливу сорбілакту на токсиновидільну функцію нирок за кліренсовими характеристиками Стр — на 21 %, Смсм — на 18 % та КГІІ — на 45 % (р < 0,05). Порівняно із першим застосуванням комплекс сорбілакту та L-аргініну активує детоксикаційну функцію нирок (за Стр — на 216 %; Смсм — на 244 %) та зменшує ендогенну інтоксикацію (за КГІІ — на 204 % та Рмсм — на 197 %).
Висновки
Використання сорбілакт-L-аргінінового комплексу — ефективний засіб впливу на перебіг синдрому ендогенної інтоксикації та активність детоксикаційної функції нирок, що сприяє зменшенню токсемії та зростанню активації механізмів елімінації токсинів.
Конфлікт інтересів. Автори заявляють про відсутність будь-якого конфлікту інтересів при підготовці даної статті.
1. The third international consensus definitions for sepsis and septic shock (Sepsis-3) / M. Singer, C.S. Deutschman, C.W. Seymour, M. Shankar-Hari, D. Annane [et al.] // Jama. — 2016. — Vol. 315, № 8. — P. 801-810. — doi: 10.1001/jama.2016.0287.
2. Quick sepsis-related organ failure assessment, systemic inflammatory response syndrome, and early warning scores for detecting clinical deterioration in infected patients outside the intensive care unit / M.M. Churpek, A. Snyder, X. Han, S. Sokol, N. Pettit [et al.] // American journal of respiratory and critical care medicine. — 2017. — Vol. 195, № 7. — P. 906-11. — https://doi.org/10.1164/rccm.201604-0854OC.
3. Sepsis, oxidative stress, and hypoxia: are there clues to better treatment? / D. Bar-Or, M.M. Carrick, C.W. Mains, L.T. Rael, D. Slone [et al.] // Redox Report. — 2015. — Vol. 20, № 5. — P. 193-7. — https://doi.org/10.1179/1351000215Y.0000000005.
4. Хирургический эндотоксикоз как проблема клинической гасроэнтерологии / С.И. Емельянов, Б.С. Брискин, Д.А. Демидов, М.В. Костюченко, Т.И. Демидова [и др.] // Экспериментальная и клиническая гастроэнтерология. — 2010. — № 7. — C. 67-73.
5. Особенности инфузионной детоксикационной терапии у больных с эндотоксикозом / А.В. Стариков, С.В. Бурнаева, О.И. Гаврилюк, О.В. Асса, А.К. Петров [и др.] // Актуальные проблемы транспортной медицины. — 2010. — № 3. — С. 147-149.
6. Галушко О.А. Применение осмотически активных препаратов у больных острым инсультом при сопутствующем сахарном диабете / О.А. Галушко // Здоровье мужчины. — 2017. — № 4(63). — С. 33-37. — doi: https://doi.org/10.30841/зм.v0i4(63).123481.
7. Черний В.И. Инфузионная терапия как ключевой компонент лечения сепсиса / В.И. Черний, С.Е. Куглер // Матеріали ІІІ Міжнародного конгресу з інфузійної терапії, 6–7 жовтня, 2016, Київ. — К., 2016. — С. 82.
8. Черний В.И. Актуальные аспекты инфузионной терапии / В.И. Черний // Медицина неотложных состояний. — 2015. — № 3(66). — C. 43-52.
9. Нужно ли усовершенствовать технологии кровозамещения? / В.П. Шано, И.В. Гуменюк, И.В. Струкова, Е.З. Губиева // Острые и неотложные состояния в практике врача. — 2012. — № 2/3. — С. 25-33.
10. Дацюк О.И. Показатели системной воспалительной реакции у больных с тяжелым острым панкреатитом в ранней стадии в зависимости от компонентов инфузионной терапии / О.И. Дацюк // Медицина неотложных состояний. — 2014. — № 5(60). — C. 103-106.
11. Ералина С.Н. Малообъемная инфузионная терапия при кровотечении в экстренной хирургии у пациентов пожилого и старческого возраста / С.Н. Ералина, Е.Л. Исмаилов, М.М. Сиезбаев // Жизнеобеспечение при критических состояниях. — 2017. — С. 29-30.
12. Бойко В.В. Профилактика послеоперационных парезов кишечника после операций на толстой кишке / В.В. Бойко, И.В. Криворотько, Н.В. Тимченко // Вестник хирургии Казахстана. — 2014. — № 2(38). — С. 6-7.
13. Чепкий Л.П. Роль інфузійної терапії в профілактиці поліорганної недостатності / Л.П. Чепкий, В.І. Чернишов, С.В. Мінов // Біль, знеболення і інтенсивна терапія. — 2012. — № 1(58). — С. 28-35.
14. Влияние аргинина, предуктала и сорбилакта на функцию почек крыс при сулемовой нефропатии / А.И. Гоженко, А.С. Федорук, С.И. Доломатов, И.В. Погорелая // Нефрология. — 2003. — Т. 7, № 1. — С. 98-101. — https://doi.org/10.24884/1561-6274-2003-7-1-98-101.
15. Preventive oral supplementation with glutamine and arginine has beneficial effects on the intestinal mucosa and inflammatory cytokines in endotoxemic rats / X. Zhou, X. Wu, Y. Yin, C. Zhang, L. He // Amino Acids. — 2012. — Vol. 43, № 2. — P. 813-821.
16. Arginine, citrulline and nitric oxide metabolism in sepsis / C.C. Kao, V. Bandi, K.K. Guntupalli [et al.] // Clinical Science. — 2009. — Vol. 117, № 1. — P. 23-30.
17. Пат. 112508 Україна, МПК G01N 33/48. Спосіб оцінки перебігу ендогенної інтоксикації / В.М. Коновчук, А.В. Андрущак, Н.О. Максимчук; власник Вищий державний навчальний заклад України «Буковинський державний медичний університет» МОЗ України. — № u201604697; Заявл. 26.04.2016; Опублік. 26.12.2002, Бюл. № 24. — 2 с.
18. Surviving Sepsis Campaign: International Guidelines for Management of Sepsis and Septic Shock 2016 / A. Rhodes, L.E. Evans, W. Alhazzani [et al.] // Critical Care Medicine. — 2017. — Vol. 45, № 3. — P. 486-52. — Doi: 10.1097/CCM.0000000000002255.
19. Khwaja A. KDIGO clinical practice guidelines for acute kidney injury / A. Khwaja // Nephron. Clinical Practice. — 2012. — Vol. 120, № 4. — P. c179-c184. — https://doi.org/10.1159/000339789.
20. Пузырева И.Н. Экспресс-анализ биологической активности композиции из спиртоводного извлечения расторопши, астрагала и таурина / И.Н. Пузырева, М.А. Огай, А.Ю. Петров // Научные ведомости Белгородского государственного университета. Серия: Медицина. Фармация. — 2016. — Т. 34, № 12(233).
21. Камышников В.С. Справочник по клинико-биохимическим исследованиям и лабораторной диагностике. — 3-е изд. — М.: МЕДпресс-информ. — 2009. — 889 с.

/103-1.jpg)