Журнал «Медицина неотложных состояний» №1(96), 2019
Вернуться к номеру
Улсепан (пантопразол) як ефективний засіб профілактики ерозивно-виразкових уражень гастродуоденальної зони в пацієнтів під час оперативних втручань на органах шлунково-кишкового тракту
Авторы: Усенко О.Ю., Манойло М.В., Бабій І.В.
Національний інститут хірургії та трансплантології імені О.О. Шалімова НАМН України, м. Київ, Україна
Рубрики: Медицина неотложных состояний
Разделы: Клинические исследования
Версия для печати
Мета: дослідження проблеми виникнення ерозивно-виразкових уражень верхніх відділів шлунково-кишкового тракту, вивчення функціональних механізмів захисту слизового бар’єру шлунка й порівняння ефективності медикаментозних засобів, що використовуються для профілактики. Матеріали та методи. У дослідженні проаналізовано досвід лікування 58 хворих, яким було виконано оперативні втручання. Усім хворим проводилась профілактика розвитку ерозивно-виразкових уражень гастродуоденальної зони препаратами групи інгібіторів протонної помпи (інтраопераційно й у ранньому післяопераційному періоді) і порівнювалась їх ефективність. Результати. За даними дослідження, препарат Улсепан (пантопразол) порівняно з омепразолом має більшу ефективність щодо регуляції рН шлунка й запобігання виникненню стресових уражень слизової оболонки верхніх відділів шлунково-кишкового тракту. Висновки. Препарат Улсепан (пантопразол ) є ефективним і безпечним засобом для профілактики ерозивно-виразкових уражень у пацієнтів, які мають фактори ризику, під час оперативних втручань.
Цель: исследование проблемы возникновения эрозивно-язвенных поражений верхних отделов желудочно-кишечного тракта, изучение функциональных механизмов защиты слизистого барьера желудка и сравнение эффективности медикаментозных средств, используемых для профилактики. Материалы и методы. В исследовании проанализирован опыт лечения 58 больных, которым были выполнены оперативные вмешательства. Всем больным проводилась профилактика развития эрозивно-язвенных поражений гастродуоденальной зоны препаратами группы ингибиторов протонной помпы (интраоперационно и в раннем послеоперационном периоде) и сравнивалась их эффективность. Результаты. По данным исследования, препарат Улсепан (пантопразол) по сравнению с омепразолом имеет большую эффективность относительно регуляции рН желудка и предупреждения возникновения стрессовых поражений слизистой оболочки верхних отделов желудочно-кишечного тракта. Выводы. Препарат Улсепан (пантопразол) является эффективным и безопасным средством для профилактики эрозивно-язвенных поражений у пациентов, имеющих факторы риска, во время оперативных вмешательств.
Background. The purpose was to study the problem of erosive and ulcerative lesions of the upper gastrointestinal tract, the functional mechanisms for the protection of gastric mucosal barrier and to compare the effectiveness of the drugs used for prevention. Materials and methods. The study analyzed the experience of treatment of 58 patients who underwent surgical intervention. All patients were prevented from developing erosive and ulcerative lesions of the gastroduodenal zone using proton pomp inhibitors (intraoperatively and in the early postoperative period), their effectiveness was compared. Results. According to the study, Ulsepan (pantoprazole) compared with omeprazole has a greater efficacy in regulating the pH of the stomach and preventing the occurrence of stress lesions of the mucous membrane of the upper gastrointestinal tract. Conclusions. Ulsepan (pantoprazole) is an effective and safe mean for preventing erosive and ulcerative lesions in patients at risk during surgical interventions.
ерозивно-виразкові ураження; стресові виразки; Улсепан; пантопразол
эрозивно-язвенные поражения; стрессовые язвы; Улсепан; пантопразол
erosive and ulcerative lesions; stress ulcers; Ulsepan; pantoprazole
Вступ
Особливістю гострих ерозивно-виразкових уражень верхніх відділів шлунково-кишкового тракту (ШКТ) у ранньому післяопераційному періоді є дифузний характер ураження, різноманітність клінічних проявів і зв’язок зі стресовою ситуацією.
Шлунково-кишкові кровотечі з гострих стресових виразок є одними з найбільш небезпечних ускладнень, становлячи залежно від рівня профілактики, за даними різних авторів, від 1 до 12 % після обширних хірургічних втручань [1, 2].
Досліджено фактори ризику, за наявності яких ймовірність виникнення шлунково-кишкової кровотечі, обумовленої стрес-пошкодженням шлунково-кишкового тракту, істотно підвищується. До таких станів, за даними різних авторів, належать: обширні оперативні втручання, сепсис, велика травма або опік (понад 35 % поверхні тіла), дихальна недостатність (гострий респіраторний дистрес-синдром і необхідність штучної вентиляції легень (ШВЛ) понад 48 годин), коагулопатія, печінково-ниркова недостатність, декомпенсація кислотно-лужного стану крові, відсутність ентерального харчування, нещодавня пептична виразка в анамнезі, застосування нестероїдних протизапальних препаратів (НПЗП) або глюкокортикостероїдів (ГКС), інфекція Helicobacter pylori [3–5].
Встановлено високу значимість віку, алкогольного анамнезу, наявності хронічних хвороб до операції, об’єму інтраопераційної крововтрати, тяжких ускладнень, застосування ГКС у післяопераційному періоді, НПЗП у доопераційному періоді. Автори рекомендують призначати ефективну профілактичну терапію в післяопераційному періоді пацієнтам із високим ризиком розвитку стресової кровотечі [6].
Відомо, що патофізіологічною основою виникнення ерозивно-виразкових уражень гастродуоденальної зони є поєднання порушення захисних механізмів бар’єрної функції слизової оболонки та наявності факторів, що вражають слизову оболонку шлунка. Провідну роль у патогенезі стресових виразок відіграють ішемія слизової оболонки шлунка й дванадцятипалої кишки в умовах порушення мікроциркуляції, нерівномірного розподілу кровотоку за рахунок спланхнічної вазоконстрикції, гіповолемії, плазмовтрати й гіпотонії; дисбаланс ренін-ангіотензин-альдостеронової системи в бік симпатоміметичної стресової активації, збільшення продукції адренокортикотропного гормону, кортикостероїдів, катехоламінів, гістаміну, які чинять негативний вплив на захисний бар’єр слизової оболонки шлунка й дванадцятипалої кишки та підсилюють кислотно-пептичну агресію; порушення гастродуоденальної моторики та евакуації (парез шлунка і кишечника, дуоденогастральний рефлюкс) (Mutlu G.M. et al., 2001) [7] (рис. 1).
У нормі захисна система шлунка включає великий спектр механізмів, що забезпечують цілісність слизової оболонки та її стійкість до факторів агресії. Протективні механізми перебувають у тісній взаємодії й регулюються нервовими і гуморальними механізмами за участю нейропептидів і вазоактивних медіаторів.
Протективний бар’єр шлунка має три лінії захисту [8]. Перша включає слиз, шлункову й дуоденальну секрецію бікарбонатів, гідрофобний шар слизової оболонки шлунка й дванадцятипалої кишки. Слиз являє собою водонерозчинний гель, що складається з глікопротеїдів, які тісно прилягають до поверхні епітеліальних клітин. До складу слизу входять імуноглобуліни (IgA), лізоцим, лактоферин та інші компоненти. Шар слизу захищає слизову оболонку від фізичних і хімічних впливів, соляної кислоти й пепсину, від бактерій, вірусів і їх токсинів. Секреція бікарбонатів зменшує агресивні властивості соляної кислоти й підвищує рівень рН захисного шару.
Другу лінію захисту становить епітеліальний бар’єр. Апікальні поверхні покривного шлункового епітелію й міжклітинні з’єднання надзвичайно стійкі до зворотної дифузії іонів водню (Н+) завдяки наявності на їх базолатеральних поверхнях двох транспортних систем, що видаляють водневі іони з оболонки. Цілісність даного бар’єра регулюється ендогенними факторами росту. До складу даного бар’єра входять тканинні субстанції, що містять сульфгідрильні групи (глутатіон і тіолвмісні протеїни), які є потужними природними антиоксидантами, а також можуть захоплювати вільні радикали водню й кисню, включно з екзогенними, що надходять зі слиною та їжею. Певну роль у підтриманні другої лінії захисту відіграють компоненти вродженого й адаптаційного імунітету (Toll-подібні рецептори, антибактеріальні пептиди, α- і β-дефензин, IgA тощо), які забезпечують стійкість бар’єра щодо проникнення патогенних бактерій, вірусів і їх токсинів.
Третя лінія захисту включає фізіологічну мікроциркуляцію, що сприяє видаленню іонів водню (Н+), забезпечує енергією метаболічні процеси, підтримує першу й другу лінії захисту, а також репаративні процеси в захисному бар’єрі.
Німецькі вчені L. Buendgens та співавт. (2016) запропонували алгоритм оцінки необхідності профілактики стресової виразки у пацієнтів хірургічного профілю, у якому зазначено, що профілактика необхідна всім пацієнтам із факторами ризику (рис. 2).
Основними напрямками профілактики й лікування ерозивно-виразкових уражень гастродуоденальної зони та пов’язаних із ними шлунково-кишкових кровотеч є: корекція гемодинамічних розладів, зниження продукції факторів агресії (соляної кислоти, пепсину), підвищення захисних властивостей слизової оболонки. Надзвичайно важливою складовою є раннє застосування ентерального харчування.
Провідна роль у профілактиці й терапії ерозивно-виразкових уражень гастродуоденальної зони належить лікарським засобам, що знижують продукцію соляної кислоти й активність пепсину. Найбільш ефективний і безпечний кислотодепресивний ефект мають препарати — інгібітори протонної помпи (ІПП), що доведено в результаті порівняння їх з антацидами та Н2-блокаторами [9].
У результаті численних порівняльних рандомізованих досліджень встановлено перевагу ІПП щодо здатності блокувати продукцію соляної кислоти, пришвидшувати рубцювання виразок та ерозій, знижувати частоту хірургічних втручань і рецидивних кровотеч при пептичних виразках, а також підвищувати ефективність еридикаційної терапії за наявності інфекції Helicobacter pylori [10, 11]. До групи ІПП входять: омепразол, езомепразол, пантопразол, лансопразол, рабепразол, які різняться між собою радикалами в піридиновому й бензимідазольному кільцях, а також деякими фармакокінетичними й фармакодинамічними властивостями.
Матеріали та методи
Проаналізовано лікування 58 хворих у період із жовтня 2018 р. по січень 2019 р., які перебували на стаціонарному лікуванні у відділі хірургії шлунково-кишкового тракту ДУ «Національний інститут хірургії та трансплантології ім. О.О. Шалімова» НАМН України. З них чоловіків — 32, жінок — 26. Серед пацієнтів віком до 25 років було 5 хворих, 25–60 років — 36, понад 60 років — 17. Середній вік хворих становив 53 ± 16 років. Маса тіла 86 ± 16 кг. Усім хворим було виконано оперативне втручання на органах черевної порожнини й проводилась профілактика ерозивно-виразкових уражень гастродуоденальної зони у зв’язку з наявністю факторів ризику. 38 (65,5 %) хворих мали 1 фактор ризику (прийом НПЗП), 20 (34,5 %) мали 2 і більше фактори ризику (прийом НПЗП, наявність ерозивної гастродуоденопатії чи виразки в анамнезі, прийом ГКС тощо).
У випадковому порядку сформовано 2 групи пацієнтів по 29 осіб, у кожній групі було по 19 осіб, які мали 1 фактор ризику, і по 10 осіб, які мали 2 і більше фактори ризику.
Для профілактики розвитку ерозивно-виразкових уражень гастродуоденальної зони в пацієнтів І групи використовувався Улсепан (пантопразол, компанія World Medicine) внутрішньовенно по 40 мг кожні 12 годин, у пацієнтів ІІ групи — омепразол внутрішньовенно по 20 мг кожні 12 годин у післяопераційному періоді. Після стабілізації стану й відновлення ентерального харчування профілактика проводилась відповідними препаратами в пероральній формі. Також проводилось парентеральне введення ІПП у пацієнтів І групи — Улсепан (пантопразол) внутрішньовенно по 40 мг, у пацієнтів ІІ групи — омепразол внутрішньовенно по 20 мг під час анестезії, у тому числі з метою профілактики кислотоаспіраційного синдрому [12].
Критерії виключення з дослідження: прийом протягом останніх 4 тижнів до початку обстеження антибіотиків, препаратів вісмуту, інгібіторів протонної помпи, блокаторів Н2-гістамінових рецепторів, наявність запальних або ерозивно-виразкових змін слизової оболонки шлунка чи дванадцятипалої кишки.
Усім хворим проводилось комплексне обстеження, що включало збір анамнезу, фізикальне обстеження, лабораторну діагностику, а також інструментальну діагностику відповідно до хірургічної патології. Усім хворим у передопераційному періоді проведено фіброезофагогастродуоденоскопію (ФЕГДС), за результатами якої запальних або ерозивно-виразкових змін слизової оболонки шлунка чи дванадцятипалої кишки не виявлено.
Для оцінки ефективності профілактики ерозивно-виразкових ускладнень гастродуоденальної зони в ранньому післяопераційному періоді в усіх хворих проводилась оцінка загального стану, наявності скарг (відчуття дискомфорту в епігастрії, наявність печії), оцінка лабораторних показників крові. Хворим, які мали 2 і більше фактори ризику в анамнезі, у І та ІІ групі проводились ФЕГДС і добовий рH-моніторинг на 5–6-ту добу після операції.
Результати
Середня тривалість перебування в стаціонарі становила 8 діб.
Летальних випадків не було. Ускладнення зі сторони операційної рани (післяопераційна серома) відмічено у 2 (3,4 %) хворих, гематома післяопераційної рани — в 1 (1,7 %) хворого. Ускладнення були ліквідовані консервативно.
Ознак гострих ерозивно-виразкових уражень гастродуоденальної зони та шлунково-кишкової кровотечі в ранньому післяопераційному періоді не спостерігалось.
Тривалість спостереження за рН становила 22,0 ± 1,5 год у 20 пацієнтів. За результатами добового рH-моніторингу на 5–6-ту післяопераційну добу пацієнтів І і ІІ групи, які мали понад 2 фактори ризику, виявлено більшу ефективність кислоторегуляції в І групі. Середнє значення рН у І групі становило 6,5 ± 1,2, у ІІ групі — 5,9 ± 1,6 (табл. 1, рис. 3).
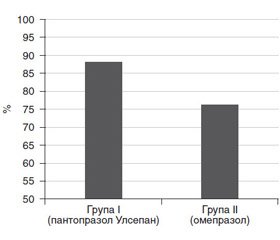
При 24-годинному моніторуванні рН одним із показників ефективності антисекреторної терапії є загальний час, при якому рН > 4,0. У І групі він становив 88 % від часу спостереження, в ІІ групі — 76 % від часу спостереження (табл. 1, рис. 4).
Потребує подальшого вивчення показник варіабельності значень рН, а також взаємозв’язку клінічного стану хворого, частоти розвитку шлунково-кишкових кровотеч і загального часу, протягом якого рН всередині шлунка < 4,0. У дослідженнях in vitro показано, що утворення кров’яного згустку відбувається ефективніше, а його розчинення протеолітичними ферментами сповільнюється за умови високих значень рН [13, 14]. Пепсин розчиняє тромби, що знаходяться на поверхні кратера виразки, і його активність є рН-залежною [15]. Крім того, in vitro функція тромбоцитів суттєво порушується при знижені рівня рН [16].
При плановій ФЕГДС у пацієнтів І групи патології не виявлено, в 1 (10 %) пацієнта ІІ групи виявлено ерозивну гастродуоденопатію. Це доводить кращу клінічну ефективність препарату Улсепан (пантопразол).
Обговорення
Улсепан (пантопразол) на відміну від омепразолу не акумулюється в організмі після прийому повторних доз. Так, після внутрішньовенного введення Улсепану в дозі 40 мг/добу протягом 5 днів виявилося, що показники фармакокінетики відповідають таким, що отримані після його однократного внутрішньовенного введення. При цьому встановлено, що площа під кривою «концентрація — час» (Area under Curve — AUC) становила 535 мг/год/л, максимальна концентрація в плазмі крові (Cmax) — 526 мг/л, період напіввиведення (t1/2) — 111 годин. При фармакокінетичних дослідженнях пантопразолу при пероральному прийомі в дозах від 10 до 80 мг і внутрішньовенному введенні в дозі 240 мг його концентрація в сироватці/плазмі крові мала лінійний характер. Ці властивості істотно відрізняють Улсепан від омепразолу, при підвищенні дози якого в тому ж діапазоні площа під кривою AUC змінюється непропорційно, t1/2 збільшується вже після однократного внутрішньовенного введення [17–19].
Важливою характеристикою препарату Улсепан, що робить його лікарським засобом вибору в терапії ерозивно-виразкових уражень верхніх відділів шлунково-кишкового тракту, є відсутність необхідності корекції дози у хворих похилого віку, а також при наявності в пацієнтів ниркової й печінкової недостатності [20].
Відмінності фармакокінетики різних ІПП обумовлені особливостями їх взаємодії із системою цитохрому Р450.
При виборі ІПП у клінічному аспекті, крім кислотодепресивного ефекту, важливими є такі властивості препаратів: низький рівень взаємодії з іншими лікарськими засобами, відсутність кумулятивного ефекту при тривалому застосуванні, а також наявність лікарських форм для парентерального введення й ентерального застосування, необхідних для профілактики й терапії ерозивно-виразкових уражень гастродуоденальної зони й шлунково-кишкових кровотеч. Пантопразол (Улсепан) відзначається значно меншим рівнем лікарської взаємодії порівняно з іншими ІПП. Так, у ряді клінічних досліджень показано, що пантопразол не взаємодіє з антацидними засобами, антипірином, кофеїном, оральними контрацептивами, етанолом, глібенкламідом, метопрололом, амоксициліном, кларитроміцином, диклофенаком, напроксеном, карбамазепіном, дигоксином, ніфедипіном, варфарином тощо, що дозволяє використовувати його в комплексному лікуванні й профілактиці ерозивно-виразкових уражень у періопераційному й післяопераційному періоді [20].
У зв’язку з різними фармакокінетичними й фармакодинамічними особливостями ІПП (наприклад, максимальний кислотодепресивний ефект досягається при використанні Улсепану після першої дози, а омепразолу — на 7-му добу) необхідно пролонгувати пероральну терапію препаратом Улсепан. Тривалість лікування і добова доза ІПП визначаються індивідуально залежно від клінічної картини захворювання та стану слизової оболонки шлунка. У середньому для рубцювання стресових ерозивно-виразкових уражень потрібен 4-тижневий курс терапії ІПП.
За результатами дослідження пантопразол показав кращі результати в профілактиці стресових ерозивно-виразкових уражень верхніх відділів ШКТ.
Таким чином, препарат Улсепан (ІПП пантопразол) має низку переваг порівняно з іншими ІПП, а саме:
— це єдиний ІПП, який зв’язується з цистеїном 822 протонної помпи і внаслідок цього має найбільш довготривале й стійке інгібування секреції соляної кислоти;
— має найбільшу рН-селективність серед ІПП, що забезпечує добру переносимість і найменшу кількість побічних ефектів;
— низька взаємодія з цитохромом Р450 і відсутність клінічно значущої взаємодії лікарських засобів, що дає безпечну та гарантовану терапію;
— має постійну лінійну передбачувану фармакокінетику. При подвоєнні дози ІПП, що мають нелінійну фармакокінетику, їх концентрація в сироватці крові буде або нижчою, або вищою за очікувану, вона непередбачувана. Це може вплинути на безпеку використання препарату;
— відсутність необхідності корекції дози у пацієнтів похилого віку, а також при наявності у пацієнтів ниркової та печінкової недостатності;
— ефективність препарату не залежить від прийому їжі.
Висновки
За наявності у хворого факторів ризику розвитку стресових ерозивно-виразкових уражень верхніх відділів шлунково-кишкового тракту провідне місце у профілактиці таких станів займає група інгібіторів протонної помпи. Пантопразол — представник групи інгібіторів протонної помпи з доведеною ефективністю та перевагами порівняно з іншими препаратами цієї групи. Не має значущої взаємодії з лікарськими засобами, що дозволяє застосовувати його комбінації з препаратами, які використовуються в лікуванні пацієнтів хірургічного профілю.
Застосування препарату Улсепан (пантопразол) було ефективним у профілактиці ерозивно-виразкових ускладнень гастродуоденальної зони в ранньому післяопераційному періоді.
Конфлікт інтересів. Не заявлений.
1. Constantin V.D., Paun S., Ciofoaia W., Budu V., Socea B. Multimodal management of upper gastrointestinal bleeding caused by stress gastropathy // J. Gastrointestin. Lіver Dis. — 2009 Sep. — 18(3). — 279-84.
2. Гельфанд А.Н., Мартынов В.А., Гурьянов В.А., Шипилова О.С. Профилактика стресс-повреждений желудочно-кишечного тракта у больных в критических состояниях // Consilium Medicum. — 2005. — № 6. — 16-20.
3. Cook D., Guyatt G. Prophylaxis against Upper Gastrointestinal Bleeding in Hospitalized Patients // N. Engl. J. Med. — 2018 Jun 28. — 378(26). — 2506-2516. doi: 10.1056/NEJMra1605507.
4. Fiddian-Green R.G., McGough E., Pittenger G., Rothman E. Predictive value of intramural pH and other risk factors for massive bleeding from stress ulceration // Gastroenterology. — 1983. — 85(3). — 613-620.
5. Knight A., Bihari D., Tinker J. Stress ulceration in the critically ill patient // Br. J. Hosp. Med. — 1985. — 33(4). — 216-219.
6. Chen C., Shi Y., Zhang X.P., Zhang P.D. Risk factors associated with stress ulcer bleeding in postoperative rectal cancer patients // Chin. J. Gastrointest. Surg. — 2012. — 12. — 1277-1281.
7. Mutlu G.M., Mutlu E.A., Factor P. GI complications in patients receiving mechanical ventilation // Chest. — 2001. — 119. — 1222-1241.
8. Powell D.W. Barrier function of epithelia // American Journal of Physiology. — 1981. Осt. DOI: 10.1152/ajpgi.1981.241.4.G275.
9. Ritchie W.P. Prostaglandins: A surgeon’s perspective // Dig. Dis. Sci. — 1986. — 31. — S. 32-4.
10. Wedemeyer R.S., Blume H. Pharmacokinetic drug interaction profiles of proton pump inhibitors: an update // Drug Saf. — 2014 Apr. — 37(4). — 201-11. doi: 10.1007/s40264-014-0144-0.
11. Захарова Н.В. Ингибиторы протонной помпы с позиции эффективности и безопасности // Врач. — 2013. — T. 10. — С. 10-13.
12. Bliesath H., Huber R., Hartmann M., Lühmann R., Wurst W. Dose linearity of the pharmacokinetics of the new H+/K(+)-ATPase inhibitor pantoprazole after single intravenous administration // Int. J. Clin. Pharmacol. Ther. — 1996 May. — 34 (Suppl. 1). — S18-24.
13. Dammann H.G., Burkhardt F. Pantoprazole versus omeprazole: influence on meal-stimulated gastric acid secretion // Eur. J. Gastroenterol. Hepatol. — 1999. — 11(11). — 1277-82.
14. Geus W.P., Mathot R.A., Mulder P.G. Pharmacodynamics and kinetics of omeprazole MUPS 20 mg and pantoprazole 40 mg during repeated oral administration in Helicobacter pylori-negative subjects // Aliment. Pharmacol. Ther. — 2000. — 14(8). — 1057-64.
15. Allen M.E., Kopp B.J., Erstad B.L. Stress ulcer prophylaxis in the postoperative period // Am. J. Health-System Pharm. — 2004 March. — 6. — 588-596.
16. Hartmann M., Ehrlich A., Fuder H., Lühmann R., Emeklibas S., Timmer W., Wurst W., Lücker P.W. Equipotent inhibition of gastric acid secretion by equal doses of oral or intravenous pantoprazole // Aliment. Pharmacol. Ther. — 1998. — 12(10). — 1027-32.
17. Morris J., Karlstadt R., Blatcher D. et al. Intermittent intravenous pantoprazole rapidly achieves and maintains gastric pH > 40 compared with continuous infusion H2-receptor antagonist in intensive care unit patients // Crit. Care Med. — 2001. — 29. — A147.
18. Huber R., Hartmann M., Bliesath H. et al. Pharmacokinetics of pantoprazole in man // Int. J. Clin. Pharmacol. Ther. — 1996. — 34(5). — 185-94.
19. Andersson T., Cederberg C., Heggelund A. The pharmacokinetics of single and repeated once daily dose of 10, 20 and 40 mg omeprazole as enteric coated granules // Drug Invest. — 1991. — 3. — 45-52.
20. Leontiadis G.I., Sharma V.K., Howden C.W. Proton pump inhibitor treatment for acute peptic ulcer bleeding // Cochrane Database Syst. Rev. — 2010 May 12. — 5. — CD002094. doi: 10.1002/14651858.CD002094.pub4.
21. Brzozowski T., Magierowska K., Magierowski M., Ptak-Belowska A., Pajdo R., Kwiecien S., Olszanecki R., Korbut R. Recent Advances in the Gastric Mucosal Protection Against Stress-induced Gastric Lesions. Importance of Renin-angiotensin Vasoactive Metabolites, Gaseous Mediators and Appetite Peptides // Curr. Pharm. Des. — 2017. — 23(27). — 3910-3922. doi: 10.2174/1381612823666170220160222.
22. Whittle B.J.R., Gustavsson S., Kumar D., Graham D.Y. Protective mechanisms of the gastric mucosa. — Edinburgh, London, Madrid: Churchill Livingstone, 1992. — 81-101.
23. Яковенко Е.П., Яковенко А.В. Виразки, патогенетичні підходи до терапії // Фараматека. — 2008. — № 6. — S. 62-67.
24. Buendgens L., Koch A., Tacke F. Prevention of stress-related ulcer bleeding at the intensive care unit: Risks and benefits of stress ulcer prophylaxis // World J. Crit. Care Med. — 2016 Feb 4. — 5(1). — 57-64. doi: 10.5492/wjccm.v5.i1.57

/78-1.jpg)
/79-1.jpg)
/80-1.jpg)