Резюме
Актуальність. У теперішній час у світі понад 90 % всіх гінекологічних операцій виконується лапароскопічно. Все частіше такі операції проводяться в умовах реґіонарної анестезії. Мета. Порівняння перебігу післяопераційного періоду у пацієнток, які зазнали лапароскопічних гінекологічних втручань в умовах загальної або реґіонарної анестезії. Матеріали та методи. У проспективне когортне дослідження було включено 208 пацієнток, яким виконувались лапароскопічні консервативна міомектомія та екстирпація матки з придатками у відділенні оперативної гінекології з малоінвазивними технологіями Харківського регіонального перинатального центру Комунального закладу охорони здоров’я «Обласна клінічна лікарня — Центр екстреної медичної допомоги та медицини катастроф» у 2016–2018 роках. Середній вік пацієнток становив 44,78 ± 8,01 року. Пацієнтки були розподілені на дві групи: у першій використовували загальну анестезію (ЗА) зі штучною вентиляцією легень (група ЗА) (n = 103), у другій комбіновану реґіонарну анестезію (група РА) (n = 105). Результати. Впродовж усього післяопераційного періоду оцінка болю за візуальною аналоговою шкалою (ВАШ) була вірогідно нижчою серед пацієнтів групи РА. Найбільша різниця між показниками в обох групах спостерігалась через 3, 6 та 12 годин після операції (бали за ВАШ у групі ЗА були більше, ніж у групі РА, у 6,4 раза). Частота виникнення післяопераційної нудоти та блювання була вірогідно вищою у групі ЗА — 20,4 % порівняно з 5,7 % у групі РА. Активізація пацієнток групи РА починалась через 5 годин, у групі ЗА — через 16–18 годин. Рівень задоволеності пацієнток лікуванням за шкалою Лайкерта (1–5 балів) оцінювався через 3 місяці після операції: у групі РА (4,67 ± 0,41 бала) показано значно більшу задоволеність лікуванням, ніж у групі ЗА (4,15 ± 0,73 бала). Висновки. Комбінована реґіонарна анестезія — ефективний метод знеболювання лапароскопічних гінекологічних операцій. Саме така багатокомпонентна методика, за результатами нашого дослідження, є більш ефективною, безпечною, комфортнішою для пацієнтів.
Актуальность. В настоящее время в мире более 90 % всех гинекологических операций выполняется лапароскопически. Все чаще такие операции проходят в условиях регионарной анестезии. Цель. Сравнение течения послеоперационного периода у пациенток, подвергшихся лапароскопическим гинекологическим вмешательствам в условиях общей или регионарной анестезии. Материалы и методы. В проспективное когортное исследование были включены 208 пациенток, которым проводились лапараскопические консервативная миомэктомия и экстирпация матки с придатками в отделении оперативной гинекологии с малоинвазивными технологиями Харьковского регионального перинатального центра Коммунального предприятия здравоохранения «Областная клиническая больница — Центр экстренной медицинской помощи и медицины катастроф» в 2016–2018 годах. Средний возраст пациенток составил 44,78 ± 8,01 года. Пациентки были раcпределены на две группы: в первой использовали общую анестезию (ОА) с искусственной вентиляцией легких (группа ОА) (n = 103), во второй комбинированную регионарную анестезию (группа РА) (n = 105). Результаты. В течение всего послеоперационного периода оценка боли по визуальной аналоговой шкале (ВАШ) была достоверно ниже среди пациентов группы РА. Наибольшая разница между показателями обеих групп наблюдалась через 3, 6 и 12 часов после операции (баллы по ВАШ в группе ОА были больше, чем в группе РА, в 6,4 раза). Частота возникновения послеоперационной тошноты и рвоты была достоверно выше в группе ОА — 20,4 % по сравнению с 5,7 % в группе РА. Активизация пациенток группы РА начиналась через 5 часов, в группе ОА — через 16–18 часов. Уровень удовлетворенности пациенток лечением по шкале Лайкерта (1–5 баллов) оценивался через 3 месяца после операции; пациентки в группе РА (4,67 ± 0,41 балла) выразили значительно большую удовлетворенность лечением, чем пациентки группы ОА (4,15 ± 0, 73 балла). Выводы. Комбинированная регионарная анестезия — эффективный метод обезболивания лапароскопических гинекологических операций. Именно такая многокомпонентная методика, по результатам нашего исследования, является более эффективной, безопасной, комфортной для пациентов.
Background. Currently, more than 90 % of all gynecologic surgeries in the world are performed laparoscopically. The advantages of this type of surgery are less trauma, cosmetic effect, the possibility of early activation of patients and reduced hospital stay. Increasingly, such operations are performed under regional anesthesia. The purpose was to compare the postoperative period in patients undergoing laparoscopic gynecologic interventions under general (GA) or regional anesthesia (RA). Materials and methods. A prospective cohort study included 208 patients who underwent laparoscopic conservative myomectomy and removal of the uterus with appendages in the department of operative gynecology with minimally invasive technologies of the Kharkiv Regional Perinatal Center of “Regional Clinical Hospital — Center for Emergency Medical Care and Disaster Medicine” in 2016–2018. The average age of patients was 44.78 ± 8.01 years. Patients were divided into 2 groups: in the first one (n = 103), GA with mechanical ventilation was used, in the second one (n = 105) — combined RA. The clinical status of patients was evaluated based on the results of non-invasive monitoring. The assessment of the pain syndrome was carried out using a visual analog scale (VAS). Various side effects such as nausea and vomiting, shoulder pain, postoperative shivering, headache as well as frequency and type of anesthesia have been analyzed by patients’ surveys. Results. Throughout all postoperative period, pain according to VAS was significantly lower among patients in the RA group. The biggest difference between both groups was observed 3, 6 and 12 hours after surgery (VAS scores in the GA group were 6.4 times higher than those in the RA group). The pain in the shoulders, which often accompanies the early postoperative period of surgeries performed using pneumoperitoneum, was found in 14.6 % of patients from the GA group and in 3.8 % — from the RA group that is significantly lower. The incidence of postoperative nausea and vomiting was significantly higher in the GA group — 20.4 % compared to 5.7 % in the RA group. When comparing methods of analgesia in the postoperative period, it was found that patients in the GA group received narcotic analgesics in average twice, while patients in the RA group received non-steroidal anti-inflammatory drugs 1–2 times per day. Activation of patients in the RA group began after 5 hours, in the group of GA — after 16–18 hours. Already in the first postoperative day, patients of the RA group had active peristalsis and passage of flatus; among GA patients, restoration of bowel activity occurred 2–3 days after surgery. The results of patient satisfaction with treatment on Likert scale (1–5 points) were evaluated 3 months after surgery in terms of recovery, pain severity and return to normal activity. One hundred patients in the GA group and 99 patients of the RA group took part in a telephone survey. The majority of patients in the RA group expressed significantly greater satisfaction with the treatment (4.67 ± 0.41 points) than patients in the GA group (4.15 ± 0.73 points). Conclusions. Combined regional anesthesia is an effective method of pain relief in laparoscopic gynecologic surgeries. Regional anesthesia provides adequate muscle relaxation and appropriate working environment for operators, without compromising general anesthesia and avoiding its unwanted risks. It is this multicomponent technique, according to our research, that it is more effective, safe, more comfortable for patients. We also found that patients operated under RA were generally more satisfied with treatment.
Вступ
Лапароскопічні операції давно стали мейнстримом у сучасному гінекологічному товаристві. Їх переваги безперечні: менші травматизація та больовий синдром після втручання, істотно кращій косметичний ефект, рання активізація пацієнтів та скорочення часу перебування у лікарні [1–4]. Довгий час лапароскопічні втручання виконувались лише в умовах загального знеболювання, проте достатня аналгезія і міорелаксація, менша вартість та простота виконання, відсутність потреби у медикаментозному сні і штучній вентиляції легень, стимулювання перистальтики кишечника при використанні реґіонарної анестезії привертають все більше уваги до цього методу знеболювання [2, 4, 5].
Мета роботи: порівняти перебіг післяопераційного періоду у пацієнток, які зазнали лапароскопічних гінекологічних втручань в умовах загальної або реґіонарної анестезії.
Матеріали та методи
До проспективного когортного дослідження було залучено 208 пацієнток, яким виконувались лапароскопічні консервативна міомектомія та екстирпація матки з придатками у відділенні оперативної гінекології з малоінвазивними технологіями Харківського регіонального перинатального центру Комунального закладу охорони здоров’я «Обласна клінічна лікарня — Центр екстреної медичної допомоги та медицини катастроф» у 2016–2018 роках. Середній вік пацієнток становив 44,78 ± 8,01 року, маса тіла — 79,6 ± 7,5 кг, індекс маси тіла — 28,3 ± 0,9 кг/м2, фізичний статус — I–II клас за АSA. Добровільна інформована згода на участь у дослідженні була отримана в усіх пацієнток. Пацієнтки були розподілені на дві групи: у першій використовували загальну анестезію (ЗА) зі штучною вентиляцією легень (група ЗА) (n = 103), у другій комбіновану реґіонарну анестезію (група РА) (n = 105). Клінічний стан хворих оцінювався за результатами неінвазивного моніторингу (неінвазивне вимірювання артеріального тиску, частота серцевих скорочень, електрокардіограма, пульсоксиметрія) за допомогою мультифункціонального пристрою «Монітор паціента Mediana Lucon M30» (Mediana, Корея). Інтраопераційна інфузія становила 10–15 мл/кг/год розчину Рінгера протягом операції.
Методика (ЗА) зі штучною вентиляцією легень. Пацієнтам групи ЗА проведена премедикація сибазоном у середній дозі 0,15 ± 0,01 мг/кг, атропіном — 0,008 ± 0,001 мг/кг, фентанілом — 0,001 ± 0,0002 мкг/кг. Індукція анестезії здійснювалась пропофолом у дозі 2,3 ± 0,2 мг/кг, після інтубації трахеї підтримка анестезії продовжувалась севофлюраном у концентрації 1,5–4,0 об% на апараті Leon із потоком газової суміші не більше 1,5 л/хв. Аналгезія забезпечувалась введенням фентанілу 0,01 мг/кг/год, міоплегія — тракріумом у дозі 0,1–0,2 мг/кг. Екстубація трахеї виконувалась в умовах операційної, хворі переводились до відділення оперативної гінекології з малоінвазивними технологіями.
Методика комбінованої реґіонарної анестезії. Субарахноїдальну анестезію проводили в положенні хворої на боці з опущенням лінії хребта в краніальному напрямку на 5°, парамедіанним доступом на рівні L2–3–4, голкою G26 і вводили 16–20 мг 0,5% гіпербаричного розчину бупівакаїну. При повертанні хворої на спину під коліна підкладали валик (для вирівнювання поперекового лордозу), нахил столу контролювали електронним кутоміром у межах 0–2,5°, до відчуття потепління в мізинцях кистей рук (Т2–3). Справа на шиї проводили блокаду діафрагмового нерва, що знаходиться в фасціальному ложі між ключичною ніжкою грудино-ключично-соскоподібного м’яза шиї і передньою порцією переднього драбинчастого м’яза. Ін’єкцію виконували зігнутою під кутом 45° внутрішньом’язовою голкою перпендикулярно до шкіри до відчуття провалу з наступним паралельним м’язу просуванням голки по фасціальному простору. Вводили 10 мл 0,8% лідокаїну. Здійснювали музичний супровід за допомогою навушників із релаксуючою музикою, який продовжували протягом усієї операції. За допомогою багатофункціо–нального фізіотерапевтичного нейростимулятора Mini Massager проводили поверхневу черезшкірну, комфортну для хворого, нейростимуляцію (в режимі гальмування) точок виходу меридіану легень (1 — чжун-фу, 2 — юнь-мень), які знаходяться максимально близько до проходження плечового сплетення у підключичній ямці. Гальмування функції меридіану легень усуває біль у ділянці грудей, підребір’ї, в ділянці спини і плечового суглоба, яка виникає внаслідок синдрому грудного вихідного отвору. Кардіологічні електроди-липучки накладаються із захопленням зони обох точок рефлексотерапії, і нейростимуляція підключається до початку оперативного втручання. Після ліквідації пневмоперитонеуму стимуляція відключається. Перед створенням пневмоперитонеуму внутрішньовенно хворим одноразово вводили кетамін у субнаркотичному дозуванні 0,1–0,2 мг/кг та пропофол у кількості 0,5–0,8 мг/кг з метою аналгезії та поверхневої седації до моменту анестезії діафрагми [6, 7]. Одразу після введення лапароскопічних інструментів під контролем камери довгим розпилювачем на поверхню діафрагми методом зрошення проводили аплікацію 20 мл 3% лідокаїну. Під візуальним контролем затискачем піднімали очеревину на мисі крижової кістки (L5–S1) і спеціальною голкою з обмежувачем глибини проникнення вводили 40 мл 0,25% бупівакаїну + дексаметазон 4 мг. Місце введення коагулювали електрокоагулятором. Проводили легкий масаж інструментом для рівномірного поширення анестетика. Після операції здійснили місцеву анестезію підшкірною інфільтрацією місць входу 5 портів 20 мл 0,25% бупівакаїну + декскетопрофен 50 мг [8]. Під час операції хворі були притомними. Зберігалось спонтанне дихання повітрям, що збагачено киснем із потоком 3–4 л/хв, дані пульсоксиметрії (SpO2) були в межах фізіологічної норми. Гемодинаміка підтримувалась введенням низьких доз адреналіну за допомогою шприц-насосу й була стабільною. Після операції хворих переводили до профільного відділення зі збереженою аналгезією і залишковим моторним блоком. Під час транспортування та подальшого лікування пацієнти були притомні, вітальні функції клінічно компенсованими. Пиття рідини призначалося через 2 години після операції, а ентеральне харчування — через 4 години. Активізація пацієнтів: ходіння по палаті через 5 годин. Знеболювання після операції здійснювалось введенням нестероїдних протизапальних засобів 1–2 рази на добу за потребою пацієнток (за результатами візуальної аналогової шкали (ВАШ) > 3 балів), без застосування опіоїдів.
Оцінку больового синдрому проводили за допомогою ВАШ через 3, 6, 12, 24, 48 годин після операції. При використанні ВАШ пацієнткам пропонували висловити суб’єктивне відчуття болю. Шкала проградуйована від 0 до 10, де 0 — відсутність болю, 10 — максимально сильний біль, який коли-небудь відчував пацієнт. Різноманітні побічні ефекти, такі як частота нудоти та блювання, біль у плечах, післяопераційний озноб, постпункційний головний біль, а також частота і характер знеболювання були проаналізовані шляхом опитування пацієнтів.
Статистична обробка отриманих даних. На початку статистичного аналізу перевіряли відповідність ряду даних вибірки нормальному закону розподілу за допомогою критерію Шапіро — Уїлка. Для порівняння застосовувався параметричний t-критерій Стьюдента або непараметричний критерій Манна — Уїтні. Порівняльне оцінювання якісних ознак проводилось за допомогою точного критерію χ2 із включенням критерію Мак-Немара. Розрахунки здійснювались на персональному комп’ютері за допомогою пакета програм Microsoft Office та Statistica 6.0. Відмінності вважали вірогідними при р < 0,05.
Результати та обговорення
Пацієнтки обох груп були статистично однорідними за антропологічними характеристиками, ступенем анестезіологічного ризику, характером і тривалістю оперативного втручання. У післяопераційному періоді для контролю больового синдрому всі хворі отримували внутрішньовенно парацетамол 1 г через 6 годин після операції, потім кожні 8 годин протягом доби, за потребою пацієнток: якщо результат ВАШ > 3 балів, внутрішньом’язово вводили 50 мг декскетопрофену 1–2 рази на день, а при показнику ВАШ > 5 балів — внутрішньом’язово 10 мг промедолу.
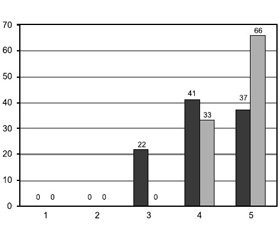
Протягом усього післяопераційного періоду оцінка болю за ВАШ була вірогідно нижчою серед пацієнтів групи РА. Найбільша різниця між показниками обох груп спостерігалась через 3, 6 та 12 годин після операції (бали за ВАШ у групі ЗА були більше за такі результати в групі РА у 6,4 раза). Детальні дані відображено на рис. 1.
/91-1.jpg)
Біль у плечах, який часто супроводжує ранній післяопераційний період операцій, що виконуються в умовах пневмоперитонеуму, було виявлено у 14,6 % пацієнтів групи ЗА та у 3,8 % пацієнтів групи РА, що вірогідно нижче. Частота виникнення післяопераційної нудоти та блювання була вірогідно вищою у групі ЗА — 20,4 % порівняно з 5,7 % у групі РА. Післяопераційний озноб розвинувся з однаковою частотою в обох групах. Профілактика цього ускладнення проводилась шляхом підігрівання розчинів, які вводились пацієнткам. Постпункційний головний біль виник у 1 (0,95 %) пацієнтки. Такий низький відсоток цього ускладнення пояснюється застосуванням спінальних голок G26 та парамедіанним доступом.
При порівнянні методів знеболювання у після–операційному періоді було встановлено, що пацієнтки групи ЗА отримували наркотичні анальгетики в середньому двічі, в той час як пацієнтки групи РА для знеболювання отримували нестероїдні протизапальні засоби 1–2 рази на добу.
Активізація пацієнток групи РА починалась через 5 годин, у групі ЗА — через 16–18 годин.
Вже у першу післяопераційну добу в пацієнтів групи РА вислуховувалась активна перистальтика та відходили гази, серед пацієнтів із ЗА відновлення роботи кишечника відбувалось на 2-гу — 3-тю добу після операції.
Рівень задоволеності пацієнток лікуванням за шкалою Лайкерта (1–5) оцінювався через 3 місяці після операції в аспекті відновлення, інтенсивності болю та повернення до нормальної активності. В телефонному опитуванні взяли участь 100 пацієнток групи ЗА та 99 пацієнток групи РА. Більшість хворих у групі РА (4,67 ± 0,41) показали значно більшу задоволеність лікуванням, ніж пацієнтки групи ЗА (4,15 ± 0,73). Рівень задоволеності всіх хворих наведено на рис. 2.
Висновки
Комбінована реґіонарна анестезія (субарахноїдальна анестезія, блокада діафрагмального нерва, ней–ростимуляція (в режимі гальмування) точок виходу меридіану легень, поверхнева седація до зрошення діафрагми анестетиком, аплікаційна анестезія лідокаїном, блокада plexus hypogastricus superior, місцева інфільтраційна анестезія місць входу портів) є ефективним методом знеболювання лапароскопічних гінекологічних операцій. Реґіонарна анестезія забезпечує адекватне розслаблення м’язів і відповідне робоче середовище для операторів, не поступаючись загальній анестезії, та дозволяє уникнути її небажаних ризиків. Саме така багатокомпонентна методика, за результатами нашого дослідження, є більш ефективною, безпечною, комфортнішою для пацієнтів. Також ми виявили, що пацієнти, оперовані в умовах РА, були в цілому більш задоволені лікуванням.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів при підготовці даної статті.
Список литературы
1. Yildirim D., Hut A., Uzman S. et al. Spinal anesthesia is safe in laparoscopic total extraperitoneal inguinal hernia repair. A retrospective clinical trial // Videosurgery and Other Miniinvasive Techniques. 2017; 12(4): 417-427. doi: 10.5114/wiitm.2017.72325.
2. Nikodemski T., Biskup A., Taszarek A. et al. Implementation of an enhanced recovery after surgery (ERAS) protocol in a gynaecology department — the follow-up at 1 year // Contemporary Oncology. 2017; 21(3): 240-243. doi: 10.5114/wo.2017.69589.
3. Asgari, Zahra et al. Spinal Anesthesia and Spinal Anesthesia with Subdiaphragmatic Lidocaine in Shoulder Pain Reduction for Gynecological Laparoscopic Surgery: A Randomized Clinical Trial // Pain Research & Management. 2017; 1721460. PMC. Web. 27 Jan. 2018.
4. Mohamed K.S., Abd-Elshafy S.K., El Saman A.M. The impact of magnesium sulfate as adjuvant to intrathecal bupivacaine on intra-operative surgeon satisfaction and postoperative analgesia during laparoscopic gynecological surgery: randomized clinical study // The Korean Journal of Pain. 2017; 30(3): 207-213. doi: 10.3344/kjp.2017.30.3.207.
5. Bajwa S.J.S., Kulshrestha A. Anaesthesia for laparoscopic surgery: General vs regional anaesthesia // Journal of Minimal Access Surgery. 2016; 12(1): 4-9. doi: 10.4103/0972-9941.169952.
6. Hadi B.A. A randomized, controlled trial of a clinical pharmacist intervention in microdiscectomy surgery — low dose intravenous ketamine as an adjunct to standard therapy / B.A. Hadi, R. Daas, R. Zelkó // Saudi Pharmaceutical Journal. 2013; 21(2): 169-175.
7. Thomas M., Tennant I., Augier R. et al. The role of pre-induction ketamine in the management of postoperative pain in patients undergoing elective gynaecological surgery at the University Hospital of the West Indies / M. Thomas, I. Tennant, R. Augier et al. // The West Indian Medical Journal. 2012; 61(3): 224-229.
8. Пат. 113158 Україна, МПК A61M 19/00, A61M 21/00 (2016.01). Спосіб комбінованої реґіонарної анестезії лапаро–скопічних гінекологічних операцій / Чаплинський Р.П., Фесенко В.С., Сафонов Р.А — З. № u2016 08379; заявл. 29.07.2016; опубл. 10.01.2017.

/91-1.jpg)
/91-2.jpg)
/92-1.jpg)