Журнал «Медицина неотложных состояний» №6(93), 2018
Вернуться к номеру
Вплив нейрометаболічної терапії на рівень нейронспецифічної енолази та когнітивний статус у хворих у гострому періоді ішемічного інсульту
Авторы: Кущ К.О., Клигуненко О.М.
ДЗ «Дніпропетровська медична академія МОЗ України», м. Дніпро, Україна
Рубрики: Медицина неотложных состояний
Разделы: Клинические исследования
Версия для печати
Досліджено ефективність нейрометаболічної терапії у хворих із гострим порушенням мозкового кровообігу за ішемічним типом шляхом визначення рівня нейронспецифічної енолази та динаміки когнітивного статусу. Доведено, що застосування комбінації препаратів, які впливають на холінергічну систему, прискорює відновлення свідомості, зменшує неврологічний дефіцит та зберігає когнітивний статус.
Исследована эффективность нейрометаболической терапии у больных с острым нарушением мозгового кровообращения по ишемическому типу путем определения уровня нейронспецифической энолазы и динамики когнитивного статуса. Доказано, что применение комбинации препаратов, которые влияют на холинергическую систему, ускоряет восстановление сознания, уменьшает неврологический дефицит и сохраняет когнитивный статус.
Efficiency of neurometabolic therapy was studied in patients with acute ischemic stroke by determining the level of neuron-specific enolase and the dynamics of cognitive status. It is proved that the combination of drugs that affects the cholinergic system accelerated recovery of consciousness, reduced neurologic deficit and maintained cognitive status.
ішемічний інсульт; когнітивний статус; нейронспецифічна енолаза; цитиколін; холіну альфосцерат
ишемический инсульт; когнитивный статус; нейронспецифическая энолаза; цитиколин; холина альфосцерат
ischemic stroke; cognitive status; neuron-specific enolase; citicoline; choline alphoscerate
Вступ
За даними Всесвітньої організації охорони здоров’я, мозковий інсульт посідає 2-ге місце серед чинників смерті у світі, 3-тє — у розвинутих країнах та є основним чинником інвалідизації населення. Щороку від 100 до 110 тис. мешканців України вперше переносять мозковий інсульт (МІ). Експерти Всесвітньої організації охорони здоров’я до 2030 р. очікують 23 млн інсультів, із них 7,8 млн — із летальними наслідками.
Так, за даними офіційної статистики Міністерства охорони здоров’я України, у 2015 році зареєстровано понад 96 тис. МІ, що становить 274 випадки на 10 тис. населення, і цей показник перевищує аналогічний у європейських країнах. Смертність від інсультів в Україні у 2015 році становила 78,9 випадку на 100 тис. населення, що також перевищує європейські показники [1].
Серед осіб, молодших за 45 років, частота виникнення інсульту становить 0,1–0,3 на 1000 чоловік на рік, тоді як в осіб, старших від 75 років, вона досягає 12–20 випадків на 1000 чоловік на рік [2].
Провідну роль у загибелі нейронів відіграють: ексайтотоксичність (внаслідок неконтрольованого вивільнення амінокислотних медіаторів), порушення кальцієвого гомеостазу клітини, руйнівна дія вільних радикалів, активація внутрішньоклітинного метаболізму, запалення, апоптоз. Успіхи фундаментальних досліджень пошкодження мозку зародили надію на те, що лікувальний вплив, спрямований на усунення або пригнічення тих чи інших ланцюгів патогенезу, може запобігти пошкодженню мозку, а отже, знизити летальність внаслідок ішемічного інсульту, а також зменшити інвалідність.
Існує так звана ієрархія ішемічного пошкодження мозку, згідно з якою спочатку припиняється функція нейронів, а потім втрачається цілісність клітин. При ішемічному пошкодженні головного мозку навколо вогнища пошкодження формується зона пенумбри, або ішемічної напівтіні. Ішемічна напівтінь становить собою ділянку життєздатної тканини, що перфузується із субоптимальною швидкістю (16–18 мл/100 г/хв) та розташована навколо ішемічної серцевини. Клітини, що знаходяться в центрі ішемічної серцевини, гинуть протягом декількох хвилин від початку ішемії. Клітини ішемічної напівтіні піддаються вторинній дезінтеграції, що потенційно може призвести до їх загибелі. Для зони, що безпосередньо оточує первинну напівтінь, загибель менш ймовірна, оскільки її перфузія є кращою, незважаючи на те, що вона нижча, ніж нормальний мінімум (50 мл/100 г/хв).
Патофізіологічні зміни, що відбуваються при ішемії, називаються ішемічним каскадом. Патобіохімічна сутність ішемічного каскаду така:
— зниження доставки О2 та глюкози, зменшення напруження СО2;
— негайне розщеплення аденозинтрифосфату (АТФ) для забезпечення потреб клітин в енергії (триває 2–4 хвилини після повної ішемії);
— використання фосфокреатиніну, рівень якого в мозку в 3 рази більший, ніж АТФ, для процесів ресинтезу АТФ з аденозиндифосфатів (АДФ);
— зниження внутрішньоклітинного рН і перехід на анаеробний гліколіз, що призводить до підвищення вмісту молочної кислоти;
— перетворення тривалентного заліза у двовалентне (за допомогою лактату), що сприяє утворенню вільних радикалів та окисленню ліпідів клітинних мембран;
— підвищення рівня збуджуючих амінокислот-нейротрансміттерів — глутамату й аспартату. Глутамат активує всі типи рецепторів: NMDA (N-метил-D-аспартат)-рецептори, локалізовані в корі гіпокампа, сприяють надходженню в клітину Na, Cl, H2O і Ca. AMPA-рецептори, або рецептори до квізклавату, сприяють надходженню в клітину Na (локалізовані в корі та таламусі). Рецептори каїнату сприяють надходженню в клітину Na (локалізовані в стріатумі гіпокампа). Аспартат впливає тільки на NMDA-рецептори;
— підвищення позаклітинної концентрації глутамату призводить до загибелі клітин двома шляхами: по-перше, при активації глутаматом NMDA-рецепторів розвивається негайна нейротоксичність, яка спричиняє надходження в клітину натрію, хлору та води — виникають клітинний набряк, лізис мембран та клітинна смерть. По-друге, у період від 24 до 72 годин після ішемії формується відстрочена нейротоксичність. Активація NMDA-рецепторів сприяє надходженню в клітину іонів кальцію, внаслідок чого активуються фосфоліпази, протеази, вільні жирні кислоти, утворюються арахідонова кислота та вільні радикали, що призводить до окислення ліпідів та смерті клітин;
— підвищене надходження іонів кальцію в клітину — рання та центральна подія ішемічного каскаду, оскільки виснаження запасів АТФ пошкоджує функцію енергозалежної натрій-калієвої АТФ-залежної іонної помпи, внаслідок чого іони натрію і хлору входять, а іони калію виходять із клітини; вторинно підвищується надходження в клітину води та розвивається набряк, прогресуюча мембранна деполяризація відкриває заряд-чутливі кальцієві канали для додаткового входження іонів кальцію в клітину; зниження рівня АТФ також призводить до вивільнення кальцію з ендоплазматичного ретикулуму; підвищений рівень вільних жирних кислот стимулює глутаматні рецептори та відкриває NMDA-залежні кальцієві канали; разом із тим виведення іонів кальцію з клітини є активним процесом, що припиняється при виснаженні запасів АТФ;
— численні ішемічні ефекти кальцію, якого в клітині в надлишку, формують традиційний шлях ішемічного каскаду, руйнуючи нейроцити. Підвищення рівня внутрішньоклітинного кальцію активує фосфоліпази А1, А2 і С, що призводить до гідролізу мембранних фосфоліпідів і вивільненню вільних жирних кислот. Втрата мембранних фосфоліпідів спричиняє руйнування мітохондріальних і клітинних мембран. Арахідонова кислота метаболізується до простагландинів (через шлях циклооксигенази), лейкотрієнів (через шлях ліпоксигенази) і вільних радикалів, які посилюють церебральну ішемію.
Тромбоксан А2 і простагландини, що утворилися з арахідонової кислоти, мають потужні судинозвужуючі властивості та сприяють агрегації тромбоцитів, викликають ішемію і залучаються до механізму реперфузійного пошкодження.
Супероксидні, пероксидні і гідроксильні радикали призводять до перокисного окислення ліпідів всередині мембрани нервової клітини. Це пошкоджує функції мембрани і вивільнює токсичні побічні продукти (альдегіди та гідрокарбонатні гази), які призводять до набряку клітин, порушують проникність гематоенцефалічного бар’єру, спричиняють запалення. Супероксидні радикали самі по собі можуть формувати запальну відповідь з утворенням судинних тромбів.
Вищесказане клінічно проявляється порушенням когнітивних функцій, до яких належать: підтримання ясної свідомості та уваги, моторні та соматосенсорні функції, ініціація та виконання реакцій на зовнішній стимул, мовленнєва функція, зорово-просторова орієнтація, здатність міркувати та приймати рішення, пам’ять та здатність до навчання [3–5].
Порушення когнітивних функцій є найбільш частими та значущими наслідками, що призводять до інвалідизації хворих після ішемічного інсульту.
Запобігання дезадаптуючим наслідкам і прогредієнтному перебігу гострих цереброваскулярних розладів залежить від якості інтенсивної терапії гострого періоду, зокрема від своєчасного застосування терапії, направленої на захист головного мозку від гіпоксії. Захистити головний мозок від пагубної дії ішемії та гіпоксії можна завдяки:
— відновленню адекватної перфузії (комплекс неспецифічних заходів, спрямованих на збільшення доставки кисню);
— фармакологічній нейропротекції, що складається:
- із захисту мембрани клітин від пошкоджуючої дії ішемічного каскаду;
- збільшення доставки енергетичних субстратів (захист від гіпоксії).
Метою фармакологічної нейропротекторної або нейрометаболічної терапії є збереження структури та/або функцій нейронів в умовах пошкодження головного мозку внаслідок ішемічного пошкодження (Casson R.J. зі співавт., 2012).
Основними етапами нейрозахисного лікування при цереброваскулярних розладах є:
— церебральна протекція — запобігаючий комплекс терапевтичних заходів для покращання неврологічних результатів у пацієнтів із ризиком виникнення церебральної ішемії; мета — запобігти пагубній дії ішемії;
— церебральна ресусцитація — комплекс терапевтичних заходів, яких вживають після ішемічної атаки; мета — лікування ішемії та зменшення ступеня пошкодження нейронів;
— цитопротекція — комплекс терапевтичних заходів, яких вживають після ішемічної атаки; мета — відновлення пошкодженої мозкової тканини, включаючи як нейрони, так і нейрональні клітини;
— клінічна церебропротекція — лікування, спрямоване на забезпечення максимального надходження О2 у клітину за рахунок збільшення його доставки та зменшення потреби в О2; мета — принципово зберегти мозковий кровообіг та усунути гіпоксемію;
— нейропротекція— лікувальний вплив, що запобігає або уповільнює прогресуючу втрату нейронів (Morales M.I., Pittman J., Cottrell J.E., 2007).
На переривання ішемічного каскаду впливають попередники холіну, а саме цитиколін та холіну альфосцерат, які в організмі є донаторами холіну. Це, зі свого боку, забезпечує відновлення та синтез фосфоліпідів клітинних мембран, а також сприяє синтезу нейромедіаторів ацетилхоліну та дофаміну (Saver J.L. et al., 2010 р.)
Цитиколін (цитидин-5-холінфосфат) як складова нейрометаболічної терапії застосовується у Європі вже понад 30 років (Афанасьєв, 2016). Цитиколін забезпечує репарацію клітинних мембран, відновлює рівень фосфатидилхоліну в нейронах, які зазнали ішемії. Введення цитиколіну в умовах ішемії відновлює рівні сфінгомієліну (фосфоліпіду клітинної мембрани) та кардіоліпіну (структурного фосфоліпіду внутрішньої мембрани мітохондрій), руйнування яких відбувається за участю активованої фосфоліпази А2 (Ніконов В.В., Савицька І.Б., Бутко Л.В., 2013).
Холіну альфосцерат бере участь у синтезі ацетилхоліну, позитивно впливає на нейротрансмісію, є джерелом фосфатидилхоліну. Останній забезпечує біосинтетичні процеси мембранних фосфоліпідів, що покращує пластичність та щільність нейронів. Іншим механізмом дії холіну альфосцерату є анаболічний ефект, що проявляється в стимуляції мембранного і гліцероліпідного синтезу внаслідок утворення попередників фосфоліпідів мембран із продуктів його метаболічного розпаду (Khaselev N., Murphy R.C., 2000).
Основним маркером пошкодження нервової тканини є нейронспецифічна енолаза (NSE). NSE — це внутрішньоклітинний фермент центральної нервової системи, що наявний у клітинах нейроектодермального походження (у нейронах головного мозку і периферичної нервової тканини).
Енолаза (2-фосфо-D-гліцерат гідролаза або фосфопіруват гідратаза) є гліколітичним ферментом, що перетворює 2-фосфо-D-гліцерат на фосфоенолпіруват. Вона є функціонально активним білком як гетеродимер, який складається з трьох субодиниць — α, β та γ [14]. Ізоензими γγ и αγ називають нейронспецифічною енолазою (NSE), оскільки із самого початку вважалось, що ці ізоферменти були виявлені виключно в нейронах. Але в подальшому було доведено, що нейроендокринні клітини та деякі клітини ненейронального та неендокринного походження також містять NSE. На відміну від нейронів, які експресують γγ-ізофермент, клітини ненейронального походження містять αγ-ізофермент [13, 14]. Гомодимер NSE γγ локалізований у тілах та аксонах нейронів та складає близько 1/50 обсягу головного мозку[15]. Діапазон енцефальної концентрації NSE від 0,4 до 2,2 % і може становити до 4 % від загальної кількості розчинних білків у деяких нейронах. У головному мозку дорослих людей NSE міститься в сірій речовині (наприклад, у неокортексі), а в білій речовині (наприклад, у пірамідному тракті та мозолистому тілі) її рівень набагато нижчий. Відомо, що NSE міститься в еритроцитах та тромбоцитах, тому незначний гемоліз (навіть у 2 %) може збільшити рівень NSE у сироватці в 5 разів. Нейронспецифічна енолаза має високу стійкість у біологічних рідинах і як вільно розчинний цитоплазматичний протеїн може легко дифундувати в інтерстиціальний простір та цереброспінальну рідину при пошкодженні мембран нейронів [13]. При захворюваннях, пов’язаних із безпосереднім залученням нервової тканини в патологічний процес, якісне та кількісне визначення цього білка в спинномозковій рідині або сироватці крові дають цінну інформацію щодо ступеня вираженості ушкоджень нейронів і порушення загальної цілісності гематоенцефалічного бар’єру [16–18]. Ось чому рівень NSE у сироватці підвищується не тільки при нейроендокринних пухлинах, але й при геморагічному шоці, ішемії органів та реперфузії, політравмі, травматичному та нетравматичному пошкодженні головного мозку, нейроінфекціях, епілепсії. При пошкодженні структури клітини NSE вивільнюється в позаклітинний простір та цереброспінальну рідину з подальшим рухом через субарахноїдальний простір до мозкових вен та потраплянням у кровоток. Швидкість цього руху визначається обсягом пошкодженої нервової тканини [20]. Період напіввиведення NSE в сироватці становить 24 години [16]. NSE є також специфічним білком астроцитарної глії. Збільшення концентрації цих білків у плазмі та спинномозковій рідині обумовлено активацією мікроглії.
NSE може характеризувати ступінь постішемічного пошкодження головного мозку: наприклад, у хворих з ішемічним інсультом її концентрація при надходженні до стаціонару становить 3–5 мкг/л, а на третю добу концентрація NSE підвищується більше ніж у 2 рази [23]. Швидкість її збільшення при ішемічних та геморагічних інсультах асоційована з несприятливим прогнозом захворювання [21]. За іншими повідомленнями, ферментативна активність НСЕ буває вищою при поширенні патологічного процесу на оболонки мозку порівняно з пошкодженням тільки паренхіми мозку [22].
За даними різних джерел, референтні значення NSE можуть коливатися від 12,7 до 16,3 нг/мл. Підвищення концентрації білка NSE > 12,0 нг/мл збільшує ризик смерті за APACHE II на 26,6 % [21].
На жаль, наукових праць, що вивчають вплив комбінації цих препаратів на регрес порушень когнітивного статусу та відновлення нервової системи у хворих із гострим ішемічним інсультом, недостатньо, а результати досліджень нейронспецифічної енолази з гострою судинною церебральною патологією неоднозначні. Тому вивчення впливу комбінованої нейрометаболічної терапії на вищезазначені параметри в таких хворих є актуальним та перспективним.
Мета дослідження: дослідити вплив нейрометаболічної терапії на рівень нейронспецифічної енолази, регрес порушень когнітивних функцій та швидкість відновлення нервової системи у хворих із гострим ішемічним інсультом.
Матеріали та методи
У проспективному рандомізованому дослідженні проводили аналіз лікування 80 пацієнтів із гострим порушенням мозкового кровообігу за ішемічним типом у ВІТ № 1 КЗ «Клінічне об’єднання швидкої медичної допомоги» ДОР.
Критерії включення: пацієнти з гострим ішемічним інсультом (14–20 балів за NIHSS), які госпіталізовані в перші 24 години від початку захворювання, наявність згоди родичів або хворих на участь у дослідженні.
Критерії виключення: геморагічний інсульт або повторний ішемічний інсульт, гостре порушення мозкового кровообігу в стовбурі головного мозку, термін від початку ішемічного інсульту понад 24 години, декомпенсація хронічних захворювань, відмова родичів або хворих від участі в дослідженні.
Діагностика та лікування на всіх етапах здійснювались за уніфікованим клінічним протоколом (Наказ МОЗ України № 602 від 03.08.2012 р.). Оцінка стану проводилась при надходженні хворих у стаціонар, на 1-шу, 3-тю, 5-ту, 7-му та 14-ту добу. Використовувались загальноклінічні (АТ, ЧСС, ЧДР, SpO2), лабораторні (загальний аналіз крові, рівень глікемії, коагулограма) та інструментальні методи дослідження (нейровізуалізація на спіральному комп’ютерному томографі Thoshiba Activion-16 TSX-031A, електрокардіографія). Для оцінки неврологічного статусу використовувалися шкали NIHSS, коми Глазго, FOUR, Coma Recovery Scale та шкала оцінки стадійності відновлення нервової системи (за Доброхотовою Т.А., 2006), а також The Rancho Los Amigos Scale (Martin S., Kessler M., 2007) для оцінки когнітивних функцій у хворих із пригніченням свідомості.
Концентрацію нейронспецифічної енолази в сироватці крові визначали методом імуноферментного аналізу (NSE EIA) на імуноферментному аналізаторі HumaReader за допомогою стандартних наборів реактивів CanAg (Швеція) у перші 3–8 годин від початку захворювання, на 3-тю та 6-ту добу.
Для аналізу первинної бази даних використовували результати описової статистики. Для кількісних даних перевірку гіпотези про нормальний закон розподілу випадкової величини проводили за критерієм Шапіро — Уілка (W). У разі нормального закону розподілу даних статистичні характеристики були подані у вигляді: обсягу вибірки (n — кількість спостережень), середнього арифметичного (М), стандартної похибки середнього (m), 95% довірчого інтервалу для середнього (95% ДІ). Відмінності вважали статистично значущими при р < 0,05.
Залежно від виду нейрометаболічної терапії хворих було розподілено на 2 групи (за методом конвертів).
До 1-ї групи (контрольної) увійшло 45 хворих із гострим порушенням мозкового кровообігу за ішемічним типом, у лікуванні яких нейрометаболічною складовою був цитиколін. Його вводили внутрішньовенно по 1000 мг 2 рази на добу протягом 14 діб.
2-гу групу (основну) становили 35 хворих із гострим порушенням мозкового кровообігу за ішемічним типом. Їм до цитиколіну (2000 мг на добу протягом 14 діб) додавали введення холіну альфосцерату. Препарат вводили внутрішньовенно по 1000 мг на добу протягом 14 днів.
Серед обстежених було 46 (57,5 %) чоловіків та 34 (42,5 %) жінки. Середній вік пацієнтів коливався від 51 до 84 років (68,0 ± 5,4 року). Групи не відрізнялися за віковим чи гендерним складом.
Результати та обговорення
При надходженні хворих до стаціонару артеріальний тиск систолічний (АТ сист.) становив 190 ± 10 мм рт.ст., артеріальний тиск діастолічний (АТ діаст.) — 115 ± 5 мм рт.ст., частота серцевих скорочень — 92 ± 3 скорочення за хвилину. Усі хворі мали порушення свідомості за шкалою коми Глазго (ШКГ). У 20 (42 %) із них порушення свідомості за ШКГ дорівнювало 7–8 балам, що відповідало комі I ступеня. У 28 (58 %) пацієнтів порушення свідомості за ШКГ становило 9–12 балів (сопор). При нейровізуалізації головного мозку у всіх пацієнтів виключено геморагічний інсульт. На КТ у всіх пацієнтів діагностовані ішемічні вогнища: у 70 % пацієнтів — у системі середньої мозкової артерії (лобна, тім’яна та скронева долі), у 30 % — ураження артерій вертебробазилярної системи на різних рівнях. Міжгрупових відмінностей за локалізацією патологічного процесу не було. Тяжкість стану хворих також не відрізнялася між групами та становила за NYHSS 18,0 ± 1,7 бала, за шкалою FOUR — 11,0 ± 0,8 бала, за Coma Recovery Scale — 11,0 ± 0,8 бала. За шкалою оцінки стадійності відновлення нервової системи (за Доброхотовою Т.А., 2006) стан хворих при надходженні відповідав 1–3-й стадії, а когнітивний статус за The Rancho Los Amigos Scale (Martin S., Kessler M., 2007) — 2–4-й стадії.
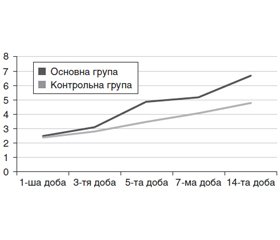
На 5-ту — 7-му добу спостереження в контрольній групі тяжкість хворих за NYHSS знизилась до 16,0 ± 1,3 бала, за шкалою FOUR рівень свідомості становив 12,0 ± 1,1 бала, за Coma Recovery Scale — до 11,0 ± 1,2 бала. За шкалою оцінки стадійності відновлення нервової системи стан хворих відновився до 2–4-ї стадії (рис. 1), а когнітивний статус — до 3–5-ї стадії (рис. 2).
В основній групі хворих, які отримували комбіновану нейрометаболічну терапію, на 5-ту — 7-му добу спостерігалося прискорення регресу неврологічної симптоматики. Так, за шкалою NYHSS кількість балів знизилась до 13,0 ± 1,5 бала (за рахунок відновлення сили м’язів верхньої кінцівки, зменшення вираженості афазії, дизартрії та відновлення рівня свідомості), за шкалою FOUR рівень свідомості досягав 13,0 ± 1,1 бала, за Coma Recovery Scale — 15,0 ± 1,2 бала. У цій групі хворих спостерігалося прискорене відновлення нервової системи та когнітивних функцій. Так, відновлення нервової системи відповідало 3–6-й стадії, а відновлення когнітивного статусу підвищилося до 5–7-ї стадії.
Аналіз динаміки відновлення нервової системи на 14-ту добу захворювання показав, що в контрольній групі він не перевищував 4-ї стадії, що відповідало акінетичному мутизму з емоційними реакціями, тоді як при використанні комбінованої нейрометаболічної терапії рівень відновлення нервової системи досягав 6-ї стадії або дезінтеграції (реінтеграції) мовлення на тлі сплутаної свідомості.
Аналіз відновлення когнітивного статусу за The Rancho Los Amigos Scale показав, що на тлі введення цитиколіну відновлення когнітивного статусу хворих не перевищувало 5-го рівня. Це відповідало сплутаній свідомісті, але без постійного збудження, та початку орієнтації в навколишньому середовищі. На тлі комбінованої терапії цитиколіном із холіном альфосцератом відновлення когнітивних функцій було вищим та досягало 7-го рівня, що відповідало адекватній поведінці, автоматичному та неякісному виконанню звичних навичок.
Летальність на 7-му — 14-ту добу в контрольній групі становила 48 %, в основній — 35 %.
Установлено, що рівень гліколітичного ферменту нейронспецифічної енолази при надходженні становив 2,32 ± 0,26 мкг/л у першій групі та 2,78 ± 0,14 мкг/л — у другій, що на 69,7 та 63,8 % відповідно було нижчим від норми (рівень NSE у добровольців даної вікової групи). У хворих 1-ї групи (контрольної) рівень НСЕ підвищувався до 10,7 ± 1,6 мкг/л на 3-тю добу з подальшим зниженням до 8,88 ± 0,64 мкг/л на 6-ту добу (табл. 1). Але ці показники перевищували референтні значення NSE для даної вікової групи, що пов’язано зі ступенем тяжкості патологічного процесу. На тлі проведення нейрометаболічної терапії (основна група) зниження NSE було значно більшим: на 3-тю добу спостереження рівень NSE становив 6,00 ± 0,57 мкг/л, на 6-ту добу — 5,78 ± 0,36 мкг/л. Ці показники вірогідно (р > 0,05) відрізнялися від показників контрольної групи на відповідну добу. Це свідчило про менше ураження клітин головного мозку, що підтверджувалося прискореним регресом неврологічної симптоматики (за шкалою NYHSS) та виходом із коми (кількість годин у стані пригніченої свідомості в основній групі на 34 % була меншою, ніж у контрольній).
Висновки
1. При надходженні до стаціонару у хворих із ГІІ рівень нейронспецифічної енолази значно нижчий за норму.
2. Для більш точного порівняння у хворих із гострим ішемічним інсультом необхідно враховувати референтні значення рівня нейронспецифічної енолази в здорових добровольців відповідної вікової групи.
3. Комбінація холіну альфосцерату із цитиколіном сприяє зниженню (p < 0,05) нейронспецифічної енолази на 35 % на 6-ту добу (порівняно з контрольною групою), що в подальшому сприяє більш швидкому відновленню рівня неврологічного статусу. Це дозволяє нам рекомендувати комбіновану нейрометаболічну терапію в гострому періоді ішемічного інсульту.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів при підготовці даної статті.
1. Мищенко Т.С. Эпидемиология цереброваскулярных заболеваний и организация помощи больным с мозговым инсультом в Украине // Український вісник психоневрології. — 2017. — Т. 25. — Вип. 1(90). — С. 22-24.
2. Кущ К.О., Клигуненко О.М., Зозуля О.О. Вплив комбінованої нейрометаболічної терапії на регрес неврологічної симптоматики у хворих із гострим ішемічним інсультом // Медицина невідкладних станів. — 2017. — 5(84). — С. 86-90.
3. Клигуненко Е.Н., Емельянова Е.А. Нейропротекция: настоящее и будуще // Нейронауки: теоретичні та клінічні аспекти. — 2008. — Т. 4, № 1. — С. 75-81.
4. Віничук С.М. Мозговий інсульт: Навчальний посібник. — К., 1998. — 50 с.
5. The Neurologic Complications of Ischemic Stroke / N.I. Osemone // US Pharm. — 2013. — Vol. 38, № 1. — Р. 1-5.
6. Moore D.P. Textbook of clinical neuropsychiatry. — 2nd ed. — London: Hodder Arnold., 2008. — 731 p.
7. David A., Fleminger S., Kopelman M.D. et al. Lishman’s organic psychiatry. A textbook of neuropsychiatry. — 4th ed. — Oxford — Hoboken, NJ: Wiley-Blackwell, 2009. — 933 p.
8. Vinogradov O.I., Daminov V.D., Rybalko N.V. The use of choline alfoscerate (gliatiline) in patients with ischemic stroke // Zh. Nevrol. Psikhiatr. Im. S.S. Korsakova. — 2013. — 113(1). — Р. 43-5.
9. Assessment Scales for Disorders of Consciousness: EvidenceBased Recommendations for Clinical Practice and Research Report of the American Congress of Rehabilitation Medicine, Brain Injury-Interdisciplinary Special Interest Group, Disorders of Consciousness Task Force: Ronald T. Seel, PhD, Task Force Chair — 2010.
10. Мищенко Т.С. Глиатилин в лечении постинсультных больных / Т.С. Мищенко, В.Н. Мищенко, И.А. Лапшина // Здоровье Украины. — 2012. — № 3(22). — С. 36-37.
11. Румянцева С.А., Афанасьев В.В., Кузьмина Ю.В., Силина Е.В. Рациональная фармакокоррекция поражений мозга при острой и хронической ишемии // Consilium Medicum. — 2010. — Vol. 12, № 9. — Р. 23-31.
12. Новые возможности мультимодальной фармакотерапии острого периода ишемического инсульта / Дзяк Л.А., Зозуля О.А., Клигуненко Е.Н., Кущ Е.А. // Международный неврологический журнал. — 2015. — № 5(75). — С. 39-44.
13. Adibhatla R.M., Hatcher J.F., Dempsey R.J. Citicoline: Neuroprotective mechanisms in cerebral ischemia // J. Neurochem. — 2002. — Vol. 80. — Р. 12-23.
14. Lima J.E., Takayanagui O.M., Garcia L.V., Leite J.P. Use of neuron-specific enolase for assessing the severity and outcome in patients with neurological disorders // Brazilian Journal of Medical and Biological Research. — 2004. — 37. — Р. 19-26.
15. Marangos P.J., Schmechel D.E. Neuron specific enolase, a clinically useful marker for neurons and neuroendocrine cells // Annual Review of Neuroscience. — 1987. — 10. — Р. 269-295.
16. Білошицький В.В., Кобилецький О.Я. Можливості біохімічних біомаркерів в прогнозуванні наслідків черепно-мозкової травми // Український нейрохірургічний журнал, спецвипуск. — 2016. — С. 85-93.
17. The prognostic value of serum neuron-specific enolase in traumatic brain injury: systematic review and meta-analysis / F. Cheng, J. Yang, Q. Yuan, et al. // PLoS. — 2014. — V. 9, № 9. — Р. 1-15.
18. Secondary brain injury in trauma patients: the effects of remote ischemic conditioning / B. Joseph, V. Pandit, B. Zangbar et al. // J. Trauma Acute Care Surg. — 2015. — № 78. — С. 698-703.
19. Pandey A. Neuron specific enolase and c-reactive protein levels in stroke and its subtypes: correlation with degree of disability / A. Pandey, A.K. Shrivastava, K. Saxena // Neurochemical research. — 2014. — № 39. — С. 1426-1432.
20. Biomarkers for the diagnosis and prognosis of mild traumatic brain injury/concussion / C.B. Jeter, G.W. Hergenroeder, M.J. Hylin, J.B. Redell, A.N. Moore, P.K. Dash // J. Neurotrauma. — 2013. — V. 30, №8. — P. 657-670.
21. Ogata M. Neuron-specific enolase as an effective immunohistochemical marker for injured axons after fatal brain injury / M. Ogata, O. Tsuganezawa // Int. J. Legal Med.— 1999. — V. 113. — P. 19-25.
22. Карякина Г.М. Нейронспецифическая энолаза как индикатор поражения мозговой ткани при ишемических инсультах / Г.М. Карякина, М.В. Надеждина, М.А. Хинко // Неврологический вестник. — 2007. — Т. XXXIX. — Вып. 1. — С. 41-44.
23. Молодых А.С. Влияние цитиколина на уровень маркеров повреждения нервной ткани при остром нарушении мозгового кровообращения: Сборник статей по материалам 70-й Юбилейной итоговой научной студенческой конференции им. Н.И. Пирогова (г. Томск, 16–18 мая 2011 г.) / под ред. В.В. Новицкого, Л.М. Огородовой. — Томск: Сибирский государственный медицинский университет, 2011. — 430 с.
24. Lenka Hajduková, Ondlej Sobek, Darina Prchalová, Zuzana Bílková, Martina Koudelková, Jilina Lukášková, InkaMatuchová: Biomarkers of Brain Damage: S100B and NSE Concentrations in Cerebrospinal Fluid — A Normative Study. — 2014. — Hindawi Publishing Corporation BioMed Research International Article ID 379071.

/96-1.jpg)
/97-1.jpg)