Введение
Заболеваемость раком прямой кишки (РПК) занимает третье место в мире и составляет 9,7 % среди всех злокачественных новообразований. На мужчин приходится 10 % всех диагностированных онкологических заболеваний, на женщин — 9,2 % случаев, что соответствует 3-му и 2-му месту в структуре заболеваемости [1]. В Украине ежегодно диагностируется более 9000 случаев РПК, 32,5 % пациентов проводят комбинированное лечение. Летальность до года достигает 30 % и остается неизменной с 2001 года. Удельный вес РПК в структуре онкологической заболеваемости среди мужчин составляет 6,1 %, среди женщин он равен 4,9 %, оба показателя занимают 6-е место. Удельный вес РПК в структуре смертности от онкологических заболеваний среди мужчин составляет 6,3 %, среди женщин — 6,6 %, что соответствует 5-му и 4-му местам в структуре [2]. Стандарт лечения РПК 2–3-й стадии — это сочетание хирургического метода с предоперационной лучевой и, в большинстве случаев, химиотерапией [4]. Несмотря на усовершенствование методов обез–боливания, использование новых аналгетиков и анестетиков, 59 % пациентов в послеоперационном периоде ощущают боль средней и сильной интенсивности [3].
Ухудшение нутритивного статуса пациента с потерей массы тела, кровотечение из опухоли, боль в месте локализации новообразования, формирование хронического болевого синдрома, предоперационная химиолучевая терапия, которая может сопровождаться иммунодепрессией, — все это обу–словливает уязвимость пациентов в периоперационном периоде, актуализируя проблему адекватного обезболивания и быстрого восстановления пациентов после хирургического вмешательства при РПК.
Современная концепция анестезиологического обеспечения при хирургическом лечении РПК основана на принципах fast track surgery [5–7] и программах ЕRAS [8] в колоректальной хирургии. Комбинации различных методов обезболивания, включая региональные техники, в сочетании с аналгетиками разного механизма действия улучшают аналгезию и уменьшают потребление наркотических аналгетиков, снижают побочные эффекты опиоидов [9], способствуют более быстрому восстановлению пациентов после колоректальных операций [10].
Целью данного исследования является изучение эффективности и безопасности различных вариантов мультимодальной аналгезии при хирургическом лечении колоректального рака.
Материалы и методы
Исследование проведено в отделении анестезиологии и интенсивной терапии Национального института рака за период с 2015 по 2018 год и одобрено локальной комиссией по этике. Все пациенты, включенные в исследование, дали письменное согласие на участие в научном исследовании.
Критериями исключения из данного исследования были наличие отдаленных метастазов, синхронный рак, ургентные операции, сопутствующие заболевания в стадии декомпенсации, инфаркт мио–карда в анамнезе менее 6 месяцев, возраст старше 75 и менее 18 лет.
Проспективно методом выборочных чисел пациенты были рандомизированы на три группы. В группы А (гр. А), Б (гр. Б) и В (гр. В) были включены по 30 пациентов с РПК (Т2–3N1–2M0), всего 90 пациентов. Всем пациентам было выполнено хирургическое вмешательство в объеме передней резекции прямой кишки, низкой передней резекции и прокт–эктомии. Метод анестезии гр. А включал сочетание ингаляционной анестезии (ИА) севораном 0,5–0,6 МАК с фентанилом внутривенно (в/в) в дозе 3–4 мкг/кг и эпидуральной аналгезии (ЭА) ропивакаином 0,2% 6–8 мл в комбинации с фентанилом 100 мкг эпидурально болюс до начала операции, атракуриум в стандартной дозе. Метод анестезии гр. Б включал сочетание пропофола в дозе 4–5 мг/кг/час с фентанилом в дозе 3–4 мкг/кг и ЭА ропивакаином 0,2% 6–8 мл болюс до начала операции, атракуриум в стандартной дозе. В гр. В пациенты оперированы под общим эндотрахеальным наркозом, пропофолом 5–6 мг/кг/час с фентанилом 5 мкг/кг и релаксацией атракуриумом в стандартной дозе. Повторные дозы фентанила 50–100 мкг вводили в/в по необходимости во время операции во всех группах.
Для послеоперационного обезболивания в гр. А была использована ЭА смесью ропивакаина 0,2%, фентанилом 2,5 мкг/мл и адреналином 2 мкг/мл со скоростью 4–6 мл/час. Для продленного введения была использована одноразовая эластическая инфузионная помпа с регулируемой скоростью подачи анестетика. Как компонент мультимодальной аналгезии использовали нестероидный противовоспалительный препарат (НПВП) (декскетопрофен 50 мг 3 раза в сутки) и парацетамол (1000 мг в/в 3 раза в сутки). В гр. Б для послеоперационного обезболивания применяли ЭА ропивакаином 0,2% в дозе 5–6 мл/час, в/в контролируемую пациентом аналгезию фентанилом в дозе 10 мкг/мл болюс, локаут 6 минут, НПВП (декскетопрофен 50 мг 3 раза в сутки) и парацетамол (1000 мг в/в 3 раза в сутки). В гр. В для послеоперационного обезболивания использовали внутримышечно омнопон 20 мг в сочетании с анальгином 500 мг 3–4 раза в сутки.
Интраоперационно проводили мониторинг артериального давления (АД) среднего, частоты сердечных сокращений (ЧСС) каждые 10 минут монитором PHILIPS MP60 (Германия), в после–операционном периоде — каждые 2 часа монитором NIHON KOHDEN (Япония). Потребность в фентаниле, мышечных релаксантах учитывали во время операции. Для оценки стресс-реакции рассматривали содержание глюкозы в крови перед операцией и на 3-и, 10-е сутки после хирургического вмешательства. Контролируемая пациентом аналгезия осуществлялась через электрическую девайс-кнопку с помощью шприцевого насоса перфузора B/braun (Германия). Интенсивность послеоперационной боли оценивали по визуально-аналоговой шкале боли (ВАШ) в баллах от 1 до 10. Оценку боли проводили каждые 2 часа в первые 6 часов после операции, затем каждые 6 часов в течение 72 часов. Пациенты во всех группах получили предоперационный курс химиолучевой терапии согласно Национальному стандарту лечения рака прямой кишки [4].
Статистическую обработку полученных результатов проводили с помощью программного обеспечения Statistica 8.0, StatSoft Inc., 2008. Распределение непрерывных данных в группах оценивали с построением диаграмм распределения, а также по критерию Колмогорова — Смирнова. При ненормальном распределении данных сравнение между группами проводили, используя непараметрические методы оценки. Сравнение между группами количественных показателей оценивали с использованием критерия Манна — Уитни, качественных — двустороннего критерия Фишера. Статистически значимыми считали различия при вероятности ошибки 1-го рода менее 5 % (р < 0,05).
Результаты
Пациенты в трех группах, включенные в исследование, статистически значимо не различались между собой по возрасту, полу, массе тела, длительности хирургического вмешательства и анестезиологическому риску по ASA. Объем оперативных вмешательств также не различался между группами исследования.
Характеристика больных, включенных в исследование, представлена в табл. 1.
При сравнении между группами потребности в фентаниле во время операции было установлено, что доза фентанила в гр. А была наименьшей по сравнению с гр. Б и гр. В (табл. 2). Потребность в мышечном релаксанте атракуриуме во время операции статистически значимо не различалась между гр. А и гр. Б, но имела значительные различия с гр. В (табл. 2).
Изменения показателей гемодинамики (АД среднее) имели общую тенденцию к снижению через 20 минут после введения местного анестетика эпидурально в гр. А и гр. Б. Снижение АД среднего было кратковременным, не превышало 20 % от исходных значений, восстанавливалось в течение 10–15 минут в гр. А и гр. Б, составляло в среднем 74,3 ± 8,2 и 82,6 ± 14,3 соответственно. Снижение АД среднего в гр. В не превышало 15 % от исходных значений после начала анестезии и статистически значимо не отличалось от гр. А и гр. Б. Изменения АД среднего оставалось выше 70 мм рт.ст. во всех группах до конца операции (рис. 1).
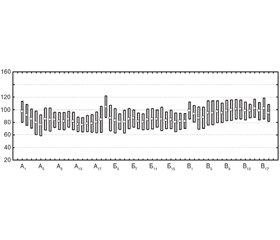
Частота сердечных сокращений у больных в гр. А снизилась с 74,0 ± 5,4 уд–1 перед началом операции до 70 ± 6 уд–1 через 20 мин после эпидурального введения местного анестетика и была стабильной в течение всей операции. В гр. Б отмечалось снижение ЧСС с 72,0 ± 2,5 уд–1 перед операцией до 72 ± 8 уд–1 во время операции. В гр. В наблюдались аналогичные изменения ЧСС в течение всей операции (рис. 2).
При анализе гликемии было установлено, что колебания сахара в крови у больных гр. А оставались в пределах границ нормы, с незначительным увеличением к окончанию 10-х суток послеоперационного периода. Хотя изменения носили статистически значимый характер, они не имели клинической значимости (табл. 3). Подобные изменения уровня гликемии были выявлены и у больных гр. Б, они также не имели клинической значимости. У больных гр. В содержание глюкозы в крови значительно увеличилось к окончанию операции и сохранялось выше границ нормы на 3-и и 10-е сутки послеоперационного периода.
/148-1.jpg)
При оценке интенсивности послеоперационной боли в первые 24 часа по ВАШ было установлено, что у больных гр. А и гр. Б интенсивность боли в среднем была значительно ниже по сравнению с больными гр. В (рис. 4). Так, при подсчете количества оценок боли выше 4 баллов в гр. А и гр. Б эти цифры составили соответственно 12 и 32 (р = 0,022), тогда как у больных гр. В количество оценок боли более 4 баллов составило 126 (р = 0,0001 и р = 0,0001 при сравнении с гр. А и гр. Б). Более высокая интенсивность боли у больных гр. В сохранялась в течение всего периода наблюдения, что требовало более высоких доз опиоидного аналгетика омнопона.
При оценке такого показателя, как длительность нахождения в стационаре, было установлено, что средняя длительность хирургического лечения больных гр. А составила 11,3 ± 3,5 дня, в гр. Б — 10,6 ± 3,1 дня, а в гр. В — 13,5 ± 5,7 дня (р = 0,3614 при сравнении гр. А и гр. Б, р = 0,2738 при сравнении гр. А и гр. В, р = 0,0649 при сравнении гр. Б и гр. В).
Обсуждение
Результаты исследования показали, что потребность в фентаниле и мышечных релаксантах была наименьшей в гр. А, средней — в гр. Б и самой высокой — в гр. В со статистически значимыми различиями (p < 0,05).
Во время операции снижение среднего АД во всех группах после интубации трахеи было кратковременным, не превышало 20 % от исходных значений и восстанавливалось в течение 10–20 минут. Установлено, что после эпидурального введения местного анестетика и развития симпатической блокады до Th5 развивается ауторегуляция периферического сосудистого тонуса за счет механизма компенсаторной вазоконстрикции вышележащих грудных сегментов с рефлекторным учащением ЧСС и характерными изменениями гемодинамики. Время, необходимое для включения механизма компенсаторной ауторегуляции, составляет не менее 20 минут [8]. Наблюдаемые изменения ЧСС в гр. А и гр. Б после интубации трахеи согласуются с механизмом компенсаторной ауторегуляции гемодинамики и не выходят за пределы допустимых значений в сравнении с гр. В. Ни одному пациенту не требовалось введение атропина и вазоконстрикторов интраоперационно. ЧСС в трех группах оставалась стабильной и не имела статистически значимых различий между группами. Выявление ранних изменений гемодинамики, в частности среднего АД, позволяло избегать длительной артериальной гипотонии у пациентов в нашем исследовании, что соответствовало рекомендациям ERAS для колоректальной хирургии [9].
Характерные изменения одного из маркеров хирургического стресса, гликемии, отмечались в интра- и послеоперационном периодах во всех группах пациентов. В гр. А и гр. Б на всех этапах исследования уровень гликемии оставался стабильным и не выходил за пределы нормы, тогда как в гр. В уровень сахара крови повышался до 50 % в сравнении с дооперационным значением. Только к 10-м суткам после операции уровень гликемии снижался до операционных значений, что свидетельствовало о переходе состояния пациента из фазы катаболизма в стадию анаболизма. Наши результаты согласуются с данными [10], которые показали, что эпидуральная анестезия вызывает эфферентную блокаду ноцицептивных стимулов надпочечника и печени, уменьшая выделение адреналина, и предупреждает повышение сахара в крови во время хирургического стресса, тогда как хирургическое вмешательство под общей анестезией без нейроаксиальной анестезии приводит к усилению распада гликогена, способствуя развитию катаболизма [11]. При оценке болевого синдрома по шкале ВАШ в гр. А по сравнению с гр. В установлено, что эпидуральная аналгезия смесью местного анестетика в низкой концентрации с опиоидным аналгетиком имеет больший потенциал сохранения адекватной послеоперационной аналгезии. В гр. Б сочетание эпидуральной аналгезии местным анестетиком с контролируемой пациентом аналгезией фентанилом эффективнее защищает пациентов от хирургического стресса в сравнении с гр. В вследствие блокады периферической ноцицептивной стимуляции, снижения симпатического тонуса соответственно области распространения местного анестетика, лучшего контроля боли [12], быстрого восстановления кишечной перистальтики без негативного эффекта на состоятельность кишечного анастомоза [13, 14]. Назначение нестероидных противовоспалительных препаратов и парацетамола в гр. А и гр. Б снижало потребность в опиатах, уменьшало частоту послеоперационной тошноты и рвоты, потенцировало действие эпидуральной аналгезии за счет аддиктивного компонента [15]. По результатам проведенного исследования, применение мультимодальной аналгезии привело к статистически достоверному уменьшению потреб–ления дозы фентанила и мышечного релаксанта, эффективнее защитило пациентов от хирургического стресса, уменьшило длительность лечения пациентов в хирургическом стационаре.
Выводы
1. Общая ингаляционная анестезия севораном в сочетании с эпидуральной аналгезией смесью ропивакаина с фентанилом и фентанилом в/в является эффективным методом защиты пациента от хирургического стресса при оперативном вмешательстве по поводу РПК.
2. Внутривенная анестезия пропофолом с эпидуральной аналгезией ропивакаином является альтернативным по эффективности и безопасным методом обезболивания при хирургическом лечении РПК.
3. Эпидуральная аналгезия с помощью эластической инфузионной помпы смесью ропивакаина, фентанила и адреналина в сочетании с парентеральным введением декскетопрофена и парацетамола является эффективным и безопасным методом послеоперационного обезболивания в сравнении с парентеральным введением омнопона.
4. Контролируемая пациентом аналгезия фентанилом в сочетании с эпидуральной аналгезией с помощью эластической инфузионной помпы с ропивакаином в сочетании с парентеральным введением декскетопрофена и парацетамола эффективно купирует острую послеоперационную боль в сравнении с рутинным назначением омнопона.
Конфликт интересов. Авторы заявляют об отсутствии какого-либо конфликта интересов при подготовке данной статьи.
Список литературы
1. World Cancer Research Fund International. — https://www.wcrf.org.
2. Національний канцер-реєстр. Структура захворюваності та смертності. — 2016. — № 19.
3. Apfelbaum J.L., Chen C., Mehta S.S., Gan T.J. Postoperative pain experience: Results from a national survey suggest postoperative pain continues to be undermanaged // Anesth. Analg. — 2003. — Vol. 97. — P. 534-540.
4. Уніфікований клінічний протокол первинної, вторинної (спеціалізованої), третинної (високоспеціалізованої) медичної допомоги та медичної реабілітації, колоректальний рак. Наказ Міністерства охорони здоров’я України, 12.07.2016, № 703.
5. Kehlet H., Dahl J.B. Anaesthesia, Surgery, and Challenges in Postoperative Recovery // Lancet. — 2003. — 362. — Р. 1921-1928.
6. White P.F., Kehlet H., Neal J.M., Schricker T., Carr D.B., Carli F.; Fast-Track Surgery Study Group. The role of the ane–sthesiologist in fast-track surgery: from multimodal analgesia to perioperative medical care // Anest. Analg. — 2007. — 104. — Р. 1380-1396.
7. Bundgaard-Nielsen M., Holte K., Secher N.H., Kehlet H. Monitoring of peri-operative fluid administration by individua–lized goal-directed therapy // Acta Anaesthesiologica Scandinavica. — 2007. — 51(3). — Р. 331-340.
8. Cousins and Bridenbaugh’s. Epidural Neral Blockade // Neural Blockade in Clinical Anesthesia and Pain Medicine. — 1988. — 2nd ed. — Р. 253-360.
9. Clinical Nutrition 31 (2012) 801-816, Guidelines ERAS (enhanced recovery programmes after surgery), 2012.
10. Wilmore D.W. From Cuthbertson to fast-track surgery: 70 years of progress in reducing stress in surgical patients // Ann. Surg. — 2002. — 236. — Р. 643-48.
11. Christopher L.Wu, Seth R. Cohen, Jeffrey M. Richman, Andrew J. Rowlingson, Genevieve E. Courpas et al. Efficacy of postoperative patient- controlled and continuous infusion epidural analgesia versus intravenous patient-controlled analgesia with opioids: a meta-analysis // Anesthesiology. — 103(5). — Р. 1079-88.
12. Jorgensen H., Wetterslev J., Moiniche S. et al. Epidural local anaesthetics versus opioid-based analgesic regimens on postoperative gastrointestinal paralysis, PONV and pain after abdo–minal surgery // Cochrane Database Syst. Rev. — 2000. — 4. — CD 001893.
13. Holte K., Kehlet H. Epidural analgesia and risk of anastomotic leakage // Reg. Anesth. Pain. Med. — 2001. — 26. — 111.
14. Kehlet H., Dahl J.B. The value of ”multimodal” or ”ba–lanced analgesia” in postoperative pain treatment // Anesth. Analg. — 1993 Nov. — 77(5). — Р. 1048-56.
15. Maund E., McDaid C., Rice S., Wright K., Jenkins B., Woolacott N. Paracetamol and selective and non-selective non-steroidal anti-inflammatory drugs for the reduction in morphine-related side-effects after major surgery // Br. J. Anaesth. — 2011 Mar. — 106(3). — Р. 292-7.

/147-1.jpg)
/148-1.jpg)