Резюме
Актуальність. Емпієма плеври (ЕП), як і будь-яке гнійно-запальне захворювання, потребує призначення антибактеріальної терапії та визначення чутливості патогенів до антибіотиків. Однак мікробний пейзаж та антибіотикорезистентність бактерій постійно змінюються. Це робить актуальним вивчення спектра та властивостей збудників ЕП. Мета дослідження: вивчити мікробіологічну характеристику хворих на гостру ЕП плеври та розробити рекомендації щодо оптимізації емпіричної антибактеріальної терапії. Матеріали та методи. Проведене комплексне ретроспективне дослідження 124 випадків захворювання на гостру неспецифічну парапневмонічну ЕП. Чоловіків було 92 (74,2 %). Медіана віку хворих становила 50,3 (38; 61) року. Результати. При мікробіологічному дослідженні плеврального ексудату позитивний результат отримано в 34 (27,4 %) випадках. Необхідно зазначити, що більшість хворих (101 — 81,5 %) отримували попередню антибактеріальну терапію. Так, серед пацієнтів, які раніше не отримували лікування, цей показник був істотно вищий — 12 (52,2 %) vs 22 (21,8 %), p < 0,01. Грамнегативні та грампозитивні мікроорганізми зустрічались однаково часто — 19 (51,4 %) та 18 (48,6 %) ізолятів відповідно. Серед причинної мікрофлори виділяються 5 основних збудників: Ps. aeruginosa, St. epidermidis, St. aureus, Str. pneumoniae, Str. mitis, що сумарно становили 59,4 % ізолятів. Висновки. Культуральні дослідження при ЕП характеризується значною кількістю негативних результатів (72,6 %). З огляду на на чутливість основних збудників до антибіотиків рекомендована емпірична антибактеріальна терапія першої лінії має складатись з комбінації похідних імідазолу (метронідазол, орнідазол) та цефоперазону із сульбактамом. Доцільне використання гатифлоксацину як препарату другої лінії, а як антибіотика резерву — гентаміцину чи тобраміцину.
Актуальность. Эмпиема плевры (ЭП), как и любое гнойно-воспалительное заболевание, требует назначения антибактериальной терапии и определения чувствительности микроорганизмов к антибиотикам. Однако микробный пейзаж и антибиотикорезистентность бактерий постоянно меняются. Это делает актуальным изучение спектра и свойств возбудителей ЭП. Цель исследования: изучить микробиологическую характеристику больных острой ЭП плевры и разработать рекомендации по оптимизации эмпирической антибактериальной терапии. Материалы и методы. Проведено комплексное ретроспективное исследование 124 случаев заболевания острой неспецифической парапневмонической ЭП. Мужчин было 92 (74,2 %). Медиана возраста больных составила 50,3 (38; 61) года. Результаты. При микробиологическом исследовании плеврального экссудата положительный результат получен в 34 (27,4 %) случаях. Необходимо отметить, что большинство больных (101 — 81,5 %) получали предшествующую антибактериальную терапию. Так, среди пациентов, ранее не получавших лечения, этот показатель был существенно выше — 12 (52,2 %) vs 22 (21,8 %), p < 0,01. Грамотрицательные и грамположительные микроорганизмы встречались одинаково часто — 19 (51,4 %) и 18 (48,6 %) изолятов соответственно. Среди причинной микрофлоры выделяются 5 основных возбудителей: Ps. aeruginosa, St. epidermidis, St. aureus, Str. pneumoniae, Str. mitis, которые суммарно составили 59,4 % изолятов. Выводы. Культуральные исследования при ЭП характеризуются значительным количеством негативных результатов (72,6 %). С учетом чувствительности основных возбудителей к антибиотикам рекомендованная эмпирическая антибактериальная терапия первой линии должна состоять из комбинации производных имидазола (метронидазол, орнидазол) и цефоперазона с сульбактамом. В качестве препарата второй линии целесообразно использование гатифлоксацина, а антибиотика резерва — гентамицина или тобрамицина.
Background. Pleural empyema, like any purulent disease, requires antibiotic therapy and determining the sensitivity of bacteria to antibiotics. However, the microflora and the antibiotic resistance of bacteria are constantly changing. So, it is important to study the spectrum and properties of causative agents. The purpose was to study the microbiological characteristics of patients with acute pleural empyema and to develop recommendations for optimizing empiric antibiotic therapy. Materials and methods. A comprehensive retrospective study was performed of 124 cases of acute nonspecific parapneumonic pleural empyema. There were 92 (74.2 %) male patients. The median age of the patients was 50.3 (38; 61) years. Results. A positive result was obtained in 34 (27.4 %) cases when analyzing pleural effusion. It should be noted that the majority of patients — 101 (81.5 %) previously received antibiotic therapy. Thus, among patients who had not previously received treatment, this index was significantly higher — 12 (52.2 %) vs 22 (21.8 %), p < 0.01. Gram-negative and Gram-positive bacteria were equally common: 19 (51.4 %) and 18 (48.6 %) isolates, respectively. There were 5 main pathogens: Ps.aeruginosa, St.epidermidis, St.aureus, Str.pneumoniae, Str.mitis, which accounted for 59.4 % of isolates. Conclusions. Cultural studies in pleural empyema are characterized by a significant number of negative results (72.6 %). Based on the sensitivity of the main pathogens to antibiotics, the recommended empiric first-line antibacterial therapy should consist of a combination of imidazole derivatives (metronidazole, ornidazole) and cefoperazone with sulbactam. As a second-line preparation, it is advisable to use gatifloxacin, and as reserve antibiotic — gentamicin or tobramycin.
Вступ
Емпієма плеври (ЕП), як і будь-яке гнійно-запальне захворювання, у схемі лікування передбачає застосування антибактеріальної терапії, що потребує визначення чутливості патогенів до антибіотиків. У той же час у вітчизняних закладах охорони здоров’я не завжди доступні мікробіологічні методи експрес-діагностики, у тому числі визначення чутливості мікроорганізмів до антибактеріальних препаратів. Тому в переважній більшості випадків стартова терапія має емпіричний характер.
Аналізуючи наукові праці, в яких висвітлюються ці питання, визначають певні різночитання та протиріччя в мікробіологічній характеристиці ЕП. За даними С.М. Луценко та Є.І. Тарасова, у 1975 році в мікробному спектрі превалювали стафілококи, які виявлялись у 77 % випадків. Сучасні дослідження вказують на значну роль стрептококів (72 %) у структурі збудників позалікарняної ЕП. При нозокоміальній інфекції переважають стафілококи (40 %) та грамнегативні мікроорганізми (26 %), а представники роду Streptococcus становлять лише 23,1 % випадків. Стафілокок, що стійкий до метициліну, та Pseudomonas aeruginosa зустрічались лише у випадках госпітальної ЕП, а летальність у цих випадках була вищою [1, 2].
У дослідженнях, проведених в Китаї та Індії, роль грампозитивних бактерій була порівняно меншою. Так, колеги з Гонконгу ідентифікували грампозитивні види в 39 % випадків, грамнегативні – в 31 %, анаероби – в 30 % [3]. У лікарнях Делі грам-негативні організми виявлялись у 86,4 % випадків, грампозитивні – у 13,6 %. Особливу увагу звертає збільшення частки антибіотикостійких штамів, особливо мультирезистентних, порівняно з попередніми роками [4, 5].
Мікробний фон змінюється залежно від впровадження нових фармакологічних досягнень. У зв’язку з поширенням антипневмококової вакцини, починаючи з 2000 року, змінилась сероструктура пневмокока. Нові серовари відрізняються більшою патогенністю: відмічена кореляція між зростанням захворюванності на гостру ЕП та поширеністю цих штамів [1]. Після впровадження зазначеної вакцини в Іспанії виявлене зростання захворюванності на пневмококову ЕП з 7,6 до 14,9 % [6].
Таким чином, мікробний пейзаж та антибіотикорезистентність патогенів мають варіабельний характер, що змінюється з плином часу, віковою структурою, географічним регіоном та поширенням антибактеріальних засобів. Це робить актуальним постійне вивчення спектра та властивостей збудників гострої ЕП.
Мета дослідження: вивчити мікробіологічну характеристику хворих на гостру ЕП плеври та розробити рекомендації щодо оптимізації емпіричної антибактеріальної терапії.
Матеріали та методи
Проведене комплексне ретроспективне дослідження 124 випадків захворювання на гостру неспецифічну парапневмонічну ЕП. Хворі перебували на обстеженні та лікуванні у відділенні торакальної хірургії комунальної установи «Міська клінічна лікарня екстреної та швидкої медичної допомоги м. Запоріжжя» у період з 2013 по 2017 рік. Критерії включення: ЕП 1-ї чи 2-ї стадії за класифікацією EACTS [7]; вік хворих — 18 та більше років; наявність інформованої згоди пацієнта на участь у дослідженні; пара- чи метапневмонічний генез ЕП. Критерії виключення: виявлення специфічного характеру емпієми плеври; діагностика хронічної емпієми плеври (3-тя стадія за EACTS); наявність супутньої онкологічної патології поза станом ремісії; ВІЛ або СНІД; наявність бронхіальної нориці; переривання курсу лікування; наявність попередніх операцій на органах плевральної порожнини, окрім торакоцентезу з приводу даного випадку ЕП; травма грудної клітки в анамнезі, що могла стати причиною ЕП; відсутність продуктивного контакту з хворим на період обстеження.
За гендерним складом переважали чоловіки — 92 (74,2 %), що є характерним для запальних захворювань органів дихання та узгоджується з даними інших вчених [8]. Медіана віку хворих становила 50,3 (38; 61) року. Переважна більшість — це особи працездатного віку (89 — 71,8 %). Лівобічна ЕП зустрічалась у 64 (51,6 %) випадках Зважаючи на загальновідому роль паління як фактора, що провокує розвиток захворювань органів дихання, проведено аналіз поширення цієї звички серед досліджуваних осіб: палили 77 (62,1 %) хворих, в основному чоловіки — 75 (60,5 %).
Коморбідне навантаження відмічалося в 60 (48,4 %) хворих: у 32 (25,8 %) випадках діагностовано одне супутнє захворювання, у 17 (13,7 %) — два, у 10 (8,1 %) — три. Його якісний склад наданий у табл. 1.
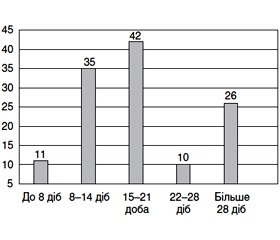
Тривалість захворювання від появи перших клінічних проявів до госпіталізації у відділення грудної хірургії дорівнювала 19 (13; 24) діб. З наданих на рис. 1 даних видно, що переважна більшість пацієнтів надходила до відділення на другому — 35 (28 %), третьому — 42 (34 %) чи пізніше четвертого тижня захворювання — 26 (21 %).
Значна частка пацієнтів отримувала попереднє лікування — 105 (84,7 %). Більшість хворих направлені зі стаціонарів терапевтичного (59; 47,6 %) та пульмонологічного профілю (27; 21,8 %), а медіана тривалості захворювання в цих випадках становила 20 (14; 30) та 16 (13; 21) діб відповідно (р = 0,14). Це свідчить про те, що навіть обстеження в умовах спеціалізованого пульмонологічного відділення не прискорювало діагностику ЕП.
Хворі підлягали стандартному клінічному, лабораторному та інструментальному дослідженню. Комплекс бактеріологічних досліджень проводився згідно з існуючими методичними рекомендаціями шляхом посіву плеврального вмісту на кров’яний, шоколадний та жовтково-сольовий агар, тіогліколеве середовище, середовище Сабуро та Ендо з подальшою інкубацією в термостаті при температурі 37 °С упродовж 24–72 годин. У разі позитивного росту збудник підлягав подальшій ідентифікації. Стандартну дискдифузійну методику використовували для визначення чутливості мікроорганізмів до антибактеріальних препаратів. Матеріал для дослідження отримували шляхом плевральної пункції та аспірації в стерильний сухий шприц, за наявності плеврального дренажу — шляхом одержання змивів із плевральної порожнини стерильним фізіологічним розчином або безпосередньо під час оперативного втручання з використанням стерильного ватного тампона.
Статистичний аналіз проведено з використанням пакета вільного програмного забезпечення PSPP 42.2.3 (GNUProject). У разі розподілення відмінного від нормального дані подано у вигляді медіани (верхньої та нижньої квартилі). Оцінку вірогідності розподілення якісних бінарних ознак проведено із застосуванням критерію хі-квадрат. Рівень статистичної значущості — p < 0,05.
Робота виконана відповідно до наявних клінічних протоколів із дотриманням етичних і законодавчих норм та ухвалена локальною етичною комісією.
Результати
При мікробіологічному дослідженні плеврального ексудату позитивний результат отримано в 34 (27,4 %) випадках. Оцінюючи ці дані, необхідно зазначити, що 101 (81,5 %) хворий отримував попередню антибактеріальну терапію. Серед пацієнтів, які отримали попереднє лікування, у 62 (61,4 %) випадках отримували багатокомпонентну антибактеріальну терапію: у 27 (26,7 %) — з двох, у 21 (20,8 %) — з трьох, у 11 (10,9 %) — з чотирьох, у 2 (2,0 %) — з п’яти та в 1 (1,0 %) — з шести антибактеріальних препаратів, що призначались одночасно чи послідовно. Вісімнадцять пацієнтів (17,8 %) отримували один антибактеріальний препарат, а у 21 (20,8 %) відсутні дані в медичній документації про компоненти антибактеріальної терапії та їх кількість. Спектр антибіотиків (за групами) надано в табл. 2.
/110-1.jpg)
Серед пацієнтів із позитивним результатом мікробіологічних досліджень у переважній більшості виділено монокультуру — 32 (94,1 %). У 2 (5,8 %) випадках ідентифіковано мікробні асоціації: в одному випадку спостерігали асоціацію з двох мікроорганізмів (Pseudomonas aeruginosa та Morganella morganii), а в іншому — із трьох (Escherichia coli, Enterobacter agglomerans та Streptococcus pneumoniae).
Грамнегативні та грампозитивні мікроорганізми зустрічались однаково часто: 19 (51,4 %) та 18 (48,6 %) ізолятів відповідно. Аналогічна тенденція зберігалась й в підгрупах пацієнтів незалежно від проведеного раніше лікування: грампозитивні організми виявлялись у 46,2 % нелікованих пацієнтів та в 50 % тих, хто отримував антибактеріальну терапію. Детальніше мікробіологічна структура збудників ЕП подана в табл. 3.
Ефективність антибактеріальних препаратів та чутливість до них вищезазначених штамів подані в табл. 4.
Обговорення
Порівняно мала частка позитивних результатів мікробіологічного дослідження (34; 27,4 %) узгоджується з даними більшості авторів, які вказують, що традиційні культуральні дослідження виявляли патоген у 15,8–58 % випадків [4, 5, 9, 10]. Немає сумнівів, що факт попередньої антибактеріальної терапії, що відмічався в 101 (81,5 %) випадку, погіршує вказаний результат [10]. Так, серед пацієнтів, які раніше не отримували лікування, цей показник був істотно вищий — 12 (52,2 %) vs 22 (21,8 %), p < 0,01.
Як зазначено раніше, переважна кількість пацієнтів надійшли з пульмонологічних та терапевтичних відділень, куди були госпіталізовані з діагнозом «пневмонія». Згідно з чинними настановами стаціонарне лікування у відділеннях терапевтичного профілю призначається хворим на пневмонію 3-ї категорії. Антибактеріальна терапія в цієї групи пацієнтів має полягати в призначенні захищених амінопеніцилінів чи цефалоспоринів 2–3-го покоління в комбінації з макролідом. Як антибіотик резерву пропонуються фторхінолони 3–4-го покоління або карбапенеми у вигляді монотерапії.
Водночас, аналізуючи характер антибактеріальної терапії, що проводили, неможливо не відмітити преважне призначення цефалоспоринів (58; 29,7 %). При цьому застосування макролідів (26; 13,3 %) не відповідало кількості ані цефалоспоринів, ані пеніцилінів (17; 8,7 %), комбінація яких є терапією вибору, як згадано вище. Також звертає на себе увагу широке призначення фторхінолонів (55; 28,2 %), які позиціонуються як антибіотики резерву.
Згідно з результатами мікробіологічного дослідження плеврального ексудату частіше за інші виявлялись п’ять збудників: Ps. aeruginosa, St. epidermidis, St. aureus, Str. pneumoniae, Str. mitis, що сумарно становили 59,4 % ізолятів, а отже, й більше їх клінічне значення.
У табл. 5 наведена питома вага виділених ізолятів, що виявились чутливими до перерахованих антибактеріальних препаратів.
З огляду на ці дані, загальну чутливість до антибіотиків (табл. 5), а також характер антибактеріальної терапії, що отримували хворі на попередніх етапах лікування, розроблено стратегію раціональної емпіричної антибактеріальної терапії у хворих на ЕП. Доцільним є призначення двокомпонентної антибактеріальної терапії, що поєднує як антибіо–тик широкого спектра дії, що ефективно впливає на грамнегативні та грампозитивні збудники, так і антианаеробний препарат (похідні імідазолу: метронідазол, орнідазол). Призначення останньої групи препаратів доцільне з кількох причин. По-перше, незважаючи на незначну частку облігатних анаеробів серед ідентифікованих мікрооргнанізмів (2,7 %), більшість авторів, які досліджували спектр збудників ЕП із застосуванням спеціальних методів, вказує на значну роль цих організмів у розвитку даної нозології (20–75 %). По-друге, на попередніх етапах лікування похідні імідазолу назначались лише в 4,1 % випадків. Це характеризує низьку поширеність цих препаратів серед пацієнтів пульмонологічного профілю. Це, зі свого боку, дозволяє очікувати низьку резистентність анаеробів до цієї групи антибіотиків. До того ж відсутність антианаеробних препаратів на попередніх етапах лікування, можливо, сприяла прогресуванню запального процесу та розвитку ЕП як ускладнення пневмонії.
/112-1.jpg)
Другий препарат для стартової емпіричної терапії має відповідати ряду вимог. Насамперед він має бути ефективним щодо більшості поширених збудників ЕП, чинити бактерицидну дію, мати парентеральні форми та не впливати на мікобактерію туберкульозу. Останній факт особливо актуальний у пульмонологічних хворих через поширення туберкульозу органів дихання в Україні.
Згідно з результатами проведених досліджень цефоперазон у поєднанні з сульбактамом найкраще підходить як другий компонент стартової емпіричної терапії. Цей бактерицидний антибактеріальний препарат належить до цефалоспоринів 3-го покоління та має широкий спектр дії. Він ефективний у 60 % збудників, що виділено у хворих на ЕП. Значна резистентність до цього антибіотика характерна лише для Ps. aeruginosa, що виявлявся у 18,9 % випадків. Він не впливає на мікобактерію туберкульозу.
Як альтернативний антибактеріальний препарат для стартової терапії доцільне використання гатифлоксацину — респіраторного фторхінолону 4-го покоління. Він також чинить бактерицидну дію та доступний як у парентеральних так і в ентеральних формах. До гатифлоксацину чутливі 75 % штамів, що виділені в дослідженні. Із вагомих недоліків необхідно відмітити чутливість мікобактерії туберкульозу до гатифлоксацину. Його застосування може утруднити клінічну діагностику та виділення кислотостійких бактерій, сприяти розвитку антибіотикорезистентності в палички Коха. Саме цей факт не дозволяє використовувати цей антибіотик як препарат першої лінії.
У разі неефективності антибактеріальної терапії очевидно, що збудником є мікроорганізм із широким спектром резистентності до антибіотиків. У цьому разі висока вірогідність виявлення Ps. аeruginosa, резистентної до більшості антибактеріальних препаратів. Цей мікроорганізм виявився найбільш чутливим до гентаміцину та тобраміцину (71 % випадків). Тому як антибіотики резерву доцільно використовувати один із наведених препаратів.
Серед особливостей застосування необхідно відмітити, що гентаміцин та тобраміцин є ото- та нефротоксичними та, як і всі аміноглікозидні препарати, здатні впливати на мікобактерію туберкульозу. Однак вони мають бактерицидну дію на більшість грамнегативних мікроорганізмів та стафілококи, тобто мікроорганізми з найбільш широким спектром антибіотикорезистентності. Окрім того, ця група препаратів не поширена серед пульмонологічних хворих (лише в 7,2 % випадків), а цей факт, зі свого боку, сприяє збереженню чутливості цільових мікроорганізмів, що важливо для антибіотиків резерву.
Висновки
Культуральне мікробіологічне дослідження плеврального ексудату при ЕП характеризується значною кількістю негативних результатів (72,6 %). Серед «причинної» мікрофлори можливо виділити 5 основних збудників: Ps. aeruginosa, St. epidermidis, St. aureus, Str. pneumoniae, Str. mitis, що сумарно становили 59,4 % ізолятів. Емпірична антибактеріальна терапія першої лінії має складатись із комбінації похідних імідазолу (метронідазол, орнідазол) та цефоперазону із сульбактамом. Як препарат другої лінії доцільне використання гатифлоксацину, а антибіотик резерву — гентаміцин чи тобраміцин.
Конфлікт інтересів. Автор заявляє про відсутність конфлікту інтересів при підготовці даної статті.
Інформація про фінансування: всі витрати за кошт автора.
Подяки. Автор висловлює подяку завідуючому кафедрою медицини катастроф, військової медицини, анестезіології та інтенсивної терапії Запорізького державного медичного університету доктору медичних наук, професору Перцову Володимиру Івановичу та кандидату медичних наук, доценту Тєлушко Ярославу Володимировичу.
Інформація про внесок кожного автора. Автор дякує В.І. Перцову та Я.В. Тєлушко за рецензування статті.

/109-1.jpg)
/109-2.jpg)
/110-1.jpg)
/111-1.jpg)
/112-1.jpg)