Вступ
У багатьох пацієнтів хірургічних стаціонарів у період від передопераційного огляду до виписки на післяопераційну реабілітацію можуть виникати певні особливості перебігу захворювання та ускладнення. Деякі з них мають маніфестний характер і яскраву клініку (больовий синдром, ранова інфекція, лихоманка тощо). Але є й такі процеси, що розвиваються поступово, приховано, проте можуть призводити до тяжких наслідків і навіть погіршувати загальні результати лікування. До таких порушень слід віднести насамперед порушення водно-електролітного балансу. Причиною цих порушень є як сама хірургічна патологія (наприклад, перитоніт, кишкова непрохідність, пілородуоденальний стеноз), так і наявна у хворого супутня патологія (декомпенсований цукровий діабет, серцева недостатність тощо) [2].
Одним із прихованих порушень водно-електролітного обміну є гіпофосфатемія (ГФЕ), що часто розвивається непомітно для хворого і лікаря, маскується за клінічною картиною основного захворювання, проте несе приховану небезпеку розвитку тяжких ускладнень. У той же час залишаються точно не встановленими частота виникнення ГФЕ у хворих у періопераційному періоді, обсяги та способи її корекції, ефективність та безпечність такої терапії.
Для того щоб спробувати дати відповідь на поставлені питання, було проведено дослідження бази даних Medline з метою ідентифікування статей, які містили б як одне з ключових слово «гіпофосфатемія». За останні 20 років (з 1 серпня 1998 р. по 1 серпня 2018 р.) цей пошук дав 3244 статті. До пошуку включили клінічні та експериментальні дослідження, огляди та повідомлення про клінічні випадки за умови наявності англомовного резюме. При обмеженні вибірки зазначеними умовами були отримані посилання на 1754 публікації. Усі статті були проаналізовані на предмет ставлення до хворих у періопераційному періоді. Ці публікації були досліджені особливо детально. Натомість статті про хронічну гіпофосфатемію (наприклад, внаслідок спадкових гіпофосфатемічних синдромів) були виключені.
На основі вивчених статей нами були підсумовані відомості про метаболізм фосфатів та методи лікування порушень обміну цих іонів, які викладені нижче в наведеному матеріалі.
Метаболізм фосфату та причини гіпофосфатемії у хворих у періопераційному періоді
Фосфор є суттєво важливим елементом для всіх живих клітин із різноманітними функціями (табл. 1) [12].
Баланс фосфату є наслідком комплексної взаємодії між надходженням та видаленням фосфату. Нормальні рівні сироваткового фосфату — від 0,80 до 1,45 ммоль/л (2,5–4,5 мг/дл). Близько 300 мг фосфатів надходять та втрачаються з кісток щодня. Надмірна втрата або порушення надходження фосфатів у кістки супроводжується остеомаляцією. Метаболізм фосфору в кістках детермінується багатьма факторами (паратгормоном, вітаміном D, статевими гормонами, кислотно-основним станом, запальним процесом) [16]. Особливості фосфорного гомео–стазу наведені на рис. 1.
Гіпофосфатемія
Незважаючи на важливість функцій сполук фосфору в організмі, рутинного визначення вмісту цього мікроелемента в періопераційному періоді в сироватці крові не проводять. Саме тому ГФЕ, що інтраопераційно виникає з частотою від 44,8 до 63 % [24], часто залишається незафіксованою. Оскільки фосфати є своєрідним субстратом для АТФ-залежних метаболічних процесів, гіпофосфатемія в періопераційному періоді є суттєвим фактором, що впливає на результат хірургічного втручання. «Пропущене» інтраопераційне зниження вмісту фосфору, особливо під час великих кардіохірургічних та абдомінальних втручань, може спричинити ускладнення в післяопераційному періоді [24].
Гіпофосфатемією називають зменшення вмісту фосфору в сироватці крові нижче звичайного рівня (менше 2,5 мг/дл або 0,8 ммоль/л для дорослих) [17]. У нормі рівень фосфору в плазмі крові становить 0,80–1,45 ммоль/л. Залежно від рівня фосфатів у плазмі крові розрізняють легку (0,65–0,80 ммоль/л), помірну (0,32–0,65 ммоль/л) та тяжку (< 0,32 ммоль/л) гіпофосфатемію [1]. Частота ГФЕ в загальній популяції госпіталізованих пацієнтів становить 0,2–2,2 %, проте в певних когортах хворих може траплятися більше ніж у 21,5 % випадків [12]. ГФЕ іноді виникає за відсутності дефіциту фосфору в клітинах, але її розвиток, як правило, асоціюють з істинним виснаженням запасів фосфору в організмі.
Гіпофосфатемія може виникати внаслідок трьох механізмів [3, 12]:
— зниженого поглинання (всмоктування) в кишечнику,
— збільшеної ниркової екскреції,
— внутрішнього перерозподілу неорганічного фосфату.
Зменшення інтенстинального поглинання фосфату рідко викликає гіпофосфатемію. Так само й низькофосфатна дієта, що підвищує ниркову реабсорбцію та підвищує інтенстинальне всмоктування фосфату.
Перерозподіл через мембрану клітини — найбільш загальна причина ГФЕ у періопераційному періоді, що може бути викликана численними клінічними станами [6, 12]:
— індуковане респіраторним алкалозом збільшення внутрішньоклітинного pH призводить до активізації гліколізу, що потребує входження в клітину глюкози і фосфату [25];
— призначення глюкози та інсуліну також стимулює метаболізм вуглеводів, у результаті чого фосфат переміщується в клітини разом із глюкозою;
— високі сироваткові рівні катехоламінів, таких як епінефрин та норепінефрин (незалежно, чи ендогенного, чи екзогенного походження), викликають зниження рівня фосфату сироватки [15];
— поглинання фосфату клітинами підвищується за певних специфічних умов, наприклад при синдромі голодної кістки, та в разі хвороб зі швидкою проліферацією клітин, наприклад при гострій лейкемії;
— ниркове виділення фосфату підвищується при метаболічному ацидозі та застосуванні багатьох ліків, таких як сечогінні, глюкокортикоїди [22], аміноглікозиди, антиретровірусні засоби та протиракові ліки.
Причинами ГФЕ в післяопераційному періоді можуть бути численні перелічені фактори та їх комбінації [29]. Це особливо стосується великої хірургії, наприклад кардіохірургії чи хірургії черевної аорти. Роль екстракорпорального кровообігу не з’ясована.
Залежність між рівнем сполук фосфору в крові та частотою розвитку кардіопульмональних ускладнень після хірургічних втручань на печінці була виявлена ще наприкінці XX століття [1, 13]. Автори опублікованого у 2014 році у США аналізу 749 випадків гепатектомії (major hepatectomy) зазначають, що підвищення рівня фосфору > 2,4 мг/дл на 2-гу добу після операції та зниження до критичного рівня на 3-тю добу вірогідно пов’язані з розвитком печінкової недостатності [18].
Важливе значення підтримці нормального вмісту фосфору надають протоколи ERAS із гепатобіліарної хірургії. У 2017 році Susanne G. Warner та співавтори, провівши огляд літературних джерел та самостійно проаналізувавши 125 клінічних випадків резекції печінки різної складності та часткової гепатектомії, запропонували як маркер подальшого одужання використовувати періопераційну концентрацію фосфатів у крові [33]. В іншому дослідженні виділено кілька критичних періодів щодо розвитку гіпофосфатемії: 2-га та 44-та години після операції, а також період між 36-ю та 72-ю годинами [20].
У разі резекції печінки ГФЕ < 1,5 мг/дл асоційована зі збільшенням частоти інфекційних ускладнень [33]. Якщо вміст фосфатів нижчий 1,0 мг/дл, ризик кардіопульмональних ускладнень, кровотечі та печінкової недостатності в післяопераційному періоді суттєво вищий [13].
Цікавим є опубліковане нещодавно ретроспективне обсерваційне ревю 8 випадків гіперглікемії, резистентної до інсулінотерапії, у хворих після кардіохірургічних операцій із застосуванням апарату штучного крововообігу. Гіперглікемію вдалося ліквідувати корекцією ГФЕ. Усім пацієнтам проводилася швидка інфузія інсуліну з метою корекції гіперглікемії, під час чого зафіксовано ГФЕ [11]. Автори рекомендують визначати рівень фосфатів у крові в ранньому післяопераційному періоді при кардіохірургічних втручаннях [11].
Важливим аспектом у передопераційній підготовці пацієнтів є корекція анемії. Однією з порівняно нових методик, що набуває все більшої популярності, є застосування внутрішньовенних та пероральних препаратів заліза (Patient’s Blood Management протоколи). У нещодавно опублікованих дослідженнях автори звертають увагу на досить нетипове ускладнення терапії препаратами заліза — гіпофосфатемію, від легкої асимптоматичної до тяжкої [21, 35]. Розвиток гіпофосфатемії пов’язують зі зростанням рівня у крові фактора росту фібробластів 23 (FGF-23). Найвищий ризик розвитку такого ускладнення виникає при прийомі препаратів заліза (залізної карбоксимальтози, полімальтози заліза та сахаризованого оксиду заліза) [35].
Гіпофосфатемія виникає в значної кількості пацієнтів, які перенесли трансплантацію нирки (50–80 %), майже одразу після трансплантації [31]. У багатьох пацієнтів цей стан спостерігається протягом усього періоду функціонування трансплан–тата і вірогідно зумовлений уже згаданим FGF23 (посилює фосфатурію, знижуючи синтез кальцитріолу, та накопичується у разі хронічної хвороби нирок) [4]. Зниження рівня фосфатів у крові спостерігається на 3–4-му тижні після операції, особливо в пацієнтів із гострим відторгненням трансплантата та в разі високого доопераційного рівня паратгормона [32]. Причиною такого зниження вмісту фосфору в посттрансплантаційному періоді є посилене його виведення із сечею.
Гостра тяжка гіпофосфатемія часто виникає у хворих на хронічний алкоголізм, але також описана в пацієнтів, які страждають від порушення харчування (анорексія, булімія тощо), і пацієнтів, які перебувають на парентеральному харчуванні в післяопераційному періоді [23].
Повідомлялося, що гіпофосфатемія часто виникає в травмованих пацієнтів [9]. Нирковий метаболізм фосфату змінений у травмованих пацієнтів, що призводить до неадекватно збільшеної екскреції фосфату. Гіпофосфатемія також зустрічається в постраждалих від опіків, у яких фосфат втрачається через шкіру [5, 10]. У пацієнтів із черепно-мозковою травмою індукція поліурезу може бути посилюючим фактором [26].
У пацієнтів із недоїданням (мальнутрицією) так званий refeeding-синдром може виникати тоді, коли вони отримують парентеральне харчування. Синдром характеризується численними метаболічними аномаліями, включаючи виснаження загальних запасів фосфору організму та перерозподіл фосфатів в інтрацелюлярний простір, що може закінчитися тяжкою гіпофосфатемією [19].
Симптоми гіпофосфатемії
Рівні фосфату сироватки точно не відображують загальні запаси фосфора організму; отже, ступінь гіпофосфатемії не завжди корелює з наявними симптомами. Хоча в більшості пацієнтів із гіпофосфатемією симптоми не розвиваються, фатальні ускладнення в літературі описані. Загальний механізм ускладнень, викликаних гіпофосфатемією, полягає в порушенні енергетичного метаболізму, що призводить до кліткової дисфункції в мультиорганних системах. Симптоми підсумовані в табл. 2.
/44-1.jpg)
Тяжка ГФЕ може спричиняти рабдоміоліз, що пов’язано з різким підвищенням вмісту креатинфосфокінази та лактатдегідрогенази в організмі. Цей клінічний синдром (м’язова слабість, міалгія, міоглобінурія) найчастіше описаний у хворих із хронічним алкоголізмом, проте зустрічаються випадки рабдоміолізу й серед інших категорій пацієнтів. Наприклад, у 2015 році описано випадок рабдоміолізу в 10-річної дівчинки, хворої на цукровий діабет 1-го типу, госпіталізованої з приводу діабетичного кетоацидозу. Концентрація фосфатів у плазмі крові становила 0,256 ммоль/л [27].
Респіраторні ефекти
ГФЕ асоціюється з дисфункцією дихальних м’язів, що може призвести до (гострого) ушкодження легень та невдач при відлученні від респіратора [27]. Вважається, що механізм цих явищ пов’язаний зі зменшенням доступності фосфат-вміщуючих енергетичних джерел. Зниження вмісту 2,3-дифосфогліцерату (2,3-ДФГ) зміщує криву дисоціації оксигемоглобіну вліво та зменшує доставку кисню до периферичних тканин. Це могло б бути особливо важливим для пацієнтів із хронічними захворюваннями легень, тому що ці пацієнти можуть мати більш високі рівні 2,3-ДФГ, які компенсують гіпоксемію. Крім того, ГФЕ також асоціюється зі зниженням оксигенації тканин після корекції рівня 2,3-ДФГ [7].
Кардіоваскулярні ефекти
ГФЕ може призводити до міокардіальної дисфункції та аритмій. За наявності тяжкої гіпофосфатемії описані випадки тяжкої гострої серцевої недостатності. ГФЕ, що виникала після кардіохірургічних операцій, асоціювалася з більш високою потребою в інотропній підтримці [8]. При корекції ГФЕ відбувалося покращання (збільшення) хвилинного об’єму серця (серцевого викиду) [34]. ГФЕ — значимий предиктор шлуночкової аритмії та інших аритмій у пацієнтів із сепсисом [28].
Гіпофосфатемія та летальність
Численні дослідження показують взаємозв’язок між гіпофосфатемією та підвищеною летальністю [8, 14, 30, 34]. Тяжка ГФЕ є предиктором дуже значного (до 8-разового) підвищення летальності в пацієнтів із сепсисом [30]. Однак ГФЕ не асоціюється з підвищеною летальністю після кардіохірургічних операцій [8]. Залишається неясним, чи ГФЕ дійсно незалежно сприяє збільшенню летальності, чи це просто маркер тяжкості захворювання. Питання, чи корекція ГФЕ зменшує летальність пацієнтів, залишається на сьогодні не з’ясованим.
Корекція гіпофосфатемії
У зв’язку із значним поширенням гіпофосфатемії у хворих, які підлягають хірургічному лікуванню, рекомендована часта лабораторна перевірка, особливо в згаданих групах високого ризику. Зазвичай рекомендують коригувати гіпофосфатемію в гіпофосфатемічних пацієнтів за наявності специфічної симптоматики [3]. Однак жодне рандомізоване контрольоване дослідження не вказує на те, що незалежна корекція гіпофосфатемії в безсимптомних пацієнтів покращує наслідки лікування.
Корекція гіпофосфатемії можлива пероральним та внутрішньовенним шляхами. Відповідно, необхідно знати:
— коли показана внутрішньовенна терапія фосфатом,
— скільки потрібно вводити фосфату,
— як швидко фосфат повинен бути введений.
Внутрішньовенна терапія зазвичай рекомендована при симптомній гіпофосфатемії та рівні фосфату < 0,82 ммоль/л.
Помірна гіпофосфатемія може лікуватися пероральним призначенням фосфату. Пацієнти, які отримують харчування після періоду голодування, часто мають дефіцит фосфату, такий додатковий фосфат повинен бути доданий до харчових продуктів. Додаткова профілактична стратегія полягає в поступовому нарощуванні калоричного навантаження [19]. Загальна потреба у фосфаті не може бути спрогнозована за рівнем фосфату сироватки через те, що фосфат пересувається між численними компартментами організму.
Слід зазначити, що через поточний брак доказів сироватковий рівень фосфату рутинно не вимірюється в пацієнтів у періопераційному періоді.
Аналіз власного досвіду
У КЗ КОР «Київська обласна клінічна лікарня» у 2013 році було запроваджено визначення показників рівня фосфатів у пацієнтів відділення інтенсивної терапії загального профілю. Для виявлення та підтвердження ГФЕ хворим проводили комплекс досліджень. Зокрема, крім рівня фосфатів у сироватці крові, визначали рівні магнію, кальцію та калію в сироватці крові. Це пов’язано з такими аргументами:
— гіпомагніємія часто пов’язана з переміщенням фосфатів у клітини;
— гіперкальціємія характерна для первинного гіперпаратиреозу;
— при певній етіології гіпофосфатемії, такій як алкоголізм та діабетичний кетоацидоз, можливі зміни рівня калію.
У деяких пацієнтів для виключення найчастіших факторів гіпофосфатемії (наприклад, сепсису, печінкової енцефалопатії) проводили відповідні дослідження, включаючи розгорнутий загальний аналіз крові, визначення вмісту лактату та аміаку в сироватці крові. За підозри на наявність дихального алкалозу як етіології ГФЕ визначали склад газів артеріальної крові.
Загалом визначення рівнів фосфатів проведено у 328 хворих, які перенесли хірургічні вручання в операційних різного хірургічного профілю. Розподіл хворих за профілем оперативних втручань і частотою виявлення гіпофосфатемії поданий у табл. 3.
Як видно з табл. 3, ГФЕ в середньому виявлялася в 14,33 % хворих, обстежених на рівень фосфатемії. При цьому більш висока частота ГФЕ спостерігалася в опікових хворих (23,08 %), після нейрохірургічних (17,94 %) та абдомінальних (17,64 %) оперативних втручань. Натомість, більш рідко ГФЕ зустрічалася після проктологічних, торакальних та урологічних операцій (близько 7 % хворих).
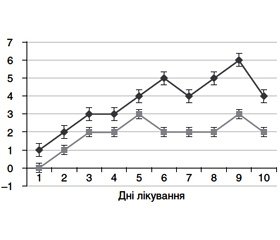
При аналізі таблиці видно також, що ГФЕ відносно рідко виявлялася в передопераційному періоді — лише в 3,05 % хворих. Тоді як у післяопераційному періоді частота ГФЕ становила вже 11,28 % (р < 0,01; χ2). Крім того, виявилося, що частота виявлення ГФЕ (у тому числі і ГФЕ тяжкого ступеня) зростає протягом перебування хворого в лікарні (рис. 2).
Як видно з наведеного графіку, кількість хворих із вперше виявленою ГФЕ поступово зростала до 8–9-го дня перебування в стаціонарі.
Для корекції виявленої гіпофосфатемії усім хворим із рівнем неорганічного фосфору плазми нижче 0,6 ммоль/л проводилося в/в введення препаратів фосфору. У пацієнтів наведених груп використовували внутрішньовенний препарат D-фруктозо-1,6-дифосфату натрію — Езафосфіну® («Біомедика Фоскама Груп С.П.А.», Італія), яка містить 100 мг/мл D-фруктозо-1,6-дифосфат натрію, що еквівалентно 75 мг/мл D-фруктозо-1,6-дифосфорної кислоти (приблизно 0,47 мг-екв/мл фосфору). Вибір коригуючого препарату базувався на тому, що в Україні інші препарати фосфатів для внутрішньовенного введення (натрію або калію фосфат) для клінічного використання не доступні.
Залежно від тяжкості ГФЕ добова доза коливалася в межах від 70 до 120 мг/кг діючої речовини, що в середньому становило 5–9 г (1–2 флакони Езафосфіни) на добу. У наших пацієнтів курс лікування тривав 1–2 доби. Потреби в повторному в/в введенні Езафосфіни не виникало.
Коли рівень фосфору плазми перевищував 0,75 ммоль/л, корекцію продовжували пероральними препаратами фосфору в добовій дозі 1200–1500 мг/добу. Необхідно пам’ятати, що на фоні прийому пероральних препаратів фосфору можливий розвиток діареї, що ускладнює корекцію. Тому в деяких випадках можна замість пероральної підтримуючої дози вводити по 500 мг в/в у вигляді інфузії.
Після початку введення фосфатів їх рівень у крові стабілізувався і швидко повертався до референтних значень, що збіглося з клінічним покращанням стану хворих. Усі хворі добре перенесли корекцію ГФЕ препаратом Езафосфіна. Жодного випадку припинення лікування через побічні ефекти від застосування зазначеного препарату не було зареєстровано.
Висновки
1. Частота виявлення гіпофосфатемії у хворих в періопераційному періоді становить 14,33 %, а в окремих когортах хворих може перевищувати рівень у 20 % випадків.
2. Найбільш висока частота ГФЕ спостерігалася в опікових хворих (23,08 %), після нейрохірургічних (17,94 %) та абдомінальних (17,64 %) оперативних втручань.
3. Протягом перебування в лікарні частота виявлення ГФЕ зростає, тому при одноразовому визначенні вмісту фосфатів часто недооцінюється можливість розвитку гіпофосфатемії.
4. Корекцію гіпофосфатемії тяжкого ступеня доцільно проводити внутрішньовенним введенням препарату D-фруктозо-1,6-дифосфату натрію — Езафосфіни («Біомедика Фоскама Груп С.П.А.», Італія). Після проведеної внутрішньовенної корекції цим препаратом рівень фосфатемії стабілізувався до референтних значень, що збіглося з клінічним покращанням стану пацієнтів. Хворі загалом добре перенесли терапію Езафосфіною, у жодного не було зареєстровано побічних ефектів.
Конфлікт інтересів. Не заявлений.
Список литературы
1. Галушко О.А. Гіпофосфатемія у пацієнтів відділень інтенсивної терапії: огляд літератури і власний досвід / Зб. наук. праць співробітників НМАПО імені П.Л. Шупика. — 2014. — Вип. 23, кн. 2. — С. 602-613.
2. Шлапак И.П., Галушко А.А. Периоперационная инфузионная терапия // Медицина неотложных состояний. — 2015. — № 1(64). — С. 91-96.
3. Amanzadeh J., Reilly R.F. Jr. Hypophosphatemia: an evi–dence-based approach to its clinical consequences and management // Nat. Clin. Pract. Nephrol. — 2006. — 2. — Р. 136-148.
4. Baia L.C., Heilberg I.P., Navis G., de Borst M.H. NIGRAM investigators. Phosphate and FGF-23 homeostasis after kidney transplantation // Nat. Rev. Nephrol. — 2015 Nov. — 11(11). — Р. 656-66.
5. Berger M.M., Rothen C., Cavadini C., Chiolero R.L. Exudative mineral losses after serious burns: a clue to the alterations of magnesium and phosphate metabolism // Am. J. Clin. Nutr. — 1997. — 65. — Р. 1473-1481.
6. Bugg N.C., Jones J.A. Hypophosphataemia: pathophysio–logy, effects and management on the intensive care unit // Anaesthesia. — 1998. — 53. — Р. 895-902.
7. Clerbaux T., Detry B., Reynaert M., Kreuzer F., Frans A. Reestimation of the effects of inorganic phosphates on the equilibrium between oxygen and hemoglobin // Intensive Care Med. — 1992. — 18. — Р. 222-225.
8. Cohen J., Kogan A., Sahar G., Lev S., Vidne B., Singer P. Hypophosphatemia following open heart surgery: incidence and consequences // Eur. J. Cardiothorac. Surg. — 2004. — 26. — Р. 306-310.
9. Daily W.H., Tonnesen A.S., Allen S.J. Hypophosphatemia: incidence, etiology, and prevention in the trauma patient // Crit. Care Med. — 1990. — 18. — Р. 1210-1214.
10. Dickerson R.N., Gervasio J.M., Sherman J.J., Kudsk K.A., Hickerson W.L., Brown R.O. A comparison of renal phosphorus regulation in thermally injured and multiple trauma patients receiving specialized nutrition support // JPEN J. Pa–renter. Enteral. Nutr. — 2001. — 25. — Р. 152-159.
11. Garazi Е., Bridge S., Caffarelli А. et al. Acute Cellular Insulin Resistance and Hyperglycemia Associated with Hypophosphatemia After Cardiac Surgery // A&A Case Reports. — 2015. — 4. — Р. 22-25.
12. Gaasbeek A., Meinders A.E. Hypophosphatemia: an update on its etiology and treatment // Am. J. Med. — 2005 Oct. — 118(10). — Р. 1094-101.
13. George R., Shiu M.H. Hypophosphatemia after major hepatic resection // Surgery. — 1992. — 111(3). — Р. 281-286.
14. Hoffmann M., Zemlin A.E., Meyer W.P., Erasmus R.T. Hypophosphataemia at a large academic hospital in South Africa // J. Clin. Pathol. — 2008. — 61. — Р. 1104-1107.
15. Kjeldsen S.E., Moan A., Petrin J., Weder A.B., Julius S. Effects of increased arterial epinephrine on insulin, glucose and phosphate // Blood Press. — 1996. — 5. — Р. 27-31.
16. Lederer E. Hyperphosphatemia / E. Lederer, V. Batuman. —2017. — Режим доступу до ресурсу: https://emedicine.medscape.com/article/241185-overview.
17. Lederer E. Hypophosphatemia / E. Lederer, R. Ouseph. — 2018. — Режим доступу до ресурсу: https://emedicine.medscape.com/article/242280-overview.
18. Malcolm Squires M.H. 3rd, Dann G.C., Lad N.L. et al. Hypophosphataemia after major hepatectomy and the risk of post-operative hepatic insufficiency and mortality: an analysis of 719 patients // HPB (Oxford). — 2014 Oct. — 16(10). — Р. 884-91. doi: 10.1111/hpb.12276.
19. Marinella M.A. Refeeding syndrome and hypophosphatemia // J. Intensive Care Med. — 2005. — 20. — Р. 155-159.
20. Morrison B., Kelliher L., Jones C. Enhanced reco–very for liver resection-early recovery pathway for hepatectomy: data-driven liver resection care and recovery // HepatoBi–liary Surg. Nutr. — 2018. — 7(3). — Р. 217-220. doi: 10.21037/ hbsn.2018.03.13.
21. Muñoz M., Gómez-Ramírez S., Besser M. et al. Current misconceptions in diagnosis and management of iron deficiency // Blood Transfus. — 2017. — 15. — Р. 422-37. doi: 10.2450/2017.0113-17.
22. Murer H., Hernando N., Forster I., Biber J. Proximal tubular phosphate reabsorption: molecular mechanisms // Physiol. Rev. — 2000. — 80. — Р. 1373-1409.
23. O’Connor G., Nicholls D. Refeeding hypophosphatemia in adolescents with anorexia nervosa: a systematic review // Nutr. Clin. Pract. — 2013 Jun. — 28(3). — Р. 358-64.
24. Pagel J.I., Hulde N., Kammerer T. et al. The impact of phosphate-balanced crystalloid infusion on acid-base homeostasis (PALANCE study): study protocol for a randomized controlled trial // Trials. — 2017, Jul 10. — 18(1). — Р. 313. doi: 10.1186/s13063-017-2051-z.
25. Paleologos M., Stone E., Braude S. Persistent, progressive hypophosphataemia after voluntary hyperventilation // Clin. Sci. (Lond.) — 2000. — 98. — Р. 619-625.
26. Polderman K.H., Bloemers F.W., Peerdeman S.M., Girbes A.R. Hypomagnesemia and hypophosphatemia at admission in patients with severe head injury // Crit. Care Med. — 2000. — 28. — Р. 2022-2025.
27. Rhabdomyolysis Due to Severe Hypophosphatemia in Dia–betic Ketoacidosis / S.K. Shah, L. Shah, S. Bhattarai, M. Giri // JNMA J. Nepal. Med. Assoc. — 2015. — № 53. — С. 137-140.
28. Schwartz A., Gurman G., Cohen G., Gilutz H., Brill S., Schily M., Gurevitch B., Shoenfeld Y. Association between hypophosphatemia and cardiac arrhythmias in the early stages of sepsis // Eur. J. Intern. Med. — 2002. — 13. — Р. 434.
29. Shlapak I.P., Holubovska O.A., Halushko O.A. Dehidration syndrome // Острые и неотложные состояния в практике врача. — 2015. — 6. — С. 15-19.
30. Shor R., Halabe A., Rishver S., Tilis Y., Matas Z., Fux A., Boaz M., Weinstein J. Severe hypophosphatemia in sepsis as a mortality predictor // Ann. Clin. Lab. Sci. — 2006. — 36. — Р. 67-72.
31. van Londen M., Aarts B.M., Deetman P.E., van der Weijden J., Eisenga M.F., Navis G. et al. Post-Transplant Hypophosphatemia and the Risk of Death-Censored Graft Failure and Mortality after Kidney Transplantation // Clin. J. Am. Soc. Nephrol. — 2017, Aug 7. — 12(8). — Р. 1301-1310.
32. Vangala C., Pan J., Cotton R.T., Ramanathan V. Mi–neral and bone disorders after kidney transplantation // Front. Med. — 2018. — 5. — Р. 211. doi: 10.3389/fmed.2018.00211.
33. Warner S.G., Jutric Z., Nisimova L. et al. Early recovery pathway for hepatectomy: data-driven liver resection care and recovery // Hepatobiliary Surg. Nutr. — 2017. — 6. — Р. 297-311.
34. Zazzo J.F., Troche G., Ruel P., Maintenant J. High incidence of hypophosphatemia in surgical intensive care patients: efficacy of phosphorus therapy on myocardial function // Intensive Care Med. — 1995. — 21. — Р. 826-831.
35. Zoller H., Schaefer B., Glodny B. Iron-induced hypophosphatemia: an emerging complication // Curr. Opin. Nephrol. Hypertens. — 2017. — 26. — Р. 266-275. doi: 10.1097/MNH.0000000000000329.

/42-1.jpg)
/42-2.jpg)
/44-1.jpg)
/45-1.jpg)
/46-1.jpg)