Синдром старечої астенії (англ. frailty — крихкість, слабкість, немічність) — це асоційований із віком синдром, що характеризується п’ятьма основними клінічними проявами (за Fried L. et al.):
1. Втрата маси тіла (саркопенія).
2. Доведене динамометричне зниження сили кисті.
3. Виражена слабкість і підвищена втомлюваність.
4. Зниження швидкості руху.
5. Значне зниження фізичної активності.
При наявності трьох і більше вищевказаних симптомів діагностується синдром старечої астенії (СА), а у випадку одного або двох — стареча преастенія [1].
СА розвивається в осіб похилого та старечого віку внаслідок дегенерації, що пов’язана зі старінням, і проявляється у зниженні психологічного, фізіологічного та соціального функціонування. Він часто поєднується з іншими патологічними станами та факторами ризику, що спостерігаються у геріатрії: саркопенією, синдромом мальнутриції, остеопорозом, різноманітними когнітивними порушеннями та депресією. СА супроводжується порушеннями поведінки та адаптації, сприяє порушенню сімейних зв’язків і соціальній ізоляції, зумовлює залежність від сторонньої допомоги у повсякденному житті, різко погіршуючи його якість та скорочуючи тривалість.
Взаємозв’язок СА з іншими геріатричними синдромами знайшов відображення у моделі накопичення дефіциту, запропонованій K. Rockwood та співавт. [2].
Поширеність та прогноз
— Середнє значення поширеності СА становить 12,9 %, а старечої преастенії — 48,9 % (за відсутності адекватного лікування преастенія переходить в –астенію протягом 4–5 років [3]).
— Поширеність СА зростає з віком, спостерігається у 10–27 % осіб віком понад 65 років і в 45 % — понад 85 років.
— СА наявна майже у 50 % пацієнтів із хронічною серцевою недостатністю або хронічним обструктивним захворюванням легень, у кожного п’ятого пацієнта з хронічним захворюванням нирок [4–6].
— СА (або крихкість) тісно пов’язана з інвалідністю та іншою супутньою старечою патологією, хоча може розвиватись і самостійно. При наявності кількох хронічних захворювань ризик розвитку СА у літніх пацієнтів є значно вищим.
— СА часто є несприятливим прогностичним фактором. У стадії преастенії вірогідність смерті протягом п’яти років становить у середньому 20,4 %, а при розгорнутій клінічній картині — 44,5 %.
Фактори ризику
Розвиток СА обумовлений такими основними факторами, як вік, стать, рівень освіти, соціально-економічні умови, урбанізація [3].
— Вік:
– генетичний фенотип (Fried-like) СА зустрічається у віці 65–70 років у 3–6 % осіб, 71–80 років — 8–17 %, 81–84 роки — 16 %, понад 85 років — 56 %;
– набутий дефіцит функцій на тлі поліморбідності (Rockwood-like) при СА зустрічається в осіб віком 65–70 років — у 5–15 % випадків, 71–80 років — 5–12 %, у 81–84 роки — 16 %, у понад 85 років — 26 %.
— Стать (частіше спостерігається у жінок, ніж у чоловіків усіх вікових груп).
— Рівень освіти (виявляється частіше в осіб із низьким рівнем освіти).
— Сімейний статус (частіше виникає у розлучених і вдівців; у віці 81–84 роки — в одружених).
— Соціально-економічні умови (погані умови життя сприяють прогресуванню СА). Зокрема, у Бельгії даний синдром зустрічається у 40 % осіб похилого віку, Швейцарії — 50 %, США — 55 %, Фінляндії — 60 %, Німеччині — 66,4 %, Росії — 84 % [7].
— Урбанізація (частіше у сільських жителів).
Патогенез
«Жертвами» СА є кістково-м’язова, імунна і нейроендокринна системи (табл. 1) [2].
NB! Запам’ятати!
В основі розвитку СА виділяють три взаємозалежних зумовлених віком стани [8]:
1. Синдром недостатності харчування (мальнутриція).
2. Саркопенія (втрата м’язової маси).
3. Зниження метаболічного індексу та фізичної активності.
При мінімальних зовнішніх або внутрішніх впливах це несприятливе патологічне коло — синдром мальнутриції, саркопенія і зниження метаболічного індексу та рівня фізичної активності — здатне в найкоротші терміни призвести до погіршення здоров’я, інвалідності та смерті.
— Синдром мальнутриції (недостатність харчування) розвивається внаслідок асоційованого з процесом старіння зниження здоров’я ротової порожнини, зменшення смакової чутливості до вживаної їжі та появи синдрому «швидкого насичення», що значно знижує об’єм вживаної їжі. Внаслідок цього погіршується апетит та зменшується об’єм їжі. Основні клінічні прояви синдрому мальнутриції — зниження м’язової сили та витривалості, обмеження фізичної активності, зниження маси тіла.
— Саркопенія, або асоційована з віком м’язова слабкість — наслідок підвищення субклінічного запалення й оксидативного стресу та взаємодії цих факторів із мальнутрицією. Саркопенія — пусковий патогенетичний фактор розвитку порушень балансу із синдромом падіння, остеопенії. При саркопенії знижується чутливість периферичних тканин до інсуліну та інтенсивність метаболічних процесів.
— Зниження інтенсивності метаболічних процесів і фізичної активності. Даний стан є закономірним наслідком двох попередніх синдромів — мальнутриції та саркопенії, а також численних гострих і хронічних захворювань, які притаманні особам похилого та старечого віку. Всі ці процеси призводять до порушення функціонування органів і систем, зокрема до зниження когнітивної функції.
Класифікація
Класификація СА за етапами розвитку або стадіями (канадське дослідження здоров’я і старіння — CSHA, 2009) [9]:
— Збережене здоров’я: пацієнти активні, енергійні, з високою мотивацією, не обмежені у фізичній активності.
— Добре здоров’я: наявні захворювання в неактивній фазі, які дещо знижують функціональний стан.
— Добре здоров’я за наявності успішно лікованих хронічних захворювань: встановлені окремі симптоми хронічних захворювань, які задовільно контролюються проведеною терапією, але вираженіше знижують функціональний стан.
— Стареча преастенія (стан із хвилеподібним перебігом захворювання): часті періоди загострення, декомпенсація патології зі значним зниженням функціональних можливостей.
— Легка СА: незначні обмеження активності.
— Помірна СА: формування потреби у тривалому часовому догляді (?).
— Виражена СА: необхідність постійного дбайливого догляду.
— Термінальна стадія СА.
Класификація СА за ступенем вираженості (згідно зі спеціальними опитувальниками і шкалами виявляють індекс старечої астенії (ІСА)) [10]:
— Легкий.
— Помірний.
— Виражений.
Клініка
Синдром СА включає понад 65 різних геріатричних синдромів, серед яких: синдром падіння, недостатність харчування (мальнутриція), саркопенія, нетримання сечі, апатія, віковий андрогенний дефіцит, інсомнія, пролежні, хронічний больовий синдром, гіпотермія, порушення зору та слуху, когнітивні порушення, депресія тощо [9, 11–13].
Обізнаність щодо СА та її найбільш поширених проявів вважається невід’ємною частиною клінічної практики лікарів різних спеціальностей, особливо сімейних лікарів, терапевтів і кардіологів.
Основні клінічні прояви СА [14]:
— Загальна слабкість.
— Втрата апетиту.
— Схуднення (зниження маси тіла не менше 4,5 кг за рік).
— Зниження фізичної активності, порушення ходи, повільність, млявість.
— Зниження м’язової сили (виражена саркопенія).
— Погіршення пам’яті, початок деменції.
— Холодність до оточуючих.
— Зниження мотивації, втрата попередніх життєвих інтересів.
— Синдроми депресії.
Діагностика й алгоритм ведення
В алгоритмі діагностики СА виділяють дві складові:
— якісне виявлення «крихкості» (діагностичний фенотип «крихкості»);
— кількісну оцінку СА з використанням індексу «крихкості».
Це не альтернативні, але взаємодоповнюючі підходи до оцінки особи похилого віку, призначені для різних цілей.
Якісне виявлення «крихкості»
Якісне виявлення «крихкості» використовується для негайного виявлення осіб похилого віку з ознаками СА і відбору пацієнтів для обов’язкового подальшого обстеження — комплексної геріатричної оцінки (КГО) [15]. Якісний діагноз СА базується на класичному визначенні «крихкості», що включає поєднання п’яти компонентів [1]:
1. Втрата маси тіла (саркопенія).
2. Доведене динамометричне зниження сили кисті.
3. Виражена слабкість і підвищена втомлюваність.
4. Сповільнення швидкості рухів.
5. Значне зниження фізичної активності.
СА встановлюється при наявності трьох і більше ознак.
Для якісної діагностики СА необхідне спеціальне обладнання (динамометри), простір і час для визначення швидкості ходьби, що обмежує можливості лікарів у реальній клінічній практиці. Тому деякі автори пропонують використовувати скринінговий опитувальник «Вік не перешкода» для виявлення синдрому СА (табл. 2) [16]. Результати опитувальника дозволяють визначити потребу в консультації геріатра і виконанні КГО (рис. 1).
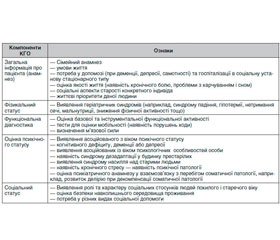
Для розробки комплексу заходів з метою довготривалої підтримки пацієнтів похилого та старечого віку і створення скоординованого плану лікування використовується спеціалізована геріатрична діагностика СА (міждисциплінарний діагностичний процес, що базується на комплексній геріатричній оцінці — КГО) (comprehensive geriatric assessment) (табл. 3) [11].
NB! Запам’ятати!
— КГО включає визначення медичного, психологічного та функціонального стану літніх пацієнтів із подальшою розробкою плану їх лікування та догляду.
— Участь у КГО можуть брати: сімейний лікар, лікар-геріатр, медична сестра, спеціаліст із когнітивних порушень (невропатолог, психотерапевт, психіатр), психолог, фахівець із соціальних проблем, логопед, інструктор з ЛФК, масажист тощо.
NB! Запам’ятати!
КГО базується на використанні опитувальників і шкал. Основні шкали:
— Оцінка ступеня порушення харчування і ризику розвитку синдрому мальнутриції (опитувальник Mini nutritional assessment (MNA)) [17, 18]
— Оцінка рухової активності у похилому віці (Functional mobility assessment in elderly patients, за Tinnetti M., 1986) [19, 20]
— Міні-дослідження когнітивного стану (опитувальник Mini-mental state examination) [21]
— Оцінка депресії (шкала Бека) [22]
— Оцінка морального статусу (опитувальник Philadelphia Geriatric Morale Scale) [23]
— Оцінка незалежності у повсякденному житті (за шкалою Бартел) [24]
Індекс старечої астенії (індекс «крихкості»)
КГО дозволяє кількісно оцінити накопичені дефіцити у фізичному, функціональному, когнітивному, психологічному та соціальному статусі пацієнта та визначити індекс «крихкості» (ІСА). Останній більш точно визначає стан пацієнта та є чутливішим до змін, ніж якісне виявлення «крихкості». Натепер відсутній уніфікований підхід до визначення ІСА, і тому методологія його розрахунку залежить від деталізації КГО [25, 26].
ІСА використовується для діагностики та визначення ступеня тяжкості СА і включає такі параметри:
— Самооцінка пацієнтом похилого та старечого віку рівня власного здоров’я (0 балів — відмінне; 0,25 бала — добре, 0,5 бала — задовільне (середнє), 0,75 бала — погане (незадовільне); 1,0 бала — дуже погане).
— Наявність зі слів пацієнта хоча б одного із таких захворювань: артрози, інсульт в анамнезі, ішемічна хвороба серця (стенокардія напруження), цукровий діабет, хронічне обструктивне захворювання легень, бронхіальна астма, тривожно-депресивний синдром, артеріальна гіпертензія, катаракта (0 балів — немає, 1 бал — наявне).
Оцінка функціонального стану: здатність сидіти без сторонньої допомоги, ходьба 100 метрів, здатність самостійно встати зі стільця, тривале стояння, самостійне ведення домашнього господарства, суспільна активність, здатність витягнути руки вперед і їх утримувати, можливість концентрувати увагу, можливість самостійно вмиватися, одягатися, приймати ванну, користуватися туалетом, працювати, переносити предмети, контроль над власними емоціями (0 балів — відсутні проблеми; 0,25 бала — легке зниження; 0,5 бала — помірне зниження; 0,75 бала — виражене; 1,0 бала — неможливість самостійно виконувати перераховані операції та дії).
— Індекс маси тіла (ІМТ) (0 балів — ІМТ > 18,5; 1 бал — < 18,5).
— Сила м’язів при кистьовій динамічній пробі (0 балів — відсутність слабкості; 1 бал — наявність).
— Здатність до швидкої ходьби (0 балів — збережена; 1 бал — не збережена).
Чим вищий ІСА, тим більший ступінь дефіциту функцій і, відповідно, зростає необхідність у сторонньому догляді. Зокрема, 0–0,2 бала — відсутня СА; 0,2–0,4 бала — помірна СА; ≥ 0,4 бала — виражена СА [27].
Формулювання діагнозу
Ds: Стареча астенія [R54].
Ізольована систолічна гіпертензія ІIІ ст., 2 ст., ризик дуже високий. Стан після транзиторної ішемічної атаки (рік). Гіпертрофія лівого шлуночка. Підвищений пульсовий артеріальний тиск. СН 1 ст. Дисліпідемія, глікемія натще (предіабет). Хронічне захворювання нирок 3А ст. (розрахункова швидкість клубочкової фільтрації 58 мл/хв/1,73 м2). Остео–артроз. Нетримання сечі.
Основні принципи лікування
— Індивідуальний догляд за особою похилого або старечого віку, підтримання життєдіяльності та вітальних функцій [28].
— При призначенні ліків уникнення поліпрагмазії та високих доз препаратів.
— При порушенні сну доцільне використання тразодону або золпідему в поєднанні з гігієнічними заходами щодо відновлення сну.
— При тривожно-депресивному синдромі доцільне використання інгібіторів зворотного захоплення серотоніну.
— При зниженні маси тіла застосування ентеральних сумішей (нутризону, нутридринку).
— Корекція дефіциту вітаміну D.
— Кінезотерапія (лікування фізичними вправами) з метою попередження падінь і відновлення м’язової сили та витривалості.
Профілактика
Для попередження СА доцільне використання алгоритму за першими буквами англійського терміну «FRAILTY»:
— F (food intake maintenance) — контроль за прийомом їжі та регуляція раціону.
— R (resistance exercises) — фізична активність.
— A (atherosclerosis prevention) — профілактика атеросклерозу.
— I (isolation avoidance) — уникнення соціальної ізоляції.
— L (limit pain) — усунення больового синдрому.
— T (tai-chi or other balance exercises) — виконання спеціальних рухових вправ.
— Y (yearly functional checking) — регулярні щорічні медичні огляди для оцінки фізичного стану.
Профілактика синдрому падіння
— Обмеження прийому психотропних препаратів і нейролептиків (седативних, снодійних, транквілізаторів, антидепресантів).
— Покращення якості зору.
— Профілактика ортостатичної гіпотензії.
— Прості силові вправи та тренування рівноваги.
— Носіння зручного взуття.
— Використання палиць і ходунків для ходьби, при потребі — стегнових протекторів.
— Регулярне приймання вітаміну D у дозі > 800 мг/добу.
— Оснащення кімнати, організація побуту.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів при підготовці даної статті.
Список литературы
1. Fried L.P. Untangling the concepts of disability, frailty, and comorbidity: implications for improved targeting and care/ L.P. Fried, L. Ferrucci, J. Darer, J.D. Williamson, G. Anderson // Journals of Gerontology Series A — Biological Sciences & Medical Sciences. — 2004. — Vol. 59(3). — R. 255-263.
2. Rockwood K. Frailty defined by deficit accumulation and geriatric medicine defined by frailty / K. Rockwood // Clin. Geriatr. Med. — 2011. — Vol. 27(1). — Р. 7-26.
3. Fisher A.L. Just what defines frailty? / A.L. Fisher // Journal of the American Geriatrics Society. — 2007. — Vol. 53(12). — Р. 2229-2230.
4. Park S.K. Frailty in people with COPD, using the National Health and Nutrition Evaluation Survey dataset (2003–2006) / S.K Park., C.R. Richardson, R.G. Holleman., J.L. Larson // Heart Lung. — 2013. — Vol. 42(3). — P. 163-70.
5. Wilhelm-Leen E.R. Frailty and chronic kidney disease: the third National Health and Nutrition Evaluation Survey. / E.R. Wilhelm-Leen, Y.N. Hall, M.K. Tamura, G.M. Chertow // Am. J. Med. — 2009. — Vol. 122(7). — P. 664-71.
6. Bergman H. Frailty: an emerging research and clinical paradigm — issues and controversies / H. Bergman, L. Ferrucci, J. Guralnik et al. // J. Gerontol. a Biol. Sci. Med. Sci. — 2007. — Vol. 62(7). — P. 731-7.
7. Gurina N.A. A roadmap of aging in Russia: the prevalence of frailty in community-dwelling older adults in the St. Petersburg district — the "Crystal" study / N.A. Gurina, E.V. Frolova, J.M. Degryse // J. Am. Geriatr Soc. — 2011. — Vol. 59(6). — Р. 980-988.
8. Yao X. Inflammation and immune system alterations in frailty / X. Yao // Clin. Geriatr. Med. — 2011. — Vol. 27(1). — Р. 79-87.
9. Ильницкий А.Н. Старческая астения (Frailty) как концепция современной геронтологии / А.Н. Ильницкий, К.И. Прощаев // Геронтология. — 2013. — Т. 1, № 1. — С. 5-16.
10. Morley J.E. Frailty and the aging male / J.E. Morley, M.J. Kim, M.T. Haren, R. Kevorkian, W.A. Banks // Aging. Male. — 2001. — Vol. 8(3–4). — Р. 135-140.
11. Ильницкий А.Н. Специализированный гериатрический осмотр / А.Н. Ильницкий, К.И. Прощаев // Геронтологический журнал им. В.Ф. Купревича. — 2012. — № 4–5. — С. 66-84.
12. Kalvach Z. Geriatricke syndromy a geriatricky pacient / Z. Kalvach, Z. Zadak, R. Jirak, H. Zavazalova, I. Holmerova, P. Weber. — Praga: Grada, 2008. — 336 р.
13. Biein B. An older person as a subject of comprehensive geriatric approach / B. Biein // Rocz. Akad. Med. Bialymst. — 2005. — № 50. — Р. 189-192.
14. Fedarko N. The biology of aging and frailty / N. Fedarko // Clin. Geriatr. Med. — 2011. — Vol. 27(1). — Р. 27-37.
15. Cesari M. The frailty phenotype and the frailty index: different instruments for different purposes / M. Cesari, G. Gambassi, G.A. Van Kan, B. Vellas // Age & Ageing. — 2014. — Vol. 43(1). — P. 10-12.
16. Ткачева О.Н., Рунихина Н.К., Остапенко В.С., Шарашкина Н.В., Мхитарян Э.А., Онучина Ю.С., Лысенков С.Н. Валидация опросника для скрининга синдрома старческой астении в амбулаторной практике // Успехи геронтол. — 2017. — Т. 30, № 2. — С. 236-242.
17. Guigoz Y. The Mini-Nutritional Assessment (MNA) Review of the Literature — What does it tell us? / Y. Guigoz // J. Nutr. Health Aging. — 2006. — Vol. 10. — P. 466-487.
18. Vellas B. Overview of the MNA — Its History and Challenges / B. Vellas, H. Villars, G. Abellan [et al.] // J. Nutr. Health Aging. — 2006. — № 10. — P. 456-465.
19. Tinetti M. Perfomance oriented assessment of mobility problems in eldery patients / M. Tinetti // J. Am. Geriatr. Soc. — 1986. — Vol. 34. — P. 119-126.
20. Tinetti M. Identifying mobility dysfunctions in eldery patients / M. Tinetti, S. Ginter // JAMA. — 1988. — Vol. 259. — P. 1058.
21. Folstein M.F. Mini-mental state. A practical method for grading the cognitive state of patients for the clinician / M.F. Folstein, S.E. Folstein, P.R. McHugh // Journal of Psychiatric Research. — 1975. — Vol. 12, № 3. — Р. 189-198.
22. Beck A.T. et al. An Inventory for Measuring Depression // Archives of general psychiatry. — 1961. — Vol. 6. — P. 561-571.
23. Lawton M.P. The Philadelphia Geriatric Center Morale Scale: A revision / M.P. Lawton // Journal of Gerontology. — 1975. — Vol. 30. — P. 85-89.
24. Machoney F. Functional evaluation: the Barthel Index / F. Machoney, D. Barthel // Md. State Med. J. — 1965. — Vol. 14. — P. 61-65.
25. Mitnitski A.B. The mortality rate as a function of accumulated deficits in a frailty index / A.B. Mitnitski, A.J. Mogilner, C. MacKnight, K. Rockwood // Mech. Ageing Dev. — 2002. — Vol. 123(11). — P. 1457-60.
26. Rockwood K. A global clinical measure of fitness and frailty in elderly people / K. Rockwood, X. Song, C. MacKnight, H. Bergman, D.B. Hogan, I. McDowell et al. // CMAJ. — 2005. — Vol. 173(5). — P. 489-95.
27. Fried L. P., Frailty in Older Adults: Evidence for a Phenotype / L.P. Fried, C.M. Tangen, J. Walston, A.B. Newman, C. Hirsch // J. Gerontol. Sci. Med. Sci.– 2001. — Vol 56(3). — Р. 146-157.
28. Shore W.S. Prevention and treatment of frailty in post-menopausal women / W.S. Shore, B.J. DeLateur // Phys. Med. Rehabil. Clin. N. Am. — 2007. — Vol. 18(3). — Р. 609-621.

/17-1.jpg)
/18-1.jpg)
/19-1.jpg)
/19-2.jpg)