Біль у поперековому відділі хребта є однією з найпоширеніших причин для відвідування лікаря. За статистикою, більшість американців будь-коли зазнавали біль у попереку, і приблизно одна чверть із дорослих осіб повідомляла про те, що вони зазнавали біль у спині упродовж як мінімум одного дня протягом останніх 3 місяців [6]. Звичайно, що, крім суто медичної проблеми, це пов’язано також із значними економічними витратами, у тому числі з медичним обслуговуванням та непрямими витратами від втрати роботи або зниження продуктивності праці [1]. Загальні витрати, пов’язані із синдромом болю в спині в Сполучених Штатах, оцінювалися в 100 мільярдів доларів США у 2006 році, дві третини з яких — непрямі втрати [8].
З патофізіологічної точки зору больовий синдром у спині найчастіше класифікують як [9]:
— неспецифічний;
— специфічний;
— корінцевий синдром.
Виділення неспецифічного характеру болю в спині зручно і обґрунтовано в більшості клінічних випадків гострого болю в разі, коли пацієнт обстежується лікарем загальної практики. Добре відомо, що внаслідок анатомо-фізіологічних особливостей хребта встановити точне джерело болю в спині неможливо без спеціального обстеження. Іноді це потребує застосування дорогих інвазивних діагностичних втручань, що є доречним при проведенні диференціальної діагностики в складних клінічних випадках. У той же час звичайний, неспецифічний гострий біль у спині є доброякісним, самообмежувальним станом зі сприятливим прогнозом. Основні завдання лікування такого стану — припинення больового синдрому та збереження/відновлення повсякденної активності людини — можуть бути з успіхом вирішені лікарем загальної практики. Згідно з існуючими консенсусами щодо лікування неспецифічного болю в спині виділяють такі види терапії:
— неінвазивну нефармакологічну терапію (фізичні вправи, носіння бандажа або корсета, мануальна терапія, акупунктура, фізіотерапевтичні методи лікування, психотерапія);
— неінвазивну фармакологічну корекцію (ненаркотичні та наркотичні анальгетики, нестероїдні протизапальні препарати (НПЗП), системні глюкокортикостероїди, центральні міорелаксанти бензодіазепінового ряду та небензодіазепінові, інгібітори зворотного захоплення серотоніну, інгібітори зворотного захоплення серотоніну та норадреналіну, трициклічні антидепресанти, антиконвульсанти тощо);
— інвазивну методику лікування (застосування ін’єкційних лікарських засобів та хірургічне втручання) [3].
Слід зауважити, що і до сьогодні йде дискусія навколо стратегій терапії та їх доказової бази. Як приклад та для порівняння наводимо останні рекомендації з лікування болю в спині двох поважних організацій — NICE (2016) та ACP (2017) [9, 10]. У рекомендаціях NICE (National Institute for Health and Care Excellence, Великобританія) 2016 року з ведення хворих із болем у нижній частині спини (БНС) зазначається, що фізичні вправи (розтягування, силові й аеробні навантаження, йога, гімнастика) показані всім пацієнтам із БНС як головний компонент неінвазивного лікування. Мануальна терапія і психологічні методи мають застосовуватись лише як доповнення до фізичних вправ. Акупунктура й електротерапія не рекомендовані.
У розділі «Фармакотерапія» зазначено, що «призначати слід лише рекомендовані препарати. Рекомендованими вважаються пероральні НПЗП і слабкі опіоїди (в монотерапії або в комбінації з парацетамолом; лише за неефективності або неможливості призначення НПЗП). Наголошується, що застосування парацетамолу в монотерапії БНС не рекомендується. Застосування інгібіторів зворотного захоплення серотоніну, інгібіторів зворотного захоплення серотоніну та норадреналіну, трициклічних антидепресантів та антиконвульсантів не рекомендується.
Для порівняння, клінічне практичне керівництво з неінвазивного лікування гострого, підгострого і хронічного БНС Американської колегії лікарів (ACP, 2017) містить три ключові рекомендації:
1. Ураховуючи, що більшість пацієнтів із гострим або підгострим БНС із часом одужують незалежно від лікування, лікарям і пацієнтам слід надавати перевагу нефармакологічним методам — поверхневому прогріванню (докази середньої якості), масажу, акупунктурі або мануальній терапії (докази низької якості). Якщо виникає потреба у фармакологічному лікуванні, препаратами першої лінії є НПЗП і центральні міорелаксанти (докази середньої якості) (сильна рекомендація).
2. У пацієнтів із хронічним БНС лікування слід починати з нефармакологічних методів — фізичних навантажень, мультидисциплінарної реабілітації, акупунктури, технік зменшення стресу (докази середньої якості), гімнастики тайцзіцюань, йоги, вправ на руховий контроль, прогресивної релаксації, електроміографії з оберненим зв’язком, низькорівневої лазеротерапії, оперантної терапії, когнітивно-поведінкової терапії або мануальної терапії (докази низької якості) (сильна рекомендація).
3. У пацієнтів із хронічним БНС, у яких не отримано адекватної відповіді на нефармакологічну терапію, першою лінією лікування є НПЗП, другою лінією — трамадол або дулоксетин. Опіоїди можуть призначатись лише в разі неефективності цих препаратів і за умови, що очікувана користь переважає потенційні ризики (слабка рекомендація, помірна якість доказів).
Слід зауважити, що рекомендації американських колег базуються на системному огляді рандомізованих клінічних досліджень із лікування БНС від 4 квітня 2017 р., тоді як британські рекомендації були опубліковані у 2016 р. Основні знахідки системного огляду рандомізованих клінічних досліджень 2017 року з лікування БНС полягали в такому [13]:
— ацетамінофен (парацетамол) був неефективним для лікування гострого БНС;
— нестероїдні протизапальні препарати мали менше переваг при хронічному БНС, ніж раніше вважалося;
— дулоксетин був ефективним для лікування хронічного БНС;
— бензодіазепіни були неефективними для лікування радикулопатії;
— для опіоїдів докази залишаються обмеженими короткостроковими дослідженнями, що демонструють скромний ефект при хронічному БНС. Короткостроковість досліджень не дозволяє оцінити серйозності шкоди їх застосування;
— скелетні м’язові релаксанти: ефективні для короткочасного знеболювання при лікуванні гострого БНС, але викликають седацію;
— системні кортикостероїди, здається, не є ефективними;
— антиконвульсанти: доказів недостатньо для того, щоб визначити ефективність їх застосування.
Для порівняння, попередні рекомендації ACP (2007 р.) та відповідний системний огляд містили рекомендації щодо використання ацетамінофену (парацетамолу) та НПЗП як першої лінії терапії для лікування БНС. Скелетні м’язові релаксанти, бензодіазепіни та антидепресанти вважалися засобами другої лінії терапії.
Таким чином, незважаючи на всі контраверсії, м’язові скелетні релаксанти значно посилили свої позиції та фактично розділили місце в першій лінії терапії гострого болю в спині з нестероїдними протизапальними засобами.
М’язові скелетні релаксанти центральної дії є досить гетерогенною групою лікарських засобів як для лікування м’язової спастичності при ураженні ЦНС, так і для лікування неспецифічного больового синдрому в спині. Тільки три препарати рекомендовано FDA для лікування м’язової спастичності при ураженні ЦНС: баклофен, дантролен та тизанідин. Друга група центральних міорелаксантів для лікування неспецифічного болю в спині є більш різноманітною. На світовому ринку препарати цієї групи представлені досить широко: карисопродол, хлорзоксазон, циклобензаприн, метаксалон, метокарбамол та орфенадрин. Віднедавна на українському фармацевтичному ринку представлена перша і поки що єдина молекула, що рекомендована саме для лікування болісного м’язового спазму, — циклобензаприн.
Слід зауважити, що декілька препаратів центральних міорелаксантів не є рекомендованими FDA через брак доказовості, але вони презентовані на європейському та українському фармацевтичних ринках. Серед останніх — тіоколхікозид та толперизон. Ці два препарати мають обмежену доказову базу відносно їх ефективності та безпеки. Незважаючи на те, що вони мають європейську реєстрацію, існують певні обмеження щодо застосування цих препаратів у широкій клінічній практиці. На підставі даних щодо ефективності та безпеки толперизону Європейська агенція з лікарських препаратів (EMA) у 2012 р. дій-шла висновку, що ризик підвищеної чутливості до препарату, що проявляється реакціями гіперчутливості (іноді навіть анафілактичним шоком), є більш значним, ніж вважалось раніше, і, як наслідок, продемонстрована користь перевищує потенційний ризик лише для пероральної лікарської форми і лише за єдиним показанням — симптоматичне лікування післяінсультної спастичності в дорослих. Тобто ЕМА видалила всі показання до застосування толперизону, крім одного — постінсультної спастичності. Крім того, агенція видала рекомендацію щодо усунення з ринку лікарської форми толперизону для парентерального (ін’єкційного) застосування [11].
Щодо тіоколхікозиду його виробники отримали застережного листа EMA у 2013 р. [12]. На підставі даних, які були представлені італійською агенцією, що здійснює контроль за обігом лікарських препаратів (AIFA), було встановлено, що один із метаболітів тіоколхікозиду в організмі людини може вражати клітини, що активно діляться, та викликати анеуплоїдію (утворення клітин з непарним числом хромосом). На підставі цих даних EMA застерегла від застосування великих доз тіоколхікозиду та рекомендувала значно обмежити терміни лікування цим препаратом. Звичайно, що препарат був заборонений до застосування у вагітних жінок, жінок фертильного віку та дітей.
На цьому фоні циклобензаприн виглядає досить привабливо з точки зору ефективності та профілю безпеки.
Циклобензаприн є похідним амітриптиліну та має характерну трициклічну структуру, що й обумовлює його фармакологічні властивості (рис. 1, 2). Так само як і амітриптилін, циклобензаприн впливає на ЦНС, переважно на рівні стовбура головного мозку, а не на рівні спинного мозку. Основним механізмом дії циклобензаприну вважається зменшення тонізуючої соматичної моторної активності внаслідок впливу на α- та γ-мотонейрони. Крім зниження підвищеного м’язового тонусу, для циклобензаприну характерними є слабкі аналгетичний та снодійний ефекти, антихолінергічна дія (як центральна, так і периферична). Але на відміну від амітриптиліну препарат справляє слабкий антидепресивний ефект [7].
/65-1.jpg)
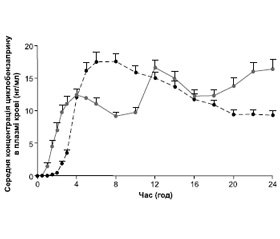
Циклобензаприн був введений у клінічну практику в 1977 р. у лікарській формі з негайним вивільненням діючої речовини. З метою покращання комплайєнсу та, як показали дослідження, зменшення вираженості деяких побічних ефектів у 2007 р. було впроваджено лікарську форму з повільним вивільненням циклобензаприну (технологія Diffucaps®). Це дозволило призначати препарат один раз на добу, що є беззаперечним позитивним досягненням. При цьому 24-годинний фармакокінетичний профіль при однократному застосуванні циклобензаприну (з повільним вивільненням) загалом відповідає профілю з негайним вивільненням діючої речовини із застосуванням тричі на добу (рис. 3) [5]. Але при використанні циклобензаприну з повільним вивільненням виникає лише один пік концентрації на відміну від трьох при застосуванні циклобензаприну зі звичайним вивільненням, що і зумовлює кращій профіль безпеки. Доречною є рекомендація щодо прийому цього препарату на ніч: в тих рідких випадках, коли пацієнти можуть відчувати сонливість внаслідок прийому Міориксу (циклобензаприн у формі капсул пролонгованої дії), пік концентрації припадатиме на нічний період.
/66-1.jpg)
Клінічну ефективність циклобензаприну при болю в спині було доведено в низці досліджень, які були підсумовані в метааналізі 2001 р. (Browning et al.) (рис. 4) [4].
Згідно з даними цього ж метааналізу, найбільш частими побічними явищами при прийомі циклобензаприну зі звичайним вивільненням були сонливість (у 20 % пацієнтів), сухість у роті (8 %), запаморочення (7 %). Пізніше, при аналізі об’єднаних даних, Weil та співавтори (2010) дійшли висновку, що частота сонливості при використанні циклобензаприну з повільним вивільненням (Міориксу) була вірогідно нижчою (0,8 % при застосуванні 15 мг та 1,6 % при використанні 30 мг), ніж при використанні циклобензаприну зі звичайним вивільненням (р < 0,05) [14]. На жаль, на сьогодні не існує прямих порівняльних досліджень щодо ефективності та профілю безпеки різних представників групи центральних міорелаксантів один з одним, щоб можна було більш повно порівняти їх та усвідомити переваги певної молекули, а також сформулювати рекомендації щодо персоніфікованого підходу до призначення міорелаксантів центральної дії різним категоріям пацієнтів.
Висновки
1. Незважаючи на всі контраверсії, міорелаксанти центральної дії належать до засобів першої лінії терапії неспецифічного гострого болю в спині. Препарати цієї групи можуть застосовуватися разом із нестероїдними протизапальними засобами.
2. Препаратом першого вибору для лікування болісного м’язового спазму при неспецифічному болю в спині (серед існуючих на фармацевтичному ринку України) може бути саме циклобензаприн.
3. Додатковою перевагою циклобензаприну можна вважати лікарську форму з повільним вивільненням діючої речовини, що дозволяє застосовувати препарат один раз на добу. Слід зауважити, що це єдиний препарат у своїй терапевтичній підгрупі, що має таку лікарську форму.
Конфлікт інтересів. Не заявлений.
Промокод UA/MRX/0618/0014
За сприяння ТОВ «Такеда Україна»

/65-1.jpg)
/66-1.jpg)